CompositionPrincipes actifs
Methylphenidati hydrochloridum.
Excipients
Capsules à 10 mg: Saccharose (34-49 mg), amidon de maïs, povidone, hypromellose, macrogols, éthylcellulose, sébacate de dibutyle, indigotine (E 132), dioxyde de titane (E 171), oxydes de fer (E 172), gélatine, gomme-laque, propylène glycol, hydroxyde de sodium, hydroxyde d'ammonium.
Capsules à 20 mg: Saccharose (68-100 mg), amidon de maïs, povidone, hypromellose, macrogols, éthylcellulose, sébacate de dibutyle, indigotine (E 132), dioxyde de titane (E 171), oxydes de fer (E 172), gélatines, gomme-laque, propylène glycol, hydroxyde de sodium, hydroxyde d'ammonium.
Capsules à 30 mg: Saccharose (102-150 mg), amidon de maïs, povidone, hypromellose, macrogols, éthylcellulose, sébacate de dibutyle, indigotine (E 132), dioxyde de titane (E 171), oxydes de fer (E 172), gélatines, gomme-laque, propylène glycol, hydroxyde de sodium, hydroxyde d'ammonium.
Indications/Possibilités d’emploiEquasym XR est indiqué pour le traitement d'un trouble déficitaire de l'attention/hyperactivité (TDAH) des enfants à partir de six ans et des adolescents jusqu'à 18 ans dans le cadre d'une stratégie e thérapeutique globale, lorsque d'autres mesures thérapeutiques seules s'avèrent insuffisantes. Le traitement doit être initié et surveillé exclusivement par des médecins spécialisés dans les troubles du comportement des l'enfants et des l'adolescents. Le diagnostic doit être posé selon les critères DSM-IV ou la classification ICD-10 et s'appuyer sur une anamnèse et un examen complets du patient.
L'efficacité d'Equasym XR a été documentée lors du traitement du TDAH dans des essais cliniques contrôlés sur des enfants et des adolescents âgés de 6 à 17 ans, qui remplissaient les critères selon le DSM-IV pour le TDAH.
Informations complémentaires pour la sécurité d'emploi du médicament
Le TDAH est également connu sous l'appellation de trouble déficitaire de l'attention (TDA). D'autres termes utilisés pour décrire ce trouble de comportement sont: «syndrome hyperkinétique», «dysfonctionnement cérébral minime de l'enfant», «syndrome de l'enfant hyperactif» et «syndrome psycho-organique».
L'utilisation d'Equasym XR doit être limitée aux patients ayant besoin d'un médicament dont l'effet se prolonge de la prise matinale jusqu'au soir. Equasym XR doit être utilisé dans le cadre d'un programme complet de traitement lorsque des comportementales à elles seules n'ont pas suffi. Un programme thérapeutique complet pour traiter le TDAH peut comprendre des mesures psychologiques, pédagogiques et sociales. Le traitement par Equasym XR peut d'atténuer les principales manifestations du TDAH comme la distraction moyenne à forte, le relâchement rapide de l'attention, l'impulsivité, une activité motrice accrue (agitation) et un comportement perturbé en société.
Le traitement par Equasym XR n'est pas indiqué chez tous les enfants et adolescents atteints de TDAH et la décision d'utiliser le médicament doit reposer sur une évaluation très soigneuse du degré de gravité des symptômes du patient. Les stimulants ne sont pas prévus pour être utilisés chez des patients qui montrent des symptômes secondaires dus à leur environnement et/ou d'autres troubles psychiatriques primaires, psychoses comprises. Des mesures pédagogiques adaptées sont essentielles et une prise en charge psychosociale est souvent bénéfique.
L'étiologie spécifique de ce syndrome est inconnue. Un diagnostic adéquat ne peut pas être posé par un seul test diagnostique. Il exige l'emploi de ressources médicales, psychologiques, pédagogiques et sociales spéciales. L'apprentissage peut être entravé, mais pas obligatoirement.
Posologie/Mode d’emploiExamens préconisés avant le début du traitement
Avant de commencer le traitement par Equasym XR, il est nécessaire d'effectuer et de documenter un examen cardiovasculaire, comprenant la tension artérielle et la fréquence cardiaque. Comme il n'existe pas de données à long terme, des examens cardiovasculaires réguliers doivent être effectués en présence d'un profil de facteurs de risque (voir la rubrique «Mises en garde et précautions»).
Avant le début du traitement, il faut également relever le poids et la taille et documenter ces données dans une courbe de croissance.
Equasym XR n'a pas été étudié chez l'adulte et ne doit donc pas être utilisé chez ce groupe de patients.
Enfants et adolescents (âgés de plus de 6 ans):
Patients recevant du méthylphénidate pour la première fois: afin d'éviter les doses inutilement élevées de méthylphénidate, il est nécessaire que le médecin procède soigneusement à une augmentation progressive de la dose au début du traitement. Chez les patients recevant du méthylphénidate pour la première fois, de faibles doses de la formule de méthylphénidate à action rapide peuvent déjà suffire. La dose initiale d'Equasym XR recommandée est de 10 mg une fois par jour chez les patients qui ne sont pas sous traitement au méthylphénidate au moment de la prescription ou qui prennent d'autres stimulants que le méthylphénidate.
Patients prenant déjà du méthylphénidate: les patients suivant déjà un traitement au méthylphénidate à libération immédiate peuvent passer à la dose équivalente (en mg) d'Equasym XR. Ainsi, 20 mg d'Equasym XR sont considérés comme équivalents à deux prises de 10 mg d'une formule de méthylphénidate à libération rapide (une prise de 10 mg au petit-déjeuner et une deuxième à midi).
La capsule d'Equasym XR contient une composante à libération immédiate (30 % de la dose) une composante à libération prolongée (70 % de la dose). Par conséquent, Equasym XR 10 mg contient 3 mg du principe actif à libération immédiate et 7 mg à libération prolongée. La partie de la dose libérée de façon prolongée a été développée pour maintenir le succès thérapeutique jusqu'à la fin de l'après-midi sans exiger une prise du médicament à midi. Equasym XR a été développé pour assurer le maintien de taux plasmatiques thérapeutiques pendant une période correspondant à la journée d'école (plutôt que toute la journée) (voir «Pharmacocinétique»).
Si l'effet du médicament diminue trop rapidement le soir, des troubles du comportement et/ou de l'endormissement peuvent apparaître. Une faible dose de comprimés de méthylphénidate à libération immédiate, prise le soir, peut contribuer à résoudre ce problème.
La dose journalière maximale d'Equasym XR est de 60 mg.
Les capsules retard Equasym XR doivent être administrées le matin avant le petit-déjeuner. Elles doivent être avalées entières, sans être divisées ni croquées. On peut ouvrir la capsule retard et mélanger la totalité de son contenu dans un peu (une cuillerée) de compote de pommes ou de bouillie (suivies d'une boisson). Là aussi, il faut veiller à ne pas mâcher les granules.
Posologies spéciales
L'utilisation du méthylphénidate [ou dénomination de la préparation] chez les patients de moins de six ans n'a pas été étudiée dans des études contrôlées. Le méthylphénidate [ou dénomination de la préparation] ne doit donc pas être utilisé chez des patients de moins de six ans.
Remarque: si aucune amélioration des symptômes n'est constatée après augmentation de la dose pendant un mois, le traitement doit être interrompu. Le traitement médicamenteux du TDAH est généralement arrêté au cours de la puberté ou après la puberté.
Poursuite du traitement/traitement de longue durée
On ne dispose pas de données fiables d'études cliniques contrôlées sur la durée optimale du traitement par Equasym XR chez les patients présentant un TDAH. Il est toutefois généralement reconnu qu'il peut être nécessaire de poursuivre le traitement pharmacologique du TDAH pendant une période prolongée. Le médecin prescripteur qui prévoit un traitement de longue durée chez un patient présentant un TDAH doit cependant vérifier régulièrement l'utilité du médicament pour le patient en question en faisant des essais d'arrêt (mais au plus tard au bout de 12 mois) afin d'évaluer le bénéfice du traitement en l'absence d'une pharmacothérapie. Une amélioration peut se maintenir lorsque le traitement est interrompu temporairement ou définitivement.
Insuffisance rénale
Aucun examen systématique des patients souffrant d'une insuffisance rénale n'est disponible (voir «Pharmacocinétique»).
Insuffisance hépatique
Aucun examen systématique des patients souffrant d'une insuffisance hépatique n'est disponible.
Adultes et patients âgés
La sécurité et l'efficacité d'Equasym XR n'ont pas été étudiées chez les adultes et les patients âgés.
Contre-indicationsEquasym XR ne doit pas être utilisé en cas d'hypersensibilité connue au méthylphénidate ou à l'un des composants du produit.
Equasym XR ne doit pas être utilisé en cas de crises d'angoisse, tension psychique et agitation prononcées, car le méthylphénidate peut renforcer ces symptômes. Equasym XR ne doit pas être utilisé chez les patients présentant des tics moteurs/verbaux, ayant des frères/sœurs avec des tics ou une personne de la famille avec un syndrome de Gilles de la Tourette diagnostiqué.
Equasym XR ne doit pas être utilisé en association avec un inhibiteur de la monoamine oxydase (MAO) et un délai d'au moins 14 jours doit être respecté après l'arrêt d'administration d'un IMAO avant d'administrer Equasym XR (ce qui pourrait entraîner une hypertension artérielle aiguë) (voir «Interactions»).
Equasym XR ne doit pas non plus être utilisé dans les cas suivants:
·Présence d'un phéochromocytome
·Présence d'un glaucome
·Présence d'une hyperthyroïdie
·Présence d'une thyréotoxicose
·Présence de troubles du rythme cardiaque
·Présence des maladies cardiovasculaires préexistantes, y compris hypertension sévère, insuffisance cardiaque, angine de poitrine, cardiopathie congénitale importante sur le plan hémodynamique, cardiomyopathies, infarctus, arythmies potentiellement mortelles et canalopathies (maladies causées par un dysfonctionnement des canaux ioniques)
·maladie artérielle occlusive périphérique
·Présence d'une artériopathie oblitérante des membres inférieurs
·Diagnostic ou anamnèse de dépression grave, anorexie mentale, symptômes psychotiques, tendance suicidaire, manie, schizophrénie, trouble de la personnalité borderline, car le méthylphénidate peut aggraver ces états
·Dépendance connue aux drogues ou abus de médicaments ou d'alcool
·Présence des maladies cérébrovasculaires préexistantes comme anévrismes cérébraux, vaisseaux anormaux, y compris vasculite ou accident vasculaire cérébral
Mises en garde et précautionsChez les enfants de moins de 6 ans il n'y a pas de données suffisantes concernant l'efficacité, la sécurité et le dosage.
Equasym XR ne doit pas être utilisé pour le traitement de dépressions exogènes sévères ou de dépressions endogènes.
Mort cardiaque subite, anomalies cardiaques structurelles préexistantes et autres cardiopathies sévères
Enfants et adolescents
Des cas de décès soudains ont été rapportés chez des enfants traités par des stimulants, y compris le méthylphénidate, et ayant des anomalies cardiaques structurelles. En conséquence, le méthylphénidate ne sera pas administré aux enfants ayant des anomalies cardiaques structurelles ou des antécédents de maladies cardiovasculaires.
Hypertension artérielle et autres maladies cardio-vasculaires
L'utilisation de stimulants provoque une augmentation moyenne modérée de la tension artérielle (d'environ 2 à 4 mmHg) et de la fréquence cardiaque (d'environ 3 à 6 battements par minute). Ces augmentations peuvent cependant être plus grandes chez certains patients. Tous les patients présentant des modifications cliniquement significatives de la fréquence cardiaque et de la tension artérielle doivent être surveillés. Une prudence particulière est de rigueur chez les patients dont les co-morbidités peuvent être renforcées par une augmentation de la tension artérielle et de la fréquence cardiaque, par exemple chez les patients présentant déjà une hypertension artérielle, une insuffisance cardiaque, un antécédent récent d'infarctus du myocarde ou une arythmie ventriculaire.
Évaluation de la situation cardio-vasculaire chez les patients traités aux stimulants
Afin de détecter des maladies cardiaques préexistantes, il faut effectuer, chez les patients que l'on prévoit de traiter avec Equasym XR, une anamnèse soigneuse (y compris l'anamnèse familiale de décès subits ou d'arythmies ventriculaires) et un examen physique. Si les premiers résultats indiquent une maladie de ce type, d'autres examens cardiologiques (p.ex. électrocardiogramme, échocardiogramme) doivent être faits.
Le statut cardiovasculaire doit être surveillé. La tension et la fréquence cardiaque doivent être vérifiées et documentées à chaque ajustement de dose ou à intervalles adaptés (mais au moins tous les 6 mois) et après si cela s'avère cliniquement indiqué.
Chez les enfants qui montreraient pendant un traitement par Equasym XR des symptômes de types palpitations, douleurs dans la poitrine lors d'efforts physiques, syncopes ou d'autres symptômes laissant supposer une maladie cardiaque, un examen cardiologique doit être effectué immédiatement.
Maladies cérébrales préexistantes, y compris altérations structurelles du cerveau
Les patients qui présentent des anomalies cérébrales préexistantes telles qu'un anévrisme cérébral et/ou des anomalies vasculaires telles qu'une vascularite, ou encore un antécédent d'accident vasculaire cérébral, ne doivent pas être traités par Equasym XR.
Effets indésirables psychiatriques
Psychose préexistante
Chez les patients présentant un trouble psychotique préexistant, l'administration de stimulants peut éventuellement aggraver les symptômes d'un trouble du comportement, d'un trouble de la pensée et d'un vécu psychotique.
Trouble bipolaire
Chez les patients qui pourraient présenter un trouble bipolaire comorbide, mais se trouvent actuellement en phase de rémission, l'utilisation de stimulants pour le traitement d'un TDAH requiert une prudence particulière étant donné qu'il pourrait déclencher un épisode maniaque mixte chez ces patients (voir «Contre-indications»). Avant de commencer un traitement aux stimulants chez des patients présentant des symptômes dépressifs comorbides, il faut examiner très soigneusement s'ils présentent un risque de trouble bipolaire ou psychotique. Cette démarche diagnostique inclut une interrogation détaillée sur l'histoire psychiatrique du patient ainsi qu'une anamnèse familiale concernant les suicides, les troubles bipolaires et les dépressions.
Survenue de nouveaux symptômes psychotiques ou maniaques
Chez les enfants et adolescents n'ayant présenté jusque-là aucun trouble psychotique et aucune manie, le traitement par des doses normales de stimulants peut déclencher l'apparition de symptômes psychotiques ou maniaques tels qu'hallucinations, troubles délirants ou manies. Si de tels symptômes sont observés, il faut évaluer s'il existe un lien de causalité avec le stimulant et si un arrêt du traitement est indiqué. Dans une méta-analyse de plusieurs études de courte durée contrôlées par placebo, de tels symptômes ont été constatés chez environ 0,1 % des patients sous stimulants (4 patients avec survenue d'événements sur un total de 3482 patients sous méthylphénidate ou amphétamine à doses normales pendant plusieurs semaines), par rapport à 0 % des patients sous placebo.
Agressivité
On constate souvent un comportement agressif ou hostile chez les enfants et adolescents présentant un TDAH. Ces particularités ont été rapportées également dans les études cliniques et les observations postcommercialisation concernant le traitement du TDAH. Bien qu'il n'existe aucun indice fiable d'une provocation de comportements agressifs ou hostiles par les stimulants, il faut surveiller attentivement l'apparition ou aggravation éventuelle de comportements agressifs ou d'hostilité chez les patients au début d'un traitement du TDAH (voir aussi la section sur les tendances suicidaires, puisque l'hostilité peut aussi se manifester en rapport avec des tendances suicidaires).
Chez les patients commençant un traitement par méthylphénidate, il faut faire attention à l'apparition ou au renforcement de comportements agressifs.
Une surveillance étroite est requise. L'agressivité est souvent liée au TDAH; cependant, on a signalé une apparition ou un renforcement inattendu de l'agressivité pendant le traitement par méthylphénidate. Une interruption de traitement pourra être envisagée (voir «Effets indésirables»).
Syndrome sérotoninergique
Comme avec d'autres substances sérotoninergiques, un syndrome sérotoninergique pouvant mettre en jeu le pronostic vital peut survenir au cours du traitement par le méthylphénidate, en particulier lorsque le méthylphénidate est associé à d'autres médicaments sérotoninergiques. Ces médicaments sont notamment les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), les antidépresseurs tricycliques, les phénothiazines, les triptans, le lithium, le fentanyl, le dextrométhorphane, le tramadol, le tapentadol, la mépérine, la méthadone, la pentazocine, le millepertuis (Hypericum) ou les principes actifs influençant le métabolisme de la sérotonine, tels que l'antibiotique linézolide et l'inhibiteur non sélectif de la MAO bleu de méthylène entraînant une inhibition non sélective et réversible de la MAO, ou des précurseurs de la sérotonine (tels que le tryptophane).
L'administration concomitante de méthylphénidate et de médicaments sérotoninergiques n'est pas recommandée, car cela peut provoquer le développement d'un syndrome sérotoninergique. Les symptômes du syndrome sérotoninergique peuvent comprendre: altérations de l'état mental (p.ex. agitation, hallucinations, délire et coma), instabilité du système autonome (p.ex. tachycardie, labilité de la pression artérielle, vertiges, diaphorèse, flush, hyperthermie), symptômes neuromusculaires (p.ex. tremblements, rigidité, myoclonie, hyperréflexie, troubles de la coordination), convulsions et/ou symptômes gastro-intestinaux
(p.ex. nausées, vomissements, diarrhée). Le syndrome sérotoninergique dans sa forme la plus sévère peut ressembler à un syndrome malin des neuroleptiques qui comprend des symptômes tels qu'hyperthermie, rigidité musculaire, instabilité du système autonome associée à une éventuelle fluctuation rapide des signes vitaux et des altérations de l'état mental. Il est important d'identifier rapidement ces symptômes.
Il convient d'arrêter immédiatement le méthylphénidate et les médicaments sérotoninergiques et d'instaurer un traitement approprié (voir «Interactions»).
Dans le cadre d'un traitement par des produits contenant du méthylphénidate, des cas isolés de priapisme (érections prolongées et douloureuses), ayant nécessité un traitement médical immédiat, voire une intervention chirurgicale, ont été rapportés chez des enfants, des adolescents et des adultes (voir «Effets indésirables»).
Le priapisme n'a généralement pas été rapporté au début du traitement, mais au bout d'un certain temps d'utilisation du médicament, souvent à la suite d'une augmentation de la dose.
Le priapisme s'est également manifesté dans des phases sans prise de méthylphénidate (suspension ou interruption du traitement).
Les patients qui développent des érections douloureuses qui sont inhabituellement persistantes (plus de 2 heures) ou fréquentes doivent immédiatement consulter un médecin. Les professionnels de santé doivent expressément aborder ce problème avec les patients et leurs parents, et leur signaler qu'il s'agit d'une urgence.
Tendances suicidaires
Il est scientifiquement démontré que les maladies psychiatriques sont associées à un risque accru d'idées suicidaires, d'automutilation et de suicide. Des comportements suicidaires (tentatives de suicide ou idées suicidaires) ont été constatés aussi chez des patients sous méthylphénidate.
Les patients traités pour un TDAH doivent être surveillés attentivement quant à l'apparition ou aggravation de symptômes psychopathologiques tels que l'hostilité et l'instabilité émotionnelle. On ne peut fondamentalement pas exclure que des tendances suicidaires (idées suicidaires, comportement suicidaire) puissent se développer ou s'aggraver sous méthylphénidate.
En présence d'une détérioration générale de l'état du patient, même sans indices spécifiques de tendances suicidaires, il faut aussi songer à la possibilité d'un développement de tendances suicidaires et initier les interventions correspondantes par des médecins spécialisés (voir «Contre-indications»).
De tels patients doivent par conséquent être surveillés avec un soin particulier au cours du traitement. Les patients (et les personnes qui s'occupent d'eux) doivent être instruits de la nécessité absolument essentielle d'une surveillance de l'état du patient (ce qui inclut aussi le développement de nouveaux symptômes) et du fait que des idées suicidaires, des comportements suicidaires et des intentions autodestructrices peuvent éventuellement apparaître et qu'il faut immédiatement consulter le médecin si de tels symptômes se manifestent. Dans ce contexte, il faut aussi songer que la survenue de certains symptômes – par exemple d'agitation – peut provenir aussi bien de la maladie de base que du traitement médicamenteux.
Un mauvais usage de médicaments stimulant le système nerveux central pourrait être associé à des cas de mort subite ou à d'autres événements cardiovasculaires sévères.
Un traitement au méthylphénidate n'est pas indiqué chez tous les enfants présentant un trouble déficitaire de l'attention avec hyperactivité. On ne doit y recourir qu'après avoir procédé à un examen et à une anamnèse approfondis et complets de l'enfant. La décision de prescrire du méthylphénidate doit dépendre de l'appréciation de la sévérité des symptômes en rapport avec l'âge de l'enfant, et ne pas être prise simplement en raison de la présence d'une ou de plusieurs caractéristiques anormales du comportement. Si de tels symptômes sont accompagnés de réactions de stress aiguës, le traitement par Equasym XR n'est généralement pas indiqué.
Des indices cliniques montrent que des troubles psychiatriques (y compris comportements de dépendance et suicidaires) ainsi qu'une perte de poids et d'appétit surviennent plus fréquemment lors de l'administration de médicaments à base de méthylphénidate. Il faut donc procéder lors de toute visite et adaptation de la posologie à un relevé soigneux de ces changements mais aussi des signes pouvant indiquer une mauvaise utilisation ou un abus du médicament.
Des cas d'inhibition de la croissance (prise de poids réduite et/ou augmentation réduite de la taille) en rapport avec le traitement à long terme d'enfants par méthylphénidate ont été rapportés.
Des études de suivi chez des enfants âgés de 7 à 10 ans indiquent que les enfants prenant du méthylphénidate en continu (p.ex. 7 jours par semaine pendant 1 an) peuvent présenter un ralentissement passager de la croissance (retard de croissance en moyenne de 2 cm pour la taille et de 2,7 kg pour le poids en 3 ans). C'est pourquoi il faut surveiller étroitement (au moins tous les 6 mois) et documenter dans une courbe de croissance la taille, le poids et l'appétit des patients nécessitant un traitement au long cours. Le traitement doit être interrompu chez les patients ne présentant pas la croissance ou la prise de poids attendue.
Equasym XR ne doit pas être utilisé pour la prévention ou le traitement d'états de fatigue normaux.
Un mésusage chronique de méthylphénidate peut entraîner une accoutumance prononcée et une dépendance psychique, avec différents degrés de comportements anormaux. En particulier le mésusage par voie parentérale peut entraîner des épisodes psychotiques.
La prudence est de mise chez des patients émotionnellement instables, par exemple en rapport avec des antécédents de dépendance aux drogues ou à l'alcool, car de tels patients peuvent éventuellement augmenter la dose de leur propre initiative.
Equasym XR doit être utilisé avec prudence chez les patients ayant des antécédents de crises d'épilepsie, les patients présentant des anomalies préexistantes à l'EEG sans avoir de crises d'épilepsie et même les patients sans antécédents d'épilepsie ni anomalies à l'EEG, étant donné que l'expérience clinique a montré que ce médicament peut abaisser le seuil épileptogène chez un faible nombre de patients. Si la fréquence des crises augmente chez un patient, l'administration de méthylphénidate doit être arrêtée.
Si le traitement est arrêté, une surveillance étroite est nécessaire du fait de possibles manifestations de sevrage et pour détecter des dépressions ou des effets d'une hyperactivité chronique. Un suivi à long terme pourra par conséquent s'avérer nécessaire chez certains patients.
Pour les interactions avec les agonistes alpha-2 d'action centrale, comme la clonidine (voir «Interactions»).
Dans de rares cas, des symptômes de troubles de la vision se sont produits. On a rapporté alors des troubles de l'accommodation et une vision floue.
Les stimulants à effet sur le système nerveux central, méthylphénidate compris, ont été mis en relation avec le déclenchement ou l'aggravation de tics moteurs ou verbaux. Avant de commencer un traitement par stimulants, le patient doit donc d'abord subir un examen clinique visant à déterminer s'il a des tics. L'anamnèse familiale doit être également prise en compte.
On ne connaît pas entièrement le profil de sécurité et d'efficacité à long terme du méthylphénidate. Les patients nécessitant un traitement au long cours doivent donc être surveillés attentivement, avec des hémogrammes, des hémogrammes différentiels et des numérations plaquettaires à intervalles réguliers.
Une surveillance attentive est nécessaire lors de l'arrêt du traitement, étant donné que l'arrêt peut démasquer une dépression ou une hyperactivité chronique. Certains patients auront éventuellement besoin d'examens de suivi pendant une période prolongée.
Les patientes en âge de procréer (à partir des premières règles) ne doivent pas prendre de méthylphénidate, sauf si ce traitement est indispensable (voir «Grossesse/Allaitement» et «Données précliniques»).
Les patients présentant des problèmes héréditaires rares d'intolérance au fructose, de malabsorption du glucose-galactose ou de déficience en sucrase-isomaltase ne doivent pas prendre ce médicament.
Les patients présentant une intolérance au fructose/au galactose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par capsule, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsDes études pharmacologiques effectuées chez l'homme ont montré que le méthylphénidate peut inhiber le métabolisme des anticoagulants de type coumarinique, de certains anticonvulsivants (phénobarbital, phénytoïne, primidone), de la phénylbutazone et de certains antidépresseurs (antidépresseurs tricycliques, inhibiteurs sélectifs de la recapture de sérotonine). La dose de ces médicaments doit éventuellement être réduite. Du fait d'une élévation possible de la tension artérielle, Equasym XR sera administré avec prudence en cas d'association avec des agents vasopresseurs. (voir «Mises en garde et précaution»).
Le méthylphénidate peut réduire l'efficacité des antihypertenseurs.
Des effets indésirables graves ont été signalés en cas d'utilisation simultanée de clonidine, y compris des cas de mort subite. La sécurité de l'utilisation du méthylphénidate en association avec la clonidine ou d'autres agonistes alpha-2 à effet central n'a pas été systématiquement étudiée à ce jour.
Utilisation avec des médicaments dopaminergiques
La prudence est recommandée lors de l'administration de méthylphénidate avec des médicaments dopaminergiques, y compris les antipsychotiques. L'augmentation des concentrations extracellulaires de dopamine est l'un des principaux effets du méthylphénidate; de ce fait, le méthylphénidate peut provoquer des interactions pharmacodynamiques lorsqu'il est administré concomitante avec des agonistes directs ou indirects de la dopamine (y compris la DOPA et les antidépresseurs tricycliques) ou avec les antagonistes de la dopamine (y compris les antipsychotiques).
Administration concomitante de médicaments sérotoninergiques
L'administration concomitante de méthylphénidate et d'autres médicaments sérotoninergiques (incluant triptans, ISRS, IRSN, lithium, fentanyl et ses analogues, tramadol, dextrométhorphane, tapentadol, mépéridine, méthadone, pentazocine ou millepertuis (Hypericum), de médicaments inhibiteurs du métabolisme de la sérotonine (dont les IMAO, tels que le bleu de méthylène) ou de précurseurs de la sérotonine (p.ex. tryptophane) n'est pas recommandée, car ceci peut provoquer le développement d'un syndrome sérotoninergique (voir «Mises en garde et précautions»). Il a été démontré que le méthylphénidate augmente les concentrations extracellulaires de sérotonine et de noradrénaline et qu'il semble avoir une faible capacité de liaison aux transporteurs de la sérotonine.
Les effets indésirables des médicaments psychoactifs – dont Equasym XR – sur le système nerveux central peuvent être renforcés par l'alcool. Il est donc déconseillé aux patients de consommer de l'alcool au cours du traitement.
Anesthésiques halogénés:
Il existe un risque de poussée hypertensive soudaine au cours d'une opération. En cas d'intervention planifiée, le traitement au méthylphénidate doit être adapté transitoirement aux besoins de l'opération (par exemple suspendre l'administration le jour de l'opération) après concertation avec le psychiatre traitant / le psychiatre pédiatrique et les anesthésistes.
Grossesse, allaitementGrossesse
Les données d'une étude de cohorte portant sur au total 3 400 grossesses exposées au cours du premier trimestre n'indiquent pas d'augmentation générale du risque d'anomalies congénitales. La fréquence des malformations cardiaques était légèrement plus élevée (risque relatif poolé ajusté 1,3; IC à 95 %: 1,0–1,6) et correspondait à 3 enfants supplémentaires présentant une malformation cardiaque congénitale sur 1 000 femmes ayant reçu du méthylphénidate au cours du premier trimestre par rapport aux grossesses non exposées.
Des cas de toxicité cardiorespiratoire néonatale, notamment des foetales tachycardies et des détresses respiratoires, ont été rapportés dans le cadre des notifications spontanées.
Des expérimentations animales sur le méthylphénidate ont révélé une toxicité sur la reproduction (voir «Données précliniques»). Le risque potentiel chez l'homme est inconnu.
Le méthylphénidate ne doit pas être utilisé au cours de la grossesse, sauf en cas de nécessité absolue.
Allaitement
On ignore si le méthylphénidate ou ses métabolites passent dans le lait maternel. Pour des raisons de sécurité, les mères qui allaitent doivent toutefois renoncer à une utilisation d'Equasym XR.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLe méthylphénidate peut provoquer des vertiges, une somnolence et des troubles visuels (problèmes d'accommodation, vue trouble). La prudence est donc recommandée pour les activités potentiellement dangereuses telles que la conduite de véhicules ou l'utilisation de machines.
Effets indésirablesEstimation des fréquencesdes effets indésirables: très fréquents ≥10 %; fréquents ≥1 % à <10 %; occasionnels ≥0,1 % à <1 %; rares ≥0,01 % à <0,1 %; très rares <0,01 %, fréquence inconnue (fréquence impossible à estimer à partir des données disponibles).
Certains effets indésirables observés lors de utilisation de médicaments contenant du méthylphénidate sont considérés comme un effet de classe. Les effets indésirables les plus fréquents sont les suivants:
Infectionset infestations: rhinopharyngite.
Troubles du métabolisme et de la nutrition: anorexie, diminution de l'appétit, prise de poids et de taille modérément réduite en cas d'utilisation prolongée chez les enfants
Affections psychiatriques: insomnie, nervosité, anorexie, faiblesse affective, agressivité, excitation, anxiété, dépression, irritabilité, comportement anormal
Affections du système nerveux: céphalées, vertiges, dyskinésie, hyperactivité psychomotrice, somnolence
Affections cardiaques: arythmie, tachycardie, palpitations
Affections vasculaires: hypertonie
Affections respiratoires, thoraciques et médiastinales: toux, douleurs pharyngées et laryngées
Affections gastro-intestinaux: douleurs abdominales, diarrhée, nausées, maux d'estomac et vomissements, sécheresse de la bouche, dyspepsie, douleurs dentaires
Affections de la peau et du tissu sous-cutané: alopécie, prurit, éruptions cutanées, urticaire
Affections musculo-squelettiques et du tissu conjonctif: arthralgie
Troubles généraux et anomalies au site d'administration: pyrexie, ralentissement de la croissance en cas d'utilisation prolongée chez les enfants, sentiment d'agitation
Investigations: modifications de la tension artérielle et de la fréquence cardiaque (généralement à la hausse), perte de poids
Indépendamment de leur fréquence, les effets indésirables cliniquement importants ou graves associés aux médicaments contenant du méthylphénidate sont les suivants:
Affections psychiatriques: suicide, tentatives de suicide, pensées suicidaires, comportements stéréotypés (souvent répétés de façon pathologique), hallucinations tactiles
Affections du système nerveux: mouvements choréiformes, tics ou détérioration des tics existants, troubles nerveux réversibles, migraines, syndrome malin des neuroleptiques
Affections oculaires: troubles de l'accommodation
Affections cardiaques: mort cardiaque subite, infarctus du myocarde
Affections vasculaires: troubles cérébrovasculaires ou hémorragie, vascularite, syndrome de Raynaud, sensation de froid dans les extrémités (mains ou pieds froids)
Affections gastro-intestinaux: trouble de la fonction hépatique
Affections de la peau et du tissu sous-cutané: dermatite exfoliatrice, syndrome de Stevens-Johnson, érythème polymorphe, exanthème pigmenté
Affections des organes de reproduction et du sein: gynécomastie
En outre des effets indésirables ont été mentionnés en rapport avec l'utilisation d'Equasym XR:
La nervosité et les insomnies sont des effets indésirables très fréquents au début du traitement, mais ces problèmes peuvent généralement être contrôlés par une réduction de la dose et/ou en supprimant la dose de l'après-midi ou du soir.
Une réduction de l'appétit est également fréquente, mais généralement transitoire.
Affections hématologiques et du système lymphatique
Très rares: leucopénie, thrombopénie, anémie.
Troubles du métabolisme et de la nutrition
Fréquents: anorexie (diminution de l'appétit), prise de poids ralentie dans le cadre d'une utilisation prolongée chez l'enfant.
Affections psychiatriques
Très fréquents: insomnie, nervosité.
Fréquents: comportement anormal, agressivité, excitation, anxiété, dépression, irritabilité, troubles du sommeil, bruxisme*.
Très rares: hallucinations, troubles psychotiques, comportements suicidaires (y compris suicide), tics ou aggravation de tics préexistants, syndrome de Gilles de la Tourette, états dépressifs transitoires.
Fréquence inconnue: logorrhée, trouble de la libido.
Affections du système nerveux
Très fréquents: insomnie, nervosité.
Fréquents: céphalées, somnolence, vertiges, dyskinésie, tremor, abattement, hyperactivité.
Très rares: convulsions, mouvements choréo-athétosiques.
De très rares cas insuffisamment documentés de syndrome malin des neuroleptiques (SMN) ont été rapportés. La plupart de ces rapports concernent des patients qui prenaient également d'autres médicaments et le rôle du méthylphénidate n'est pas clair.
Fréquence inconnue: dysphémie.
Affections oculaires
Rares: difficultés d'accommodation et vue trouble.
Affections cardiaques
Fréquents: tachycardie, palpitations cardiaques, arythmie, modification de la tension artérielle et de la fréquence cardiaque (généralement augmentée).
Rare: angine de poitrine.
Très rare: arrêt cardiaque.
Fréquence inconnue: cardiomyopathie.
Affections vasculaires
Très rares: artérite et/ou occlusion cérébrale.
Fréquence inconnue: contusion, épistaxis.
Affections gastro-intestinaux
Fréquents: douleurs abdominales, nausées et vomissements. Ces problèmes se manifestent surtout au début du traitement et peuvent être atténués par une prise de nourriture avec le médicament. Sécheresse buccale.
Affections hépato-biliaires
Très rares: anomalies de la fonction hépatique, pouvant aller d'une augmentation des taux de transaminases jusqu'à un coma hépatique.
Affections du système immunitaire
Occasionnels: réactions d'hypersensibilité telles qu'angio-œdèmes, réactions anaphylactiques, gonflements de l'oreille, réactions bulleuses, réactions exfoliatives, urticaire, prurit, éruptions cutanées et éruptions.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée, prurit, urticaire, chute des cheveux.
Très rares: purpura thrombopénique, dermatite exfoliative et érythème polymorphe.
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: arthralgies.
Très rares: crampes musculaires.
Fréquence inconnue: trismus*.
Affections du rein et des voies rénales
Occasionnels: hématurie.
Fréquence inconnue: incontinence.
Affections des organes de reproduction et du sein
Fréquence inconnue: dysfonction érectile.
Autres
Fréquent: fièvre.
Occasionnels: hyperhidrose.
Rares: des retards de croissance ont été rapportés lors d'une utilisation prolongée de stimulants chez l'enfant.
Très rare: mort subite.
* D'après la fréquence calculée au cours des études consacrées au TDAH chez l'adulte (aucun cas n'a été rapporté au cours des études pédiatriques)
Expériences post-commercialisation
Les effets indésirables identifiés après la commercialisation d'Equasym sont listés ci-dessous. Les effets indésirables sont présentés par catégories de fréquence (d'après les taux de rapports spontanés). Les fréquences sont indiquées conformément à la convention suivante:
Très fréquents: ≥1/10
Fréquents: ≥1/100 à <1/10;
Occasionnels: ≥1/1 000 à <1/100;
Rares: ≥1/10'000 à <1/1000;
Très rares: <1/10'000, y compris cas isolés
Troubles des organes de reproduction et des seins:
Très rares: érections prolongées et/ou douloureuses (priapisme).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageIl faut également tenir compte de la part à libération différée des formulations de méthylphénidate lors du traitement de patients surdosés.
Signes et symptômes
Parmi les signes et symptômes d'un surdosage de méthylphénidate [ou dénomination de la préparation] résultant principalement d'une hyperstimulation du système nerveux central et sympathique, on trouve: vomissements, agitation, secousses musculaires, convulsions suivies de coma, confusion, hallucinations (auditives et/ou visuelles), transpiration excessive, céphalées, pyrexie, tachycardie, palpitations, augmentation de la fréquence cardiaque, arythmies sinusales, hypertension, mydriase, sécheresse de la bouche et rhabdomyolyse.
Traitement
Il n'existe aucun antidote spécifique pour traiter un surdosage d'Equasym XR.
Le traitement consiste en des mesures de soutien appropriées, en empêchant le patient de se nuire et en le protégeant contre les stimulus extérieurs susceptibles de renforcer l'hyperexcitabilité déjà présente. Chez un patient conscient dont les symptômes ne sont pas trop sévères, on peut évacuer le contenu gastrique par des vomissements provoqués ou par un lavage gastrique. En présence d'une intoxication sévère, il faut administrer un barbiturique d'action rapide à une dose adaptée avec précaution avant de procéder au lavage gastrique.
Il faut veiller très soigneusement au maintien de la circulation sanguine et de la respiration. Il se peut que des mesures extérieures de refroidissement soient nécessaires en cas d'hyperpyrexie.
L'efficacité de la dialyse péritonéale et de l'hémodialyse extracorporelle dans le traitement de surdosages d'Equasym XR n'est pas établie.
Propriétés/EffetsCode ATC
N06BA04
Mécanisme d'action
Mécanisme d'action: Equasym XR est un stimulant léger du SNS avec un effet marqué sur les activités mentales et motrices. Son mode d'action chez l'homme n'est pas entièrement élucidé, mais on suppose que les effets sont dus à une stimulation corticale et une éventuelle stimulation du système réticulaire activateur ascendant.
Le mécanisme par lequel Equasym XR atteint ses effets comportementaux et mentaux chez l'enfant n'est pas clairement établi; on ne dispose pas de données démontrant définitivement comment ces effets sont liés à l'état du système nerveux central.
Pharmacodynamique
On suppose que le médicament inhibe la recapture de la noradrénaline et de la dopamine au niveau des terminaisons nerveuses présynaptiques et que la libération de ces monoamines dans l'espace extra-neuronal est ainsi accrue. Equasym XR est un mélange racémique composé des énantiomères D-thréo-méthylphénidate et L-thréo-méthylphénidate. L'énantiomère D est pharmacologiquement plus actif que l'énantiomère L.
Efficacité clinique
Le méthylphénidate est un stimulant du SNC apparenté aux amphétamines.
Dans une étude pivot, 318 patients sur 327 patients randomisés âgés de 6 à 12 ans ont reçu au moins une dose du médicament expérimental. Pour la population per protocole (279 patients traités pendant 21 jours), les scores sur l'échelle IOWA Conners, l'évaluation du paramètre cible primaire pendant la journée d'école par l'enseignant, ont donné les résultats suivants:
|
|
Placebo
(N = 39)a
|
Méthylphénidate à libération immédiate
(N = 120)b
|
Equasym Retard
(N = 120)
| |
Jugement global de l'enseignant
Échelle IOWA Conners I/H
Valeur moyenne
(écart-type)
|
6,0 (3,64)
|
6,1 (3,74)
|
5,8 (3,59)
| |
Jour 21/arrêt du médicament
| |
Moyenne des MC
(facteur standard)
|
7,7 (0,50)
|
4,3 (0,29)
|
4,5 (0,29)
| |
Intervalle de confiance à 95 %
|
6,69; 8,66
|
3,71; 4,84
|
3,98; 51,0
| |
Différence par rapport au placebo
|
–
|
–3,4
|
–3,1
| |
Intervalle de confiance à 95 % pour la différence
|
–
|
–4,53; –2,26
|
–4,26; –2,00
| |
Valeur pc
|
–
|
< 0,001
|
< 0,001
| |
Différence par rapport au méthylphénidate à libération immédiate
|
–
|
–
|
–0,3
| |
Limite inférieure de l'intervalle de confiance à 97,5 % pour la différence
|
–
|
–
|
–1,06
| |
a
N = 38 au Jour 7; b N = 118 au Jour 7; c Groupes de traitement comparés en utilisant ANCOVA, avec l'effet du traitement et la valeur initiale comme covariantes
|
Des différences ont été observées entre le groupe Equasym retard et le groupe méthylphénidate à libération immédiate pour les variables cibles secondaires, le jugement par les parents sur l'échelle IOWA Conners, contrairement aux résultats pour le paramètre cible primaire. Ces observations étaient basées sur les évaluations réalisées plus tard dans la soirée qui indiquent une perte partielle d'efficacité d'Equasym retard en fin de journée en comparaison avec l'administration deux fois par jour du méthylphénidate à libération immédiate. Voir également les rubriques Pharmacocinétique et Posologie/Mode d'emploi.
Mélange racémique
Equasym XR est un mélange racémique composé des énantiomères D-thréo-méthylphénidate et L-thréo-méthylphénidate. L'énantiomère D est pharmacologiquement plus actif que l'énantiomère L.
PharmacocinétiqueAbsorption
Le profil plasmatique d'Equasym XR correspond à une libération biphasique du principe actif, avec une augmentation initiale rapide (de façon similaire aux comprimés de méthylphénidate à libération immédiate) et une deuxième augmentation environ trois heures plus tard, après quoi la concentration baisse progressivement (voir le graphique ci-dessous présentant les valeurs d'enfants atteints de TDAH, avec calcul des valeurs au bout de plus de 8,5 heures à l'aide de modèles pharmacocinétiques).
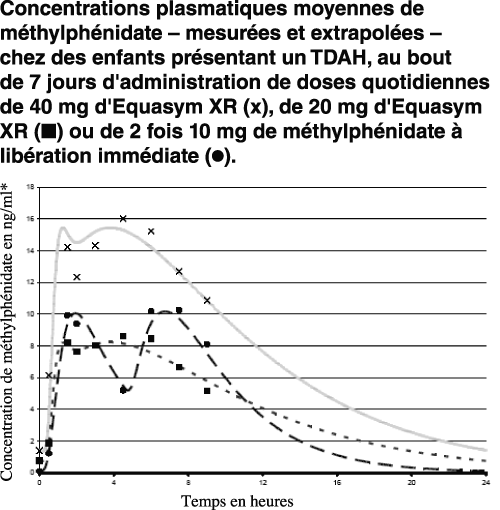
* Les valeurs jusqu'à 8 h sont des valeurs mesurées; les courbes reposent sur des extrapolations.
Après l'administration de 0,30 mg/kg, des concentrations plasmatiques maximales d'environ 40 nmol/l (11 ng/ml) sont atteintes en moyenne au bout de 1 à 2 h. Les concentrations plasmatiques maximales présentent une grande variabilité interindividuelle.
Le domaine de concentration observé au bout de 1,5 h était de 3,2 à 13,3 ng/ml, avec une valeur moyenne de 7,7 ng/ml. Au bout de 4,5 h, la deuxième vague de libération de principe actif a conduit chez la majorité des sujets à un deuxième pic de concentration de 4,9 à 15,5 ng/ml, avec une valeur moyenne de 8,2 ng/ml.
L'administration d'une formule à libération prolongée une fois par jour au petit-déjeuner au lieu de deux administrations d'une formule à libération immédiate (au petit-déjeuner et au déjeuner) peut être associée à un plus faible pic de concentration du méthylphénidate après le déjeuner et conduire ainsi à une différence au niveau du comportement. Cet aspect doit être pris en compte lors de l'appréciation des besoins individuels du patient.
L'aire sous la courbe de la concentration plasmatique (AUC) et la concentration plasmatique maximale sont proportionnelles à la dose.
Prise avec de la nourriture: une étude auprès de volontaires sains a montré que l'absorption du médicament avec un repas riche en graisse ralentit l'absorption (Tmax) d'environ une heure, réduit la concentration maximale (Cmax) d'environ 30 % et augmente la quantité absorbée (AUC) d'environ 17 % (voir le tableau et le graphique).
Pharmacocinétique d'Equasym XR chez des adultes à jeun vs après un repas
|
Médicament
|
Dose
|
Paramètre pharmacocinétique
Valeurs moyennes (ET)
| |
|
|
Cmax (ng/ml)
|
Tmax (h)
|
AUC (0-inf) (ng.h/ml)
| |
Equasym XR
|
2 × 20 mg après un repas
|
11,7 (4,6)
|
5,7 (1,7)
|
116,5 (48,0)
| |
Equasym XR
|
2 × 20 mg à jeun
|
8,7 (3,0)
|
4,8 (1,2)
|
99,8 (41,3)
|
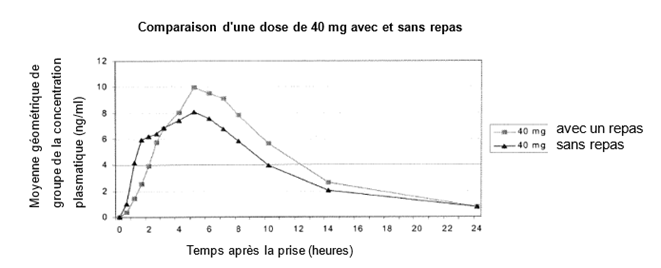
Ouverture de la capsule et prise du granulat incorporé à de la nourriture: les Cmax, Tmax et AUC du contenu de la capsule d'Equasym XR intégré à de la nourriture sont similaires (bioéquivalents) aux valeurs mesurées pour les capsules avalées intactes. Par conséquent, Equasym XR peut être avalé en tant que capsule intacte ou sous forme de granulat incorporé à de la compote de pomme ou à un autre aliment ayant la consistance d'une bouillie. Pour les deux formes d'administration, il faut veiller à ne pas mâcher le granulat.
En raison d'un important effet de premier passage hépatique, la biodisponibilité systémique est d'environ 30 % (11 à 51 %) de la dose.
Distribution
Dans le sang, le méthylphénidate et ses métabolites se répartissent entre le plasma (57 %) et les érythrocytes (43 %). Le méthylphénidate et ses métabolites sont faiblement liés aux protéines plasmatiques (10 à 33 %). On a calculé un volume de distribution apparent de 13,1 l/kg.
Métabolisme
Le méthylphénidate est largement et rapidement métabolisé. Les concentrations plasmatiques maximales de l'acide alpha-phényl-2-pipéridine acétique sont atteintes environ 2 heures après l'administration du méthylphénidate et sont environ 30 à 50 fois plus élevées que celles de la substance active inchangée. La demi-vie de l'alpha-phényl-2-pipéridine acétique est environ deux fois supérieure à celle du méthylphénidate et la clairance systémique moyenne est de 0,17 l/h/kg. Les métabolites hydroxylés – par exemple hydroxyméthylphénidate et acide hydroxyritalinique – ne sont décelables qu'en faibles quantités. L'activité thérapeutique semble due essentiellement à la substance active inchangée.
Élimination
Le méthylphénidate est éliminé du plasma avec une demi-vie moyenne de 2 heures et la clairance systémique moyenne calculée est d'environ 10 l/h/kg.
La demi-vie moyenne (t½) du méthylphénidate après l'administration chez des volontaires sains a été plus longue dans le cas d'Equasym XR (t½ = 6,8h) que dans le cas de l'hydrochlorate de méthylphénidate sous forme de comprimés à libération immédiate (t½ = 2,9h). Cela signifie que le processus d'élimination observé avec Equasym XR dépend du taux de libération du méthylphénidate par la formule à libération prolongée.
En l'espace de 48 à 96 heures, 78 à 97 % de la dose administrée sont éliminés sous forme de métabolites dans les urines et 1 à 3 % dans les selles.
La plus grande partie de la dose est éliminée sous forme d'acide alpha-phényl-2-pipéridine acétique (APPA, 60 à 86 %) dans les urines.
Cinétique pour certains groupes de patients
Patients présentant une insuffisance rénale
Les données d'élimination chez des patients présentant une fonction rénale normale laissent supposer que l'élimination rénale du méthylphénidate inchangé n'est pratiquement pas diminuée lors d'insuffisance rénale. L'élimination rénale du métabolite acide alpha-phényl-2-pipéridine-acétique peut toutefois être réduite.
Patients présentant une insuffisance hépatique
On ne dispose pas de données sur l'utilisation d'Equasym XR chez les patients présentant une insuffisance hépatique.
Patients pédiatriques
La pharmacocinétique d'Equasym XR n'a pas été étudiée chez les enfants de moins de 7 ans.
Données précliniquesMutagenicité
Des tests in vitro – test de mutation inverse d'Ames, test de mutation antérograde sur cellules de lymphome de souris, test d'aberrations chromosomiques sur lymphocytes humains – n'ont révélé aucun effet mutagène du méthylphénidate. Une augmentation des échanges de chromosomes sœurs et des aberrations chromosomiques a été observée dans des tests in vitro sur des cellules ovariennes de hamster chinois, mais seulement à des doses élevées cytotoxiques. Les tests des micronoyaux effectués pour le méthylphénidate sur des cellules de moelle osseuse de souris in vivo ont été négatifs.
Cancérogénicité
Dans des études à long terme sur le potentiel cancérigène chez des rats et chez des souris, seules les souris mâles ont présenté une incidence accrue de tumeurs malignes du foie. On ignore quelle signification ces constats peuvent avoir pour l'utilisation chez l'homme.
Toxicité de reproduction
Des indices suggérant que le méthylphénidate peut avoir des effets tératogènes ont été trouvés chez deux espèces d'animaux: spina bifida et malformations des extrémités chez le lapin et signes manifestes d'une induction d'anomalies de la colonne vertébrale chez le rat.
Même aux doses plusieurs fois supérieures à la dose thérapeutique, le méthylphénidate n'a pas eu d'effets négatifs sur la performance de reproduction ou sur la fertilité.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver le médicament dans l'emballage d'origine, à température ambiante (15 à 25 °C), hors de portée des enfants.
Numéro d’autorisation57295 (Swissmedic).
Présentation30 et 60 capsules retard de 10 mg [A]
30 et 60 capsules retard de 20 mg [A]
30 et 60 capsules retard de 30 mg [A]
Titulaire de l’autorisationTakeda Pharma AG, 8152 Opfikon
Mise à jour de l’informationMars 2023
|


