CompositionPrincipes actifs
Leuprorelinum ut leuprorelini acetas.
Excipients
Copoly(dl-lactidum-glycolidum) pro praeparatione.
Indications/Possibilités d’emploiTraitement symptomatique des carcinomes prostatiques évolués, hormono-dépendants. A titre d'alternative, lorsqu'une orchidectomie ou l'administration d'oestrogènes n'est pas indiquée ou difficile à imposer au patient.
Posologie/Mode d’emploiPosologie usuelle
Il est recommandé d'administrer 3,6 mg de leuproréline en dose unique toutes les 4 semaines.
Mode d'emploi
L'implant est injecté en sous-cutané dans la région abdominale. Changer le point d'injection - mais toujours au niveau de la région abdominale - chaque mois.
L'administration de Leuproréline Sandoz n'est autorisée que chez les hommes adultes et ne doit se faire que sous la surveillance d'un médecin expérimenté en oncologie.
A la phase initiale du traitement, il convient d'envisager l'administration complémentaire d'un anti-androgène approprié afin d'atténuer les conséquences éventuelles de l'élévation initiale de la testostérone et l'aggravation temporaire des symptômes cliniques.
Il faut suivre la réponse à l'acétate de leuproréline en mesurant les taux sériques de testostérone et d'antigène prostatique spécifique.
Recommandations posologiques spéciales
Enfants/adolescents: L'efficacité et la sécurité d'emploi de Leuproréline Sandoz 1 mois n'ont pas été évaluées chez l'enfant et l'adolescent. Il n'y a aucune indication à l'administration du produit dans ce groupe d'âge.
Patients âgés: Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Insuffisance hépatique et rénale: Une adaptation de la dose n'est pas nécessaire (cf. «Pharmacocinétique»).
Contre-indicationsHypersensibilité au principe actif, aux nonapeptides ou décapeptides similaires ou à l'un des excipients indiqués dans la composition.
Leuproréline Sandoz n'est pas indiqué si le carcinome s'avère non hormono-dépendant.
Mises en garde et précautionsRéactions d'hypersensibilité
Des cas isolés d'anaphylaxie ont été déclarés. Des réactions allergiques se manifestant par des réactions d'hypersensibilité au point d'injection et des réactions systémiques ont été observées.
Les réactions locales marquées peuvent amoindrir la résorption de la leuproréline à partir du dépôt. Dans un tel cas, il convient de déterminer le taux de testostérone.
Apoplexie hypophysaire
Dans le cadre de la surveillance post-marketing, de rares cas d'apoplexie hypophysaire (un syndrome clinique secondaire à un infarctus de l'hypophyse) ont été rapportés à la suite de l'administration d'analogues de la gonadoréline (GnRH). Un adénome hypophysaire a été diagnostiqué dans la plupart de ces cas. La majorité de ces cas d'apoplexie hypophysaire se sont produits en l'espace de 2 semaines – et certains même en l'espace d'une heure – après l'administration de la première dose. Chez ces patients, l'apoplexie hypophysaire s'est manifestée par des céphalées soudaines, des vomissements, des anomalies visuelles, une ophtalmoplégie, un état mental altéré et parfois un collapsus cardio-vasculaire. Un traitement médical immédiat était nécessaire.
Par conséquent, les patients souffrant d'un adénome hypophysaire connu ne doivent pas être traités par un agoniste de la GnRH.
Risque de suicide: Le risque de survenue de dépression (qui peut être grave) est accru chez les patients traités par des agonistes de la GnRH. Les patients avec des dépressions préexistantes peuvent présenter un risque suicidaire.
Densité osseuse/risque de fracture: Des modifications de la densité osseuse peuvent apparaître lors d'une situation hypo-œstrogénique. La baisse de la densité osseuse peut être réversible après l'arrêt de Leuproréline Sandoz 1 mois. La carence en androgènes résultant du traitement du carcinome de la prostate peut augmenter le risque de fracture.
Convulsions: Dans le cadre de la pharmacovigilance, on a rapporté la survenue de convulsions. Il s'agissait à cet égard en partie de patients qui présentaient d'autres facteurs de risque de convulsions (comme par exemple, anamnèse d'épilepsie, tumeur intracrânienne, comédication avec des médicaments pour lesquels un risque de convulsions est connu). Toutefois, il existe également des rapports de patients qui ne présentent pas ces facteurs de risque.
Facteurs de risque cardio-vasculaire/maladies cardio-vasculaires
Sous traitement par agonistes de la GnRH, on a rapporté un risque accru de diabète sucré et/ou d'événements cardio-vasculaires. En particulier, dans plusieurs études épidémiologiques importantes chez des patients présentant un cancer de la prostate, on a observé un risque accru de 20% environ d'infarctus du myocarde et d'accident vasculaire cérébral. Chez les patients chez lesquels d'autres facteurs de risque cardio-vasculaire (par exemple, hypertension artérielle, hyperlipidémie) existent ou qui présentent des maladies cardio-vasculaires préexistantes, une évaluation soigneuse du rapport bénéfice/risque doit être effectuée.
Avant l'instauration d'un traitement par la leuproréline, la pression artérielle, la glycémie et le profil lipidique doivent être déterminés. Pendant le traitement, une surveillance s'impose chez les patients pour lesquels ces facteurs de risque ainsi que les symptômes pouvant y être liés laissent présumer du développement d'une maladie cardio-vasculaire. Des facteurs de risque déjà présents (diabète sucré, hypercholestérolémie, hypertension artérielle) doivent être traités de façon appropriée, c'est-à-dire selon chacune des directives.
Effet sur l'intervalle QT
La privation androgénique peut prolonger l'intervalle QT. Chez les patients présentant des antécédents ou des facteurs de risques de l'allongement de l'intervalle QT ainsi que chez les patients recevant de manière concomitante des médicaments susceptibles d'allonger l'intervalle QT (voir «Interactions»), il faut évaluer le rapport bénéfice-risque en tenant compte du risque potentiel de torsades de pointe avant d'initier un traitement par acétate de leuproréline.
De plus, en relation avec l'utilisation d'agonistes de la GnRH, on a rapporté chez l'homme un risque accru de mort subite d'origine cardiaque.
Carcinome de la prostate
Un traitement par acétate de leuproréline entraîne initialement une augmentation de courte durée du taux sérique de testostérone, qui peut être accompagnée par une intensification passagère de certains symptômes de la maladie (par exemple faiblesse musculaire, augmentation ou apparition de douleurs osseuses, obstruction des voies urinaires, compression médullaire, œdème). Les patients qui présentent un risque de complications neurologiques, des métastases vertébrales ou une obstruction des voies urinaires doivent de ce fait, autant que possible, rester sous observation constante à l'hôpital pendant les premières semaines du traitement.
On peut envisager l'administration supplémentaire d'un anti-androgène adapté lors de la première phase du traitement pour atténuer les éventuelles manifestations consécutives à la hausse initiale du taux de testostérone et une aggravation des symptômes cliniques.
L'augmentation initiale des douleurs rétrocède spontanément, généralement sans arrêt du traitement par Leuproréline Sandoz. Par la suite, surviennent des symptômes liés au sevrage de la testostérone (cf. «Effets indésirables»).
La réponse à l'acétate de leuproréline doit être vérifiée à l'aide de mesures du taux sérique de testostérone et de l'antigène prostate spécifique.
Après castration chirurgicale, Leuproréline Sandoz n'entraîne aucune diminution supplémentaire du taux de testostérone.
Changements métaboliques
Une hyperglycémie et un risque accru de développer un diabète ont été signalés chez des hommes recevant des agonistes de la LHRH. L'hyperglycémie peut représenter le développement d'un diabète sucré ou une aggravation du contrôle de la glycémie chez les patients diabétiques. La glycémie et/ou l'hémoglobine glycosylée (HbA1c) doivent être surveillées régulièrement chez les patients recevant un agoniste de la LHRH, et les patients doivent être traités selon la pratique actuelle pour le traitement de l'hyperglycémie ou du diabète. Les changements métaboliques associés aux agonistes de la LHRH peuvent également inclure la stéatose hépatique.
Hypertension intracrânienne idiopathique
Des cas d'hypertension intracrânienne idiopathique (pseudotumeur cerebri) ont été rapportés chez des patients recevant de la leuproréline. Les patients doivent être informés des signes et symptômes d'hypertension intracrânienne idiopathique, y compris des céphalées sévères ou récurrentes, des troubles de la vision et des acouphènes. En cas d'hypertension intracrânienne idiopathique, l'arrêt de la leuproréline doit être envisagé.
Effets secondaires cutanés sévères
Des effets indésirables cutanés sévères (SCAR), y compris le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (TEN), qui peuvent mettre la vie en danger ou être mortels, ont été signalés en association avec un traitement par la leuproréline. Au moment de la prescription, les patients doivent être informés des signes et symptômes et être étroitement surveillés pour détecter des réactions cutanées graves. Si des signes et des symptômes évocateurs de ces réactions apparaissent, la leuproréline doit être arrêtée immédiatement et un autre traitement doit être envisagé si nécessaire.
InteractionsAucune interaction connue à ce jour.
Aucune étude d'interaction n'a été réalisée avec Leuproréline Sandoz. Cependant, d'après le métabolisme de l'acétate de leuproréline, les interactions devraient être rares: en effet, la leuproréline est dégradée principalement par des peptidases et non pas par le cytochrome P 450, et la liaison aux protéines plasmatiques n'est que d'environ 46%
Cancer de la prostate
Puisqu'une privation androgénique peut entraîner une prolongation de l'intervalle QT, il faut soigneusement évaluer le risque d'une administration concomitante d'acétate de leuproréline et de médicaments pouvant provoquer des torsades de pointes comme les antiarythmiques de la classe IA (p.ex. quinidine, disopyramide) ou de la classe III (p.ex. amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc. Voir «Mises en garde et précautions», Effets sur l'intervalle QT.
Grossesse, allaitementIl n'existe pas d'indication de Leuproréline Sandoz chez les femmes.
La leuproréline est contre-indiquée lors de la grossesse.
On ignore si la leuproréline est excrétée dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machinesComme Leuproréline Sandoz 1 mois peut diminuer la capacité de réaction, le traitement peut entraver l'aptitude à la conduite automobile ou la manipulation de machines. Ce risque est accru en cas de consommation concomitante d'alcool.
Effets indésirablesUn traitement par acétate de leuproréline conduit initialement à une élévation brève des taux sériques de testostérone, ce qui peut donner lieu à une majoration transitoire de certains symptômes (apparition ou accentuation des douleurs osseuses, obstruction des voies urinaires et leur conséquence, compression de la moelle dorsale, fatigue musculaire des membres inférieurs, lymphoedème). Cette accentuation des troubles régresse habituellement spontanément sans aucune nécessité d'arrêter Leuproréline Sandoz 1 mois.
Les effets indésirables les plus fréquents sous traitement par acétate de leuproréline sont: vasodilatation (57%) et bouffées de chaleur (52%), augmentation de la transpiration (42%), réduction de la libido (47%), troubles de la puissance sexuelle (45%) et prise de poids (22%).
Dans ce qui suit, figurent les effets indésirables observés sous traitement par des préparations dépôt d'acétate de leuproréline en fonction des systèmes d'organes pendant les études cliniques et l'observation du marché, la pharmacovigilance. Les fréquences sont définies comme suit: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10); «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10'000 à <1/1000), «très rare» (<1/10'000); «fréquence inconnue»: à l'exclusion de rapports pendant la surveillance du marché, la fréquence précise ne peut pas être donnée.
Infections et infestations:
Fréquent: infections des voies aériennes, pharyngite, infections urinaires, bronchite
Occasionnels: candidose, mycose de la peau, rhinite
Fréquence inconnue: pneumonie
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes):
Fréquence inconnue: carcinomes de la peau/de l'oreille
Affections hématologiques et du système lymphatique:
Fréquent: anémie
Occasionnel: augmentation des réticulocytes
Fréquence inconnue: augmentation ou baisse des valeurs leucocytaires, baisse de la numération thrombocytaire, prolongation des temps de prothrombine et de céphaline activée
Affections du système immunitaire:
Occasionnel: réactions d'hypersensibilité (par ex. fièvre, prurit, éosinophilie, éruption cutanée)
Fréquence inconnue: réactions anaphylactiques
Affections endocriniennes:
Fréquence inconnue: infarctus hypophysaire (cf. «Mises en garde et précautions»), hypertrophie thyroïdienne
Troubles du métabolisme et de la nutrition:
Très fréquent: prise de poids (22%)
Fréquents: anorexie, augmentation de l'appétit, perte d'appétit, perte de poids, hyperglycémie, accentuation de la sensation de soif, hypercalcémie
Occasionnels: hypoglycémie, déshydratation
Fréquence inconnue: diabète, élévation de l'urée, hyperuricémie, hyperlipidémie (cholestérol global, cholestérol LDL, triglycérides), hyperphosphatémie, hypoprotéinémie, élévation de la créatinine, hypokaliémie, élévation de l'AUS
Affections psychiatriques:
Très fréquent: baisse de la libido (47%)
Fréquents: troubles du sommeil, angoisse, somnolence, changements d'humeur, dépression, nervosité, labilité émotionnelle
Occasionnel: pensées délirantes
Fréquence inconnue: augmentation de la libido, suicidalité
Affections du système nerveux:
Fréquents: paresthésies, hyperesthésies, tremblements, céphalées, vertiges
Occasionnels: troubles du goût, troubles de la mémoire, amnésie, troubles de la marche
Fréquence inconnue: léthargie, neuropathie périphérique, troubles neuromusculaires, étourdissements, neuromyopathie, perte de conscience, accident ischémique transitoire, apoplexie, hypertension intracrânienne idiopathique (pseudotumor cerebri).
Très peu de cas de convulsions ont été déclarés.
Affections oculaires:
Fréquents: troubles de la vue (par ex. vision trouble), amblyopie
Fréquence inconnue: sécheresse oculaire, autres troubles ophtalmologiques
Affections de l'oreille et du labyrinthe:
Fréquents: acouphènes, douleurs auriculaires
Fréquence inconnue: troubles auditifs, troubles de l'audition
Affections cardiaques:
Fréquents: angine de poitrine, tachycardie, arythmies, extrasystoles ventriculaires
Occasionnels: insuffisance cardiaque, bradycardie
Fréquence inconnue: allongements de l'intervalle QT (voir «Mises en garde et précautions» et «Interactions»), modifications de l'ECG (par ex. signes d'ischémie myocardique), souffle cardiaque, palpitations, infarctus du myocarde, bloc AV, mort subite d'origine cardiaque (cf. «Mises en garde et précautions»)
Affections vasculaires:
Très fréquents: bouffées de chaleur (52%), vasodilatation (57%)
Fréquents: thrombophlébite, œdème lymphatique, hypertension, syncope
Occasionnel: trouble de la circulation périphérique
Fréquence inconnue: thrombose, embolie pulmonaire, hypotension, douleur variqueuse, accident vasculaire cérébral
Par ailleurs, un seul cas de patient ayant développé une thrombose de l'artère centrale de la rétine a été signalé.
Affections respiratoires, thoraciques et médiastinales:
Fréquents: toux, dyspnée, épistaxis, hémoptysie, asthme bronchique, œdème pulmonaire aigu, emphysème pulmonaire
Occasionnel: bronchopneumopathie chronique obstructive
Fréquence inconnue: frottement pleural, infiltration pulmonaire, fibrose pulmonaire, obstruction des sinus, effusion pleurale, pneumopathie interstitielle
Affections gastro-intestinales:
Fréquents: sécheresse buccale, flatulences, constipation, diarrhées, nausées, vomissements, douleurs abdominales, gastrite
Fréquence inconnue: ulcère gastroduodénal, dysphagie, hémorragies gastro-intestinales, polypes rectaux, ulcères peptiques, nodosités dures dans la gorge
Affections hépatobiliaires:
Très fréquents: élévation des ASAT (20%), élévation du LDH dans le sérum (29%)
Fréquent: troubles de la fonction hépatique (par ex. élévation des ALAT, élévation des gamma-GT)
Occasionnels: lésion hépatocellulaire, hépatite cholestatique
Fréquence inconnue: sévère lésion hépatique, hyperbilirubinémie, ictère
Affections de la peau et du tissu sous-cutané:
Fréquents: sécheresse cutanée, éruption cutanée (y compris exanthème maculopapuleux), prurit, urticaire, modifications de la pilosité (en particulier augmentation ou diminution de la pilosité corporelle), alopécie, ecchymose, troubles de la pigmentation
Occasionnels: réactions de photosensibilité, sécheresse muqueuse
Fréquence inconnue: dermatite, lésions cutanées, nodosités, syndrome de Stevens-Johnson/nécrolyse épidermique toxique (SJS/TEN) (voir «Mises en garde et précautions»), éruption cutanée toxique, érythème polymorphe
Affections musculosquelettiques et du tissu conjonctif:
Très fréquent: douleurs osseuses (14%)
Fréquents: douleurs articulaires (arthralgies), maux de dos, faiblesse musculaire, douleurs aux extrémités, myalgie, crampes musculaires
Fréquence inconnue: perte de densité osseuse, fibrose du bassin, troubles articulaires (arthropathie), paralysie, fracture spinale, spondylarthrite ankylosante, ténosynovite, gonflement osseux, douleurs dans les membres
En outre, une ostéoporose a été signalée dans le cadre d'un traitement au long cours (6 à 12 mois) (voir «Mises en garde et précautions»).
Affections du rein et des voies urinaires:
Très fréquent: nycturie (17%)
Fréquents: dysurie, pollakiurie, hématurie
Occasionnels: incontinence urinaire, polyurie, troubles de la miction, rétention urinaire, protéinurie
Fréquence inconnue: miction impérieuse accrue, spasmes de la vessie, obstruction des voies urinaires
Affections des organes de reproduction et du sein:
Très fréquent: signes d'incapacité sexuelle (45%)
Fréquents: gynécomastie, atrophie testiculaire, élévation de l'ASP
Très rares: douleurs/tension/hypersensibilité dans les seins, gonflement pénien
Fréquence inconnue: douleurs dans la région prostatique, douleur testiculaire
Troubles généraux et anomalies au site d'administration:
Très fréquents: hypersudation (42%), réactions au point d'injection (13%), par ex. rougeurs, douleurs, œdèmes, démangeaisons, infections qui se résorbent également en général en cas de poursuite du traitement, fatigue/asthénie (13%), œdème périphérique (12%)
Fréquents: inflammations au point d'injection (dont des abcès), grelottements, douleurs généralisées, gonflement (os temporal), réactions d'hypersensibilité, fièvre, malaise, accès de transpiration, transpiration nocturne, frissons et symptômes pseudo-grippaux généraux.
Dans le cadre d'une étude clinique de phase I, lors de laquelle 15 personnes ont reçu de la Leuproréline Sandoz, on a pu relever les effets secondaires suivants (fréquence >1) (voir tableau 1):
Tableau 1: incidence des effets indésirables les plus fréquents au cours de l'étude en phase I
|
Symptôme
|
Nombre de cas (N = 15)
| |
Diminution de la libido
|
13
| |
Bouffées de chaleur
|
9
| |
Céphalées
|
6
| |
Sueurs
|
6
|
Au cours des études en phase II et III, réalisées cette fois auprès de 52 patients auxquels l'on a administré de la Leuproréline Sandoz, les effets secondaires suivants ont été relevés (voir tableau 2):
Tableau 2: incidence des effets indésirables les plus fréquents au cours des études en phases II et III
|
Classement par systèmes d'organes
|
Nombre de patients (N = 52)
| |
Troubles généraux (bouffées de chaleur)
|
16
| |
Affections cardiaques
|
3
| |
Affections du rein et des voies urinaires
|
2
| |
Anomalies au site d'administration
|
1
|
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageOn n'a pas observé à ce jour de signes d'intoxication.
Dans les études cliniques avec des préparations dépôt de l'acétate leuproréline des doses allant jusqu'à 20 mg/jour pendant 2 ans ont été administrées. Les effets indésirables de ces doses ne sont pas différents de ceux notés lors d'une administration de 1 mg/jour.
Propriétés/EffetsCode ATC
L02AE02
Mécanisme d'action/Pharmacodynamique
L'acétate de leuproréline, le principe actif, est un analogue de synthèse de l'hormone de libération des gonadotrophines hypophysaires (Gonadotropin-Releasing-Hormon, GnRH) qui contrôle la libération de la LH et de la FSH, hormones gonadotropes, du lobe antérieur de l'hypophyse. Ces hormones stimulent à leur tour la synthèse testiculaire des stéroïdes.
A l'opposé de la GnRH physiologique, libérée de façon pulsatile par l'hypothalamus, l'acétate de leuproréline, utilisé en thérapeutique de façon continue, bloque en permanence les récepteurs à la GnRH et provoque, après une stimulation initiale brève sa régulation négative. Chez les adultes, le résultat après trois à quatre semaines est une suppression réversible dans l'hypophyse de la libération des hormones gonadotrophines LH et FSH avec une baisse simultanée du taux de testostérone à des valeurs comparables à celles observées après une castration.
Cette diminution des taux de testostérone ou d'oestrogènes persiste de façon fiable pendant toute la durée du traitement. Il en résulte une inhibition du développement des tumeurs hormono-dépendantes telles que le cancer de la prostate. En conséquence, les symptômes s'améliorent sous traitement.
En cas d'administration répétée, on observe une diminution soutenue du taux de testostérone à des valeurs comparables à celles observées après une castration, sans que le taux de testostérone ne montre une augmentation passagère comme après une première injection.
La Leuproréline Sandoz a fait l'objet de 2 études. Pour la première étude clinique, il s'agissait d'une étude randomisée de phase III, lors de laquelle l'efficacité et la sécurité d'un traitement par Leuproréline Sandoz chez des patients présentant un carcinome prostatique métastasé ont été comparées au traitement par Lucrin Depot. La deuxième étude clinique ouverte était de phase II, au cours de laquelle l'efficacité et la sécurité de Leuproréline Sandoz, administrée aux patients souffrant d'un carcinome prostatique métastasé, étaient évaluées. Au total, 52 patients ont reçu le traitement par Leuproréline Sandoz.
PharmacocinétiqueAbsorption
Après injection de l'implant, l'acétate de leuproréline est libéré de façon continue du copolymère, composé d'acide glycolique et d'acide lactique dans un rapport 1:1 pendant une durée d'un mois. Le copolymère est résorbé comme un au matériel de suture chirurgical.
Une heure après l'injection, des taux sériques de 707 pg/ml ont été mesurés. Des taux sériques peuvent encore être décelés plus de 4 semaines après la dernière injection.
Dans le cadre de l'étude clinique de phase I, on a constaté qu'après avoir procédé à deux injections de Leuproréline Sandoz dans un intervalle de 28 jours, le taux de leuproréline était encore décelable chez 15 personnes saines et ce, jusqu'à 39 jours après la deuxième administration. Une augmentation de la testostéronomie au-delà du seuil de castration a pu être observée entre le 42ème et le 49ème jour suivant la deuxième administration.
Distribution/Métabolisme/Élimination
La distribution, le métabolisme et l'élimination de l'acétate de leuproréline chez l'homme ne sont pas parfaitement élucidés.
Le volume de distribution est de 36 litres et la clairance totale de l'ordre de 139,6 ml/min. La demi-vie du principe actif est de 2,9 heures pour une présentation non retardée.
Lors d'une administration répétée, on observe une baisse persistante des taux de testostérone jusqu'à des taux équivalents à ceux observés après une castration, sans que ce taux ne s'élève transitoirement, comme après la première injection.
Cinétique pour certains groupes de patients
Enfants/adolescents: On ne dispose d'aucune donnée sur la pharmacocinétique de Leuproréline Sandoz chez l'enfant et l'adolescent.
Patients âgés: La pharmacocinétique chez le patient âgé ne diffère pas significativement de celle des jeunes adultes.
Insuffisances hépatiques et rénales: On a parfois mesuré des taux sériques plus élevés chez des patients présentant une insuffisance rénale, alors que les taux étaient abaissés chez les patients présentant une insuffisance hépatique. La signification clinique de cette observation est inconnue.
Données précliniquesMutagénicité
Les essais de mutagénicité (in vitro et in vivo) n'ont mis en évidence aucun signe de potentiel mutagène de la leuproréline.
Carcinogénicité
Des souris et des rats ont été traités par la leuproréline pendant deux ans au cours d'essais de carcinogénicité. Au bout de 24 mois, on a pu observer, chez les rats ayant reçu par voie sous-cutanée 0,6 à 4 mg/kg de leuproréline, une augmentation dose-dépendante d'hyperplasies hypophysaires bénignes et d'adénomes. De plus, une augmentation indépendante de la dose d'adénomes des cellules des îlots pancréatiques chez des rats femelles et des cellules testiculaires interstitielles chez des rats mâles a été constatée. Chez les souris, des doses de leuproréline allant jusqu'à 60 mg/kg, également administrées pendant deux ans, n'ont entraîné aucune tumeur ni anomalie hypophysaire.
Toxicité pour la reproduction
Des études portant sur l'administration sous-cutanée de doses de leuproréline allant jusqu'à 10 µg/kg à des rates et allant jusqu'à 1 µg/kg à des lapines n'ont pas mis en évidence de signes d'un potentiel tératogène. Des effets embryotoxiques/embryolétaux ont été observés chez les rates à une dose de 10 µg/kg et chez les lapines à des doses supérieures à 0,1 µg/kg.
Remarques particulièresIncompatibilités
Aucune incompatibilité connue à ce jour.
Influence sur les méthodes de diagnostic
Aucune incompatibilité connue à ce jour.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage original, dans le sachet stérile fermé, pas au-dessus de 30°C et hors de la portée des enfants.
Remarques concernant la manipulation
|
|
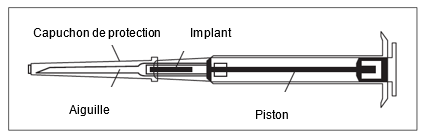
| |
1.Désinfectez le site d'injection en dessous de la ligne du nombril (abdomen).
| |
2.Prélevez l'applicateur du sachet stérile et vérifiez si l'implant est visible dans la formulation à libération prolongée (voir zone encadrée). Le cas échéant, pour ce faire, tenez l'applicateur à contre-jour ou secouez-le légèrement.
| |
|
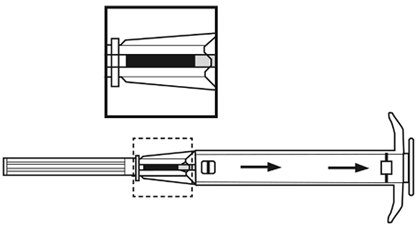
| |
3.Tirez complètement le piston de l'applicateur jusqu'à ce que vous voyiez une ligne continue dans la deuxième fenêtre.
Remarque: Le piston ne peut être poussé vers l'avant pour l'injection que lorsqu'il a été auparavant complètement tiré vers l'arrière!
| |
|
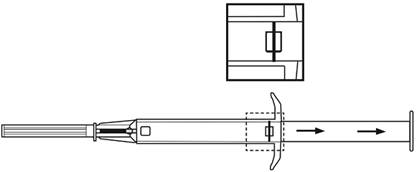
| |
4.Retirez ensuite le capuchon de protection de l'aiguille.
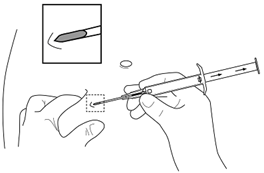
| |
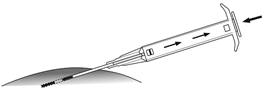
5.Maintenez le cylindre de l'applicateur avec une main. Avec l'autre main, pincez la peau en dessous de la ligne du nombril (voir figure). Introduisez l'intégralité de l'aiguille avec l'ouverture vers le haut, légèrement en diagonale, presque parallèlement à la peau, dans le tissu sous-cutané.
|
|
| |
6.Retirez délicatement l'applicateur de 1 cm environ afin de créer le canal de piqûre pour l'implant.
|
| |
7.Poussez ensuite complètement le piston vers l'avant jusqu'à ce que celui-ci s'enclenche et que vous entendiez un «clic» pour injecter l'implant dans le canal de piqûre.
|
|
| |
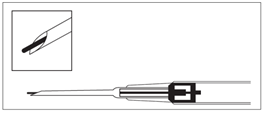
8.Retirez l'aiguille. Pour vous assurer que l'implant a bien été injecté, vérifiez que la pointe blanche du piston est visible à la pointe de l'aiguille.
|
|
|
Numéro d’autorisation57449 (Swissmedic)
Présentation1x 1 implant en seringue préremplie. [A]
3x 1 implant en seringue préremplie. [A]
Titulaire de l’autorisationSandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz
Mise à jour de l’informationFévrier 2025
|






