CompositionPrincipes actifs
Lévodopa, carbidopa sous forme de carbidopa monohydratée
Excipients
Carmellose sodique (correspondant à 277.4 mg sodium par 100 ml cassette), eau purifiée.
Indications/Possibilités d’emploiTraitement de la maladie de Parkinson à un stade avancé avec fluctuations motrices et hyper-/ dyskinésie sévères et répondant à la lévodopa, lorsque les associations disponibles d'antiparkinsoniens n'ont pas donné de résultats satisfaisants.
Avant la mise en place d'une sonde permanente, une réponse clinique positive au test d'administration de Duodopa par une sonde naso-duodénale temporaire est nécessaire.
Posologie/Mode d’emploiDuodopa est un gel pour administration intestinale continue.
Une sonde naso-duodénale temporaire doit être utilisée en premier lieu pour déterminer si le patient répond favorablement à cette méthode de traitement, et pour ajuster la posologie avant d'instaurer le traitement par une sonde à demeure.
Pour une administration à long terme, le gel doit être administré directement dans le duodénum ou dans la partie haute du jéjunum à l'aide d'une pompe portable, par une sonde à demeure mise en place lors d'une gastrostomie endoscopique percutanée comprenant la mise en place d'une sonde transabdominale externe et d'une sonde intestinale interne (sonde PEG-J). Une gastro-jéjunostomie radiologique peut être envisagée de manière alternative si la gastrostomie endoscopique percutanée ne peut pas être réalisée pour une raison quelconque. Le positionnement de l'orifice transabdominal et l'ajustement de la dose doivent se faire en partenariat avec un service de neurologie.
La posologie sera adaptée individuellement afin d'obtenir une réponse clinique optimale, ce qui consiste à maximiser le temps «ON» utile pendant la journée en minimisant le nombre et la durée des périodes «OFF» (bradykinésie) et en minimisant le temps «ON» avec dyskinésie invalidante (voir les recommandations sous «Posologie»).
Duodopa doit être administré initialement en monothérapie. La prise d'un autre antiparkinsonien en association à Duodopa est possible si nécessaire. Utiliser pour l'administration de Duodopa uniquement la pompe à CADD-legacy 1400 (CE marquée). Un manuel d'utilisation de la pompe portable est fourni avec la pompe.
Le traitement par Duodopa à l'aide d'une sonde à demeure peut être arrêté à tout moment en retirant la sonde et en laissant cicatriser la plaie. Le traitement doit ensuite être poursuivi avec des médicaments par voie orale, notamment l'association de lévodopa et de carbidopa.
Posologie usuelle
La dose totale quotidienne de Duodopa se compose de trois doses ajustées individuellement: la dose matinale en bolus, la dose d'entretien continue et les doses supplémentaires en bolus, administrées en l'espace d'environ 16 heures. Le traitement est généralement administré pendant la période d'éveil du patient. L'administration de Duodopa pendant 24 heures est possible si le tableau clinique le justifie.
Dose matinale: La dose matinale en bolus est administrée avec la pompe de manière à atteindre rapidement (dans un délai de 10 à 30 minutes) le niveau de dose thérapeutique. La dose doit être calculée sur la base de la dose matinale précédente de lévodopa à laquelle s'ajoute le volume de remplissage de la sonde. La dose matinale est généralement comprise entre 5 et 10 ml, ce qui correspond à 100 - 200 mg de lévodopa. La dose matinale totale ne doit pas dépasser 15 ml (300 mg de lévodopa).
Dose d'entretien continue: La dose d'entretien peut être ajustée par paliers de 2 mg/heure (0,1 ml par heure). Cette dose doit être calculée en fonction de la prise quotidienne antérieure de lévodopa par le patient. En cas d'arrêt des traitements associés, la dose de Duodopa devra être adaptée. La dose d'entretien continue est ajustée individuellement. Elle doit être comprise à l'intérieur d'une fourchette de 1 à 10 ml/heure (20 à 200 mg de lévodopa par heure) et elle est habituellement de 2 à 6 ml/heure (40 à 120 mg de lévodopa par heure). Une dose plus élevée peut se révéler nécessaire dans des cas exceptionnels.
Exemple:
Prise quotidienne de lévodopa sous forme de Duodopa: 1640 mg/jour
Dose matinale en bolus: 140 mg = 7 ml (non compris le volume de remplissage de la sonde intestinale)
Dose d'entretien continue: 1500 mg/jour
1500 mg/jour: 20 mg/ml = 75 ml de Duodopa par jour
L'administration est calculée sur 16 heures: 75 ml/16 heures = 4,7 ml/heure.
Doses supplémentaires en bolus: Elles sont administrées selon les besoins si le patient devient hypokinétique au cours de la journée. La dose supplémentaire doit être ajustée individuellement, variant généralement entre 0,5 et 2,0 ml. Dans de rares cas, une dose plus élevée pourra être nécessaire. Si le besoin de doses supplémentaires en bolus dépasse 5 doses par jour, il conviendra d'augmenter la dose d'entretien.
Une fois que la dose initiale a été établie, l'ajustement précis de la dose matinale en bolus, de la dose d'entretien et des doses supplémentaires en bolus devra être réalisé pendant les semaines qui suivent le début du traitement.
Surveillance du traitement
Il faut soupçonner un déplacement de la partie distale de la sonde du duodénum/jéjunum supérieur dans l'estomac en cas de diminution brutale de l'efficacité du traitement marquée par des fluctuations motrices récurrentes. Un contrôle radiologique sera alors pratiqué afin de déterminer la localisation de la sonde et son extrémité sera repositionnée dans le duodénum/jéjunum supérieur.
Ajustement de la posologie ou arrêt du traitement
Si une réduction soudaine de la dose ou un arrêt du traitement devient nécessaire, les patients doivent être surveillés attentivement, surtout dans le cas de patients sous neuroleptiques (voir «Mises en garde et précautions»).
Manipulation du produit en cas de démence
Dans le cas d'une démence suspectée ou diagnostiquée avec un seuil de désorientation abaissé, la pompe du patient ne doit être manipulée que par le personnel soignant ou par un proche expérimenté dans la manipulation de la pompe.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique ou rénale
Il n'existe pas d'études sur la pharmacocinétique de la lévodopa et de la carbidopa chez les patients présentant une insuffisance hépatique ou rénale. La posologie de Duodopa est ajustée progressivement conformément à la réponse individuelle du patient, de sorte à atteindre l'effet optimal (correspondant à l'exposition plasmatique optimisée à la lévodopa/carbidopa pour le patient individuel). Par conséquent, l'influence potentielle d'une insuffisance hépatique ou rénale de grade léger à modéré sur l'exposition à la lévodopa et à la carbidopa est indirectement prise en compte lors de l'ajustement de la dose. Duodopa est contre-indiqué chez les patients présentant une insuffisance rénale ou hépatique sévère.
Patients âgés
L'expérience d'utilisation de l'association lévodopa et carbidopa chez le sujet âgé est importante. Les doses recommandées ci-dessus reflètent les données cliniques recueillies au cours de cette expérience.
Enfants et l'adolescents
Il n'y a pas d'indication pertinente pour l'utilisation de Duodopa chez l'enfant et l'adolescent. La sécurité de Duodopa chez les patients de moins de 18 ans n'est pas établie. Une utilisation chez les patients de moins de 18 ans n'est pas recommandée.
Mode d'administration
Pour utiliser une cassette, il faut la fixer sur la pompe portable et connecter le système à la sonde nasoduodénale ou duodénale/jéjunale conformément aux instructions pour administrer le produit.
Contre-indicationsDuodopa est contre-indiqué chez les patients ayant
·une hypersensibilité à la lévodopa, à la carbidopa ou à un autre composant;
·un glaucome à angle fermé;
·une insuffisance hépatique ou rénale sévère;
·une insuffisance cardiaque sévère;
·une arythmie cardiaque sévère;
·un accident vasculaire cérébral aigu.
·Les inhibiteurs non sélectifs de la MAO et les inhibiteurs sélectifs de la MAO-A sont contre-indiqués pendant un traitement par Duodopa. Leur administration doit être arrêtée au moins deux semaines avant l'instauration du traitement par Duodopa. Inhibiteurs de la MAO-B: voir «Interactions».
·Les affections avec une contre-indication aux adrénergiques sont p. ex.: phéochromocytome, hyperthyroïdie, syndrome de Cushing.
La lévodopa pouvant activer un mélanome malin, Duodopa ne doit pas être utilisé chez les patients ayant des lésions cutanées suspectes ou non diagnostiquées et chez les patients ayant un antécédent connu de mélanome.
Mises en garde et précautionsCertains mises en garde et précautions sont valables de manière générale pour la lévodopa et sont en conséquence applicables à Duodopa également:
·Duodopa n'est pas recommandé pour le traitement des syndromes extrapyramidaux d'origine médicamenteuse.
·Le traitement par Duodopa doit être administré avec précaution aux patients présentant une maladie cardiovasculaire ou pulmonaire sévères, un asthme bronchique, une maladie rénale, hépatique ou endocrinienne, ou ayant des antécédents d'ulcère gastro-duodénal ou de convulsions.
·Chez les patients avec des antécédents d'infarctus du myocarde présentant des troubles séquellaires du rythme auriculaire, nodal ou ventriculaire, la fonction cardiaque doit être étroitement surveillée pendant la période des premiers ajustements posologiques.
·Tous les patients traités par Duodopa doivent être étroitement surveillés afin de déceler le développement éventuel de modifications de leur état mental, d'une dépression avec tendances suicidaires, ou d'autres changements psychiques graves. Les patients présentant des antécédents ou des symptômes de psychose doivent être traités avec précaution.
·L'administration concomitante de neuroleptiques inhibiteurs des récepteurs de la dopamine, en particulier les antagonistes des récepteurs D2, doit être effectuée avec précaution, et le patient doit être surveillé étroitement afin de détecter une éventuelle perte de l'effet antiparkinsonien ou une aggravation des symptômes parkinsoniens (voir «Interactions»).
·Les patients souffrant de glaucome chronique à angle ouvert peuvent être traités par Duodopa avec prudence, à condition que la pression intraoculaire soit bien contrôlée et que le patient soit étroitement surveillé afin de détecter les éventuels changements de la pression intraoculaire.
·Duodopa peut provoquer une hypotension orthostatique. Par conséquent, Duodopa sera administré avec précaution chez les patients recevant d'autres médicaments susceptibles de provoquer une hypotension orthostatique (voir «Interactions»).
·La lévodopa a été associée à une somnolence ainsi qu'à des épisodes d'endormissement soudain chez les patients atteints de la maladie de Parkinson, par conséquent, la prudence s'impose lors de la conduite d'un véhicule ou de l'utilisation de machines (voir également rubrique «Effet sur l'aptitude à la conduite et l'utilisation de machines»).
·Un symptôme complexe évoquant le syndrome malin des neuroleptiques (SMN), comprenant une rigidité musculaire, une augmentation de la température corporelle, des changements psychiques (p.ex. agitation, confusion mentale, coma) et une augmentation des concentrations de créatine phosphokinase sérique, a été observé chez les patients lors de l'arrêt brutal de médicaments antiparkinsoniens. Une rhabdomyolyse secondaire à un syndrome malin des neuroleptiques ou une dyskinésie sévère ont été observées rarement chez des patients souffrant de la maladie de Parkinson. Par conséquent, les patients doivent être étroitement observés lorsque la posologie des associations lévodopa/carbidopa est brutalement réduite ou interrompue, en particulier si le patient est traité par des neuroleptiques. Il n'a été rapporté ni syndrome malin des neuroleptiques ni rhabdomyolyse en association avec Duodopa.
·Si une anesthésie générale est nécessaire, le traitement par Duodopa peut être poursuivi aussi longtemps que le patient est autorisé à prendre des liquides et des médicaments par voie orale. Si le traitement doit être interrompu temporairement, le traitement par Duodopa peut être repris à la même dose qu'auparavant dès que la prise orale de liquides est autorisée.
·Il peut s'avérer nécessaire de réduire la dose de Duodopa afin d'éviter la dyskinésie induite par la lévodopa.
·Une évaluation périodique des fonctions hépatique, hématologique, cardiovasculaire et rénale est recommandée lors d'un traitement prolongé par Duodopa.
·Les patients doivent être surveillés régulièrement quant à une détérioration du contrôle des impulsions. Les patients et les proches s'occupant d'eux doivent être instruits que des symptômes d'une détérioration du contrôle des impulsions (p.ex. jeu pathologique, libido accrue et hypersexualité, achat compulsif ou besoin anormal de dépenser de l'argent, hyperphagie incontrôlée et grignotage compulsif) peuvent apparaître chez des patients traités par des agonistes de la dopamine et/ou d'autres dopaminergiques contenant de la lévodopa, y compris Duodopa. Si de tels symptômes se manifestent, le traitement doit être réévalué.
·Des cas de polyneuropathie aiguë ou subaiguë avec des troubles sensoriels et moteurs ont été observés, parfois avec une évolution sévère, sous traitement par des gels à base de lévodopa/carbidopa pour administration intestinale continue. Avant de débuter le traitement par Duodopa, puis à intervalles réguliers pendant ce dernier, les patients doivent être examinés afin de rechercher des antécédents de neuropathie ou des signes de neuropathie existante ainsi que les facteurs de risque connus (voir également la rubrique «Données précliniques»).
·Des études épidémiologiques ont montré que la maladie de Parkinson est associée à un risque plus élevé de mélanome que dans la population générale. Il n'est pas clair si le risque accru est dû à la maladie de Parkinson ou à d'autres facteurs tels que p.ex. les médicaments utilisés pour traiter cette maladie. Par conséquent, les patients et les médecins doivent régulièrement inspecter la peau pour détecter tout signe de mélanome pendant le traitement par Duodopa, quelle que soit l'indication du traitement. Idéalement, la peau doit être examinée régulièrement par des personnes disposant d'une qualification correspondante (p.ex. dermatologues).
·Duodopa contient de l'hydrazine (voir également la rubrique «Données précliniques»), un métabolite de la carbidopa, qui peut être potentiellement génotoxique et carcinogène. La dose quotidienne moyenne du Duodopa est de 100 ml, contenant 2 g de lévodopa et 0.463 g de carbidopa. La dose quotidienne maximale usuelle est de 200 ml. Cela signifie une exposition moyenne à l'hydrazine de jusqu'à 4 mg/jour, avec un maximum de 8 mg/jour. La signification clinique de cette exposition à l'hydrazine n'est pas connue.
·En cas d'antécédent de chirurgie dans la partie supérieure de l'abdomen, des difficultés peuvent être rencontrées lors de la réalisation de la gastrostomie ou jéjunostomie.
·Les rapports de complications dans le cadre des études cliniques et des études post-marketing englobent la formation d'un abcès, un bézoard, un iléus, une érosion/ulcération au site d'implantation, des hémorragies intestinales, une ischémie intestinale, une obstruction intestinale, une perforation intestinale, une invagination intestinale, une pancréatite, une péritonite, une pneumonie (y compris une pneumonie d'aspiration), un pneumopéritoine, une infection postopératoire de la plaie et un septicémie. Les bézoards sont des concrétions des fibres non-digestibles émanant de légumes ou des fruits dans les voies gastro-intestinales. Les bézoards sont le plus souvent trouvés dans l'estomac, mais ils peuvent aussi se trouver dans d'autres segments des voies gastro-intestinales. Un bézoard situé près de l'extrémité de la sonde jéjunale peut être à l'origine d'une obstruction intestinale ou de la formation d'une invagination intestinale. Les complications mentionnées ci-dessus peuvent se manifester par des symptômes tels que douleurs abdominales, nausées et vomissements. Certains événements peuvent avoir une évolution grave (p.ex. interventions chirurgicales et/ou décès). Les patients doivent être instruits de la nécessité d'avertir leur médecin si l'un des symptômes associés aux événements ci-dessus se manifeste. La consommation d'aliments fibreux (p.ex. asperges) peut constituer un facteur de risque favorisant la formation d'un bézoard.
·Une diminution de la capacité à manipuler le système (pompe, connexions tubulaires) peut entraîner des complications. Chez ces patients, un prestataire de soins (p.ex. personnel soignant, une aide-soignante ou un parent proche) expérimenté dans l'utilisation de la pompe doit assister le patient
·Une aggravation brutale ou graduelle de la bradykinésie peut indiquer une obstruction du dispositif pour une raison quelconque, et nécessiter une investigation.
Chez certains patients traités par carbidopa/lévodopa le Syndrome de Dysrégulation Dopaminergique (SDD) a été observé. Il s'agit d'un trouble addictif résultant en une utilisation abusive du produit. Avant l'initiation du traitement, les patients et les soignants doivent être avertis du risque potentiel de développer un SDD (voir aussi rubrique «Effets indésirables»).
Ce médicament contient 277.4 mg de sodium par 100 ml cassette, ce qui équivaut à 13.9% de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
La dose quotidienne maximale du médicament correspond à 27.7% de l'apport quotidien maximal recommandé par l'OMS.
Duodopa est considéré comme riche en sodium. Il convient d'en tenir compte, notamment chez les patients suivant un régime pauvre en sodium.
InteractionsAucune étude d'interaction n'a été réalisée avec Duodopa. Les interactions suivantes sont connues de la combinaison générique de lévodopa/carbidopa.
L'administration concomitante de Duodopa avec les médicaments suivants doit être effectuée avec précaution:
Antihypertenseurs
Une hypotension orthostatique symptomatique est survenue lorsque l'association de lévodopa et d'un inhibiteur de la décarboxylase a été ajoutée au traitement de patients recevant déjà des antihypertenseurs. Un ajustement posologique de l'antihypertenseur peut s'avérer nécessaire.
Antidépresseurs
Quelques rares cas d'effets indésirables comportant une hypertension et des dyskinésies ont été rapportés lors de l'administration concomitante d'antidépresseurs tricycliques et d'associations carbidopa/lévodopa.
Anticholinergiques
Les anticholinergiques peuvent agir de manière synergique avec la lévodopa pour diminuer les tremblements. Cependant, leur utilisation simultanée peut accentuer les mouvements involontaires anormaux. Les anticholinergiques peuvent diminuer les effets de la lévodopa en retardant son absorption. Un ajustement de la dose de Duodopa peut s'avérer nécessaire.
Inhibiteurs de la COMT (tolcapone, entacapone)
L'utilisation concomitante d'inhibiteurs de la COMT (catéchol-O-méthyl transférase) et de Duodopa peut augmenter la biodisponibilité de la lévodopa. Un ajustement de la posologie de Duodopa peut s'avérer nécessaire.
Autres médicaments
Les antagonistes des récepteurs de la dopamine (certains neuroleptiques, p.ex. phénothiazines, butyrophénones et rispéridone ainsi que les antiémétiques, p.ex. le métoclopramide), les benzodiazépines, l'isoniazide, la phénytoïne et la papavérine peuvent réduire les effets thérapeutiques de la lévodopa. Les patients recevant ces médicaments en même temps que Duodopa doivent être surveillés étroitement afin de déceler une éventuelle perte de la réponse thérapeutique.
Duodopa peut être administré en association à un inhibiteur de la monoamine oxydase spécifique de la MAO de type B (p.ex. le chlorhydrate de sélégiline) à la posologie recommandée.
L'utilisation concomitante de sélégiline et de lévodopa / carbidopa a été associée à une hypotension orthostatique sévère.
L'amantadine exerce un effet synergique avec la lévodopa, et peut augmenter les effets indésirables liés à la lévodopa. Un ajustement de la posologie de Duodopa peut s'avérer nécessaire.
Les sympathomimétiques peuvent accentuer les effets indésirables cardiovasculaires liés à la lévodopa.
La lévodopa se chélate avec le fer dans le tractus gastro-intestinal, conduisant à une réduction de l'absorption de la lévodopa.
Comme la lévodopa entre en compétition avec certains acides aminés, l'absorption de la lévodopa peut être perturbée chez les patients soumis à un régime alimentaire hyperprotéiné.
Les effets de l'administration d'antiacides et de Duodopa sur la biodisponibilité de la lévodopa n'ont pas été étudiés.
Grossesse, allaitementGrossesse
On ne dispose pas de données pertinentes sur l'utilisation de lévodopa/carbidopa chez la femme enceinte. Les données provenant des études chez l'animal ont montré une toxicité sur la reproduction (voir la rubrique «Données précliniques»). Le risque potentiel chez l'homme est inconnu. Duodopa ne doit pas être utilisé au cours de la grossesse, sauf en cas de nécessité absolue.
Allaitement
La lévodopa est excrétée dans le lait maternel en quantités significatives. Des données montrent que la lactation est supprimée au cours d'un traitement par la lévodopa.
On ne sait pas si la carbidopa est excrétée dans le lait maternel humain. Des études chez l'animal ont montré que la carbidopa est excrétée dans le lait maternel. La sécurité d'emploi de la lévodopa et de la carbidopa chez le nourrisson n'a pas été établie.
Duodopa ne doit pas être utilisé chez les femmes qui allaitent.
Effet sur l’aptitude à la conduite et l’utilisation de machinesDuodopa a une influence sur l'aptitude à la conduite ou l'utilisation de machines. La lévodopa et la carbidopa peuvent provoquer une hébétude et une hypotension orthostatique. Par conséquent, la prudence est requise lors de la conduite de véhicules et l'utilisation de machines. Les patients traités par Duodopa et présentant une somnolence et/ou des accès de sommeil d'apparition soudaine doivent être informés qu'ils ne doivent pas conduire des véhicules ni exercer une activité où une altération de leur vigilance pourrait les exposer eux-mêmes ou d'autres personnes à un risque de lésion sévère ou de décès (p.ex. la manœuvre de machines) jusqu'à la disparition de ces épisodes récurrents et de la somnolence (voir rubrique «Mises en garde et précautions»).
Effets indésirablesLes effets indésirables qui surviennent fréquemment avec la lévodopa/carbidopa sont ceux résultant de l'activité neuropharmacologique centrale de la dopamine. Ces réactions peuvent habituellement être réduites par une baisse de la posologie de la lévodopa.
Les effets indésirables médicamenteux souvent observés sous Duodopa englobent des nausées et des dyskinésies.
Les effets indésirables fréquents liés au dispositif et à la méthode d'utilisation du système Duodopa englobent des douleurs abdominales, des complications à l'insertion de la sonde, une formation excessive de tissu de granulation, un érythème au site d'incision, une infection postopératoire de la plaie, un suintement de liquide après l'intervention, des douleurs pendant l'intervention et des réactions au site d'application.
La plupart de ces effets indésirables ont été signalés à un stade précoce des études, à la suite de la gastrostomie endoscopique percutanée; ils se sont manifestés dans les 28 premiers jours (voir aussi le chapitre «Mises en garde et précautions», rubrique «Rapports de complications dans les études cliniques»).
Effets indésirables en rapport avec Duodopa
Les effets indésirables suivants englobent des effets indésirables du médicament, des effets indésirables liés au dispositif et à la procédure et des effets indésirables survenus sous Duodopa après sa commercialisation. Les fréquences des effets indésirables sont définies comme suit: très fréquents (≥1/10), fréquent (<1/10, ≥1/100), occasionnels (<1/100, ≥1/1000), rares (<1/1000, ≥1/10'000)*; très rares (<1/10'000), fréquence indéterminée: exclusivement sur la base de rapports dans le cadre de la pharmacovigilance, sans possibilité de déterminer la fréquence exacte.
Effets indésirables signalés dans le cadre des études cliniques et des rapports postcommercialisation
Infections et infestations
Très fréquent: infections des voies urinaires.
Affections hématologiques et du système lymphatique
Occasionnel: leucopénie, anémie.
Rare: thrombopénie.
Affections du système immunitaire
Fréquence indéterminée: réaction anaphylactique.
Troubles du métabolisme et de la nutrition
Fréquent: perte de poids, perte d'appétit, concentration accrue d'acides aminés, taux sanguin accru d'homocystéine, déficit en vitamine B6, déficit en vitamine B12.
Occasionnel: prise de poids.
Affections psychiatriques
Fréquent: rêves anormaux, agitation, états anxieux, hallucinations, confusion mentale, troubles du sommeil, accès de sommeil (l'administration de lévodopa/carbidopa a été associée à un état d'hébétude et, dans de très rares cas, à une somnolence diurne excessive et à des accès soudains de sommeil), insomnie, dépression, épisodes psychotiques, comportement impulsif**.
Occasionnel: désorientation, euphorie, hypoesthésie, libido accrue (voir «Mises en garde et précautions»), cauchemars, tentative de suicide
Rare: démence, anxiété, idées anormales.
Fréquence indéterminée: suicide, syndrome de dysrégulation dopaminergique***.
* Effets indésirables observés sous Duodopa, mais pour lesquels on ne dispose pas d'estimations de leur fréquence. Les fréquences indiquées reposent sur les données historiques recueillies sur la lévodopa/carbidopa par voie orale.
** Des troubles du contrôle des impulsions – jeu pathologique, libido accrue et hypersexualité, achat compulsif ou besoin anormal de dépenser de l'argent, hyperphagie incontrôlée et grignotage compulsif – peuvent apparaître chez des patients traités par des agonistes de la dopamine et/ou d'autres dopaminergiques contenant de la lévodopa, y compris Duodopa (voir «Mises en garde et précautions»).
*** Le Syndrome de Dysrégulation Dopaminergique (SDD) est un trouble addictif observé chez certains patients traités par carbidopa/lévodopa. Les patients atteints d'un tel syndrome montrent une utilisation abusive compulsive du médicament dopaminergique au-delà des doses nécessaires pour contrôler les symptômes moteurs de la maladie de Parkinson. Cela peut entraîner dans certains cas des dyskinésies sévères notamment (voir aussi rubrique «Mises en garde et précautions»).
Affections du système nerveux
Très fréquent: dyskinésies.
Fréquent: dystonie, céphalées, phénomène «ON-OFF», paresthésies, vertiges, aggravation de la maladie de Parkinson, polyneuropathie, somnolence, syncopes, tremblement.
Occasionnel: ataxie, troubles de la démarche.
Rare: crises convulsives.
Affections oculaires
Occasionnel: blépharospasme (peut être un signe précoce de surdosage), diplopie, glaucome à angle fermé.
Rare: vision floue.
Fréquence indéterminée: neuropathie ischémique du nerf optique.
Affections cardiaques
Fréquent: palpitations cardiaques, battements de cœur irréguliers.
Affections vasculaires
Fréquent: hypotension, hypotension orthostatique.
Occasionnel: hypertension.
Rare: phlébite.
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée, douleurs oro-pharyngées, pneumonie (y compris pneumonie d'aspiration).
Occasionnel: dysphonie, douleurs thoraciques.
Rare: respiration anormale.
Affections gastro-intestinales
Très fréquent: nausée.
Fréquent: vomissements, sécheresse buccale, dysgueusie, distension abdominale, constipation, diarrhée, dyspepsie, flatulences.
Occasionnel: hypersalivation, dysphagie.
Rare: bruxisme, hoquet, glossodynie.
Affections de la peau et du tissu sous-cutané
Fréquent: dermatite de contact, hyperhidrose.
Occasionnel: œdèmes, prurit, alopécie, éruption cutanée.
Rare: urticaire, érythème, mélanome malin (voir «Mises en garde et précautions»).
Affections musculo-squelettiques et du tissu conjonctif
Fréquent: crampes musculaires, douleurs de la nuque.
Affections du rein et des vois urinaires
Occasionnel: incontinence urinaire, rétention urinaire.
Rare: priapisme.
Troubles généraux et anomalies au site d'administration
Fréquent: épuisement, douleurs.
Occasionnel: asthénie, malaise.
Lésions, intoxications et complications liées aux procédures
Fréquent: tendance aux chutes.
Effets indésirables liés au dispositif et aux procédures
Infections et infestations
Très fréquent: infection postopératoire de la plaie.
Fréquent: cellulite au site d'incision, infection postopératoire.
Occasionnel: abcès postopératoire.
Fréquence indéterminée: septicémie.
Affections gastro-intestinales
Très fréquent: douleurs abdominales.
Fréquent: symptômes abdominaux, douleurs dans l'abdomen supérieur, péritonite, pneumopéritoine.
Occasionnel: bézoard (voir «Mises en garde et précautions»), colite ischémique, ischémie gastro-intestinale, obstruction gastro-intestinale, invagination intestinale, pancréatite, hémorragie de l'intestin grêle, ulcère de l'intestin grêle.
Fréquence indéterminée: perforation de l'estomac, perforation gastro-intestinale, ischémie de l'intestin grêle, perforation de l'intestin grêle.
Affections de la peau et du tissu sous-cutané
Très fréquent: formation excessive du tissu de granulation.
Troubles généraux et anomalies au site d'administration
Très fréquent: complications lors de l'insertion du dispositif****.
Fréquent: dislocation du dispositif, obturation du dispositif.
**** Des complications lors de l'insertion du dispositif ont été signalées fréquemment en tant qu'effet indésirable aussi bien pour la sonde NJ que pour la sonde PEG-J. Cet effet indésirable était accompagné d'un ou de plusieurs des effets indésirables suivants de la sonde NJ: douleurs oropharyngées, distension abdominale, douleurs abdominales, symptômes abdominaux, douleurs, irritations dans la gorge, lésions gastro-intestinales, hémorragie œsophagienne, états anxieux, dysphagie et vomissements. Avec la sonde PEG-J, cet effet indésirable était accompagné d'un ou de plusieurs des effets indésirables suivants: douleurs abdominales, symptômes abdominaux, distension abdominale, flatulences ou pneumopéritoine. Autres effets indésirables non sérieux rapportés avec les complications liées à l'insertion du dispositif: symptômes abdominaux, douleurs de l'abdomen supérieur, ulcère duodénal, hémorragie d'ulcère duodénal, duodénite érosive, gastrite érosive, hémorragies gastro-intestinales, péritonite, pneumopéritoine, ulcère de l'intestin grêle.
Lésions, intoxications et complications liées aux procédures
Très fréquent: érythème au site d'incision, suintement de liquide après l'intervention, douleurs pendant l'intervention, réaction au site d'application.
Fréquent: complication d'une stomie gastro-intestinale, douleurs au site d'incision, iléus postopératoire, complications après l'intervention, symptômes après l'intervention, hémorragies après l'intervention
Les fluctuations motrices peuvent réapparaître après un déplacement de la sonde intestinale dans l'estomac ou une obstruction de la pompe.
Effets indésirables sous lévodopa/carbidopa par voie orale
Les effets indésirables supplémentaires mentionnés ci-dessous (conformément à la terminologie MedDRA, termes préférentiels) ont été observés dans le cadre de l'administration de lévodopa/carbidopa par voie orale et pourraient se manifester aussi avec le gel intestinal de lévodopa/carbidopa.
Sous lévodopa/carbidopa par voie orale, on a rapporté rarement une anémie hémolytique, un trismus, un syndrome malin des neuroleptiques (voir «Mises en garde et précautions»), un syndrome de Horner, une mydriase, des crises oculogyres, un angiœdème et un purpura de Henoch-Schönlein, et très rarement une agranulocytose.
Des cas de polyneuropathie ont été signalés chez des patients traités par des associations de lévodopa/carbidopa, y compris Duodopa. Chez certains de ces patients, des carences en acide folique, vitamine B12 et vitamine B6 ont été constatés. L'étiologie des carences vitaminiques n'est pas claire. On ne sait pas s'il existe un lien causal entre la polyneuropathie et le traitement par Duodopa ou d'autres associations de lévodopa/carbidopa.
Valeurs de laboratoire: les anomalies suivantes des valeurs de laboratoire ont été rapportées pendant le traitement par la lévodopa/la carbidopa; elles doivent être prises en considération pendant le traitement par Duodopa: élévation de l'azote uréique, de la phosphatase alcaline, des ASAT sériques, des ALAT sériques, de la LDH, de la bilirubine, de la glycémie, de la créatinine, de l'acide urique et positivité du test de Coombs, diminution des valeurs de l'hémoglobine et de l'hématocrite. La présence de leucocytes, de bactéries et de sang dans l'urine a été rapportée. La lévodopa/carbidopa, et donc Duodopa, peut provoquer une réaction faussement positive en cas d'utilisation de bandelettes réactives pour le test cétonique dans l'urine; cette réaction n'est pas modifiée par l'ébullition de l'échantillon d'urine. La possibilité de résultats de glucosurie faussement négatifs est possible en utilisant des réactifs à la glucose-oxydase.
Système technique: les complications avec le système technique sont très fréquentes (≥1/10), p.ex. fuites au niveau des joints de raccordement, déplacement de la sonde intestinale. Un déplacement de la sonde intestinale dans l'estomac provoque une réapparition des fluctuations motrices (à mettre sur le compte d'une vidange irrégulière de l'estomac et de Duodopa dans l'intestin grêle). Le repositionnement de la sonde peut généralement se faire avec une tige directrice permettant de replacer la sonde dans le duodénum sous contrôle fluoroscopique. L'occlusion, la formation de nœuds ou la coudure de la sonde intestinale conduit à l'émission par la pompe de signaux sonores indiquant une surpression. Les occlusions sont généralement corrigées en rinçant la sonde à l'eau du robinet; la formation de nœuds, une coudure ou un remplacement de la sonde doivent être corrigés par un réajustement de la sonde. Si la sonde intestinale ou la pompe présente un dysfonctionnement complet, le patient doit être traité par une association lévodopa/carbidopa par voie orale jusqu'à la résolution du problème technique. Généralement, la stomie cicatrise sans complication. Toutefois, des douleurs abdominales, une infection et une fuite de liquide gastrique peuvent survenir peu de temps après la chirurgie, il s'agit rarement d'un problème à long terme. Les complications rapportées sont: perforation des structures anatomiques voisines, surtout lors du positionnement de la sonde et des hémorragies ainsi qu'infection de la cicatrice (complication la plus fréquente), et péritonite. Des infections locales autour de la stomie sont traitées de manière symptomatique avec un désinfectant; une antibiothérapie est rarement nécessaire. Il existe des rapports isolés de formation d'un bézoard (voir la rubrique «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Les principaux symptômes cliniques d'un surdosage de lévodopa/carbidopa sont les dystonies et les dyskinésies. Le blépharospasme peut être un signe précoce de surdosage.
Traitement
Généralement, le traitement d'un surdosage aigu de Duodopa est le même que lors d'un surdosage aigu de lévodopa. Toutefois, la pyridoxine n'inverse pas l'action de Duodopa. Procéder à une surveillance par ECG et surveiller le patient soigneusement à la recherche du développement éventuel d'arythmies cardiaques. Si nécessaire, un traitement antiarythmique adéquat doit être instauré. Envisager la possibilité que le patient ait pris d'autres médicaments en association à Duodopa. Aucune expérience avec la dialyse n'ayant été rapportée à ce jour, on ignore si elle pourrait être utile dans le traitement d'un surdosage.
Propriétés/EffetsCode ATC
N04BA02
Mécanisme d'action
Duodopa est une association de lévodopa et de carbidopa (rapport 4/1) en suspension dans un gel pour perfusion entérale continue dans la maladie de Parkinson à un stade avancé avec fluctuations motrices et hyper-/dyskinésie sévères. La lévodopa, un précurseur métabolique de la dopamine, réduit les symptômes de la maladie de Parkinson après décarboxylation en dopamine dans le cerveau. La carbidopa, qui ne franchit pas la barrière hémato-encéphalique, inhibe la décarboxylation extracérébrale de la lévodopa, ce qui signifie que de plus grandes quantités de lévodopa sont disponibles pour être transportées vers le cerveau et y subir une transformation en dopamine. Sans l'administration simultanée de carbidopa, l'obtention de l'effet recherché exigerait une dose bien supérieure de lévodopa. La perfusion entérale des doses de Duodopa ajustées conformément aux besoins individuels du patient permet de maintenir les concentrations plasmatiques de lévodopa à un niveau stable au sein de la marge thérapeutique individuelle du patient.
Pharmacodynamique
Le traitement par perfusion entérale avec Duodopa réduit les fluctuations motrices et le temps «OFF» pour les patients à un stade avancé de la maladie de Parkinson recevant depuis de nombreuses années un traitement oral à base de lévodopa associée à un inhibiteur de la décarboxylase sous la forme de comprimés. Les fluctuations motrices et les hyper-/dyskinésies sont réduites grâce au maintien des concentrations plasmatiques de lévodopa à un niveau stable au sein de la fenêtre thérapeutique individuelle. L'effet thérapeutique sur les fluctuations motrices et les hyper-/dyskinésies s'obtient souvent au cours de la première journée de traitement.
Efficacité clinique
Une étude de phase IIIb ouverte, randomisée et multicentrique a été réalisée afin d'examiner les effets de Duodopa sur les dyskinésies par rapport à un traitement médical optimisé (OMT, optimized medical treatment) pendant 12 semaines chez des patients présentant une maladie de Parkinson à un stade avancé. L'étude a été réalisée chez des patients qui répondaient à la lévodopa mais présentaient des fluctuations motrices persistantes qui ne pouvaient pas être contrôlées par un traitement médical optimisé. Les patients inclus atteignaient un score total de référence ≥30 selon l'Unified Dyskinesia Rating Scale (UDysRS). 61 patients ont été traités dans l'étude. La variation du score total de l'UDysRS de la valeur de référence jusqu'à la semaine 12 a montré une différence statistiquement significative dans la moyenne des moindres carrés en faveur du groupe de traitement Duodopa (Tableau 1). L'analyse de tous les critères secondaires d'évaluation de l'efficacité, à l'exception du score UPDRS III (examen moteur), a montré des résultats statistiquement significatifs en faveur de Duodopa par rapport au groupe recevant un traitement médical optimisé.
Tableau 1. Critères d'évaluation de l'efficacité principaux et secondaires clés à la semaine 12
|
Groupe de traitement
|
Référence
|
Semaine 12
| |
N
|
Moyenne (écart type)
|
N
|
Variation (écart type)
|
Moyenne des moindres carrés (erreur type) de la variation
|
Moyenne des moindres carrés (erreur type) de la différence
|
Valeur de p
| |
Critère d'évaluation principal
| |
Score total de l'UDysRS
| |
Traitement médical optimisé
|
32
|
51,2 (11,56)
|
26
|
-1,5 (11,19)
|
-2,33 (2,56)
|
|
| |
Duodopa
|
27
|
53,2 (12,24)
|
24
|
-18,7 (14,39)
|
-17,37 (2,79)
|
-15,05 (3,20)
|
<0,0001
| |
Critères d'évaluation secondaires clés
| |
Période «ON» sans dyskinésie gênante (heures)
| |
Traitement médical optimisé
|
32
|
9,7 (3,57)
|
28
|
-0,2 (2,60)
|
-0,12 (0,63)
|
|
| |
Duodopa
|
27
|
8,8 (2,88)
|
25
|
3,3 (3,37)
|
3,15 (0,69)
|
3,27 (0,78)
|
0,0001
| |
Score total PDQ-8
| |
Traitement médical optimisé
|
32
|
43,4 (15,81)
|
29
|
-0,7 (15,00)
|
-4,95 (3,11)
|
|
| |
Duodopa
|
27
|
45,1 (20,46)
|
25
|
-16,8 (19,28)
|
-21,62 (3,47)
|
-16,66 (3,89)
|
<0,0001
| |
Nombre de points CGI-C
| |
Traitement médical optimisé
|
32
|
5,0 (1,05)a
|
29
|
4,6 (1,12)b
|
4,58 (0,25)b
|
|
| |
Duodopa
|
27
|
5,2 (1,03)a
|
25
|
2,5 (1,36)b
|
2,48 (0,28)b
|
-2,11 (0,33)
|
<0,0001
| |
Nombre de points UPDRS II (activités de la vie quotidienne)
| |
Traitement médical optimisé
|
33
|
18,4 (6,44)
|
29
|
-0,0 (3,40)
|
0,21 (1,16)
|
|
| |
Duodopa
|
27
|
18,3 (6,35)
|
24
|
-5,7 (8,28)
|
-5,33 (1,28)
|
-5,54 (1,52)
|
0,0006
| |
Période «OFF» (heures)
| |
Traitement médical optimisé
|
32
|
4,0 (2,99)
|
28
|
0,5 (2,39)
|
0,18 (0,49)
|
|
| |
Duodopa
|
27
|
4,8 (2,41)
|
25
|
-2,1 (2,19)
|
-2,17 (0,53)
|
-2,35 (0,58)
|
0,0002
| |
UPDRS IIIc (examen moteur)
| |
Traitement médical optimisé
|
33
|
25,4 (10,91)
|
29
|
-0,4 (7,23)
|
-0,87 (1,89)
|
|
| |
Duodopa
|
27
|
26,3 (6,66)
|
25
|
-4,2 (10,06)
|
-4,93 (2,08)
|
-4,05 (2,24)
|
0,0762
|
a Nombre de points CGI-S à la référence
b Nombre de points CGI-C à la semaine 12 plutôt que variation de la valeur de référence
c Réalisé pendant la période «On»
PharmacocinétiqueAbsorption
Duodopa est administré via une sonde introduite directement dans le duodénum ou le jéjunum. La lévodopa est absorbée rapidement et efficacement au niveau de l'intestin par l'intermédiaire d'un système de transport des acides aminés à haute capacité. La biodisponibilité absolue de la lévodopa administrée par voie orale sous forme de comprimés de lévodopa/carbidopa (comprimés à libération immédiate) est généralement de 84 à 99 %. Une analyse pharmacocinétique de population portant sur plusieurs études indique que la biodisponibilité de la lévodopa administrée sous forme de Duodopa est comparable à la biodisponibilité observée avec la prise orale de comprimés de lévodopa/carbidopa (100/25 mg).
Une modélisation pharmacocinétique des données après l'administration jéjunale versus duodénale a montré que les quantités de lévodopa absorbées sur une période de 24 heures étaient similaires. Au bout de 1, de 6 et de 24 heures, les quantités de lévodopa absorbée après l'administration jéjunale versus duodénale étaient de 189 mg vs 155 mg, de 501 mg vs 482 mg et de 1626 mg vs 1607 mg.
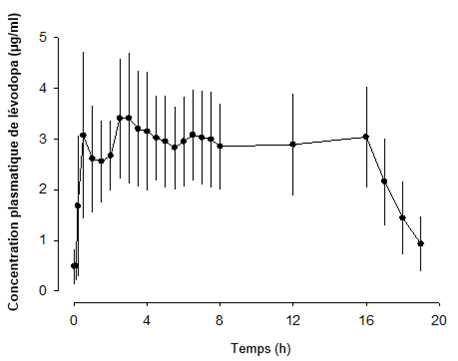
Lors de l'administration intra-jéjunale de Duodopa, les concentrations plasmatiques thérapeutiques de lévodopa ont été atteintes rapidement et la concentration de lévodopa est restée stable pendant toute la perfusion. Après la fin de la perfusion, la concentration de lévodopa a rapidement diminué (Figure 1).
Figure 1: Concentrations plasmatiques (moyenne ± écart type) versus profil chronologique de la lévodopa lors d'une perfusion de 16 heures de Duodopa
Distribution
La lévodopa est administrée conjointement à la carbidopa, un inhibiteur de la décarboxylase, ce qui augmente la biodisponibilité de la lévodopa et en diminue la clairance. Lorsqu'elle est associée à un inhibiteur de la décarboxylase, la lévodopa a une clairance 0,3 litre/heure/kg et un volume de distribution de 0,9-1,6 litres/kg. Le rapport de distribution de la lévodopa entre les érythrocytes et le plasma est d'environ 1. La liaison de la lévodopa aux protéines plasmatiques est négligeable (~10 % à 30 %). La lévodopa est transportée dans le cerveau par un mécanisme de transport pour grands acides aminés neutres.
La carbidopa se lie aux protéines plasmatiques à raison d'environ 36 %. La carbidopa ne traverse pas la barrière hémato-encéphalique.
Métabolisme
Quatre voies métaboliques sont connues. La lévodopa est cependant dégradée essentiellement par voie des enzymes AAAD (décarboxylase des acides aminés aromatiques) et COMT (catéchol-O-méthyltransférase). Les autres voies de dégradation sont la transamination et l'oxydation. Sans administration concomitante d'un inhibiteur d'enzyme, la décarboxylation de la lévodopa en dopamine par l'AAAD est le processus enzymatique le plus important. Lors de l'administration conjointe de lévodopa et de carbidopa, l'enzyme décarboxylase est inhibée de sorte que le métabolisme via la COMT devient la voie métabolique dominante. L'O-méthylation par la COMT transforme la lévodopa en 3-O-méthyldopa.
La carbidopa est dégradée en deux métabolites principaux (acide α-méthyl-3-méthoxy-acide-4-hydroxyphénylpropionique et acide α-méthyl-3,4-dihydroxyphénylpropionique).
Élimination
Lévodopa: La lévodopa est complètement éliminée par métabolisme et les métabolites formés sont excrétés principalement dans les urines. Lors d'une administration concomitante avec la carbidopa, la demi-vie d'élimination de la lévodopa est de l'ordre de 1,5 heure.
Carbidopa: Les 2 métabolites (acide α-méthyl-3-méthoxy-acide-4-hydroxyphénylpropionique et acide α-méthyl-3,4-dihydroxyphénylpropionique) sont essentiellement éliminés dans les urines (sous forme inchangée ou glucuroconjuguée). La carbidopa inchangée correspond à 30 % de l'excrétion urinaire totale. La demi-vie d'élimination de la carbidopa est d'environ 2 heures.
Relation entres les propriétés pharmacocinétiques et pharmacodynamiques
Minimiser les fluctuations de la concentration plasmatique de lévodopa permet de diminuer les fluctuations de la réponse au traitement. La dose nécessaire de lévodopa varie considérablement dans la maladie de Parkinson à un stade avancé et il importe d'ajuster individuellement la dose sur la base de la réponse clinique. Aucun phénomène de tolérance avec le temps n'a été observé pour Duodopa.
Données précliniquesLes données précliniques n'ont montré aucun risque particulier chez l'homme sur la base d'études standards portant sur la pharmacologie de sécurité, la toxicité en cas d'administration répétée, la génotoxicité et le potentiel carcinogène. Au cours des études sur la toxicité sur la reproduction, tant la lévodopa que l'association carbidopa/lévodopa ont provoqué des malformations viscérales et squelettiques chez le lapin.
L'hydrazine est un produit de dégradation de la carbidopa. En expérimentation animale, l'hydrazine montré une toxicité systémique importante, notamment en exposition inhalatoire. Ces études ont révélé que l'hydrazine s'avère hépatotoxique, présente une toxicité pour le SNC (bien que non décrite pour l'administration orale), est génotoxique et aussi carcinogène (voir aussi la rubrique «Mises en garde et précautions»). Des études menées in vitro sur des cellules de ganglions spinaux murins ont montré que l'hydrazine a aussi un effet neurotoxique sur le système nerveux périphérique.
Dans des expérimentations animales sur la carbidopa, aucun indice de carcinogénicité n'a été trouvé lors d'expositions plasmatiques à l'hydrazine dépassant le quadruple des taux observés dans une étude clinique après administration d'une dose journalière d'environ 2/3 de cassette. La signification du potentiel carcinogène de l'hydrazine chez l'homme est inconnue.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient. Peut être conservé pendant 15 semaines dans l'emballage d'origine (cassette intacte) au réfrigérateur (2 – 8 °C). Ne pas congeler.
Vers la fin de la durée de conservation, le gel peut devenir légèrement jaunâtre. Cela n'a cependant aucune influence sur la concentration du médicament ou sur le traitement.
Stabilité après ouverture
Les cassettes de médicament sont destinées exclusivement à un usage unique. Une fois le médicament sorti du réfrigérateur, la cassette ne doit pas être utilisée pendant plus de 24 heures. Tout résidu non utilisé doit être jeté.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2 – 8 °C). Ne pas congeler.
Conserver la cassette dans son carton pour le protéger de la lumière.
Conditions de stockage après la première ouverture du médicament: voir rubrique «Stabilité après ouverture».
Conserver hors de portée des enfants.
Remarques concernant la manipulation et l'élimination
Les médicaments inutilisés et autres déchets doivent être éliminés selon les directives locales.
Retourner les cassettes vides / utilisées à la pharmacie pour leur élimination.
Numéro d’autorisation57'624 (Swissmedic)
Présentation100 ml en poche PVC dans une cassette de protection en plastic dur.
Carton de 7 cassettes (B)
Titulaire de l’autorisationAbbVie AG, 6330 Cham
Mise à jour de l’informationOctobre 2023
|

