CompositionPrincipes actifs
Facteur de coagulation humain II
Facteur de coagulation humain VII
Facteur de coagulation humain IX
Facteur de coagulation humain X
Protéine C humaine
Protéine S humaine
Excipients
|
Dénomination du principe actif
|
Octaplex 500
Quantité par flacon
|
Octaplex 1000
Quantité par flacon
|
Octaplex
Quantité par ml de solution prête à l'emploi
| |
Héparine
|
100 – 250 U.I.
|
200 – 500 U.I.
|
5 – 12.5 U.I./ml
| |
Citrate de sodium dihydraté
|
Solvant: eau pour préparations injectables.
Ce médicament contient 75 – 125 mg (flacon de 500 U.I.) ou 150 – 250 mg (flacon de 1000 U.I.) de sodium par flacon.
Indications/Possibilités d’emploi·Traitement des hémorragies et prophylaxie péri-opératoire en urgence des hémorragies en cas de déficit acquis en facteurs de coagulation du complexe prothrombique, par exemple à la suite d'un traitement par des antagonistes de la vitamine K.
·Lors de surdosage en antagonistes de la vitamine K, lorsqu'un traitement rapide du déficit est nécessaire.
·Traitement des hémorragies et prophylaxie péri-opératoire d'un déficit congénital en un facteur de coagulation dépendant de la vitamine K, lorsqu'un concentré du facteur spécifique de coagulation n'est pas disponible.
Posologie/Mode d’emploiPosologie
Seules des directives générales figurent ci-après. On devra recourir à l'avis d'un spécialiste ayant de l'expérience dans le traitement des troubles de la coagulation.
La posologie et la durée du traitement de substitution dépendent de la gravité du trouble de la coagulation, du site et de l'importance de l'hémorragie ainsi que de l'état clinique du patient.
La quantité administrée et la fréquence d'administration doivent toujours être guidées par l'efficacité clinique.
La dose nécessaire en cas de déficit congénital en facteurs de coagulation du complexe prothrombique dépend également de la demi-vie du facteur nécessaire mesurée in vivo (voir ci-après «Pharmacocinétique»).
Le principe sur lequel repose une posologie individuelle est la détermination régulière de la concentration plasmatique du facteur de coagulation correspondant, la mesure des paramètres globaux de la concentration en complexe prothrombique (comme par exemple valeur de Quick/INR) ainsi que la surveillance continue de l'état clinique du patient.
En cas de déficit congénital en facteurs, le facteur correspondant devra être régulièrement mesuré, comme ceci est recommandé pour un déficit acquis.
En cas d'intervention chirurgicale importante, une surveillance précise de l'hémostase est indispensable.
a) Déficit acquis en facteurs du complexe prothrombique
L'administration simultanée de vitamine K et de concentré de complexe prothrombique doit toujours être envisagée. L'administration répétée d'Octaplex peut ce faisant être superflue, s'expliquant par l'entrée en action de la vitamine K la plupart du temps dans un délai de 4 à 6 heures, alors que la durée d'action d'Octaplex dure de 6 à 8 heures environ.
L'augmentation souhaitée du INR/de la valeur de Quick, qui est corrélée à l'activité du facteur IX, doit être déterminée en fonction de l'état clinique. La dose nécessaire en concentré de complexe prothrombique peut être calculée à l'aide de la formule suivante:
Unités nécessaires en facteur IX = poids corporel × [activité souhaitée en facteur IX – (moins) activité effective actuelle en facteur IX (%)].
Méthode de calcul alternative sur la base de la valeur de Quick cible:
Unités d'Octaplex (IU) à perfuser = (valeur de Quick cible – (moins) valeur de Quick de base) x kg de poids corporel.
En cas d'hémorragies potentiellement mortelles, il est généralement nécessaire d'obtenir une activité en facteur IX de 50% (ce qui correspond à une valeur de Quick de 60–80% ou bien à un INR d'environ 1,15–1,4); en cas d'hémorragies d'intensité légère, de petites lésions ou encore d'interventions peu importantes, il est nécessaire d'obtenir une activité en facteur IX de 20–25% (correspondant à une valeur de Quick de 30–50% ou à un INR d'environ 1,6–2,4).
Si le traitement par le concentré de complexe prothrombique a comme objectif d'inverser l'effet des antagonistes de la vitamine K de longue demi-vie, il faudra tenir compte du fait que l'activité des antagonistes de la vitamine K peut durer plus longtemps que l'activité d'Octaplex. Ceci est dû à une demi-vie relativement courte du facteur VII présent dans le concentré de complexe prothrombique. Il est donc nécessaire d'effectuer régulièrement une mesure des paramètres INR/valeur de Quick, même si la correction de l'INR est atteinte peu après la fin d'une perfusion d'Octaplex.
b) Déficit héréditaire en facteurs du complexe prothrombique lorsqu'un concentré du facteur spécifique de coagulation n'est pas disponible
L'activité plasmatique d'un facteur de coagulation précis est exprimée soit en pourcentage de l'activité normale du plasma humain, soit en Unités Internationales par rapport à l'étalon international pour ce facteur de coagulation spécifique. Une Unité Internationale (UI) de l'activité d'un facteur de coagulation correspond à la quantité de ce facteur contenue dans 1 ml de plasma humain normal.
Le calcul de la dose initiale nécessaire repose sur la formule empirique suivante:
Considération de base pour la dose initiale: 1 UI/kg de poids corporel élève l'activité des facteurs VII et IX de 0,01 UI/ml et celle des facteurs II et X de respectivement 0,02 et 0,017 UI/ml.
Formules pour la détermination de la posologie requise:
F IX: Unités requises = poids corporel (kg) × augmentation souhaitée en facteur IX (%) × 1 (U.I./kg).
F VII: Unités requises = poids corporel (kg) × augmentation souhaitée en facteur VII (%) × 1 (U.I./kg).
F II: Unités requises = poids corporel (kg) × augmentation souhaitée en facteur II (%) × 0,50 (U.I./kg).
F X: Unités requises = poids corporel (kg) × augmentation souhaitée en facteur X (%) × 0,59 (U.I./kg).
La dose d'entretien dépend de la situation clinique du patient, des demi-vies et du niveau d'activité requis.
L'expérience dans le traitement d'un déficit congénital en facteurs II, VII ou X est limitée. Du fait de la demi-vie plus longue des facteurs II et X, l'intervalle entre deux administrations de concentré de complexe prothrombique sera plus long chez les patients présentant un déficit congénital en facteur II ou X.
La demi-vie du facteur VII atteint 1,5–6 heures. En conséquence, l'intervalle entre deux administrations de concentré de complexe prothrombique sera plus court chez les patients présentant un déficit congénital en facteur VII.
Après le début du traitement de substitution, la concentration en facteur déficient doit être déterminée au moyen d'un test spécifique approprié, de façon à évaluer la réponse au traitement et à pouvoir planifier la suite du traitement.
Instructions posologiques particulières
Il n'existe aucune donnée sur l'utilisation d'Octaplex dans les hémorragies périnatales par déficit en facteurs de coagulation du complexe prothrombique. L'expérience dans le traitement d'un déficit congénital en facteurs II, VII ou X est limitée.
Enfants et adolescents
L'utilisation et la sécurité de Octaplex, poudre et solution pour préparation d'une solution injectable, chez l'enfant et l'adolescent n'ont pas été testées à ce jour.
Mode d'emploi
Le produit doit être administré par voie intraveineuse. Pour plus de précisions sur les modalités d'administration, voir «Remarques particulières, Remarques concernant la manipulation».
Contre-indicationsOctaplex ne doit pas être utilisé chez les patients qui présentent:
·Une hypersensibilité connue aux composants médicalement actifs ou à l'un des excipients.
·Une hypersensibilité connue à l'héparine ou des antécédents de thrombocytopénie induite par l'héparine.
·Étant donné qu'Octaplex ne contient pas d'ATIII, il ne doit pas être utilisé dans les situations cliniques qui peuvent conduire à un déficit en ATIII (par ex. lors de coagulopathie de consommation préexistante ou dans le cadre d'une cirrhose hépatique ou d'un syndrome néphrotique) (voir également sous «Mises en garde et précautions»).
Mises en garde et précautionsVoir aussi sous «Grossesse/Allaitement» et «Effets indésirables».
Avant l'utilisation d'Octaplex, on demandera l'avis d'un spécialiste ayant de l'expérience dans traitement des troubles de la coagulation.
Le médicament ne doit être utilisé chez les patients qui présentent un déficit acquis en facteurs de coagulation du complexe prothrombique (par ex. provoqué par un traitement par antagonistes de la vitamine K) uniquement si une augmentation rapide de la concentration en complexe prothrombique est nécessaire, comme par exemple en cas d'hémorragie grave ou d'intervention en urgence. Dans les autres cas, l'administration de vitamine K et/ou de plasma et/ou la réduction de la dose de l'antagoniste de la vitamine K sont des mesures souvent suffisantes.
Les patients recevant des antagonistes de la vitamine K peuvent présenter une disposition à l'hypercoagulation, qui peut être renforcée par la perfusion d'un concentré de complexe prothrombique.
En cas de déficit congénital en un facteur de coagulation dépendant de la vitamine K, on devra de préférence utiliser un concentré de facteur individuel, si celui-ci est disponible.
Si une réaction allergique ou anaphylactique survient, il faut immédiatement arrêter la perfusion. En cas de choc, il faudra suivre les directives médicales édictées pour le traitement du choc.
Octaplex est fabriqué à partir de plasma humain. Les mesures habituelles pour empêcher les infections transmises par l'utilisation de médicaments provenant de sang humain et de plasma sanguin, incluent le choix du donneur et le dépistage individuel des donneurs à la recherche de marqueurs spécifiques d'infection, ainsi que des étapes efficaces pour l'inactivation/l'élimination des virus au cours des procédures de fabrication. Toutefois, la possibilité de transmission d'un agent pathogène ne peut être complètement exclue lors de l'administration de médicaments fabriqués à partir de sang ou de plasma humain. Ceci est valable également pour les virus inconnus à ce jour, pour les virus nouvellement apparus ainsi que pour d'autres pathogènes.
Les mesures prises sont considérées comme étant efficaces pour les virus à enveloppe comme le VIH, le VHB et le VHC. Ces mesures peuvent avoir une efficacité limitée pour les virus sans enveloppe comme le VHA ou le Parvovirus B19. Les infections à Parvovirus B19 peuvent avoir des conséquences graves pour les femmes enceintes (infections du foetus) et pour les patients qui présentent un déficit immunitaire ou une augmentation de la production des globules rouges (par ex. lors d'anémie hémolytique).
Afin d'assurer la traçabilité des médicaments biologiques, il est recommandé de consigner le nom commercial et le numéro de lot pour chaque traitement.
Il est généralement recommandé de vacciner les patients contre l'hépatite A et l'hépatite B s'ils reçoivent régulièrement ou de façon répétée un concentré de complexe prothrombique fabriqué à partir de plasma humain.
Les patients recevant un concentré de complexe prothrombique d'origine humaine seront surveillés à la recherche de symptômes d'une coagulation intravasculaire ou d'une thrombose. Il existe en particulier chez les patients qui reçoivent de façon répétée des concentrés de complexe prothrombique un risque de thrombose ou de coagulation intravasculaire disséminée (CIVD). Ceci est valable aussi bien pour les patients qui présentent un déficit congénital que pour ceux qui ont un déficit acquis en facteurs de coagulation du complexe prothrombique. Le risque peut être accru en cas de traitement d'un déficit spécifique du facteur VII; car , dans cette situation, les autres facteurs du complexe prothrombique, en raison de leur demi-vie comparativement plus longue, peuvent s'accumuler. Les patients recevant un concentré de complexe prothrombique d'origine humaine seront surveillés à la recherche de symptômes d'une coagulation intravasculaire ou d'une thrombose. A cause du risque de complications thromboemboliques, l'administration du concentré de complexe prothrombique devrait être effectuée avec prudence chez les patients ayant une anamnèse de cardiopathie coronarienne, les patients ayant une hépatopathie, les patients en phase péri- ou post opératoire, les nouveau-nés ou les patients qui ont un risque d'événements thromboemboliques ou une coagulation intravasculaire disséminée.
Ceci est également valable pour les patients ou les situations cliniques dans lesquelles l'existence d'un déficit en anti-thrombine III est à soupçonner (voir «Contre-indications»). Chez les patients en post-opératoire, la prévention des thromboses par l'héparine est indiquée. Dans chacune de ces situations, l'avantage potentiel du traitement par Octaplex doit être comparé au risque lié à ses complications.
Ce médicament contient 75 – 125 mg (flacon de 500 U.I.) ou 150 – 250 mg (flacon de 1000 U.I.) de sodium par flacon, ce qui équivaut à 3,8 – 6,3 % ou 7,5 – 12,5 % de la dose quotidienne maximale recommandée par l'OMS de 2 g de sodium pour un adulte.
L'héparine peut provoquer des réactions allergiques et diminuer le nombre de cellules sanguines entraînant un trouble de la coagulation. En cas d'antécédents de réactions allergiques à l'héparine, les médicaments contenant de l'héparine ne doivent pas être utilisés.
InteractionsLes interactions provoquées par le concentré de complexe prothrombique humain ne sont pas connues en dehors de celles provoquées par l'association aux antagonistes de la vitamine K. Lors de tests de coagulation, qui sont perturbés par l'héparine, l'héparine provenant d'Octaplex doit être prise en considération, en particulier chez les patients recevant une posologie élevée.
Grossesse, allaitementGrossesse
La sécurité du concentré de complexe prothrombique humain au cours de la grossesse n'a pas été étudiée. Il n'existe pas d'études expérimentales sur l'animal suffisantes pour évaluer l'incidence sur la grossesse, le développement de l'embryon/foetus, ou encore le développement postnatal. Le risque potentiel sur l'humain n'est pas connu.
Octaplex ne devrait être administré à la femme enceinte ou à la femme allaitante qu'en cas d'indication clairement posée.
Effet sur l’aptitude à la conduite et l’utilisation de machinesIl n'a pas été réalisé d'étude correspondante concernant l'incidence sur l'aptitude à la conduite et l'utilisation de machines.
Effets indésirablesDes réactions allergiques ou anaphylactiques et une augmentation de la température corporelle peuvent survenir dans de rares cas.
Il existe un risque de thromboembolie après l'administration de préparations de complexe prothrombique humain. Ceci doit être particulièrement pris en compte lors du traitement d'un déficit spécifique du facteur VII (voir «Mises en garde et précautions»).
Un traitement de substitution peut dans des cas isolés entraîner la formation d'anticorps circulants dirigés contre les facteurs de coagulation individuels. Lorsque ces inhibiteurs se forment, le complexe prothrombique perfusé est inactivé partiellement ou complètement. Ce faisant, l'efficacité clinique du concentré de complexe prothrombique humain est diminuée.
En ce qui concerne les données de fréquence relatives aux effets indésirables, les catégories suivantes ont été établies: rare (≥1/10'000, < 1/1'000); très rare (< 1/10'000).
|
Classes de systèmes d’organes MedDRA
|
Effet indésirable
|
Fréquence
| |
Affections hématologiques et du système lymphatique
|
Inhibition des facteurs de coagulation
|
Cas isolés
| |
|
Thrombopénie induite par l’héparine
|
Rare
| |
Affections du système immunitaire
|
Choc anaphylactique
|
Très rare
| |
|
Réaction anaphylactique
|
Rare
| |
|
Hypersensibilité
|
Très rare
| |
Affections du système nerveux
|
Tremblement
|
Très rare
| |
Affections cardiaques
|
Arrêt cardiaque
|
Très rare
| |
|
Tachycardie
|
Très rare
| |
Affections vasculaires
|
Évènement thromboembolique
|
Très rare
| |
|
Collapsus cardiovasculaire
|
Très rare
| |
|
Hypotonie
|
Très rare
| |
|
Hypertonie
|
Très rare
| |
Affections respiratoires, thoraciques et médiastinales
|
Insuffisance respiratoire
|
Cas isolés
| |
|
Dyspnée
|
Très rare
| |
Affections gastro-intestinales
|
Nausée
|
Très rare
| |
Affections de la peau et du tissus sous-cutané
|
Urticaire
|
Très rare
| |
|
Éruption cutanée
|
Très rare
| |
Troubles généraux et anomalies au site d'administration
|
Fièvre
|
Très rare
| |
|
Frisson
|
Très rare
| |
Investigations
|
Taux accru de transaminases
|
Rare
|
Octaplex contient de l'héparine. C'est pourquoi on peut observer dans de rares cas des thrombopénies induites par des anticorps de l'héparine (type II) avec des valeurs de thrombocytes nettement inférieures à 100'000/µl ou une chute à moins de 50 % de la valeur initiale. Chez les patients ne présentant pas d'hypersensibilité préexistante à l'héparine, la chute du taux de thrombocytes débute généralement 6 à 14 jours après le début du traitement. Chez les patients présentant une hypersensibilité à l'héparine, cette chute peut survenir dans certaines circonstances en quelques heures. Il convient d'interrompre immédiatement l'administration d'Octaplex chez les patients présentant les réactions allergiques citées. Ces patients ne doivent à l'avenir plus être traités avec un médicament contenant de l'héparine. Pour les données de sécurité d'emploi à propos des agents pathogènes transmissibles, voir «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosagePour éviter un surdosage pendant le traitement, les paramètres de coagulation doivent être surveillés minutieusement. L'utilisation de doses élevées de concentré de complexe prothrombique fabriqué à partir de plasma humain a été associée à des cas d'infarctus du myocarde, de coagulation intravasculaire disséminée, de thrombose veineuse et d'embolie pulmonaire. En conséquence, en cas de surdosage, la survenue de complications thromboemboliques ou d'une coagulation intravasculaire est augmentée chez les patients présentant un risque pour ce type de complications. La prudence est particulièrement recommandée chez les patients pouvant présenter un déficit en ATIII (voir «Contre-indications»).
Propriétés/EffetsCode ATC
B02BD01
Groupe thérapeutique: Facteur de coagulation IX, II, VII et X en association.
Mécanisme d'action
L'administration d'un concentré de complexe prothrombique humain entraîne une augmentation des facteurs de la coagulation vitamine K-dépendants dans le plasma et peut corriger de façon transitoire le trouble de coagulation chez les patients qui souffrent d'un déficit d'un ou de plusieurs de ces facteurs.
Le déficit grave en facteur VII spécifique provoque des tendances hémorragiques en raison d'une altération de l'hémostase primaire accompagnée d'une réduction de la formation de thrombine et de fibrine. Le déficit en facteur IX spécifique est une des formes classiques de l'hémophilie (hémophilie B). Le déficit en facteur II ou en facteur X spécifiques est très rare, mais peut toutefois dans les formes graves être à l'origine d'hémorragies comme celles rencontrées dans les hémophilies classiques.
Le traitement par antagoniste de la vitamine K peut entraîner un déficit des différents facteurs de coagulation du complexe prothrombique (déficit acquis). Les phénomènes déficitaires graves entraînent des hémorragies importantes, caractérisées plutôt par des hémorragies rétropéritonéales ou cérébrales que par des saignements musculaires et articulaires. En cas d'insuffisance hépatique grave, il existe une tendance hémorragique faisant suite à une diminution en facteurs du complexe prothrombique ainsi qu'une coagulation (intravasculaire) simultanée, caractérisée par une augmentation de la concentration en D-dimère. Une réduction des inhibiteurs de la coagulation, une baisse de la fibrinolyse tout comme une diminution du taux des plaquettes rendent la situation particulièrement complexe.
Pharmacodynamique
Les facteurs de coagulation II, VII, IX et X sont synthétisés dans le foie sous la dépendance de la vitamine K et sont en général désignés par le nom de complexe prothrombique.
Le facteur VII est le zymogène du facteur VIIa (sérine protéase active).
Le complexe formé par la thromboplastine tissulaire et le facteur VIIa active les facteurs de coagulation F X et F IX en facteurs Xa et IXa. Au cours du déroulement de la cascade de la coagulation, la prothrombine (Facteur II) est transformée en thrombine. Sous l'action de la thrombine, le fibrinogène est transformé en fibrine , ce qui entraîne la formation d'un caillot. La formation de thrombine est également d'une grande importance pour la fonction plaquettaire dans le cadre de l'hémostase primaire.
Efficacité clinique
Dans une étude multicentrique réalisée chez 60 patients «chirurgicaux», 56 ont pu être évalués selon le protocole et 19 d'entre eux avaient subi une intervention chirurgicale importante. 91% des patients se sont avérés être des «répondeurs» (augmentation de la valeur de Quick suffisante).
Pratiquement tous les patients ont reçu un traitement antithrombotique préventif en postopératoire, le plus souvent sous forme d'héparine de bas poids moléculaire. La tolérance clinique a été évaluée comme étant satisfaisante par les participants à l'étude.
PharmacocinétiqueAbsorption
Octaplex est disponible immédiatement et complètement en raison de son administration intraveineuse.
Distribution
Aucune donnée.
Métabolisme
Les demi-vies plasmatiques des différents facteurs sont les suivantes:
|
Facteur II
|
48 - 60 heures
| |
Facteur VII
|
1,5 - 6 heures
| |
Facteur IX
|
20 - 24 heures
| |
Facteur X
|
24 - 48 heures
|
Élimination
Aucune donnée.
Données précliniquesL'étude de la toxicité d'une dose unique dans le modèle animal est insignifiante par la surcharge volumique liée à l'administration de doses importantes. Des études de toxicité après administrations répétées ne sont pas réalisables chez l'animal, étant donné que les animaux développent des anticorps contre les protéines humaines.
Remarques particulièresIncompatibilités
Octaplex ne doit pas être mélangé à d'autres médicaments.
Influence sur les méthodes de diagnostic
En cas d'application de fortes doses, l'héparine additionnée à Octaplex doit être prise en considération lors de la réalisation d'analyses de la coagulation sensibles à l'héparine. Le sulfate de protamine ou d'autres réactifs disponibles permettent, le cas échéant, de neutraliser in vitro l'effet héparinique sur les analyses de la coagulation.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
La préparation pour perfusion reconstituée ne contient pas d'agent conservateur.
La stabilité chimique et physique de la solution prête à l'emploi a été démontrée pendant un maximum de 8 heures à une température comprise entre +2°C et +25°C.
Du point de vue microbiologique, la solution prête à l'emploi doit être utilisée immédiatement après reconstitution. Si l'utilisation n'est pas immédiate, la durée de conservation et les conditions avant l'utilisation sont sous la responsabilité de l'utilisateur.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C. Ne pas congeler. Conserver dans l'emballage d'origine.
Conserver le récipient dans son carton pour le protéger de la lumière.
Tenir hors de la portée des enfants.
Remarques concernant la manipulation
Veuillez lire toutes les consignes avant de les suivre attentivement!
La reconstitution de la solution du médicament et la perfusion doivent être effectuées dans des conditions aseptiques.
À température ambiante, le produit se dissout rapidement pour donner une solution claire ou légèrement opalescente. N'utilisez pas de solutions troubles ou présentant des dépôts.
Le médicament prêt à l'emploi doit être utilisé immédiatement après sa dissolution.
Il est recommandé d'utiliser le dispositif de transfert présent dans l'emballage.
Instructions pour la fabrication de la solution
1.Porter à température ambiante (max. 37 °C) les flacons fermés de concentré et de solvant (eau pour préparations injectables). Si un bain-marie est utilisé pour réchauffer les flacons, une attention particulière doit être accordée à ce que l'eau du bain n'entre ni en contact avec les bouchons en caoutchouc ni avec les opercules des flacons avec. La température du bain-marie ne devrait pas dépasser 37 °C.
2.Retirer les opercules de protection du flacon de concentré et du flacon de solvant et désinfecter la surface des deux bouchons à l'aide d'un tampon imbibé d'alcool.
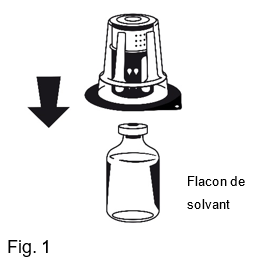
3.Retirer le couvercle de protection de l'emballage externe du set de transfert Nextaro® mais ne sortez pas le Nextaro® du blister. Placer le flacon de solvant sur une surface plane et tenir le flacon fermement. Saisir le Nextaro® avec le blister et enfoncer la pointe de la partie bleue au centre du bouchon du flacon de solvant jusqu'à ce qu'il s'enclenche (Fig. 1). Ne pas effectuer de rotation lors de la fixation!Retirer l'emballage du Nextaro® en tenant fermement le flacon de solvant et en tirant l'emballage (le blister) verticalement vers le haut. Vérifier à ce que le Nextaro® ne soit pas ôté (Fig. 2).

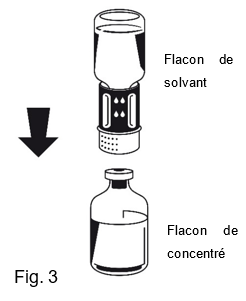
4.Placer le flacon de concentré (Poudre) sur une surface plane et tenir le flacon fermement. Retourner le flacon de solvant avec le Nextaro® fixé et placer l'extrémité blanche du Nextaro® sur le dessus du flacon de concentré (Poudre) et appuyer fermement vers le bas jusqu'à ce qu'il s'enclenche (Fig. 3). Ne pas effectuer de rotation lors de la fixation! Le solvant s'écoule automatiquement dans le flacon de concentré (Poudre).
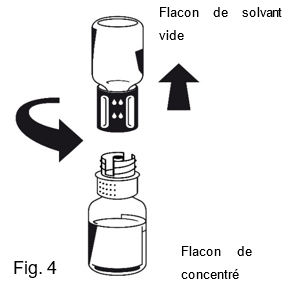
5.Pendant que les deux flacons sont encore fixés ensemble, faire pivoter doucement le flacon de concentré (ne pas secouer) jusqu'à ce que la poudre soit dissoute. Octaplex se dissout rapidement à température ambiante pour donner une solution incolore à légèrement bleue. Dévisser le flacon de solvant avec la partie bleue du Nextaro® du flacon de concentré (Fig. 4). Éliminer le flacon de solvant vide avec la partie bleue du Nextaro®.
Les solutions prêtes à l'emploi doivent être examinées visuellement avant administration. Ne pas utiliser la solution, si le concentré n'est pas complètement dissout ou si un agrégat s'est formé.
Instructions pour la perfusion:
Par mesure de précaution, il convient de contrôler la fréquence cardiaque du patient avant et pendant la perfusion. En cas d'augmentation importante de la fréquence cardiaque, la vitesse de la perfusion doit être diminuée ou l'administration doit être interrompue.
1.Après avoir préparé le concentré de la manière décrite ci-dessus, fixer une seringue à usage unique sur le flacon de concentré au raccord Luer-Lock de la partie blanche du Nextaro®. Retourner le flacon avec la seringue fixée et prélever le médicament dissous dans la seringue. Dès que la solution a été transférée dans la seringue, tenir fermement le piston de la seringue et retirer la seringue du Nextaro® (et du flacon de concentré). Le piston de la seringue est encore tenu vers le bas. Éliminer le Nextaro® et le flacon vide de concentré.
2.Désinfecter le site prévu de perfusion de manière appropriée.
3.Injecter la solution lentement par voie intraveineuse (vitesse initiale de 1 ml/minute sans dépasser 2 à 3 ml/minute).
Il faut vérifier que le sang ne reflue pas dans la seringue, en raison du risque de coagulation dans celle-ci et par conséquent d'injection de caillots de fibrine. Le Nextaro® est à usage unique.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation nationale en vigueur.
Numéro d’autorisation57918 (Swissmedic)
Présentation1 emballage d'Octaplex 500 contient:
1 flacon avec poudre
1 flacon avec 20 ml d'eau pour préparations injectables
1 set de transfert Nextaro®.
(B)
1 emballage d'Octaplex 1000 contient:
1 flacon avec poudre
1 flacon avec 40 ml d'eau pour préparations injectables
1 set de transfert Nextaro®.
(B)
Titulaire de l’autorisationOctapharma SA, Seidenstrasse 2, 8853 Lachen.
Mise à jour de l’informationNovembre 2021.
| 



