CompositionPrincipes actifs
Palipéridone.
Excipients
Oxyde de polyéthylène, chlorure de sodium (équivalant à 11,80 mg de sodium), povidone (K29-32), acide stéarique, butylhydroxytoluène (E321), oxyde de fer rouge (E172), hydroxyéthylcellulose, macrogol 3350, acétate de cellulose.
Enrobage: hypromellose, dioxyde de titane (E171), cire de carnauba.
Dans les comprimés à libération prolongée à 3 mg: lactose monohydraté (13,2 mg), oxyde de fer jaune (E172), triacétine.
Dans les comprimés à libération prolongée à 6 mg: macrogol 400, oxyde de fer jaune (E172).
Dans les comprimés à libération prolongée à 9 mg: macrogol 400.
Encre d'impression: oxyde de fer noir (E172), propylène glycol, hypromellose.
Indications/Possibilités d’emploiInvega est indiqué dans le traitement de la schizophrénie.
Posologie/Mode d’emploiAdultes (≥18 ans)
Invega est destiné à une utilisation orale et peut être pris avec des aliments ou à jeun. L'administration d'Invega doit être standardisée par rapport à la prise de nourriture (voir «Pharmacocinétique»): les patients ne doivent pas alterner entre administration à jeun et administration avec un repas. Invega dois être avalé entier avec un peu de liquide, il ne faut pas le croquer ni le diviser, ni l'écraser (voir «Mises en garde et précautions» - «possibilité d'une obstruction gastro-intestinale»). Le médicament se trouve dans une enveloppe non résorbable dont le principe actif s'échappe à une vitesse contrôlée. L'enveloppe du comprimé est éliminée du corps avec les éléments insolubles du noyau du comprimé. Si les patients découvrent par hasard quelque chose qui ressemble à un comprimé dans leurs selles, il n'y a aucune raison de s'inquiéter.
La dose d'Invega recommandée s'élève à 6 mg une fois par jour, le matin, elle doit, dans la mesure du possible, toujours être absorbée de la même manière, c'est-à-dire en principe avec le petit-déjeuner (ou même à jeun). Une titration initiale de la dose n'est pas nécessaire. Pour quelques des patients, des doses plus faibles de 3 mg ou des doses plus élevées ne dépassant pas 12 mg une fois par jour peuvent être bénéfiques. Le cas échéant, une adaptation de la dose indiquée ne doit se produire qu'après réévaluation clinique. En cas d'indication, on recommande une augmentation de la dose par paliers de 3 mg par jour, généralement à intervalles de 5 jours au minimum.
Autres groupes de patients particuliers
Une adaptation de la dose d'Invega en raison du sexe, de l'origine ethnique ou du tabagisme du patient n'est pas recommandée (pour les femmes enceintes ou qui allaitent, voir «Grossesse/Allaitement»).
Passage à d'autres antipsychotiques
Pour le passage d'Invega à d'autres antipsychotiques, aucune donnée spécifique recueillie de façon systématique n'est disponible. Lorsqu'un passage à un autre antipsychotique est considéré comme médicalement adéquat, une surveillance médicale est nécessaire en raison des différents profils pharmacodynamiques et pharmacocinétiques existants selon les types d'antipsychotiques.
Patients présentant des troubles de la fonction hépatique
Chez les patients présentant une insuffisance hépatique légère à modérée, aucune adaptation de la posologie n'est nécessaire. Comme Invega n'a pas été étudié chez des patients présentant une insuffisance hépatique sévère, la prudence est recommandée chez de tels patients.
Patients présentant des troubles de la fonction rénale
La posologie initiale recommandée pour les patients présentant une insuffisance rénale légère (clairance de la créatinine ≥50 à <80 ml/min) s'élève à la dose initiale de 3 mg une fois par jour. La posologie peut être augmentée jusqu'à une dose journalière de 6 mg en fonction de la réponse clinique et de la tolérance.
Chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine ≥30 à <50 ml/min) la posologie recommandée d'Invega est de 3 mg un jour sur deux: après une réévaluation clinique, la posologie pourra être augmentée, le cas échéant, à 3 mg par jour. Pour les patients présentant une insuffisance rénale sévère (clairance de la créatinine ≥10 à <30 ml/min), la posologie initiale recommandée d'Invega est de 3 mg tous les deux jours; après une nouvelle évaluation clinique, la posologie peut, le cas échéant, être augmentée à 3 mg une fois par jour. Comme Invega n'a pas été étudié chez des patients présentant une clairance de la créatinine inférieure à 10 ml/min, l'utilisation de ce médicament chez de tels patients n'est pas recommandée.
Patients âgés
Les recommandations concernant la posologie chez les patients âgés présentant une fonction rénale normale (clairance de la créatinine ≥80 ml/ min) correspondent aux recommandations faites pour les adultes présentant une fonction rénale normale (voir le premier paragraphe ci-dessus sous «Posologie/Mode d'emploi»). Comme la fonction rénale peut toutefois être diminuée chez les patients âgés, une adaptation de la posologie peut le cas échéant être nécessaire selon la fonction rénale (voir ci-dessus sous «Patients présentant des troubles de la fonction rénale»). Chez les patients âgés atteints de démence et présentant des facteurs de risque d'accident vasculaire cérébral, Invega doit être utilisé avec prudence (voir «Mises en garde et précautions»).
Enfants et adolescents
La sécurité et l'efficacité d'Invega n'ont pas été étudiées chez les enfants de moins de 18 ans. Ce médicament ne doit pas être utilisé chez les patients pédiatriques avant que plus de données ne soient disponibles.
Contre-indicationsIl convient de ne pas utiliser Invega chez les patients présentant une hypersensibilité connue à la palipéridone, au rispéridone ou à un autre élément présent dans la formule.
Patients déments présentant des symptômes de la maladie de Parkinson comme la raideur, la bradykinésie et les troubles de la posture liées à la maladie de Parkinson.
Les patients déments avec un diagnostic vraisemblable d'une démence de type corps de Lewy (outre les symptômes de démence, au moins deux des trois symptômes suivants: parkinsonisme/hallucinations visuelles/fluctuations de la marche).
Mises en garde et précautionsIntervalle QT
Comme avec les autres antipsychotiques, la prudence est recommandée chez les patients sous Invega présentant des maladies cardiovasculaires, un syndrome du QT long congénital, ainsi que des antécédents familiaux d'allongement de l'intervalle QT, de même que chez les patients prenant simultanément d'autres médicaments dont on sait qu'ils allongent le segment QT.
Syndrome malin des neuroleptiques
En lien avec les antipsychotiques, y compris la palipéridone, des cas de syndrome malin des neuroleptiques (SMN) ont été rapportés. Il se caractérise par une hyperthermie, une rigidité musculaire, une instabilité autonome, des troubles de la conscience et l'augmentation du taux de créatinine phosphokinase sérique. D'autres signes cliniques peuvent être une myoglobinurie (rhabdomyolyse) et une défaillance rénale sévère. En présence d'indices cliniques suggérant un SMN, il convient d'arrêter tout traitement par des antipsychotiques, y compris Invega.
Dyskinésie tardive/Symptômes extrapyramidaux
Les médicaments ayant des effets antagonistes sur le récepteur de la dopamine ont été mis en relation avec l'induction de dyskinésies tardives, caractérisées par des mouvements involontaires rythmés, surtout de la langue et/ou du visage. En présence de symptômes de dyskinésie tardive, il convient d'envisager l'arrêt de tout traitement par des antipsychotiques, y compris Invega.
Symptômes extrapyramidaux et psychostimulants
La prudence est recommandée chez les patients recevant simultanément des psychostimulants (p.ex. du méthylphénidate) et de la palipéridone, car des symptômes extrapyramidaux sont susceptibles de survenir lors de l'ajustement posologique de l'un des médicaments ou des deux médicaments. Il convient d'envisager l'arrêt progressif de l'un des traitements ou des deux traitements (voir «Interactions»).
Hyperglycémie et diabète sucré
Des cas d'hyperglycémie, de diabète sucré et d'exacerbation d'un diabète préexistant ont été rapportés sous traitement par Invega. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et d'éventuelles anomalies du glucose est rendue plus difficile par la possibilité d'un risque de base de diabète sucré chez les patients souffrant de schizophrénie et par l'incidence croissante du diabète sucré dans la population générale. En raison de ces facteurs, la relation entre l'utilisation des antipsychotiques atypiques et les effets indésirables associés à l'hyperglycémie est encore incomplètement comprise. Des études épidémiologiques suggèrent toutefois qu'il existe un risque plus élevé de survenue d'effets associés à l'hyperglycémie chez les patients sous traitement par des antipsychotiques atypiques. Chaque patient traité par des antipsychotiques atypiques, y compris par Invega, devrait être surveillé à la recherche de symptômes d'hyperglycémie et d'un diabète sucré.
Prise de poids
Une prise de poids corporel a été observée sous administration d'antipsychotiques atypiques. Il est par conséquent recommandé de surveiller régulièrement le poids.
Hypotension orthostatique
La palipéridone peut provoquer chez la plupart des patients une hypotension orthostatique en raison de son activité alpha-bloquante. Sur la base des données de groupe issues des 3 études de six semaines avec contrôle placebo avec des doses fixes d'Invega (3, 6, 9 et 12 mg), une hypotension orthostatique a été rapportée chez 2,5% des sujets sous Invega, contre 0,8% des sujets dans le groupe placebo. L'utilisation d'Invega doit se faire avec prudence chez les patients présentant une maladie cardiovasculaire avérée (par exemple, insuffisance cardiaque, infarctus du myocarde, ischémie, troubles de la conduction de l'excitation) maladies cérébrovasculaires ou présentant une prédisposition à l'hypotension (par exemple déshydratation, hypovolémie et le traitement par médicaments antihypertenseurs).
Crises d'épilepsie
Comme pour tous les antipsychotiques, il convient d'être prudent lors de l'utilisation d'Invega chez les patients présentant des antécédents connus de crise d'épilepsie ou d'autres états susceptibles d'accompagner une baisse du seuil de crise.
Possibilité d'une obstruction gastro-intestinale
Comme les comprimés d'Invega ne sont pas déformables et ne changent pas visiblement de forme dans le tractus gastro-intestinal, Invega ne devrait normalement pas être utilisé chez les patients présentant un rétrécissement du tractus gastro-intestinal (pathologique ou iatrogène) ou chez les patients présentant une dysphagie ou chez ceux ayant des difficultés importantes à avaler des comprimés. Chez des patients ayant des sténoses connues, de rares cas de symptômes obstructifs, associés à la prise de médicaments sous forme de formulations à libération contrôlée non déformables, ont été rapportés. Comme il s'agit, dans le cas d'Invega, d'une formulation à libération prolongée, Invega ne doit être administré qu'à des patients pouvant avaler le comprimé en entier (voir «Posologie/Mode d'emploi»).
Maladies avec un temps de passage gastro-intestinal réduit
Les maladies provoquant une réduction du temps de passage dans le tractus gastro-intestinal, par exemple, les maladies associées à des diarrhées chroniques sévères peuvent provoquer une réduction de la résorption de la palipéridone. L'efficacité antipsychotique peut ainsi être réduite ou des fluctuations de l'efficacité peuvent être observées. Ce phénomène n'a pas été étudié, c'est pourquoi la prudence est recommandée chez les patients présentant des diarrhées. La palipéridone ne doit pas être prescrite aux patients présentant une affection liée à des diarrhées chroniques sévères.
Insuffisance rénale
Les concentrations plasmatiques de la palipéridone sont plus élevées chez les patients présentant une insuffisance rénale, une adaptation de la dose peut donc être nécessaire pour la plupart des patients (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»). Pour les patients ayant une clairance de la créatinine inférieure à 10 ml/min, il n'existe aucune donnée. La palipéridone ne doit pas être utilisée chez les patients ayant une clairance de la créatinine inférieure à 10 ml/min.
Insuffisance hépatique
Il n'existe aucune donnée concernant les patients présentant une insuffisance hépatique sévère (classe Child-Pugh C). Lorsque la palipéridone doit être utilisée chez ces patients, il convient d'être prudent.
Patients âgés et séniles
L'utilisation d'Invega chez les patients âgés présentant une démence sénile n'a pas été étudiée. L'utilisation chez les patients âgés atteints de démence n'est pas recommandée. Au cours d'études cliniques sur certains autres antipsychotiques atypiques, un risque augmenté de cas de décès et d'événements cérébrovasculaires a été rapporté (voir «Posologie/Mode d'emploi» - «Sujets âgés» et «Effets indésirables» - «Sujets âgés»).
Les expériences obtenues avec la rispéridone sont considérées comme étant également valides à propos de la palipéridone (principal métabolite actif de la rispéridone).
Mortalité totale augmentée
Dans une méta-analyse de 17 essais cliniques contrôlés, les patients âgés séniles traités par d'autres antipsychotiques atypiques, y compris la rispéridone, l'aripiprazole, l'olanzapine et la quétiapine ont montré un risque de mortalité plus élevé que les patients du groupe placebo. Sur le groupe de patients traités à la rispéridone, la mortalité s'élevait à 4% contre 3,1% dans le groupe placebo. L'âge moyen des patients décédés s'élevait à 86 ans (fourchette d'âge 67-100 ans).
Événements cérébrovasculaires plus fréquents
Les essais cliniques randomisés avec contrôle placebo sur la population sénile sur quelques antipsychotiques atypiques, y compris la rispéridone, l'aripiprazole et l'olanzapine ont montré que le risque d'effets indésirables cérébrovasculaires, parfois avec une issue fatale, était multiplié par trois. Le mécanisme expliquant cette augmentation du risque n'est pas connu. La prudence est de mise lors de l'utilisation d'Invega chez des patients âgés atteints de démence et présentant des facteurs de risque d'accident vasculaire cérébral (voir «Posologie/Mode d'emploi» - «Sujets âgés»).
Leucopénie, neutropénie et agranulocytose
Des cas de leucopénie, de neutropénie et d'agranulocytose ont été rapportés sous traitement par des antipsychotiques (y compris Invega) au cours des études cliniques et/ou après l'introduction sur le marché. L'agranulocytose n'a que très rarement été observée (<1/10'000 patients) depuis l'introduction sur le marché. Les patients avec une anamnèse de diminution cliniquement significative des globules blancs ou ayant présenté une leucopénie/neutropénie induite par un médicament devraient être surveillés pendant les premiers mois de traitement et l'arrêt de l'administration d'Invega devrait être envisagé au premier signe de diminution significative du nombre des globules blancs en cas d'absence d'un autre facteur causal.
Les patients avec neutropénie cliniquement significative doivent être étroitement surveillés à la recherche d'une fièvre ou d'autres signes d'infection et immédiatement traités en conséquence si des symptômes correspondants venaient à apparaître. Chez les patients présentant une neutropénie marquée (nombre absolu de neutrophiles <1× 109/l), le traitement par Invega devrait être arrêté et le nombre de globules blancs devrait être régulièrement surveillé.
Thromboembolie veineuse
Des cas de thromboembolies veineuses (TEV) ont été rapportés en relation avec l'utilisation d'antipsychotiques. Étant donné que les patients traités par des antipsychotiques présentent souvent des facteurs de risque acquis de TEV, il convient d'identifier tous les facteurs de risque de thromboembolies veineuses possibles avant et pendant le traitement par Invega et de prendre les mesures préventives qui s'imposent (voir «Effets indésirables»).
Maladie de Parkinson et démence à corps de Lewy (voir «Contre-indications»)
Les antipsychotiques, y compris Invega, ne doivent être utilisés qu'avec prudence chez les patients présentant une maladie de Parkinson ou une démence à corps de Lewy qu'après évaluation du rapport bénéfice risque par un médecin. Les patients de ces deux groupes présentent un risque plus élevé de voir apparaître un syndrome malin des neuroleptiques et peuvent présenter une plus grande sensibilité aux antipsychotiques. Une telle sensibilité plus élevée aux antipsychotiques atypiques peut se manifester, outre par des symptômes extrapyramidaux, par de la confusion mentale, un affadissement affectif et une baisse de la faculté de discernement et par des troubles de l'équilibre avec des chutes fréquentes.
Suicide et tentative de suicide
Une maladie psychotique est associée à un risque suicidaire augmenté, avec ou sans tentatives de suicide. Chez les patients à haut risque, tout traitement médicamenteux doit s'accompagner d'une surveillance étroite. Le nombre de comprimés prescrits devrait toujours être aussi faible que possible, afin de réduire le risque de surdosage.
Priapisme
Les médicaments agissant par blocage alpha-adrénergique peuvent être à l'origine d'un priapisme. Des cas de priapisme ont été rapportés après l'introduction de la palipéridone sur le marché (voir «Effets indésirables»). Les patients doivent être informés de ce risque, et il faut leur recommander de consulter sans tarder un spécialiste en cas d'apparition d'une érection persistante et douloureuse.
Tumeurs dépendantes de la prolactine
Il convient de ne pas prescrire Invega en présence de tumeurs dépendantes de la prolactine, comme les prolactinomes hypophysaires ou les tumeurs susceptibles d'être dépendantes de la prolactine comme les tumeurs mammaires épithéliales.
Régulation de la température corporelle
Les antipsychotiques peuvent influencer la capacité de l'organisme à baisser la température du corps. La prudence est donc recommandée lorsque les patients auxquels Invega est prescrit sont soumis à des situations susceptibles d'augmenter la température du corps (par exemple, activité physique intense, exposition à une chaleur extrême, utilisation simultanée de médicaments ayant une action anticholinergique ou déshydratation).
Effet antiémétique
Lors des études précliniques avec la palipéridone, une action antiémétique a été observée. Si cet effet survenait chez l'homme, les signes de surdosages à certaines substances ou de maladies comme l'occlusion intestinale, le syndrome de Reye ou les tumeurs du cerveau pourraient être masqués.
Syndrome de l'iris hypotonique peropératoire
Des cas de syndrome d'iris hypotonique peropératoire (IFIS) ont été observés lors d'opérations de la cataracte chez des patients traités par des médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques, y compris Invega.
L'IFIS peut augmenter le risque de complications oculaires pendant et après l'intervention. Avant l'intervention, le chirurgien ophtalmologue doit être informé de la prise actuelle ou antérieure de médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques. Le bénéfice potentiel de l'interruption du traitement par les antagonistes α1 avant l'opération de la cataracte n'a pas été étudié et doit être évalué par rapport au risque d'une interruption du traitement antipsychotique.
Teneur en lactose (ne concerne que le comprimé à libération prolongée à 3 mg)
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivraient pas prendre les comprimés à libération prolongée d'Invega à 3 mg.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par unité de dosage, c.-à-d. qu'il est essentiellement «sans sodium».
Autres considérations
La palipéridone est un métabolite actif de la rispéridone. Le profil de libération ainsi que les propriétés pharmacocinétiques d'Invega se distinguent de celle de la formulation orale de la rispéridone à libération immédiate (voir «Pharmacocinétique»).
InteractionsIl convient d'être prudent lors de la prescription simultanée d'Invega avec d'autres médicaments dont on sait qu'ils allongent l'intervalle QT, comme les antiarythmiques de la classe IA (quinidine, disopyramide) et III (amiodarone, sotalol), quelques antihistaminiques, quelques autres antipsychotiques et quelques substances utilisées contre le paludisme (méfloquine).
Autres interactions
Utilisation simultanée d'Invega et de rispéridone
L'administration simultanée d'Invega et de rispéridone n'a pas été étudiée. Cette combinaison n'est pas recommandée car la palipéridone est un métabolite actif de la rispéridone et l'administration combinée pourrait donc entraîner une exposition additive à la palipéridone.
Utilisation simultanée d'Invega et de psychostimulants
L'utilisation de psychostimulants (p.ex. méthylphénidate) en combinaison avec la palipéridone peut, en cas de modification de l'un des traitements ou des deux traitements, entraîner l'apparition de symptômes extrapyramidaux (voir «Mises en garde et précautions»).
Effet d'Invega sur d'autres médicaments
La palipéridone ne devrait pas provoquer d'interactions pharmacocinétiques significatives avec les médicaments métabolisés par l'isoenzyme du cytochrome P450. Les études effectuées in vitro avec le microsome hépatique humain ont montré que la palipéridone n'inhibait pas réellement le métabolisme des médicaments métabolisés par l'isoenzyme du cytochrome P450 jusqu'à des concentrations de 250 ng/ml (y compris CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 et CYP3A5). On ne s'attend donc pas à ce que la palipéridone inhibe significativement d'un point de vue clinique la clairance des médicaments métabolisés par ces voies métaboliques. Des études in vitro ont montré que la palipéridone n'est pas un inducteur enzymatique des CYP1A2, 2C19 ou 3A4.
Les études effectuées in vitro ont montré que la palipéridone est un substrat de la P-GP et un inhibiteur faible de la P-GP à des concentrations élevées. Il n'existe pas de données in vivo et la pertinence clinique de cette information n'est pas connue.
En raison des effets primaires de la palipéridone sur le système nerveux central (voir «Effets indésirables»), une utilisation combinée d'Invega avec d'autres médicaments à action centrale comme p.ex. les anxiolytiques, la plupart des antipsychotiques, les hypnotiques, les opiacés, et avec l'alcool doit se faire avec prudence. La palipéridone peut réduire les effets de la lévodopa et d'autres agonistes de la dopamine. Lorsqu'il paraît nécessaire d'avoir recours à une telle combinaison, en particulier au stade terminal de la maladie de Parkinson, la posologie efficace la plus faible des deux traitements doit être prescrite.
En raison de son potentiel pour déclencher une hypotension orthostatique (voir «Mises en garde et précautions»), des effets additifs pourraient apparaître si Invega est utilisé en même temps que d'autres médicaments ayant un potentiel similaire, comme p.ex. d'autres antipsychotiques et les antidépresseurs tricycliques.
La prudence est recommandée lorsque la palipéridone est associée à d'autres médicaments pour lesquels il est connu qu'ils abaissent le seuil de crise (à savoir la phénothiazine ou la butyrophénone, la clozapine, les tricycliques ou les ISRS, le tramadol, la méfloquine, etc.).
Aucune étude portant sur les interactions entre Invega et le lithium n'a été entreprise. Des interactions pharmacocinétiques entre Invega et le lithium sont improbables.
L'administration simultanée d'Invega (12 mg une fois par jour) à l'état d'équilibre et de comprimés à libération prolongée (de 500 mg à 2000 mg 1 fois par jour) de divalproex (valproate de sodium/acide valproïque) n'a pas eu d'influence sur la pharmacocinétique du valproate à l'état d'équilibre. L'administration simultanée d'Invega et de valproate de sodium/acide valproïque en comprimés à libération prolongée a augmenté l'exposition à la palipéridone (voir «Effet d'autres médicaments sur Invega»).
Effet d'autres médicaments sur Invega
La palipéridone ne représente pas un substrat des CYP1A2, CYP2A6, CYP2C9, CYP2C19 et CYP3A5. Pour cette raison, les interactions avec les inhibiteurs ou les inducteurs de ces isoenzymes devraient être improbables. Des études in vitro suggèrent que le CYP2D6 et le CYP3A4 pourraient être impliqués dans une faible mesure dans le métabolisme de la palipéridone. En revanche, les études in vitro et in vivo ne livrent aucun indice suggérant que ces isoenzymes jouent un rôle significatif dans le métabolisme de la palipéridone.
Les études in vitro ont montré que la palipéridone est un substrat de la glycoprotéine P (P-gp). La palipéridone est métabolisée dans une mesure limitée par le CYP2D6 (voir «Pharmacocinétique» - «Métabolisme»). Dans une étude d'interactions, au cours de laquelle des sujets en bonne santé ont reçu simultanément Invega et de la paroxétine, un puissant inhibiteur du CYP2D6, on n'a pas constaté d'effets cliniquement significatifs sur la pharmacocinétique de la palipéridone. L'administration concomitante d'Invega une fois par jour avec de la carbamazépine 200 mg deux fois par jour a entraîné une diminution d'environ 37% de la Cmax moyenne et de l'AUC de la palipéridone à l'état stationnaire. Cette diminution est en grande partie la conséquence d'une augmentation de 35% de la clairance rénale de la palipéridone, probablement à la suite d'un effet combiné de l'induction de la P-gp rénale par la carbamazépine et d'un métabolisme légèrement augmenté en raison d'une induction du CYP3A4. La légère diminution de la quantité de principe actif inchangé éliminé dans l'urine était faible, ce qui suggère que l'administration concomitante de carbamazépine n'a que très peu d'effets sur le métabolisme par le CYP ou sur la biodisponibilité de la palipéridone. Des diminutions plus importantes des concentrations plasmatiques de palipéridone pourraient survenir avec des doses de carbamazépine plus élevées. Au début d'un traitement par la carbamazépine, il convient de contrôler soigneusement et d'augmenter, le cas échéant, la posologie d'Invega. À l'inverse, il convient également de contrôler et de diminuer, le cas échéant, la posologie d'Invega en cas d'arrêt de la carbamazépine. D'autres médicaments qui agissent en tant qu'inducteurs comme la rifampicine et certains phytomédicaments comme le millepertuis (Hypericum perforatum) pourraient avoir des effets comparables sur la palipéridone.
La palipéridone, qui au pH physiologique est présente sous la forme d'un cation, est éliminée principalement sous forme non modifiée par voie rénale, environ la moitié par filtration et l'autre moitié par sécrétion active. L'utilisation simultanée de triméthoprime, une substance connue pour inhiber le transport actif rénal des cations des médicaments, n'a pas eu d'effet sur la pharmacocinétique de la palipéridone.
Les médicaments ayant une action sur le temps de passage dans le tractus gastro-intestinal, comme par exemple le métoclopramide, peuvent influencer la résorption de la palipéridone.
L'administration simultanée d'une dose unique de 12 mg d'Invega et de comprimés à libération prolongée (deux comprimés de 500 mg une fois par jour) de divalproex (valproate de sodium/acide valproïque) a augmenté d'env. 50% la Cmax et l'AUC de la palipéridone. Une réduction de la posologie d'Invega doit être envisagée en fonction de la clinique en cas d'administration simultanée d'Invega et de valproate.
Grossesse, allaitementGrossesse
On ne dispose d'aucune donnée clinique sur l'utilisation de la palipéridone chez des femmes enceintes.
Une étude d'observation de cohorte rétrospective, basée sur une banque de données américaine comportant des prestations de soins remboursées, a comparé le risque de malformations congénitales chez les enfants nés vivants chez des femmes ayant utilisé des antipsychotiques ou non au cours du premier trimestre de la grossesse. Lors de cette étude, aucune évaluation concrète de la palipéridone, le métabolite actif de la rispéridone, n'a été effectuée. Après ajustement prenant en compte les variantes confondantes dans la banque de données, le risque de malformations congénitales en cas d'utilisation de rispéridone était augmenté par rapport au collectif ne recevant pas d'antipsychotique (risque relatif = 1,26, IC 95%: 1,02-1,56). Aucun mécanisme biologique susceptible d'expliquer cette constatation n'a pu être identifié et, lors des études précliniques, aucun effet tératogène n'a été observé (voir «Données précliniques»). En se fondant sur les résultats de cette unique étude d'observation, aucune relation causale entre l'exposition in utero à la rispéridone et les malformations congénitales n'a été mise en évidence. Des études sur des modèles animaux ont mis en évidence des effets toxiques pour la reproduction (voir «Données précliniques»).
La palipéridone ne doit pas être administrée pendant la grossesse, sauf en cas de nécessité absolue. Si un arrêt du traitement s'avère nécessaire pendant la grossesse, celui-ci devra, dans la mesure du possible, ne pas être brutal.
Effets postnataux
Les nouveau-nés dont les mères ont pris des antipsychotiques (dont la palipéridone) pendant le troisième trimestre de la grossesse présentent un risque de symptômes extrapyramidaux moteurs et/ou de symptômes de sevrage après la naissance. Ces symptômes chez le nouveau-né peuvent comprendre une agitation, une augmentation ou une diminution inhabituelle du tonus musculaire, des tremblements, une somnolence, des difficultés respiratoires ou des problèmes d'alimentation. Ces complications peuvent avoir un degré de sévérité variable. Dans certains cas, ils ont été autolimitants; dans d'autres cas, les nouveau-nés ont nécessité une surveillance en service de soins intensifs ou une hospitalisation prolongée.
Allaitement
Dans les études effectuées sur l'animal avec la palipéridone et les études effectuées sur l'homme avec la rispéridone, la palipéridone passe dans le lait maternel. Invega ne devrait pas être utilisé pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesInvega peut avoir un effet sur les activités nécessitant une attention intellectuelle et peut avoir des répercussions sur la vision (voir «Effets indésirables»). Il convient de demander aux patients de renoncer à la conduite de véhicules ou à l'utilisation de machines jusqu'à ce que leur propre capacité à réagir soit déterminée et jusqu'à ce que le médecin traitant ait fait les estimations nécessaires avec le patient et qu'ils aient discuté ensemble.
Effets indésirablesLes effets indésirables sont rapportés dans cette section. Les effets indésirables sont des événements non souhaités pour lesquels on peut admettre, en se fondant sur l'évaluation exhaustive des données disponibles, qu'ils sont en relation avec l'utilisation de la palipéridone. Dans certains cas isolés, aucune relation causale fiable avec l'utilisation de palipéridone ne peut être établie. Étant donné que les conditions dans lesquelles sont effectuées les études cliniques varient considérablement, les fréquences auxquelles des effets indésirables ont été constatées au cours des études cliniques sur un médicament donné ne peuvent pas être directement comparées aux fréquences observées lors des essais cliniques d'un autre médicament, et ne reflètent pas obligatoirement les fréquences observées en pratique clinique.
Les effets indésirables les plus fréquemment rapportés dans le cadre d'études cliniques ont été: céphalées, somnolence, insomnie, parkinsonisme, akathisie, tachycardie, dystonie, vertiges, tremblements, nausées, agitation, infections des voies respiratoires supérieures, constipation, angoisse, dyspepsie, vomissements, maux de ventre, sécheresse buccale, prise de poids, fatigue, douleurs musculosquelettiques et diarrhées.
Les effets indésirables dose-dépendants survenus dans les études sur la schizophrénie ont compris: céphalées, somnolence, parkinsonisme, akathisie, tachycardie, dystonie, vertiges, tremblements, infections des voies respiratoires supérieures, dyspepsie et douleurs musculosquelettiques.
La palipéridone est le métabolite actif de la rispéridone. C'est la raison pour laquelle les profils d'effets secondaires des deux substances (y compris leurs formulations orales et injectables) s'appliquent mutuellement l'un à l'autre. Les effets secondaires rapportés pour la rispéridone peuvent également survenir sous palipéridone. Les effets secondaires rapportés sous palipéridone peuvent être retrouvés dans l'information professionnelle concernant la rispéridone au chapitre «Effets indésirables».
Tous les effets indésirables mentionnés ci-après sont survenus dans le cadre d'études cliniques ou depuis la commercialisation sous palipéridone et/ou rispéridone, selon les catégories de fréquences estimées lors des études cliniques.
Les effets indésirables sont présentés selon la classification des classes de systèmes d'organes (SOC) du «Medical Dictionary for Regulatory Affairs (MedDRA®)» et par catégorie de fréquence conformément à la convention suivante:
très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1'000, <1/100), rares (≥1/10'000, <1/1'000), très rares (<1/10'000), fréquence inconnue (ne peut être estimée sur la base des données d'études cliniques disponibles).
Dans chaque groupe de fréquence, les effets indésirables sont classés par ordre décroissant de sévérité.
Infections et infestations
Fréquents: infections des voies respiratoires supérieures, sinusites.
Occasionnels: bronchites, infections des voies respiratoires, infections urinaires, infections des oreilles, amygdalites, grippe.
Rares: pneumonie, cystites, onychomycoses, cellulites, acrodermatites.
Fréquence inconnue: infections oculaires.
Affections hématologiques et du système lymphatique
Occasionnels: anémie.
Rares: neutropénie, diminution du nombre de globules blancs, thrombocytopénie, diminution de l'hématocrite.
Fréquence inconnue: agranulocytose, augmentation du nombre d'éosinophiles.
Affections du système immunitaire
Rares: réaction anaphylactique, hypersensibilité.
Affections endocriniens
Rares: hyperprolactinémiea.
Fréquence inconnue: sécrétion inadéquate d'hormone antidiurétique.
Troubles du métabolisme et de la nutrition
Fréquents: prise de poids, augmentation de l'appétit.
Occasionnels: hyperglycémie, perte de poids, anorexie, baisse de l'appétit, augmentation des triglycérides.
Rares: intoxication par l'eau, hypoglycémie, diabète sucréb, augmentation du cholestérol.
Fréquence inconnue: coma diabétique, acidocétose diabétique, hyperinsulinémie, glycosurie, polydipsie.
Affections psychiatriques
Fréquents: manie, agitation, dépression, angoisse, insomniec.
Occasionnels: troubles du sommeil, anorgasmie, cauchemars.
Rares: baisse de la libido.
Fréquence inconnue: catatonie, trouble alimentaire lié au sommeil (ingestion d'aliments incontrôlée lors de somnambulisme), somnambulisme, état de confusion, émoussement de l'affect.
Affections du système nerveux
Très fréquents: somnolence, céphalées.
Fréquents: parkinsonismec, akathisiec, dystoniec, vertiges, dysarthrie, dyskinésiec, tremblements.
Occasionnels: convulsionsc, syncopes, hyperactivité psychomotrice, vertiges positionnels, dysgueusie, hypoesthésie.
Rares: dyskinésie tardive, ischémie cérébrovasculaire, perte de connaissance, troubles de l'attention, paresthésie.
Fréquence inconnue: syndrome malin des neuroleptiques (SMN), non réponse aux stimuli, altération du niveau de conscience, troubles de l'équilibre, troubles de la coordination, titubation céphalique.
Affections oculaires
Fréquents: vue floue.
Occasionnels: conjonctivite, sécheresse oculaire, augmentation de la sécrétion lacrymale.
Rares: photophobie.
Fréquence inconnue: glaucome, troubles de la motricité oculaire, révulsion oculaire, hyperémie oculaire, syndrome de l'iris hypotonique peropératoire.
Affections de l'oreille et du labyrinthe
Occasionnels: douleurs auriculaires.
Rares: vertiges, acouphènes.
Affections cardiaques
Fréquents: troubles de la conduction, allongement de l'intervalle QT, tachycardie.
Occasionnels: bloc auriculo-ventriculaire, bradycardie, arythmie sinusale, anomalies à l'électrocardiogramme, palpitations.
Rares: fibrillation auriculaire.
Fréquence inconnue: syndrome de la tachycardie orthostatique posturale.
Affections vasculaires
Fréquents: hypotension orthostatique, hypertension.
Occasionnels: hypotension.
Rares: ischémie, embolie pulmonaire, thrombose veineuse profonde, flush.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux, nez bouché.
Occasionnels: dyspnée, respiration haletante, douleurs pharyngo-laryngées, épistaxis.
Rares: syndrome d'apnées du sommeil, hyperventilation.
Fréquence inconnue: pneumonie d'aspiration, congestion pulmonaire, obstruction des voies respiratoires, râles pulmonaires, dysphonie.
Affections gastro-intestinales
Fréquents: douleurs abdominales, vomissements, nausées, constipation, diarrhées, dyspepsie, sécheresse buccale, douleurs dentaires.
Occasionnels: gastroentérite, dysphagie, flatulence.
Rares: obstruction intestinale, gonflement de la langue, incontinence fécale, chéilite, iléus.
Fréquence inconnue: pancréatite, fécalome.
Affections hépatobiliaires
Occasionnels: augmentation des transaminases, augmentation de la gamma-glutamyl-transférase, augmentation des enzymes hépatiques.
Fréquence inconnue: ictère.
Affections de la peau et du tissu sous-cutané
Fréquents: prurit.
Occasionnels: éruption cutanée, sécheresse de la peau, acné, dermatite séborrhéique.
Rares: angio-œdème, alopécie, eczéma, érythème, coloration de la peau.
Fréquence inconnue: exanthème médicamenteux, urticaire, hyperkératose, syndrome de Stevens-Johnson/nécrolyse épidermique toxique.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: douleurs musculosquelettiques, dorsalgies.
Occasionnels: augmentation de la créatine phosphokinase, spasmes musculaires, gonflement des articulations, faiblesse musculaire, douleurs dans la nuque, arthralgies.
Rares: raideur articulaire.
Fréquence inconnue: rhabdomyolyse, posture anormale.
Affections du rein et des voies urinaires
Occasionnels: rétention urinaire, incontinence urinaire, dysurie, pollakiurie.
Affections gravidiques, puerpérales et périnatales
Très rares: symptômes extrapyramidaux moteurs et/ou phénomènes de sevrage chez le nouveau-né (voir «Grossesse/Allaitement» - «Effets postnataux»).
Affections des organes de reproduction et du sein
Occasionnels: dysfonction érectile, aménorrhée, galactorrhée, douleurs des seins.
Rares: troubles de l'éjaculation, troubles de la menstruationc, gynécomastie, dysfonction sexuelle, gonflement des seins, écoulement mammaire, pertes vaginales.
Fréquence inconnue: priapisme, retard des règles, augmentation des seins.
Troubles généraux
Fréquents: fièvre, asthénie, fatigue.
Occasionnels: œdème du visage, œdèmesc, augmentation de la température corporelle, soif, douleurs dans la poitrine, chutes.
Rares: frissons, trouble de la marche.
Fréquence inconnue: hypothermie, baisse de la température corporelle, syndrome de sevrage médicamenteux, sensation de malaise.
a Une hyperprolactinémie peut, dans certains cas, entraîner une gynécomastie, des troubles de la menstruation, une aménorrhée et une galactorrhée.
b Au cours d'études pivot contrôlées par placebo, un diabète sucré a été rapporté chez 0,05% des patients traités par Invega, contre une fréquence de 0% dans le groupe placebo. L'incidence globale pour l'ensemble des études cliniques était de 0,14% pour tous les patients traités par Invega.
c L'insomnie comprend: les troubles de l'endormissement initial, troubles de la continuité du sommeil.
Le parkinsonisme comprend: l'akinésie, l'hypo-/bradykinésie, les troubles de type démarche parkinsonienne, le phénomène de la roue dentée, la raideur musculaire, les tensions musculaires, la raideur musculosquelettique, l'hypersalivation, l'absence d'expression du visage, des symptômes moteurs extrapyramidaux, réflexe palpébral pathologique.
L'akathisie comprend: l'hyperkinésie, le syndrome des jambes sans repos, l'impatience.
La dystonie comprend: le blépharospasme, les spasme cervicaux, l'emprosthotonos, le spasme facial, l'hypertonie musculaire, le laryngospasme, les contractions musculaires involontaires, la myotonie, les crises oculogyres, l'opisthotonos, le spasme oro-pharyngé, le pleurothotonos, le rictus sardonique, la tétanie, la paralysie de la langue, le torticolis, le trismus.
La dyskinésie comprend: l'athétose, la chorée, les mouvements choréoathétosiques, des troubles des mouvements, des secousses musculaires, des myoclonies.
Les convulsions comprennent: les crises de Grand mal.
Les œdèmes comprennent: l'œdème généralisé, les œdèmes périphériques, l'œdème qui prend le godet.
Les troubles de la menstruation comprennent: les règles irrégulières, l'oligoménorhée.
Sujets âgés
Dans une étude effectuée sur des sujets âgés atteints de schizophrénie, le profil de sécurité s'est avéré semblable aux autres groupes d'âges. Toutefois, sur la base des données limitées concernant les sujets âgés ainsi que sur la base de la pratique clinique générale, il n'est pas exclu que les personnes âgées soient plus sensibles aux effets indésirables.
L'utilisation d'Invega chez les patients âgés présentant une démence sénile n'a pas été étudiée. L'utilisation d'Invega chez les patients âgés séniles n'est pas recommandée. Dans les essais cliniques avec d'autres antipsychotiques atypiques, un risque plus élevé de mortalité et d'événements cérébrovasculaires a été signalé (voir rubrique «Mises en garde et précautions»).
Événements indésirables présentant un intérêt particulier pour cette classe de principes actifs
Symptômes moteurs extrapyramidaux (SEP): Les études cliniques n'ont pas montré de différence entre le placebo et des doses de 3 mg et 6 mg d'Invega. Dans le cas des deux doses les plus élevées d'Invega (9 mg et 12 mg), une dépendance par rapport à la dose a été enregistrée pour les symptômes extrapyramidaux. Les troubles extrapyramidaux comprenaient l'analyse de groupe des notions ci-dessous: dyskinésie, dystonie, hyperkinésie, parkinsonisme et tremblements.
Prise de poids: Dans les études cliniques, les proportions de patients correspondant au critère de prise de poids ≥7% du poids, ont été comparées entre elles. Avec des doses de 3 mg et 6 mg d'Invega, l'incidence est la même que pour le placebo, avec l'administration des doses les plus élevées, 9 mg et 12 mg, d'Invega, une incidence plus forte de prise de poids a été enregistrée.
Analyses de laboratoire: prolactine sérique
Dans les études cliniques, on a observé sur 67% des sujets étudiés sous Invega une augmentation moyenne de la prolactine sérique. Des événements indésirables potentiellement associés à la prolactine (par exemple, aménorrhée, galactorrhée, gynécomastie) ont été rapportés chez 2% des participants à l'étude. Les hausses moyennes du taux de prolactine sérique ont généralement été observées le 15ème jour de traitement; toutefois, la concentration sérique en prolactine était toujours plus élevée à la fin de l'étude par rapport aux valeurs initiales.
Effets de cette classe de médicaments
Allongement du segment QT, arythmie ventriculaire (fibrillation ventriculaire, tachycardie ventriculaire), mort subite et inattendue, arrêt cardiaque et torsades de pointes peuvent survenir sous traitement aux antipsychotiques. Des cas de thromboembolie veineuse, y compris des cas d'embolies pulmonaires et de thromboses veineuses profondes, ont été rapportés sous traitement par des antipsychotiques (voir «Mises en garde et précautions» et «Effets indésirables»).
La palipéridone est le métabolite actif de la rispéridone. Le profil de sécurité de la rispéridone peut s'appliquer.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
En général, les symptômes de surdosage à surveiller sont le renforcement des effets pharmacologiques connus de la palipéridone (c'est-à-dire obnubilation et sédation, tachycardie et hypotension, allongement de l'intervalle QT ainsi que symptômes extrapyramidaux). Des torsades de pointes et une fibrillation ventriculaire ont été rapportées après un surdosage de la palipéridone prise par voie orale. En cas de surdosage aigu, la possibilité d'une intoxication avec plusieurs médicaments doit être envisagée.
Traitement
Lors de l'évaluation de la nécessité du traitement et de la récupération, il convient de tenir compte du fait qu'il s'agit d'une formule à libération prolongée. Il n'existe aucun antidote spécifique de la palipéridone. Les mesures de soutien conventionnelles doivent être appliquées. Il convient de dégager les voies respiratoires et de veiller à ce qu'elles restent ouvertes, ainsi que de toujours s'assurer que l'oxygénation et la respiration sont suffisantes. Il convient de mettre en place immédiatement un monitoring cardiovasculaire suivi directement d'une surveillance électrocardiographique continue pour identifier une éventuelle arythmie. L'hypotension et une défaillance cardiovasculaire doivent être traitées par des mesures adaptées comme l'administration intraveineuse de liquides et/ou de sympathomimétiques. Il est possible d'envisager l'administration de charbon actif avec un laxatif. En cas de symptômes extrapyramidaux moteurs sévères, il convient d'utiliser des anticholinergiques. La surveillance rapprochée doit se poursuivre jusqu'à la guérison du patient.
Propriétés/EffetsCode ATC
N05AX13
Groupe pharmacothérapeutique: antipsychotiques, antipsychotiques divers.
Invega contient un mélange racémique de palipéridone (+) et (–).
Mécanisme d'action
La palipéridone, le principe actif contenu dans Invega, est une substance psychotrope appartenant à la classe chimique des dérivés du benzisoxazole (neuroleptique antipsychotique atypique). Invega contient un mélange racémique de palipéridone (+) et (–).
La palipéridone est un antagoniste de la dopamine D2 ayant une action centrale avec une activité antagoniste importante sur les récepteurs sérotoninergiques 5HT2A. La palipéridone possède en outre des effets antagonistes sur les récepteurs adrénergiques α1 et α2 ainsi que sur les récepteurs histaminergiques H1. La substance ne possède aucune affinité avec les récepteurs cholinergiques muscariniques ou adrénergiques β1 et β2. L'activité pharmacologique des énantiomères (+) et (–) de la palipéridone est comparable d'un point de vue qualitatif et quantitatif.
Le mécanisme d'action de la palipéridone est inconnu, comme pour d'autres médicaments actifs dans le traitement de la schizophrénie. On suppose que l'efficacité thérapeutique du médicament chez les schizophrènes peut être obtenue par une association de la dopamine Type 2 (D2) et de l'antagonisme des récepteurs (5HT2A) de la sérotonine de type 2. Des effets antagonistes sur d'autres récepteurs que D2 et 5HT2A pourraient être responsables de la plupart des autres effets de la palipéridone.
Pharmacodynamique
Voir «Mécanisme d'action»
Efficacité clinique
Schizophrénie
L'efficacité d'Invega a été démontrée dans trois études multicentriques, avec contrôle placebo, en double aveugle, sur 6 semaines sur des sujets de contrôle répondant aux critères DSM-IV de la schizophrénie. Le dosage d'Invega, qui était variable selon les études, allait de 3 à 15 mg une fois par jour. Le premier point d'évaluation de l'efficacité était la baisse des valeurs Positive and Negative Syndrome Scale (échelle PANSS), comme le montre le tableau ci-dessous. Le 4ème jour, pour toutes les doses d'Invega étudiées, une différence avec le placebo était visible (p <0,05). Le deuxième point d'évaluation était indiqué par l'échelle Personal an Social Performance (PSP) ainsi que l'échelle Clinical Global Impression Severity (CGI-S). Dans les trois études, Invega était supérieur au placebo pour les résultats obtenus sur les échelles PSP et CGI-S.
Evaluation globale selon l'échelle PANSS (Positive and Negative Syndrome Scale for Schizophrenia) – modification entre la valeur terminale et la valeur initiale – LOCF pour les études R076477-SCH-303, R076477-SCH-304 et R076477-SCH-305: Population pour l'analyse selon l'intention de traitement.
|
|
Placebo
|
3 mg
|
6 mg
|
9 mg
|
12 mg
| |
R076477-SCH-303
|
(N= 126)
|
|
(N= 123)
|
(N= 122)
|
(N= 129)
| |
Valeur initiale moyenne
(écart type)
|
94,1 (10,74)
|
|
94,3 (10,48)
|
93,2 (11,90)
|
94,6 (10,98)
| |
Modification moyenne
|
-4,1 (23,16)
|
|
-17,9 (22,23)
|
-17,2 (20,23)
|
-23,3 (20,12)
| |
Valeur p (contre placebo)
|
|
|
<0,001
|
<0,001
|
<0,001
| |
Diff. de la valeur moyenne
du plus petit carré
(erreur type)
|
|
|
-13,7 (2,63)
|
-13,5 (2,63)
|
-18,9 (2,60)
| |
R076477-SCH-304
|
(N= 105)
|
|
(N= 111)
|
|
(N= 111)
| |
Valeur initiale moyenne
(écart type)
|
93,6 (11,71)
|
|
92,3 (11,96)
|
|
94,1 (11,42)
| |
Modification moyenne
|
-8,0 (21,48)
|
|
-15,7 (18,89)
|
|
-17,5 (19,83)
| |
Valeur p (contre placebo)
|
|
|
<0,006
|
|
<0,001
| |
Diff. de la valeur
moyenne du plus petit carré
(erreur type)
|
|
|
-7,0 (2,36)
|
|
-8,5 (2,35)
| |
R076477-SCH-305
|
(N= 120)
|
(N= 123)
|
|
(N= 123)
|
| |
Valeur initiale moyenne
(écart type)
|
93,9 (12,66)
|
91,6 (12,19)
|
|
93,9 (13,20)
|
| |
Modification moyenne
|
-2,8 (20,89)
|
-15,0 (19,61)
|
|
-16,3 (21,81)
|
| |
Valeur p (contre placebo)
|
|
<0,001
|
|
<0,001
|
| |
Diff. de la valeur moyenne
du plus petit carré (erreur type)
|
|
-11,6 (2,35)
|
|
-12,9 (2,34)
|
|
Remarque: Une modification négative des valeurs du score signifie une amélioration. Dans les 3 études, un contrôle actif a été utilisé (olanzapine à une dose de 10 mg). LOCF = last observation carried forward (dernière observation rapportée). La version 1–7 de l'échelle PANSS a été utilisée. Dans l'étude R076477-SCH-305 une dose de 15 mg a également été utilisée, toutefois, les résultats correspondant à ce dosage n'ont pas été présentés ici, car il dépasse la dose quotidienne maximale recommandée de 12 mg.
Dans une étude à long terme pour l'évaluation de la persistance de l'efficacité, Invega était nettement plus efficace que le placebo en ce qui concerne le contrôle des symptômes et le retard des rechutes schizophréniques. Après un traitement de 6 semaines d'un épisode aigu suivi de 8 semaines de stabilisation sous Invega (posologie entre 3 et 15 mg une fois par jour), les patients ont été randomisés par une procédure en double aveugle et ont été traités soit par Invega, soit par placebo, jusqu'à la survenue d'une rechute des symptômes de la schizophrénie. L'étude a été interrompue avant son terme car en ce qui concerne l'efficacité, chez les patients traités par Invega, l'intervalle séparant de la rechute était nettement plus long que celui observé dans le groupe placebo (p= 0,0053).
PharmacocinétiqueAprès utilisation d'Invega, la pharmacocinétique de la palipéridone administré aux doses cliniques recommandées (entre 3 et 12 mg) a un comportement proportionnel à la dose.
Absorption
Après administration d'une dose unique d'Invega, les concentrations plasmatiques de la palipéridone augmentent régulièrement jusqu'à ce que les concentrations plasmatiques maximales (Cmax) soient atteintes, environ 24 heures après la prise. Avec une administration quotidienne d'Invega une fois par jour, les concentrations stabilisées ont été atteintes chez la plupart des patients au bout de 4–5 jours de traitement.
Contrairement à la rispéridone à libération immédiate, Invega est associé à des fluctuations minimales entre la plus haute et la plus faible concentration, en raison des propriétés spécifiques de son mode de libération. Dans une étude comparant la pharmacocinétique stabilisée après administration une fois par jour de 12 mg de palipéridone (en comprimé à libération prolongée) ou de 4 mg de rispéridone (libération immédiate) chez les sujets schizophrènes étudiés, l'index de fluctuation dans le cas de la palipéridone à libération modifiée se situait autour de 38%, comparé à 125% dans le cas de la rispéridone à libération immédiate (voir figure 1).
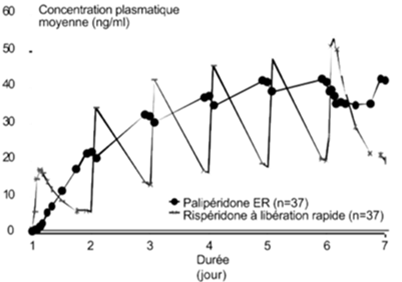
Figure 1: Profil des concentrations stabilisées après administration de 12 mg de palipéridone sous la forme de 6 comprimés à libération prolongée à 2 mg une fois par jour pendant 6 jours (les concentrations de palipéridone sont représentées) comparé à l'administration de la rispéridone à libération immédiate, administrée à une dose de 2 mg une fois par jour le premier jour et 4 mg une fois par jour du 2ème au 6ème jour (les concentrations de palipéridone et de rispéridone sont représentées).
Après utilisation d'Invega, on observe une interconversion des énantiomères (+) et (–) de la palipéridone, alors qu'à la concentration stabilisée, un rapport AUC (+)/(–) d'environ 1,6 a été atteint. Après administration d'Invega, la biodisponibilité orale absolue de la palipéridone se situe autour de 28%.
En cas d'administration des comprimés à libération prolongée de palipéridone en même temps qu'un repas riche standard à fort contenu en graisse et en calories, les valeurs Cmax et AUC de la palipéridone sont de 50 à 60% supérieures comparées aux valeurs obtenues à jeun.
Dans les études cliniques étudiant la sécurité et l'efficacité d'Invega, on n'a pas tenu compte de l'influence de la nourriture (voir «Posologie/Mode d'emploi»).
Distribution
La palipéridone est distribué rapidement. Le volume de distribution apparent est de 487 l. La liaison de la palipéridone aux protéines plasmatiques s'élève à 74%. Le principe actif se lie principalement à l'alpha 1 glycoprotéine et à l'albumine.
Métabolisme
Une semaine après administration orale d'une dose unique de 1 mg de palipéridone à libération immédiate marqué au 14C, 59% de la dose avait éliminée non modifiée dans les urines. Cela indique que la palipéridone n'est pas métabolisé de façon extensive dans le foie. Environ 80% de la radioactivité administrée a été retrouvée dans les urines, 11% dans les selles. In vivo, les voies métaboliques ont été identifiées, aucune n'est responsable de plus de 6,5% de la dose: Désalcalinisation, hydroxylation, déshydrogénisation et division du benzisoxazol. Bien que les études in vitro semblent indiquer une implication des CYP2D6 et CYP3A4 dans le métabolisme de la palipéridone, rien n'indique in vivo que ces isoenzymes jouent un rôle important dans le métabolisme de la palipéridone. Bien qu'il existe de grandes différences dans la population générale en ce qui concerne la capacité à métaboliser des substrats CYP2D6, les analyses de la pharmacocinétique de population ne montrent aucune différence nette entre la métabolisation rapide (extensive metabolisers) et la métabolisation lente (poor metabolisers) du CYP2D6 en ce qui concerne la clairance apparente de la palipéridone après utilisation d'Invega. Les études in vitro, avec des systèmes de préparations microsomiales hétérologues, ont montré que les CYP1A2, CYP2A6, CYP2C9, CYP2C19 et CYP3A5 ne sont pas impliquées dans le métabolisme de la palipéridone. La demi-vie d'élimination terminale de la palipéridone se situe autour de 23 heures.
Élimination
Voir «Métabolisme».
Cinétique pour certains groupes de patients
Origine ethnique
Les analyses pharmacocinétiques de population n'ont montré aucune différence due à l'origine ethnique concernant la pharmacocinétique de la palipéridone après l'utilisation d'Invega. Chez les personnes à la peau foncée, la clearance apparente de la palipéridone après l'administration d'Invega a été approximativement de 38% inférieure à celle observée chez les personnes d'une autre origine ethnique. Cette différence n'a vraisemblablement pas de pertinence clinique. Les recommandations posologiques pour Invega s'appliquent quelle que soit l'origine ethnique du patient car les adaptations de la posologie après le début du traitement doivent reposer sur l'examen clinique.
Aucune différence pharmacocinétique n'a été observée dans une étude menée chez des Japonais et des Caucasiens.
Sexe
Lors de l'utilisation d'Invega, la clairance apparente de la palipéridone est inférieure d'environ 19% chez les femmes par rapport à celle chez les hommes. Cet écart s'explique largement par les différences spécifiques liées au sexe des sujets entre les masses corporelles non graisseuses et la clairance de la créatinine.
Tabagisme
Les études in vitro avec les enzymes hépatiques humaines permettent de conclure que la palipéridone n'est pas un substrat du CYP1A2; le tabagisme ne devrait donc avoir aucune influence sur la pharmacocinétique de la palipéridone. Une évaluation de pharmacocinétique de population a montré une exposition à la palipéridone légèrement inférieure chez les fumeurs par rapport aux non-fumeurs. Cette différence n'a toutefois vraisemblablement pas de pertinence clinique.
Troubles de la fonction hépatique
La palipéridone n'est pas métabolisée de façon extensive dans le foie. Dans une étude sur des sujets présentant une insuffisance hépatique moyenne (classe Child-Pugh B), les concentrations plasmatiques de la palipéridone libre étaient similaires à celles obtenues sur les volontaires sains. Il n'existe aucune connaissance concernant les patients présentant une insuffisance hépatique sévère (classe Child-Pugh C).
Troubles de la fonction rénale
L'élimination de la palipéridone diminue lorsque les fonctions rénales diminuent. La clairance totale de la palipéridone, chez les sujets insuffisants rénaux participant à l'étude, était inférieure de 32% en cas d'insuffisance rénale légère (CrCl = 50 à <80 ml/min), de 64% en cas d'insuffisance rénale modérée (CrCl = 30 à <50 ml/min) et de 71% en cas d'insuffisance rénale sévère (CrCl = 10 à <30 ml/min). La demi-vie d'élimination terminale moyenne de la palipéridone s'élevait à 24, 40 et 51 heures respectivement pour les sujets participant à l'étude et présentant une insuffisance rénale légère, modérée et sévère, comparé à 23 heures pour les sujets présentant des fonctions rénales normales (CrCl ≥80 ml/min).
Patients âgés
Il n'est pas recommandé de procéder à une adaptation de la dose en raison de l'âge du patient. Les données issues d'une étude de pharmacocinétique effectuée sur des patients âgés (≥65 ans, n= 26) ont montré que la clairance stabilisée apparente de la palipéridone après d'Invega était diminuée de 20% par rapport à une utilisation sur des sujets adultes (18–45 ans, n= 28). Toutefois, dans les études de pharmacocinétique de population effectuées sur les patients schizophrènes après adaptation en fonction de la baisse de la CrCl liée à l'âge, aucun effet lié à l'âge n'a pu être démontré.
Données précliniquesToxicité en cas d'administration répétée
Les études de toxicité après administration répétée ont montré que la palipéridone, comme d'autres antagonistes des récepteurs D2 de la dopamine, provoquaient une élévation des concentrations sériques en prolactine.
Génotoxicité
Le test de mutagenèse d'Ames, l'essai sur lymphome de souris et le test du micronoyau de rat n'ont mis en évidence aucun potentiel mutagène pour la palipéridone.
Carcinogénicité
L'évaluation du potentiel cancérogène de la palipéridone, métabolite actif de la rispéridone, s'est effectuée sur la base d'études sur les souris et sur le rat avec de la rispéridone. Les souris ont été traitées pendant 18 mois à la rispéridone, les rats pendant 25 mois, à des doses pouvant atteindre 10 mg/kg/jour. Une augmentation significative du nombre d'adénomes hypophysaires, d'adénomes du pancréas endocrinien et d'adénocarcinomes des glandes mammaires a été observée. Chez les rongeurs, il a été noté une augmentation des tumeurs mammaires, de l'hypophyse et du pancréas endocrinien après administration chronique d'autres antipsychotiques, ce qui permet de supposer que cette augmentation est due à l'antagonisme prolongé de la dopamine D2. La pertinence de ces observations sur les rongeurs pour le risque chez l'homme est inconnue.
Toxicité pour la reproduction
Des effets toxiques sur les mères ont été observés chez le rat et chez les lapines. La dose sans effet nocif observé pour la mère était de 0,63 mg/kg chez le rat et de 0,31 mg/kg chez le lapin. Comparé aux valeurs AUC chez l'homme (896 ng × h/ml) à une dose maximale de 12 mg/jour, l'exposition chez le rat était, avec 804 ng × h/ml, inférieure à l'exposition clinique, idem pour le lapin, avec 8827 ng × h/ml et un facteur 10 fois supérieur. La dose embryo-fœtale sans effet nocif observé était, avec 10 mg/kg chez le rat, et avec 1,25 mg/kg chez le lapin, supérieure à la dose toxique pour la mère. Il n'existe pas de données concernant l'exposition des fœtus, l'exposition des mères (valeurs AUC) était supérieure par un facteur de 19–22 à l'exposition clinique.
Bien que le traitement par palipéridone ait provoqué des effets sur la prolactine et le système nerveux central, aucun effet sur la fertilité masculine et féminine n'a été observé chez le rat. Avec une dose toxique pour la mère, le nombre d'embryons vivants chez le rat femelle était quelque peu réduit.
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver à plus de 30 °C.
Conserver dans l'emballage d'origine afin de protéger le contenu de l'humidité.
Conserver hors de portée des enfants.
Numéro d’autorisation57961 (Swissmedic).
PrésentationEmballages blister:
Invega comprimés à libération prolongée 3 mg: 28 [B]
Invega comprimés à libération prolongée 6 mg: 28 [B]
Invega comprimés à libération prolongée 9 mg: 28 [B]
Titulaire de l’autorisationJanssen-Cilag AG, Zoug, ZG.
Mise à jour de l’informationNovembre 2022
|

