CompositionPrincipes actifs
Gestodenum, Ethinylestradiolum.
Excipients
Noyau du comprimé:
Sodium calcium edetate contient sodium 0.008 mg, stéarate de magnésium, silice colloїdale anhydre, povidone, amidon de maïs, lactose monohydrate 37.16 mg
Enrobage:
Jaune de quinoléine (E104), povidone, dioxyde de titane (E171), macrogol 6000, talc, carbonate de calcium, saccharose 19.66 mg
Indications/Possibilités d’emploiContraception hormonale.
La décision de prescrire Estinette 30 doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à Estinette 30 en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques «Contre-indications» et «Mises en garde et précautions»).
Posologie/Mode d’emploiLes CHC tels que Estinette 30 ne devraient être prescrits que par des médecins ayant l'expérience de ces traitements et qui sont en mesure, d'une part, de fournir aux patientes toutes les explications requises sur les avantages et inconvénients de toutes les méthodes contraceptives disponibles et, d'autre part, de procéder à un examen général et gynécologique.
La prescription d'un CHC doit en principe se faire conformément aux dernières recommandations de la Société Suisse de Gynécologie et d'Obstétrique (SSGO).
Les dragées doivent être prises dans l'ordre indiqué sur la plaquette, si possible à la même heure de la journée et de préférence avec du liquide. Une dragée par jour est prise pendant 21 jours successifs.
Ces 21 jours sont suivis par 7 jours de pause (sans prise de dragées) avant de commencer la plaquette suivante. Une hémorragie de privation survient habituellement pendant la pause; elle commence en général 2–3 jours après la prise de la dernière dragée et peut encore se prolonger alors que la nouvelle plaquette est déjà commencée.
Début de la prise
Femmes n'ayant pas pris de contraceptifs hormonaux le mois précédent
Il faut commencer la prise des dragées le 1er jour du cycle (= 1er jour des règles). Il est aussi possible de commencer entre le 2e et le 5e jour des règles, mais il est alors recommandé d'utiliser d'autres méthodes contraceptives non hormonales (à l'exception de la méthode d'abstinence périodique selon Ogino-Knaus et de la méthode des températures) pendant les 7 premiers jours de la prise de dragées lors du 1er cycle.
Passage d'un autre contraceptif hormonal combiné (CHC, y compris anneau vaginal ou patch transdermique) à Estinette 30
La prise d'Estinette 30 se fait de préférence le lendemain de la prise de la dernière dragée active du CHC précédent, mais au plus tard le jour suivant l'intervalle habituel sans prise ou suivant la phase placebo.
Dans le cas d'un patch transdermique ou d'un anneau vaginal, il est recommandé de commencer la prise d’Estinette 30 le jour du retrait du dernier anneau resp. du dernier patch, et dans tous les cas au plus tard le jour où le prochain patch ou anneau vaginal aurait dû être utilisé.
Passage d'une préparation à gestagène seul (minipilule, injection dépôt, implant, dispositif intra-utérin délivrant du gestagène (DIU)) à Estinette 30
Le remplacement de la minipilule peut se faire un jour quelconque, sans interruption. Celui d'un implant ou un DIU à gestagène peut se faire au plus tôt le jour du retrait, et celui d'une préparation injectable au moment où la prochaine injection devrait être faite. Dans tous ces cas, il faut utiliser d'autres méthodes contraceptives non hormonales (à l'exception de la méthode d'abstinence périodique selon Ogino-Knaus et de la méthode des températures) pendant les 7 premiers jours de la prise d'Estinette 30.
Après un avortement dans le 1er trimestre de la grossesse
La prise d'Estinette 30 peut être commencée immédiatement. Le recours à d'autres méthodes contraceptives est alors inutile.
Après un avortement dans le 2e trimestre de la grossesse ou après un accouchement
La décision quant à la (re)prise d'un CHC tel que Estinette 30 après un avortement au 2ème trimestre de grossesse ou un accouchement doit tenir compte du risque accru d'accidents thromboemboliques veineux pendant la période puerpérale (jusqu'à 12 semaines après l' accouchement; cf. « Mises en garde et précautions »).
Dans tous les cas, après un accouchement ou un avortement au 2ème trimestre de grossesse, la prise d’Estinette 30 doit débuter au plus tôt entre le 21ème et le 28ème jour. Si le traitement débute plus tard, il est recommandé d'appliquer des méthodes contraceptives supplémentaires non hormonales durant les 7 premiers jours de la prise. Si des rapports sexuels ont déjà eu lieu entre-temps, il convient d'exclure l'éventualité d'une grossesse ou d'attendre les premières règles avant de débuter le traitement.
Conduite à tenir en cas d'oubli de dragée(s)
Si la prise d'une ou plusieurs dragées a été oubliée, la protection contraceptive est compromise en fonction de la durée de l'interruption depuis la prise de la dernière dragée, en particulier lorsque l'intervalle sans hormone en est prolongé. Si l'utilisatrice s'aperçoit dans un délai de 12 heures qu'elle a oublié de prendre une dragée à l'heure habituelle, elle doit prendre celle-ci immédiatement. Les dragées suivantes seront à nouveau prises à l'heure habituelle. La protection contraceptive n'est alors pas compromise.
Si l'heure habituelle de la prise de la dragée est passée depuis plus de 12 heures ou si plusieurs dragées successives ont été oubliées, la protection contraceptive n'est plus assurée. La patiente doit ingérer la dernière dragée oubliée dès qu'elle s'en aperçoit et la dragée suivante à l'heure habituelle, même si cela implique qu'elle prenne 2 dragées ce jour-là. La prise ultérieure se fait à l'heure habituelle. Il est en plus recommandé d'utiliser d'autres méthodes contraceptives non hormonales pendant les 7 jours suivants (à l'exception de la méthode d'abstinence périodique selon Ogino-Knaus et de la méthode des températures).
Si ces 7 jours vont plus loin que la plaquette actuelle, la patiente doit commencer directement une nouvelle plaquette après avoir pris la dernière dragée de la 1ère plaquette. Ceci permet d'éviter une interruption trop longue de la prise hormonale et ainsi le risque d'une ovulation. Il est improbable qu'une hémorragie de privation survienne avant la fin de la 2e plaquette, cependant, des petites pertes sanglantes ou des saignements intermenstruels peuvent apparaître.
Si l'hémorragie de privation ne se produit pas après la prise de la deuxième plaquette, il faut exclure une grossesse avant de commencer une nouvelle plaquette.
Conduite à tenir en cas de troubles gastro-intestinaux
En cas de troubles gastro-intestinaux sévères, quelle que soit leur cause (c.-à-d. aussi en cas de diarrhée d'origine médicamenteuse, vomissements, etc…) l'absorption peut être incomplète et des méthodes de contraception supplémentaires doivent être utilisées.
En cas de vomissements dans les 4 heures suivant la prise d'une dragée, les règles de base indiquées à la rubrique «Conduite à tenir en cas d'oubli de dragée(s)» doivent être prises en compte. Afin de pouvoir conserver le schéma habituel de prise, la dragée supplémentaire doit être prélevée d'une plaquette de réserve.
Décalage de la menstruation
Report de la menstruation (allongement du cycle)
La prise doit être poursuivie par la plaquette suivante sans pause après la plaquette actuelle. La patiente peut ainsi retarder la menstruation aussi longtemps qu'elle le désire (au maximum jusqu'à la fin de la deuxième plaquette). Pendant cette période, des petites pertes sanglantes ou des saignements intermenstruels peuvent se produire. La prise régulière d'Estinette 30 sera ensuite poursuivie après la pause habituelle de 7 jours sans prise.
Avance de la menstruation
Le début de la menstruation peut être avancé à un autre jour de la semaine en raccourcissant à volonté la période de pause sans prise de dragées. Plus cette période est courte, plus la survenue d'une hémorragie de privation est improbable et plus sont fréquents des petites pertes sanglantes ou des saignements intermenstruels pendant la prise de la plaquette suivante (comme lors du report de la menstruation).
Conduite à tenir en cas d'irrégularités menstruelles
Des pertes sanglantes et des saignements intermenstruels peuvent se produire avec tous les CHC, en particulier pendant les 3 premiers mois de la prise.
Si ces saignements persistent, s'ils surviennent pour la première fois après des cycles auparavant réguliers ou s'ils se répètent, il faut aussi envisager des causes d'origine non hormonale. Il est alors indiqué d'avoir recours à des mesures diagnostiques appropriées afin d'exclure une grossesse, une infection, une affection maligne ou une autre affection.
Si un résultat pathologique a pu être exclu, la prise d'Estinette 30 peut reprendre. Le passage à une autre formulation peut éventuellement aussi résoudre le problème.
Certaines patientes ne présentent aucune hémorragie de privation pendant la pause sans prise de dragées. Une grossesse est improbable si le CHC a été pris conformément aux instructions posologiques. Si le CHC n'a pas été pris selon les instructions avant la première hémorragie de privation manquante, ou en cas d'absence de deux hémorragies de privation successives, la prise des dragées ne devrait pas être poursuivie et une méthode de contraception non hormonale devrait être utilisée jusqu'à ce qu'une grossesse puisse être exclue.
Une aménorrhée (allant éventuellement de pair avec une anovulation) ou une oligoménorrhée peuvent survenir chez certaines patientes après l'arrêt du CHC, en particulier si elles étaient déjà présentes avant ou pendant l'utilisation du CHC.
Instructions posologiques particulières
Patients présentant des troubles de la fonction rénale
Estinette 30 n'a pas été étudié chez les femmes atteintes d'insuffisance rénale et aucune recommandation posologique ne peut être formulée pour ces patientes.
Patients présentant des troubles de la fonction hépatique
Estinette 30 ne doit pas être utilisé chez les femmes souffrant d'insuffisance hépatique.
Enfants et adolescents
l'efficacité et la sécurité d'Estinette 30 ont été examinées chez des femmes à partir d'un âge de 18 ans. Si indiqué, la posologie recommandée chez les adolescentes est la même que chez les adultes. L'utilisation d'Estinette 30 avant la première menstruation n'est pas indiquée.
Patients âgés
Estinette 30 n'est pas indiqué après la ménopause.
Contre-indications·Présence ou risque de thrombo-embolie veineuse (TEV))
·Thromboembolie veineuse (patiente traitée par des anticoagulants) ou antécédents de TEV (p.ex. thrombose veineuse profonde ou embolie pulmonaire)
·Facteurs de risque majeurs de thrombo-embolie veineuse tels que:
·Prédisposition connue, héréditaire ou acquise, telle qu'une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S
·Présence simultanée de multiples facteurs de risque de thrombo-embolie veineuse, selon tableau sous la rubrique « Mises en garde et précautions ».
·Présence ou risque de thrombo-embolie artérielle (TEA)
·Thrombo-embolie artérielle, antécédents de TEA ou prodromes de TEA (p.ex. angine de poitrine, infarctus du myocarde, accident ischémique transitoire, accident vasculaire cérébral)
·Facteurs de risque majeurs de TEA comme
·diabète avec complications vasculaires
·hypertension artérielle sévère
·dyslipoprotéinémie sévère
·Antécédents de migraine avec signes neurologiques focaux
·Prédisposition héréditaire ou acquise à la TEA, telle qu'une hyperhomocystéinémie ou la présence d'anticorps anti- phospholipides (anticorps anti-cardiolipine, anticoagulant lupique)
·Présence simultanée de multiples facteurs de risque de TEA, selon tableau sous la rubrique «Mises en garde et précautions».
·Présence ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques;
·Utilisation concomitante de l'association de principes actifs ombitasvir/paritaprévir/ ritonavir, avec ou sans dasabuvir, glécaprévir/pibrentasvir et sofosbuvir/velpatasvir/voxilaprévir (médicaments utilisés pour le traitement de l'hépatite C) (voir sous «Mises en garde et précautions» et sous «Interactions»);
·Tumeur hépatique (bénigne ou maligne) ou antécédent de tumeur hépatique;
·Tumeur maligne hormonodépendante connue ou suspectée (par exemple appareil génital ou seins);
·Présence ou antécédents connus de pancréatite, si elle est ou était associée à une hypertriglycéridémie sévère;
·Saignements vaginaux d'origine inconnue;
·Grossesse confirmée ou suspicion de grossesse;
·Hypersensibilité à l'un des composants d’Estinette 30.
Mises en garde et précautionsLe risque de thrombo-embolie veineuse (TEV) et de thrombo-embolie artérielle (TEA) est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les mises en garde et précautions décrites ci-après doivent être prises en considération avant toute prescription (cf. « Risque de thrombo-embolie veineuse [TEV] » et « Risque de thrombo-embolie artérielle [TEA] »). Il est en outre important d'informer la patiente des risques d'accidents thrombo-emboliques veineux et artériels, des facteurs de risques vasculaires et en particulier des symptômes de TEV et de TEA ainsi que des mesures à prendre en présence de ces symptômes et de suspicion de thrombose (cf. « Les symptômes d'une TEV [thrombose veineuse profonde et embolie pulmonaire] » et « Les symptômes d'une TEA »).
Avant de prescrire Estinette 30, les bénéfices associés à son utilisation doivent être évalués par rapport aux maladies/risques détaillés ci- dessous. Le degré de gravité de chaque facteur individuel ainsi que la présence concomitante de plusieurs facteurs de risque doivent être pris en compte et discutés avec la patiente (cf. également «Contre-indications»). La patiente est en outre invitée à lire attentivement la notice d'emballage et à suivre les conseils qui y figurent.
Avant le début ou le renouvellement de la prise d'un CHC tel que Estinette 30, il est nécessaire de procéder à une anamnèse personnelle et familiale minutieuse ainsi qu'à un examen général et gynécologique approfondi en prenant en compte les contre-indications et les mises en garde/précautions afin de dépister les affections nécessitant un traitement ainsi que les états à risque, et de pouvoir exclure l'éventualité d'une grossesse. Ces examens comprennent généralement une mesure de la tension artérielle, un examen des seins, de l'abdomen et des organes pelviens (y compris un frottis cytologique du col) et examens de laboratoire appropriés.
Les examens doivent être répétés à intervalle régulier pendant la durée d'utilisation des CHC. La fréquence et le type d'examen doivent toutefois être déterminés individuellement et se référer aux directives de la Société Suisse de Gynécologie et d'Obstétrique (SSGO). Les contre-indications (p.ex. accident ischémique transitoire) et les facteurs de risque (p.ex. anamnèse familiale de thrombose veineuse ou artérielle; voir « Facteurs de risque de TEV » et « Facteurs de risque de TEA ») peuvent apparaître pour la première fois en cours d'utilisation d'un CHC et doivent dès lors être recherchés lors de chaque contrôle.
Motifs imposant l'arrêt immédiat
La patiente doit être informée qu'en cas d'apparition de l'une des contre-indications précitées ou de l'une des situations suivantes, il lui faut consulter au plus vite un médecin, qui décidera de la poursuite ou de l'arrêt de la prise du CHC:
·première apparition ou exacerbation de céphalées de type migraineux ou survenue plus fréquente de céphalées d'une intensité inhabituelle;
·troubles soudains de la vision, de l'audition, du langage ou autres troubles sensoriels;
·premiers signes d'événements thromboemboliques (cf. «Symptômes de TEV [thrombose veineuse profonde et embolie pulmonaire] et Symptômes de TEA»);
·au moins 4 semaines avant une intervention chirurgicale prévue et pendant une immobilisation, p.ex. à la suite d'un accident ou d'une opération;
·augmentation cliniquement pertinente de la tension artérielle (lors de mesures répétées);
·apparition d'un ictère, d'une hépatite, d'un prurit généralisé;
·fortes douleurs épigastriques ou hépatomégalie;
·états dépressifs sévères;
·grossesse ou suspicion de grossesse.
Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels que Estinette 30, peut être jusqu'à deux fois plus élevé.
La décision d'utiliser le médicament doit être prise uniquement après un entretien approfondi avec la patiente, afin de s'assurer qu'elle comprenne:
·Le risque de TEV associé à Estinette 30;
·Comment ses facteurs de risque personnels influent sur ce risque;
·Le risque plus élevé de développer une TEV pendant la première année d'utilisation (et en particulier pendant les 3 premiers mois);
·Le risque accru de TEV aussi bien lors de la première prise d'un CHC que lors de la reprise du même ou d'un autre CHC après une interruption d'au moins 4 semaines ou plus;
·Estinette 30 est un médicament. En cas d'accident ou d'intervention chirurgicale, la patiente doit informer le médecin traitant qu'elle prend Estinette 30.
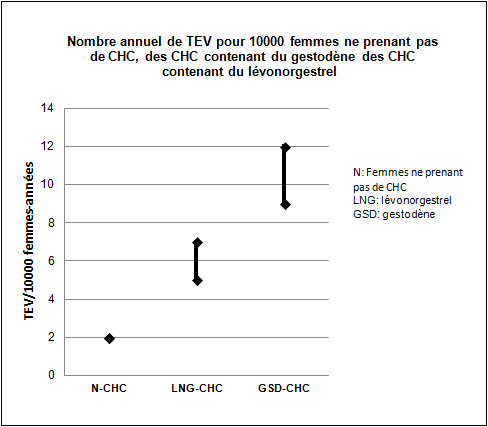
Environ 2 femmes sur 10000 n'utilisant pas de CHC et qui ne sont pas enceintes développeront une TEV au cours d'une année. Le risque peut toutefois être considérablement plus élevé, selon les facteurs de risque individuels (voir ci-dessous).
A partir des données épidémiologiques, il est possible d'estimer que 9 à 12 femmes sur 10000 utilisant un CHC contenant du gestodène développeront une TEV au cours d'une année. En comparaison, ce nombre est estimé à 5 à 7 par année pour 10000 femmes utilisant un CHC contenant du lévonorgestrel.
Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2% des cas.
Très rarement, chez des utilisatrices de CHC, des cas de thrombose veineuse ont été signalés en dehors des membres (p.ex. thromboses des veines sinusales ou thromboses des veines hépatiques, mésentériques, rénales ou rétiniennes).
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d'autres facteurs de risque sont présents, surtout s'ils sont multiples (voir le tableau ci-dessous). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thrombo-embolique en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEV doit être pris en compte.
Estinette 30 est contre-indiqué chez les femmes présentant simultanément de multiples facteurs de risque qui les exposent globalement à un risque élevé de thrombose veineuse.
Tableau: Facteurs de risque de TEV
|
Facteur de risque
|
Commentaire
| |
Obésité (indice de masse corporelle supérieur à 30 kg/m²)
|
L'augmentation de l'IMC accroît considérablement le risque.
Il est particulièrement important d'en prendre compte si d'autres facteurs de risque sont présents.
| |
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur
|
Dans ces situations, il est conseillé de suspendre l'utilisation des comprimés (au moins 4 semaines à l'avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d'éviter une grossesse non désirée.
Un traitement anti-thrombotique devra être envisagé si Estinette 30 n'a pas été interrompu à l'avance.
| |
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans)
|
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation d’Estinette 30.
Si une thrombophilie est détectée, l'utilisation de CHC comme Estinette 30 est contre-indiquée.
| |
Autres affections médicales associées à un risque accru de TEV
|
Lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique), drépanocytose, cancer.
| |
Âge
|
En particulier au-delà de 35 ans
|
Remarque: l'immobilisation temporaire, y compris les trajets aériens >4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d'autres facteurs de risque.
Il n'existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l'apparition ou la progression d'une thrombose veineuse.
Le risque accru de thrombo-embolie pendant la période puerpérale doit être pris en compte. Certaines données indiquent en effet que le risque peut être encore augmenté jusqu'à 12 semaines après l'accouchement.
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
La patiente doit être informée qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elle doit consulter un médecin en urgence et indiquer au personnel médical qu'elle utilise Estinette 30.
·Les symptômes de la thrombose veineuse profonde peuvent inclure:
·gonflement unilatéral d'une jambe et/ou d'un pied ou le long d'une veine de la jambe;
·douleur ou sensibilité dans une jambe, pouvant n'être ressentie qu'en position debout ou lors de la marche;
·sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
·Les symptômes de l'embolie pulmonaire peuvent inclure
·difficulté respiratoire subite et inexpliquée, respiration rapide ou détresse respiratoire, intolérance à l'effort;
·toux d'apparition soudaine, éventuellement accompagnée d'expectorations sanglantes;
·douleur aiguë et soudaine dans la poitrine pouvant s'amplifier à la respiration profonde;
·obnubilation sévère, vertiges ou sensation d'angoisse;
·tachycardie ou arythmie.
Certains de ces symptômes (p.ex. « essoufflement », «toux») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d'événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l'utilisation de contraceptifs hormonaux et l'augmentation du risque de thrombo- embolie artérielle (infarctus du myocarde, accident cérébrovasculaire ou accident ischémique transitoire). Avant de décider de prescrire Estinette 30, la patiente doit être informée de ce risque et, surtout, du fait que des facteurs de risque individuels préexistants sont susceptibles d'aggraver ce risque.
De très rares cas de thromboses dans d'autres vaisseaux sanguins (tels que les artères hépatiques, mésentériques, rénales ou rétiniennes) ont été observés.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d'accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir tableau). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thrombo-embolique en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEA doit être pris en compte. Estinette 30 est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle.
Tableau: Facteurs de risque de TEA
|
Facteur de risque
|
Commentaire
| |
Âge
|
En particulier au-delà de 35 ans
| |
Tabagisme
|
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC comme Estinette 30. Une méthode de contraception différente doit être fortement conseillée aux femmes de plus de 35 ans qui continuent de fumer.
| |
Hypertension artérielle
|
| |
Diabète
|
L'utilisation de CHC est contre-indiquée chez les femmes diabétiques qui présentent déjà des complications vasculaires.
| |
Dyslipoprotéinémie
|
| |
Valvulopathie cardiaque
|
| |
Fibrillation auriculaire
|
| |
Obésité (indice de masse corporelle supérieur à 30 kg/m2)
|
L'augmentation de l'IMC accroît considérablement le risque.
Il est particulièrement important d'en prendre compte si d'autres facteurs de risque sont présents.
| |
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans).
|
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation d’Estinette 30.
Si une thrombophilie est détectée, l'utilisation de CHC comme Estinette 30 est contre-indiquée.
| |
Migraine
|
L'accroissement de la fréquence ou de la sévérité des migraines lors de l'utilisation d’Estinette 30 (qui peut être le prodrome d'un événement cérébrovasculaire) peut constituer un motif d'arrêt immédiat d’Estinette 30.
| |
Autres affections médicales associées à un risque accru de TEA.
|
Hyperhomocystéinémie, lupus érythémateux disséminé, drépanocytose, cancer.
|
Symptômes de TEA
Les femmes doivent être informées qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elles doivent consulter un médecin en urgence et indiquer au personnel médical qu'elles utilisent Estinette 30.
·Les symptômes d'un accident cérébrovasculaire peuvent inclure
·perte soudaine de sensibilité ou de force au niveau du visage, d'un bras ou d'une jambe, touchant une moitié du corps;
·confusion soudaine;
·élocution incompréhensible ou difficulté de compréhension;
·troubles subits de la vision d'un ou des deux yeux;
·troubles subits de la marche;
·vertiges;
·troubles de l'équilibre ou de la coordination;
·céphalées soudaines et sévères, ou de durée inhabituelle, de cause inconnue;
·perte de connaissance ou évanouissement avec ou sans épisode convulsif.
·Les symptômes de l'infarctus du myocarde peuvent inclure
·douleurs, malaise, sensation de pression, sensation de pesanteur, sensation de serrement ou de tension dans la poitrine, le bras ou derrière le sternum;
·douleurs irradiant dans le dos, la mâchoire, le cou, le bras ou l'estomac;
·sensation de réplétion, troubles gastriques ou effort de vomissement;
·sueurs, nausées, vomissements ou vertiges;
·sensation de grande faiblesse, d'angoisse ou essoufflement;
·tachycardie ou arythmies.
·L'occlusion d'un vaisseau peut engendrer d'autres symptômes
·douleur soudaine, tuméfaction ou cyanose discrète d'une extrémité;
·abdomen aigu.
Suspicion de prédisposition héréditaire ou acquise aux complications thrombo-emboliques
En cas de suspicion de prédisposition héréditaire ou acquise aux complications thrombo-emboliques, un examen de la coagulation sanguine doit être effectué par un spécialiste, qui peut le cas échéant demander une analyse de certains paramètres hémostatiques.
Affections tumorales
Carcinome du col utérin
Un risque augmenté de cancer du col a été rapporté lors d'une utilisation au long cours des CHC (>5 ans) dans quelques études épidémiologiques. Néanmoins ceci est toujours en discussion de façon controversée dans la mesure où ce résultat est influencé par d'autres facteurs, comme une infection par des papillomavirus humains (HPV) (facteurs de risque le plus puissant), par la fréqence de la participation au screening du col de l'utérus ou par le comportement sexuel.
Cancer du sein
Une métaanalyse de 54 études épidémiologiques a montré que le risque relatif (RR) qu'un cancer du sein soit diagnostiqué, est légèrement augmenté chez les femmes qui prennent des CHC (RR = 1,24). Cette augmentation du risque diminue d'une manière continue après l'arrêt des CHC et n'est plus détectable au bout de 10 ans. Les cancers du sein étant rares avant l'âge de 40 ans, le nombre supplémentaire de cancers du sein diagnostiqués chez les femmes prenant ou ayant pris un CHC, est faible par rapport au risque total de cancer du sein.
Ces études ne donnent pas d'indications sur un lien de causalité. L'augmentation du risque observée peut être due aussi bien à un dépistage plus précoce chez les utilisatrices de CHC (au raison du suivi clinique régulier) qu'aux effets biologiques des CHC, ou aux deux facteurs. Les cancers du sein étaient, au moment où le diagnostic a été posé, tendanciellement moins évolués chez les femmes ayant pris un CHC que chez les femmes n'en ayant jamais pris.
Néoplasies hépatiques
Chez les femmes prenant des contraceptifs hormonaux, on a observé dans de rares cas des adénomes hépatocellulaires ou une hyperplasie focale nodulaire, et extrêmement rarement des carcinomes hépatocellulaires. Le risque semble augmenter avec la durée de la prise. La rupture d'un adénome hépatocellulaire peut être à l'origine d'hémorragies intra-abdominales mettant en jeu le pronostic vital. Si des douleurs épigastriques intenses, une hépatomégalie ou des signes en faveur d'une hémorragie intra-abdominale apparaissent, il faut inclure l'éventualité d'une tumeur hépatique dans le diagnostic différentiel.
Troubles dépressifs
Les dépressions et humeurs dépressives sont connues comme étant des effets indésirables potentiels lors de l'utilisation d'hormones sexuelles, y compris de contraceptifs hormonaux (voir aussi la rubrique «Effets indésirables»). De tels troubles peuvent survenir peu de temps après le début du traitement. La dépression peut être grave et représente un facteur de risque de suicide ou de comportement suicidaire. Les utilisatrices de contraceptifs hormonaux doivent donc être informées des symptômes éventuels des troubles dépressifs. Il faut impérativement conseiller à l'utilisatrice de s'adresser sans délai à un médecin si elle remarque des sautes d'humeur ou d'autres symptômes de dépression au cours de l'utilisation du contraceptif. Les patientes ayant des antécédents de dépression doivent être surveillées attentivement pendant le traitement. En cas de réapparition d'états dépressifs graves au cours de l'utilisation d’Estinette 30, le traitement doit être interrompu.
Autres précautions
Les femmes prenant un contraceptif hormonal ne doivent pas être traitées simultanément par des préparations à base de millepertuis (Hypericum) car celui-ci peut compromettre l'action contraceptive. Des saignements intermenstruels et des cas isolés de grossesses non désirées ont été rapportés (voir aussi «Interactions»).
Chez les femmes atteintes d'hypertriglycéridémie, en particulier en présence de formes familiales, l'utilisation de CHC peut augmenter le risque de pancréatite.
Bien qu'une légère augmentation de la tension artérielle pendant la prise de CHC ait été assez fréquemment rapportée, des valeurs élevées cliniquement significatives sont rares. Si la prise du CHC conduit à une augmentation cliniquement significative de la tension artérielle (confirmée par des mesures répétées), la prise du CHC devra être arrêtée. Dans les cas où l'indication semble justifiée, on pourra envisager la reprise d'un CHC, pour autant que la tension artérielle se soit normalisée (sous traitement).
La prise de CHC peut entraîner une diminution de la tolérance au glucose. Les femmes diabétiques et celles ayant une tolérance au glucose réduite doivent donc toutes être attentivement surveillées lors de la prise d'un CHC. Sauf exception, il n'existe aucune raison de modifier le traitement antidiabétique.
Des atteintes hépatocellulaires ont été rapportées lors de la prise de CHC. Dans ce cas, la patiente devra arrêter la prise d’Estinette 30 et utiliser une autre méthode contraceptive non hormonale, jusqu'à ce que les valeurs hépatiques se soient normalisées. Un dépistage précoce d'atteintes hépatocellulaires et l'arrêt de la prise du médicament peuvent réduire le degré de gravité des lésions des cellules hépatiques.
La récidive d'un ictère cholestatique apparu pour la première fois pendant une grossesse ou lors d'une prise antérieure d'hormones stéroïdiennes sexuelles, doit faire arrêter la prise du CHC.
Chez les patientes atteintes d'hépatite C qui utilisent simultanément un CHC contenant de l'éthinylestradiol, une hausse des ALAT (y compris des cas d'augmentation à plus de 5 fois la limite supérieure de la normale, dans des cas isolés à plus de 20 fois la limite supérieure de la normale) a été observée significativement plus souvent lors de l'utilisation de l'association des principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir que chez les patientes qui avaient été traitées exclusivement avec des principes actifs antiviraux (voir «Interactions»). Des élévations similaires des ALAT ont également été observées sous médicaments anti-VHC contenant du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir.La prise d’Estinette 30 doit donc être arrêtée avant l'instauration d'un traitement avec ces associations de principes actifs. Si les valeurs hépatiques sont normales, la prise d’Estinette 30 peut être recommencée au plus tôt 2 semaines, mais de préférence 4 semaines après l'arrêt des associations de principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir. Il faut par ailleurs prendre en compte que dans un intervalle inférieur à 4 semaines l'efficacité du CHC peut encore être perturbée en raison des propriétés d'induction enzymatique du ritonavir et qu'une méthode de barrière contraceptive doit donc être utilisée en plus (voir «Interactions», rubrique «Inducteurs enzymatiques»).
Les estrogènes peuvent augmenter la lithogénicité de la vésicule biliaire. Plusieurs études épidémiologiques ont montré un risque accru d'affections de la vésicule biliaire (p.ex. cholélithiase, cholécystite; y compris la nécessité d'une cholécystectomie) lors de l'utilisation de contraceptifs hormonaux combinés.
Chez les femmes atteintes d'un angioœdème héréditaire et/ou acquis, des estrogènes exogènes peuvent induire ou aggraver les symptômes.
Les affections suivantes peuvent survenir ou être aggravées pendant la grossesse ou l'utilisation d'un CHC, même si les données actuellement disponibles ne permettent pas d'imputer une relation de causalité claire avec l'utilisation d'un CHC: ictère et/ou prurit cholestatique; cholélithiase; porphyrie; lupus érythémateux disséminé; syndrome hémolytique et urémique; chorée mineure; herpes gestationis; surdité due à une otosclérose. La prise de CHC a en outre été associée à des cas de maladie de Crohn et de colite ulcéreuse.
Chez les femmes prédisposées, l'utilisation de CHC peut occasionnellement provoquer un chloasma, qui est encore renforcé par une exposition intense aux rayons solaires. Les femmes présentant une tendance au chloasma ne devraient donc pas s'exposer à des rayonnements UV importants.
Il faut informer les patientes que les CHC n'offrent aucune protection contre les infections à VIH (Sida) et autres maladies sexuellement transmissibles.
Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dragée, c.-à-d. qu’il est essentiellement « sans sodium ».
InteractionsAfin de connaître les éventuelles interactions, il est recommandé de consulter également l'information professionnelle des médicaments co-administrés.
Influence d'autres substances sur la pharmacocinétique des contraceptifs hormonaux
Inducteurs enzymatiques
Des interactions peuvent survenir entre contraceptifs hormonaux et médicaments induisant les enzymes microsomales, ce qui peut conduire à une augmentation de la clairance des hormones sexuelles, à une diminution de l'effet contraceptif et à des saignements intermenstruels. Ceci vaut par exemple pour les barbituriques, le bosentan, la carbamazépine, le felbamate, la griséofulvine (non autorisée en Suisse), le modafinil, l'oxcarbazépine, la phénylbutazone, la phénytoïne (et autres hydantoïnes), la primidone, la rifabutine, la rifampicine et le topiramate ainsi que pour les médicaments contenant du millepertuis (Hypericum perforatum).
Une induction enzymatique peut être observée après seulement quelques jours. L'induction enzymatique maximale est en général observée après 2 à 3 semaines et peut persister pendant au moins 4 semaines après l'arrêt de ces médicaments. Les femmes traitées sur une courte période par un de ces médicaments doivent provisoirement prendre une méthode de contraception non hormonale ou choisir une autre méthode contraceptive. Une méthode de contraception mécanique doit être poursuivie pendant toute la prise concomitante des inducteurs enzymatiques et encore pendant 28 jours après l'arrêt du traitement. Lorsque la prise concomitante d'un médicament dure au-delà de la fin de l'emballage du CHC, il faut passer immédiatement à l'emballage suivant, donc sauter l'intervalle habituel sans prise de comprimés. Dans ce cas, il ne faut pas s'attendre à des règles avant la fin du deuxième emballage. En l'absence de règles pendant l'intervalle sans prise de comprimés à la fin du deuxième emballage, il est impératif d'exclure toute grossesse avant de poursuivre avec un nouvel emballage. En cas de traitement de longue durée avec des médicaments qui entraînent une induction enzymatique hépatique, il convient d'utiliser des méthodes contraceptives non hormonales fiables.
On sait en outre que différents inhibiteurs de la protéase du VIH/VHC (p.ex. le bocéprévir, le télaprévir) et inhibiteurs non nucléosidiques de la transcriptase inverse (p.ex. l'éfavirenz, la névirapine), ainsi que leurs associations, peuvent entraîner une baisse ou une augmentation des concentrations plasmatiques en estrogènes et progestatifs. Ces modifications peuvent être cliniquement significatives dans certains cas.
Les inhibiteurs des protéases en particulier, tels que le ritonavir ou le nelfinavir (y compris leurs associations) sont connus comme étant des inhibiteurs puissants du CYP3A4, mais en cas de co-administration avec des hormones stéroïdiennes, ils peuvent entraîner une induction enzymatique et provoquer une baisse des concentrations plasmatiques en estrogènes et progestatifs.
Inhibiteurs enzymatiques
Inhibiteurs forts et modérés du CYP3A4 comme les antifongiques azolés (p.ex. itraconazole, voriconazole, fluconazole), les macrolides (clarithromycine, érythromycine), le cobicistat, le diltiazem, le vérapamil et le jus de pamplemousse peuvent augmenter les taux plasmatiques des estrogènes et/ou des progestatifs et entraîner des effets indésirables plus nombreux.
Interférence avec le métabolisme entéro-hépatique
En cas de prise simultanée et sur une courte durée (jusqu'à 10 jours) d'antibiotiques qui n'interagissent pas avec le système enzymatique du CYP3A4, aucune interaction pharmacocinétique n'est à prévoir. Il est cependant nécessaire d'avertir la patiente que dans certains cas, la maladie (p.ex. maladie vénérienne) contre laquelle l'antibiotique est utilisé peut nécessiter en complément l'utilisation d'une méthode contraceptive mécanique.
En cas de co-médication de longue durée avec des antibiotiques (p.ex. en cas d'ostéomyélite ou de borréliose), les données d'interaction actuellement disponibles sont insuffisantes. Pour exclure avec certitude toute grossesse, il est dans de tels cas recommandé d'utiliser en complément une méthode contraceptive mécanique pendant la durée de l'antibiothérapie et pendant les 7 jours qui suivent la fin de ce traitement.
En cas d'apparition de diarrhées et/ou de vomissements sous traitement antibiotique, se référer aux indications dans le paragraphe « Comportement lors de troubles gastro-intestinaux » dans la rubrique « Posologie / Mode d'emploi ».
Influence des contraceptifs hormonaux sur la pharmacocinétique d'autres médicaments
Les contraceptifs hormonaux peuvent, par différents mécanismes d'interaction, influer également sur la pharmacocinétique de certains autres médicaments: ils peuvent inhiber les enzymes hépatiques microsomaux ou induire la conjugaison hépatique, en particulier la glucuronoconjugaison. Les concentrations plasmatiques ou tissulaires d'autres médicaments peuvent par conséquent être soit augmentées (p.ex. la cyclosporine) soit diminuées (p.ex. la lamotrigine, voir ci-dessous). Par ailleurs, l'effet pharmacologique des groupes médicamenteux suivants peut également être influencé: analgésiques, antidépresseurs, antidiabétiques, antimalariques, certaines benzodiazépines, certainsbéta-bloquants, corticostéroïdes, anticoagulants oraux et théophylline.
Les modifications des taux plasmatiques résultant de ces interactions ne sont pas toujours cliniquement pertinentes.
Lamotrigine
Une étude sur l'interaction avec la lamotrigine, un antiépileptique, et un contraceptif oral combiné (30 µg d'éthinylestradiol/150 µg de lévonorgestrel) a montré une hausse significative de la clairance de la lamotrigine et une diminution significative des taux plasmatiques de lamotrigine lorsque ces médicaments sont administrés en même temps. Une telle diminution des concentrations plasmatiques peut s'accompagner d'une réduction du contrôle des crises. On ignore cependant dans quelle mesure ces résultats sont transposables à d'autres contraceptifs combinés contenant un autre composant progestatif et/ou une autre dose d'estrogène. Mais on peut partir du principe que ces préparations présentent un profil d'interactions comparable.
Lorsqu'un traitement par Estinette 30 est nouvellement instauré chez une patiente prenant de la lamotrigine, une adaptation de la dose de lamotrigine peut donc être nécessaire, et les concentrations de lamotrigine devraient être surveillées étroitement au début du traitement. En l'occurrence, il peut y avoir une hausse significative du taux de lamotrigine (selon les cas jusqu'à un niveau toxique) lors de l'arrêt de la prise du contraceptif hormonal (ainsi dans certains cas pendant la période de 7 jours sans prise).
Interactions dont le mécanisme est inconnu
Dans les études cliniques, une hausse des ALAT (y compris des cas d'augmentation à plus de 5 fois la limite supérieure de la normale, dans des cas isolés à plus de 20 fois la limite supérieure de la normale [LSN]) a été observée significativement plus souvent lors de l'utilisation concomitante de CHC contenant de l'éthinylestradiol et de l'association de principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir utilisée dans le traitement des infections à VHC, que chez les patientes qui avaient été traitées exclusivement avec des principes actifs antiviraux. Des élévations similaires des ALAT ont également été observées sous médicaments anti-VHC contenant du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir. La prise d’Estinette 30 doit donc être arrêtée avant l'instauration d'un traitement avec cette association d'antiviraux (voir aussi «Contre-indications» et «Mises en garde et précautions»).
Grossesse, AllaitementGrossesse
Ce médicament est contre-indiquée chez les femmes enceintes (voir la rubrique «Contre-indications»). Il faut donc exclure toute grossesse avant le début du traitement. Si une grossesse survient ou est suspectée lors de l'utilisation d'Estinette 30, la prise du médicament doit être arrêtée immédiatement et le médecin consulté.
Des études expérimentales animales suggèrent des risques pour le fœtus (voir aussi « Données précliniques »). La plupart des études épidémiologiques réalisées jusqu'à présent n'ont ttoutefois montré aucun indice en faveur d'un effet embryotoxique ou tératogène lors de la prise accidentelle de CHC pendant la grossesse.
Allaitement
Estinette 30 ne doit pas être utilisé pendant l'allaitement car il peut réduire la production de lait et modifier la qualité du lait, et que de faibles quantités de principe actif peuvent passer dans le lait. Des méthodes de contraception non hormonales devront si possible être utilisées jusqu'à ce que la mère ait complètement cessé d'allaiter.
Concernant le risque d'événements thrombo-emboliques chez la mère pendant la période puerpérale, voir la rubrique « Mises en garde et précautions ».
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune influence sur l’aptitude à la conduite ou l’utilisation de machines n'a été observée.
Effets indésirablesLes effets indésirables les plus sévères associés à la prise de CHC sont décrits dans la rubrique «Mises en garde et précautions». Les effets indésirables sérieux incluent en particulier des thrombo-embolies artérielles et veineuses.
Les effets indésirables indiqués ci-dessous ont été observés lors de l'utilisation de CHC. Les fréquences sont ici définies comme «très fréquents» (≥1/10), «fréquents» (≥1/100, <1/10), «occasionnels» (≥1/1'000, <1/100), «rares» (≥1/10'000, <1/1'000), «très rares» (<1/10'000), «fréquence inconnue» (basée principalement sur les rapports spontanés de pharmacovigilance, la fréquence précise ne peut pas être évaluée).
Infections et infestations
Fréquents: vaginites, y compris candidiase
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes)
Fréquents: néoplasies cervicales intraépithéliales
Occasionnels: carcinome cervical, carcinome mammaire.
Très rares: adénomes hépatiques, carcinome hépatocellulaire
Fréquence inconnue: hyperplasie focale nodulaire.
Affections du système immunitaire
Rares: réactions anaphylactiques/ anaphylactoïdes y compris de très rares cas d'urticaire, oedème de Quincke et réactions graves avec symptômes respiratoires et circulatoires
Très rares: exacerbation d'un lupus érythémateux systémique
Troubles du métabolisme et de la nutrition
Fréquents: modifications du poids corporel
Occasionnels: augmentation ou diminution de l'appétit, modifications du taux sérique lipidique, y compris hypertriglycéridémie
Rares: diminution de la tolérance au glucose, baisse du taux sérique des folates (ceci pourrait être cliniquement relevant chez les femmes débutant une grossesse peu après l'arrêt du COC).
Très rares: exacerbation d'une porphyrie.
Affections psychiatriques
Fréquents: changements d'humeur, y compris dépression, troubles de la libido.
Affections du système nerveux
Très fréquents: céphalées, y compris migraine (20,3%)
Fréquents: nervosité, vertiges.
Très rares: exacerbation d'une chorée.
Affections oculaires
Rares: mauvaise tolérance des lentilles de contact.
Très rares: névrite optique.
Affections vasculaires
Occasionnels: élévation de la tension artérielle.
Rares: thrombo-embolie veineuse (p.ex. thrombose veineuse profonde, embolie pulmonaire), thrombo-embolie artérielle (p.ex. accident ischémique transitoire, accident vasculaire cérébral, infarctus du myocarde)
Très rares: aggravation des varices, thrombose rétino-vasculaire.
Affections gastro-intestinales
Fréquents: nausées, vomissements, maux de ventre. Occasionnels: crampes abdominales, ballonnements.
Très rares: pancréatite, colite ischémique.
Fréquence inconnue: maladie intestinale inflammatoire chronique (maladie de Crohn, colite ulcéreuse).
Affections hépatobiliaires
Rares: ictère cholestatique
Très rares: troubles de la vésicule biliaire (y compris calculs biliaires)
Fréquence inconnue: atteintes hépatocellulaires (p.ex. fonction hépatique anormale, hépatite).
Affections de la peau et du tissu sous-cutané
Fréquents: acné
Occasionnels: rash cutané, chloasma (mélasme) (pouvant persister), alopécie, hirsutisme.
Rares: érythème noueux.
Très rares: érythème polymorphe.
Affections du rein et des voies urinaires
Très rares: syndrome hémolytique et urémique.
Affections des organes de reproduction et du sein
Très fréquents: saignements intermenstruels/spotting (13%)
Fréquents: douleur dans les seins, sensibilité et augmentation de volume des seins, sécrétion mammaire, dysménorrhée, aménorrhée, modification du flux menstruel (ménorragie, métrorragie), modification de la sécrétion de glaire cervicale et éctopie du col utérin.
Troubles généraux
Fréquents: œdèmes, rétention de liquide.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Un surdosage peut provoquer une incidence accrue des symptômes décrits sous «Effets indésirables», en particulier des nausées, des vomissements, une sensibilité des seins, des vertiges, des douleurs abdominales, une somnolence/fatigue et des hémorragies de privation.
Traitement
Il n'existe pas d'antidote spécifique. Un traitement symptomatique est éventuellement requis.
Propriétés/EffetsCode ATC
G03AA10
Mécanisme d’action
Estinette 30 est un contraceptif oral monophasique qui contient comme principes actifs l'éthinylestradiol et le gestodène.
Comme pour tous les contraceptifs hormonaux combinés (CHC), l'action contraceptive d’Estinette 30 repose sur différents facteurs dont les plus importants sont le blocage de l'ovulation et la modification de la glaire cervicale. En outre, l'endomètre offre des conditions défavorables à une nidation en raison des altérations morphologiques et enzymatiques qu'il subit. Enfin, du fait des modifications hormonales induites par le CHC, les cycles deviennent plus réguliers et les saignements moins abondants.
Pharmacodynamique
Aucune donnée.
Efficacité clinique
Aucune donnée.
PharmacocinétiqueAbsorption
Ethinylestradiol: Après administration orale, l'éthinylestradiol (EE) est résorbé rapidement et presque complètement. L'EE subit un effet de premier passage important et a une biodisponibilité d'environ 40–60%. Les concentrations sériques maximales sont atteintes dans un délai de 1–2 heures.
Gestodene: Après administration orale, le gestodène est résorbé rapidement et il est presque totalement biodisponible. Les taux plasmatiques maximaux sont atteints dans un délai d'environ 1 heure.
Distribution
Ethinylestradiol:L'EE est fortement lié à l'albumine sérique (environ 98%) et induit une augmentation des concentrations sériques de SHBG (sex hormone binding globulin). Le volume de distribution est d'environ 5 l/kg.
Conditions à l'état d'équilibre: conformément à la demi-vie terminale variable, les taux sériques d'EE atteignent leur état d'équilibre au bout d'une semaine environ.
Gestodene: Le gestodène est lié aussi bien à l'albumine sérique qu'à la sex hormone binding globulin (SHBG). Seuls 1–2% de la concentration sérique totale sont sous forme de stéroïde libre, 50–70% sont liés spécifiquement et avec une forte affinité à la SHBG. L'augmentation de la concentration de SHBG induite par l'éthinylestradiol influe sur la liaison relative aux protéines sériques, entraînant une augmentation de la liaison à la SHBG et une diminution de la liaison à l'albumine et de la fraction libre. Le volume de distribution du gestodène est de 0,7 l/kg.
Conditions à l'état d'équilibre
La pharmacocinétique du gestodène est influencée par les taux de SHBG qui sont multipliés par trois par l'éthinylestradiol. Lors d'une prise quotidienne, les taux sériques de gestodène quadruplent à peu près, l'état d'équilibre étant atteint dans la deuxième moitié du cycle d'administration.
Métabolisme
Ethinylestradiol: L'EE fait l'objet d'un métabolisme présystémique aussi bien dans la muqueuse de l'intestin grêle que dans le foie. Il subit une oxydation, catalysée par le CYP 3A4, produisant différents métabolites hydroxylés et méthylés (principaux métabolites: 2-hydroxyéthinylestradiol et 2méthoxyéthinylestradiol) et une conjugaison avec l'acide glucuronique et des sulfates. Les conjugués sont soumis à un cycle entérohépatique.
Gestodene: Le gestodène est complètement métabolisé par réduction du groupement cétonique 3 et de la double liaison Δ4, ainsi que par plusieurs étapes d'hydroxylation.
Élimination
Ethinylestradiol: La demi-vie terminale est d'environ 16 à18 heures. L'EE est éliminé, sous forme de métabolites glucuronides et sulfoconjugués, par l'urine et les fèces dans un rapport de 4:6.
Gestodene: La demi-vie terminale du gestodène est d'environ 16 à 18 heures. Les métabolites sont éliminés avec les urines et les fèces dans le rapport d'environ 6:4.
Cinétique chez certains groupes de patientes
Aucune donnée sur la pharmacocinétique chez des femmes atteintes d'insuffisance rénale ou hépatique n'est disponible.
Données précliniquesLes études précliniques effectuées avec les contraceptifs oraux combinés sur la toxicité après administration répétée, la génotoxicité et le potentiel carcinogène n'ont montré aucun indice clair de risques particuliers pour l'être humain, même si un risque accru de carcinome hépatique a pu être mis en évidence dans des études épidémiologiques.
Chez les animaux d'expérience, l'éthinylestradiol a déjà présenté un effet embryolétal à une posologie relativement faible; des malformations du tractus urogénital et une féminisation des foetus de sexe masculin ont été observées. Dans les expérimentales animales, les substances progestatives ont présenté un effet embryolétal et à des fortes doses, un effet virilisant sur les foetus de sexe féminin. Les études toxicologiques de reproduction chez le rat, la souris et le lapin n'ont montré aucun indice d'action tératogène.
Voir la rubrique «Grossesse/Allaitement» pour les expériences chez l'être humain.
Remarques particulièresInfluence sur les méthodes de diagnostic
Les stéroïdes contraceptifs peuvent perturber les résultats de certains tests de laboratoire, tels que les paramètres biochimiques du foie, de la thyroïde, de la fonction surrénalienne et rénale, les taux plasmatiques des protéines porteuses et des fractions lipidiques ou lipoprotéiniques, les paramètres du métabolisme glucidique, de la coagulation sanguine et de la fibrinolyse. Ces altérations restent en général dans les limites de la normale.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C.
Conserver dans l’emballage d’origine.
Conserver le récipient dans son carton pour le protéger de la lumière et de l’humidité).
Conserver hors de portée des enfants.
Numéro d’autorisation58321 (Swissmedic)
PrésentationEtuis à 1x21, 3x21 et 6x21 dragées
Catégorie de remise: B
Titulaire de l’autorisationGedeon Richter (Schweiz) AG, Genève.
Mise à jour de l’informationAoût 2021
|

