Propriétés/EffetsCode ATC
A10BD07
Mécanisme d'action/Pharmacodynamique
La sitagliptine appartient à une classe d'antidiabétiques oraux, les inhibiteurs de la dipeptidylpeptidase-4 (DPP-4), qui améliorent le contrôle de la glycémie chez les patients atteints de diabète de type 2 en augmentant les concentrations des incrétines actives. Les incrétines, y compris le GLP-1 (Glucagon-like Peptide-1) et le GIP (Glucose-dependent insulinotropic Peptide), sont libérées toute la journée à partir des intestins. Leur concentration augmente lors de la prise de nourriture. Les incrétines font partie d'un système endogène qui intervient dans la régulation physiologique de l'homéostasie du glucose. Lorsque la glycémie est normale ou élevée, le GLP-1 et le GIP favorisent la synthèse d'insuline et la sécrétion d'insuline à partir des cellules bêta du pancréas par des signaux intracellulaires impliquant l'AMP cyclique. Le traitement du diabète de type 2 par GLP-1 ou par inhibiteurs de la DPP-4 dans des modèles animaux a montré que la sensibilité des cellules bêta au glucose est améliorée et que la biosynthèse ainsi que la sécrétion d'insuline sont stimulées. En présence de concentrations plus élevées d'insuline, l'absorption tissulaire de glucose augmente. Parallèlement, le GLP-1 diminue la sécrétion de glucagon à partir des cellules alpha du pancréas. De faibles concentrations de glucagon accompagnées de concentrations d'insuline élevées diminuent la production de glucose dans le foie, ce qui entraîne à son tour une baisse de la glycémie. Les effets du GLP-1 et du GIP sont dépendants du glucose. Lors d'une glycémie basse, le GLP-1 ne stimule ni la sécrétion d'insuline ni la suppression de la sécrétion de glucagon. Grâce au GLP-1 et au GIP, la sécrétion d'insuline est augmentée lorsque la glycémie dépasse les valeurs normales. Le GLP-1 n'affecte pas la réaction normale du glucagon lors d'hypoglycémie. L'activité du GLP-1 et du GIP est régulée par l'enzyme DPP-4, qui hydrolyse rapidement les incrétines et les transforme en substances inactives. La sitagliptine empêche l'hydrolyse des incrétines par la DPP-4, ce qui augmente les concentrations plasmatiques des formes actives du GLP-1 et du GIP. Suite à l'augmentation de la concentration d'incrétines actives, la sitagliptine provoque une hausse de la sécrétion d'insuline et une baisse de la concentration de glucagon, en fonction de la concentration de glucose. Chez les patients atteints de diabète de type 2 et présentant une hyperglycémie, ces modifications de la concentration d'insuline et de glucagon entraînent une baisse de la concentration de l'hémoglobine A1c (HbA1c) ainsi qu'une diminution des glycémies postprandiales et à jeun. Ce mécanisme dépendant du glucose se distingue de celui des sulfonylurées. Celles-ci provoquent une sécrétion d'insuline même en présence d'une glycémie basse, ce qui peut provoquer une hypoglycémie chez les patients diabétiques de type 2 et les sujets sains. Alors que la sitagliptine est un inhibiteur puissant et très sélectif de l'enzyme DPP-4, ses concentrations thérapeutiques n'inhibent pas les enzymes apparentées DPP-8 et DPP-9, très similaires.
Chlorhydrate de metformine
La metformine est un antidiabétique qui améliore la tolérance au glucose chez les patients souffrant de diabète de type 2 et réduit aussi bien la glycémie basale que la glycémie postprandiale. Les mécanismes d'action pharmacologiques de la metformine se distinguent de ceux des autres classes d'antidiabétiques oraux. La metformine réduit aussi bien la synthèse hépatique de glucose que l'absorption intestinale de glucose; elle améliore la sensibilité à l'insuline en augmentant l'assimilation périphérique et l'utilisation du glucose. Contrairement aux sulfonylurées, la metformine ne provoque pas d'hypoglycémie chez les patients diabétiques de type 2 ou chez les sujets sains, sauf dans des cas très particuliers (voir la section «Mises en garde et précautions», Chlorhydrate de metformine). Elle ne provoque pas non plus d'hyperinsulinémie. Pendant un traitement par la metformine, la sécrétion d'insuline reste inchangée tandis que les taux d'insuline à jeun et la réponse insulinique dans le plasma au cours de la journée peuvent même baisser.
Efficacité clinique
Études cliniques
Des études cliniques avec administration concomitante de sitagliptine et de metformine ont constaté une amélioration significative du contrôle de l'équilibre glycémique chez les patients adultes souffrant d'un diabète de type 2. La bioéquivalence entre Janumet et un traitement composé de sitagliptine et de chlorhydrate de metformine administrés de façon concomitante a été démontrée. L'association de sitagliptine et de metformine a amélioré le contrôle de l'équilibre glycémique dans des études cliniques d'une durée allant jusqu'à 2 ans.
Sitagliptine et metformine chez les patients diabétiques de type 2
Une étude en double aveugle de 24 semaines, randomisée, avec contrôle par placebo, a examiné la sécurité et l'efficacité de l'association de sitagliptine et de metformine chez 1091 patients diabétiques de type 2 qui présentaient un équilibre glycémique insuffisant malgré un régime alimentaire et un exercice physique régulier.
Chez les patients ayant un contrôle glycémique insuffisant sous régime alimentaire plus exercice physique, l'association sitagliptine-metformine a permis des améliorations significatives en ce qui concerne le taux d'HbA1c, le taux plasmatique de glucose à jeun (FPG) et la valeur postprandiale à 2 h du taux plasmatique de glucose (PPG) par rapport au placebo, à la metformine seule et à la sitagliptine seule (p <0,001; tableau 2, figure 1). Une amélioration avec réduction presque maximale du FPG a été atteinte au premier bilan à 3 semaines (correspondant au premier bilan après le début du traitement) et a pu être maintenue pendant toute la durée de cette étude de 24 semaines. En comparaison avec le groupe sous placebo, les patients qui avaient eu des valeurs initiales plus élevées d'HbA1c ont bénéficié d'une réduction moyenne plus importante du taux d'HbA1c.
L'amélioration du taux d'HbA1c n'a pas été influencée par le sexe, l'âge, la race ou la valeur initiale du BMI. Les examens de la fonction des cellules bêta, HOMA-β, de même que le rapport pro-insuline/insuline, ont également montré une amélioration sous l'association sitagliptine-metformine en comparaison avec chacune des substances seules. Les paramètres lipidiques n'ont pas été influencés. Les réductions moyennes du taux d'HbA1c observées dans le sous-groupe des patients sans traitement antidiabétique avant l'étude ont été: -1,06% sous sitagliptine 100 mg une fois par jour (n = 88); -1,09% sous metformine 500 mg deux fois par jour (n = 90); -1,24% sous metformine 1000 mg deux fois par jour (n = 87); -1,59% sous sitagliptine 50 mg deux fois par jour et metformine 500 mg deux fois par jour (n = 100); -1,94% sous sitagliptine 50 mg deux fois par jour et metformine 1000 mg deux fois par jour (n = 86); -0,17% sous placebo (n = 83).
Fig. 1: Variation moyenne du taux d'HbA1c sur 24 semaines par rapport aux valeurs initiales, sous sitagliptine seule, metformine seule et sous association des deux substances chez des patients diabétiques de type 2†
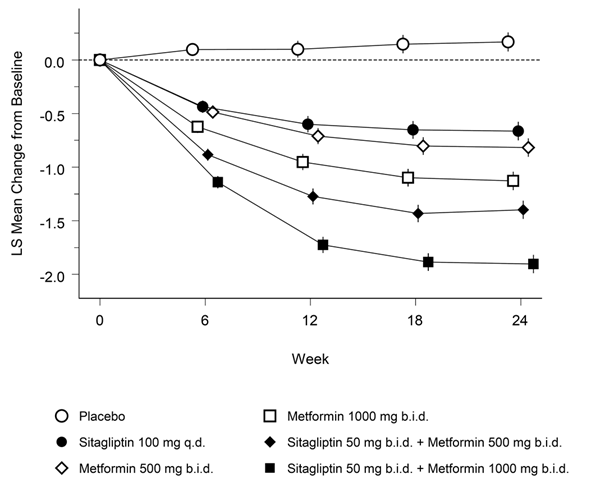
† Population de tous les patients traités (analyse en intention de traitement, ITT), moyennes des moindres carrés, ajustées en fonction du traitement antidiabétique antérieur et de la valeur initiale.
Tableau 2:
Paramètres glycémiques et poids corporel lors de l'examen final à 24 semaines†
|
|
Placebo
|
Sitagliptine
100 mg
1x par jour
|
Metformine
500 mg 2x par jour
|
Sitagliptine
50 mg 2x par jour +
metformine
500 mg 2x par jour
|
Metformine
1000 mg 2x par jour
|
Sitagliptine
50 mg 2x par jour +
metformine
1000 mg 2x par jour
| |
HbA1c (%)
|
N = 165
|
N = 175
|
N = 178
|
N = 183
|
N = 177
|
N = 178
| |
Valeur initiale (moyenne)
|
8,68
|
8,87
|
8,90
|
8,79
|
8,68
|
8,76
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
0,17
|
-0,66
|
-0,82
|
-1,40
|
-1,13
|
-1,90
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
-
|
-0,83§
|
-0,99§
|
-1,57§
|
-1,30§
|
-2,07§
| |
Patients (%) avec taux d'HbA1c <7%
|
15 (9,1)
|
35 (20,0)
|
41 (23,0)
|
79 (43,2)
|
68 (38,4)
|
118 (66,3)
| |
FPG (mmol/l)
|
N = 169
|
N = 178
|
N = 179
|
N = 183
|
N = 179
|
N = 180
| |
Valeur initiale (moyenne)
|
10,91
|
11,19
|
11,40
|
11,33
|
10,94
|
10,93
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
0,32
|
-0,97
|
-1,52
|
-2,62
|
-1,63
|
-3,55
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
-
|
-1,29§
|
-1,84§
|
-2,94§
|
-1,95§
|
-3,87§
| |
PPG à 2 h (mmol/l)
|
N = 129
|
N = 136
|
N = 141
|
N = 147
|
N = 138
|
N = 152
| |
Valeur initiale (moyenne)
|
15,38
|
15,86
|
16,26
|
16,21
|
15,74
|
15,94
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
0,02
|
-2,88
|
-2,97
|
-5,14
|
-4,33
|
-6,48
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
|
-2,9§
|
-2,98§
|
-5,16§
|
-4,35§
|
-6,49§
| |
Poids corporel (kg)**
|
N = 167
|
N = 175
|
N = 179
|
N = 184
|
N = 175
|
N = 178
| |
Valeur initiale (moyenne)
|
90,1
|
85,9
|
88,1
|
90,0
|
89,4
|
88,2
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,9
|
0,0
|
-0,9
|
-0,6
|
-1,1
|
-1,3
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
|
0,9¶
|
0,1#
|
0,4#
|
-0,1#
|
-0,3#
|
† All Patients Treated Population (une analyse en intention de traitement, ITT).
‡ Moyennes des moindres carrés, ajustées en fonction du traitement antidiabétique antérieur et de la valeur initiale.
§ p <0,001 par rapport au placebo.
** Population de tous les patients tels que traités (all Patients as Treated, APaT) à l'exclusion des données après un traitement glycémique d'urgence.
¶ p = 0,005 par rapport au placebo.
# Statistiquement non significatif (p ≥0,05) par rapport au placebo.
En outre, cette étude a inclus des patients (n = 117) présentant une forte hyperglycémie (HbA1c >11% ou glycémie >15,56 mmol/l), traités deux fois par jour par la sitagliptine 50 mg et par la metformine 1000 mg. Aucun contrôle avec placebo n'a été fait pour ce groupe de patients. Dans ce groupe de patients, le taux initial moyen d'HbA1c était de 11,15%, le FPG de 17,47 mmol et la valeur de PPG à deux heures de 24,5 mmol/l. Au bout de 24 semaines, les réductions suivantes ont été constatées par rapport aux valeurs initiales: -2,9% pour le taux d'HbA1c, -7,04 mmol/l pour le FPG et -11,55 mmol/l pour le PPG à 2 heures. Dans cette cohorte, une augmentation de 1,3 kg du poids corporel a été constatée à 24 semaines.
Traitement complémentaire par la sitagliptine chez les patients n'atteignant pas un bon équilibre glycémique sous metformine seule
Deux études cliniques effectuées en double aveugle avec contrôle par placebo auprès de patients diabétiques de type 2 ont évalué la sécurité et l'efficacité d'une association sitagliptine-metformine. Dans les deux études, des patients présentant une glycémie mal contrôlée ont poursuivi leurs prises de metformine ≥1500 mg tout en prenant de façon randomisée soit 100 mg de sitagliptine une fois par jour, soit un placebo en plus du traitement en cours par la metformine.
Dans une étude, 701 patients ont été traités 24 semaines soit avec 100 mg de sitagliptine une fois par jour, soit avec un placebo. L'ajout de la sitagliptine au traitement en cours par la metformine a permis une amélioration significative du taux d'HbA1c (-0,65%), du FPG (-1,41 mmol/l) et de la glycémie postprandiale à 2 h (-2,81 mmol/l) en comparaison avec l'ajout du placebo au traitement en cours par la metformine (voir Fig. 2 et Tableau 3). L'amélioration du taux d'HbA1c par rapport au placebo n'a pas été influencée par le taux initial d'HbA1c, les traitements antidiabétiques antérieurs, le sexe, l'âge, le BMI initial, le temps écoulé depuis le diagnostic du diabète, la présence d'un syndrome métabolique ou les indices standard de l'insulinorésistance (HOMA-IR) ou de la sécrétion d'insuline (HOMA-β).
Fig. 2: Modification moyenne du taux d'HbA1c à 24 semaines par rapport à la valeur initiale chez des patients diabétiques de type 2 traités avec une dose quotidienne de 100 mg de sitagliptine en association avec de la metformine ou avec un placebo en plus de la metformine†,‡
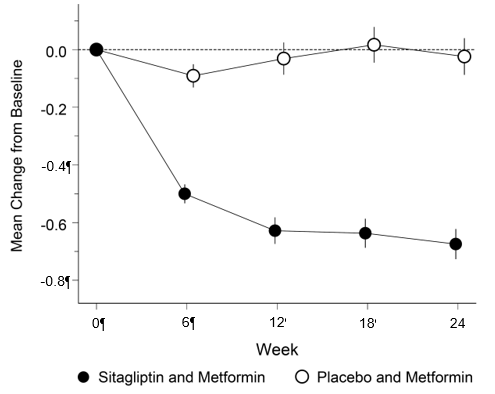
† Patients n'ayant pas atteint un équilibre glycémique suffisant sous metformine seule.
‡ All Patients Treated Population. Moyennes des moindres carrés, ajustées en fonction du traitement antidiabétique antérieur et de la valeur initiale.
Tableau 3:
Paramètres glycémiques et poids corporel lors de l'examen final (étude de 24 semaines)
Traitement complémentaire par la sitagliptine chez des patients n'ayant pas atteint un bon équilibre glycémique sous metformine seule†
|
|
Sitagliptine 100 mg par jour + metformine
|
Placebo +
metformine
| |
HbA1c (%)
|
N = 453
|
N = 224
| |
Valeur initiale (moyenne)
|
7,96
|
8,03
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,67
|
-0,02
| |
Différence par rapport au placebo + metformine (moyenne ajustée‡)
|
-0,65§
|
| |
Patients (%) avec HbA1c <7%
|
213 (47,0)
|
41 (18,3)
| |
FPG (mmol/l)
|
N = 454
|
N = 226
| |
Valeur initiale (moyenne)
|
9,44
|
9,64
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,94
|
0,47
| |
Différence par rapport au placebo + metformine (moyenne ajustée ‡)
|
-1,41§
|
| |
PPG à 2 h (mmol/l)
|
N = 387
|
N = 182
| |
Valeur initiale (moyenne)
|
15,25
|
15,13
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-3,44
|
-0,63
| |
Différence par rapport au placebo + metformine (moyenne ajustée‡)
|
-2,81§
|
| |
Poids corporel (kg)**
|
N = 399
|
N = 169
| |
Valeur initiale (moyenne)
|
86,9
|
87,6
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,7
|
-0,6
| |
Différence par rapport au placebo + metformine (moyenne ajustée‡)
|
-0,1¶
|
|
† All Patients treated Population (une analyse Intention-to-treat).
‡ Moyennes des moindres carrés, ajustées en fonction du traitement antidiabétique antérieur et de la valeur initiale.
§ p <0,001 par rapport au placebo + metformine.
** All Patients as Treated (APaT) Population, à l'exclusion des données après un traitement glycémique d'urgence.
¶ Statistiquement non significatif (p ≥0,05) par rapport au placebo + metformine.
Une autre étude a déterminé les valeurs de glycémie de 24 heures. 28 patients ont reçu deux fois par jour pendant 4 semaines soit 50 mg de sitagliptine, soit un placebo, en plus d'un traitement déjà en cours par la metformine deux fois par jour. Au bout de 4 semaines de traitement, la différence entre les effets hypoglycémiants a été déterminée sous forme de moyenne pondérée des valeurs glycémiques de 24 h mesurées dans le plasma (WMG) sur la base de plusieurs prises de sang par jour, y compris des prises de sang avant et après les repas ainsi que pendant la nuit. Le traitement avec deux fois 50 mg de sitagliptine par jour en association avec la metformine deux fois par jour a significativement réduit la valeur de WMG de 24 h en comparaison avec le placebo associé à la metformine (-1,82 mmol/l). En comparaison avec les patients sous placebo-metformine, les patients sous sitagliptine-metformine ont eu des taux plasmatiques de glucose à jeun significativement plus bas ainsi que des excursions glycémiques moindres après chacun des trois repas (voir fig. 3). La sitagliptine en association avec la metformine a permis, en comparaison avec le placebo associé à la metformine, une réduction significative de la glycémie moyenne à jeun (-1,13 mmol/l), de la moyenne glycémique de 7 points (-1,56 mmol/l) et de la glycémie postprandiale à 2 heures (-2,03 mmol/l).
Fig. 3: Profils glycémiques de 24 h chez des patients diabétiques de type 2 au bout de 4 semaines de traitement par la sitagliptine 50 mg 2x par jour associée à la metformine ou par un placebo associé à la metformine†
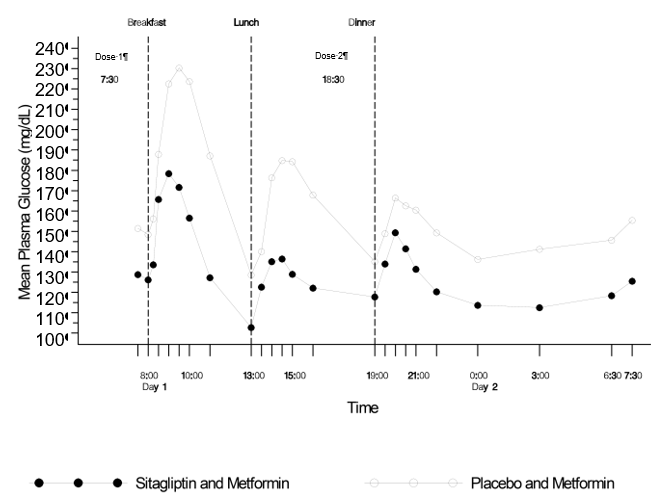
† Patients n'ayant pas atteint un équilibre glycémique suffisant sous metformine seule.
Ajout de sitagliptine au traitement de patients n'ayant pas atteint un équilibre glycémique suffisant avec l'association de metformine et de glimépiride
Une étude randomisée de 24 semaines, effectuée en double aveugle avec contrôle par placebo auprès de 441 patients diabétiques de type 2, a évalué l'efficacité de la sitagliptine à la dose de 100 mg une fois par jour en association avec le glimépiride (en monothérapie ou en association avec la metformine). Dans cette étude, 220 patients suivaient déjà un traitement associant le glimépiride (≥4 mg par jour) et la metformine (≥1500 mg par jour).
L'association de sitagliptine, de glimépiride et de metformine a permis, en comparaison avec le placebo, une réduction significative du taux d'HbA1c par rapport aux valeurs initiales (-0,89%) et de la glycémie à jeun (FPG -1,15 mmol/l) (voir tableau 4). Les patients ayant présenté initialement un taux plus élevé d'HbA1c ont atteint une plus forte réduction moyenne du taux d'HbA1c par rapport au placebo.
Tableau 4:
Paramètres glycémiques* et poids corporel à l'examen final (étude de 24 semaines) chez les patients traités par la sitagliptine en plus du traitement associant le glimépiride et la metformine†
|
|
Sitagliptine 100 mg
+ glimépiride
+ metformine
|
Placebo
+ glimépiride
+ metformine
| |
HbA1c (%)
|
N = 115
|
N = 105
| |
Valeur initiale (moyenne)
|
8,27
|
8,28
| |
Variation vs valeur initiale (moyenne ajustée‡)
|
-0,59
|
0,30
| |
Variation vs placebo (moyenne ajustée‡)
|
-0,89§
|
| |
Patients (%) avec un taux d'HbA1c <7%
|
26 (22,6)
|
1 (1,0)
| |
FPG (mmol/l)
|
N = 115
|
N = 109
| |
Valeur initiale (moyenne)
|
9,96
|
9,94
| |
Variation vs valeur initiale (moyenne ajustée‡)
|
-0,43
|
0,72
| |
Variation vs placebo (moyenne ajustée‡)
|
-1,15§
|
| |
Poids corporel (kg)**
|
N = 102
|
N = 74
| |
Valeur initiale (moyenne)
|
86,5
|
84,6
| |
Variation vs valeur initiale (moyenne ajustée‡)
|
0,4
|
-0,7
| |
Variation vs placebo (moyenne ajustée‡)
|
1,1††
|
|
* Paramètres glycémiques primaires et secondaires: HbA1c et glycémie à jeun.
† All Patients treated Population (une analyse Intention-to-treat).
‡ Moyennes des moindres carrés, ajustées en fonction du traitement antérieur et de la valeur initiale.
§ p <0,001 versus placebo.
** All Patients as Treated (APaT) Population, à l'exclusion des données après un traitement glycémique d'urgence.
†† p = 0,007 versus placebo.
Sitagliptine en tant que traitement complémentaire chez les patients insuffisamment contrôlés avec une association de metformine et d'insuline
Au total, 641 patients diabétiques de type 2 ont participé à une étude randomisée de 24 semaines, réalisée en double aveugle avec contrôle par placebo, dans laquelle on a évalué l'efficacité de la sitagliptine 100 mg une fois par jour en association avec une dose stable d'insuline. Environ 75% des patients prenaient également de la metformine. Les patients sous insulinothérapie (insuline prête à l'emploi avec une durée d'action intermédiaire ou longue) en association ou non avec de la metformine ont été randomisés pour recevoir 100 mg de sitagliptine ou un placebo en tant que traitement complémentaire. Les critères glycémiques évalués ont inclus le taux de HbA1c, la glycémie à jeun et la glycémie postprandiale (PPG) au bout de 2 heures.
L'association de sitagliptine, de metformine et d'insuline a permis, en comparaison avec le placebo, une amélioration significative du taux de HbA1c, de la glycémie à jeun et de la PPG au bout de 2 heures (tableau 5). L'amélioration du taux de HbA1c par rapport au placebo a été concordante dans tous les sous-groupes. Ces sous-groupes étaient définis en fonction de l'âge, du sexe, de la race, du BMI initial, du temps écoulé depuis le diagnostic du diabète, de la présence ou non d'un syndrome métabolique et des indices standard d'insulinorésistance (HOMA-IR) et d'insulinosécrétion (HOMA-β). Une modification significative du poids corporel par rapport à la valeur initiale n'a été observée dans aucun des groupes.
Tableau 5:
Paramètres glycémiques et poids corporel lors de l'examen final (étude de 24 semaines) après la prise de sitagliptine en tant que traitement complémentaire en plus du traitement associant la metformine et une dose stable d'insuline†
|
|
Sitagliptine 100 mg
+ insuline
+ metformine
|
Placebo
+ insuline
+ metformine
| |
HbA1c (%)
|
N = 223
|
N = 229
| |
Valeur initiale (moyenne)
|
8,73
|
8,60
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,66
|
-0,13
| |
Différence par rapport au placebo (moyenne ajustée‡,§)
|
-0,53**
|
| |
Patients (%) avec HbA1c <7%
|
32 (14,3)
|
12 (5,2)
| |
FPG (mmol/l)
|
N = 225
|
N = 229
| |
Valeur initiale (moyenne)
|
9,5
|
9,7
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-1,2
|
-0,2
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
-1,0**
|
| |
PPG à 2 h (mmol/l)
|
N = 182
|
N = 189
| |
Valeur initiale (moyenne)
|
15,4
|
15,4
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-2,1
|
0,1
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
-2,2**
|
| |
Poids corporel (kg)¶
|
N = 201
|
N = 200
| |
Valeur initiale (moyenne)
|
87,9
|
88,0
| |
Modification par rapport à la valeur initiale (moyenne ajustée‡)
|
-0,1
|
0,0
| |
Différence par rapport au placebo (moyenne ajustée‡)
|
0,1#
|
|
† All Patients treated Population (une analyse Intention-to-treat).
‡ Moyennes des moindres carrés, ajustées en fonction du traitement par insuline (prête à l'emploi ou non [de durée d'action intermédiaire ou longue]) lors de la visite 1 et en fonction de la valeur initiale.
§ Stratification en fonction de l'insuline; l'interaction n'était pas significative (p >0,10).
** p <0,001 versus placebo.
¶ All Patients as Treated (APaT) Population, à l'exclusion des données après un traitement glycémique d'urgence.
# Statistiquement non significatif (p ≥0,05) par rapport au placebo.
Dans une autre étude randomisée de 24 semaines, effectuée en double aveugle avec contrôle par placebo, destinée à analyser l'effet de la sitagliptine en traitement concomitant complémentaire sur les économies d'insuline, 660 patients ayant un contrôle glycémique insuffisant sous insuline glargine avec ou sans metformine (≥1500 mg par jour) ont été randomisés en deux groupes: 100 mg sitagliptine (N=330) ou placebo (N=330). L'administration avait lieu une fois par jour parallèlement à une intensification du traitement par insuline. Chez les patients traités par metformine, le taux initial d'HbA1c était de 8,70% et la dose initiale d'insuline de 37 UI/jour. Les patients devaient titrer leur dose d'insuline glargine selon la glycémie à jeun obtenue après piqûre du doigt. Les critères d'évaluation secondaires de l'étude comprenaient l'HbA1c et la glycémie à jeun (FPG).
Chez les patients sous metformine, la hausse de la dose quotidienne d'insuline à semaine 24 était plus faible chez les patients traités par sitagliptine (19 UI/jour, N=285) que chez les patients sous placebo (24 UI/jour, N=283). Cette différence était statistiquement significative (p=0,007).
Concernant les critères d'évaluation secondaires de l'étude, une réduction du taux d'HbA1c de -1,35% a été constatée chez les patients traités par sitagliptine, metformine et insuline contre -0,90% chez les patients sous placebo, metformine et insuline, soit une différence de -0,45% [IC à 95%: -0,62; -0,29]. La réduction de la FPG chez les patients traités par sitagliptine, metformine et insuline était de -3,0 mmol/l contre -2,4 mmol/l chez les patients sous placebo, metformine et insuline, soit une différence de -0,7 mmol/l [IC à 95%: -1,0; -0,3].
Étude contrôlée avec substance active (glipizide) en association avec la metformine
Les effets à long terme ont été examinés dans une étude randomisée de 52 semaines, effectuée en double aveugle avec contrôle par le glipizide auprès de patients diabétiques de type 2. Des patients n'ayant pas atteint un bon équilibre glycémique sous metformine (≥1500 mg par jour) ont reçu soit 100 mg par jour de sitagliptine (n = 588), soit du glipizide (n = 584) pendant 52 semaines. Les patients sous glipizide ont reçu une dose initiale de 5 mg par jour, puis la dose a été augmentée progressivement de façon sélective au cours des 18 semaines suivantes sans provoquer d'hypoglycémie significative, jusqu'à l'obtention d'un glucose plasmatique à jeun de <110 mg/dl. Une dose maximale de 20 mg par jour était autorisée pour un équilibre glycémique optimal. Par la suite, la dose de glipizide a été maintenue constante. La dose moyenne de glipizide après l'adaptation initiale a été de 10,3 mg.
Les deux traitements ont conduit à une amélioration statistiquement significative de l'équilibre glycémique en comparaison avec les valeurs initiales. À 52 semaines, la réduction du taux d'HbA1c par rapport à la valeur initiale était de 0,67% chez les patients traités par 100 mg de sitagliptine par jour et de 0,67% chez les patients traités par le glipizide. Ces résultats ont confirmé l'équivalence des deux principes actifs. La réduction de la glycémie à jeun a été de 0,56 mmol/l sous sitagliptine et de 0,42 mmol/l sous glipizide. Dans une analyse post hoc, les patients des deux groupes qui avaient présenté un taux initial plus élevé d'HbA1c (≥9%) ont bénéficié d'une réduction plus importante du taux d'HbA1c par rapport aux valeurs initiales (sitagliptine -1,68%; glipizide -1,76%). Le traitement par la sitagliptine a permis une réduction du rapport pro-insuline/insuline, un marqueur de la synthèse et de la sécrétion d'insuline. Sous glipizide, le rapport pro-insuline/insuline s'est aggravé. La fréquence des hypoglycémies a été significativement plus faible dans le groupe sous sitagliptine (4,9%) que dans le groupe sous glipizide (32,0%). Le poids corporel a baissé de façon significative chez les patients traités par la sitagliptine mais a augmenté significativement chez les patients traités par le glipizide (-1,5 kg vs +1,1 kg).
Chlorhydrate de metformine
L'étude prospective randomisée UKPDS a confirmé les avantages à long terme d'un contrôle intensif de la glycémie dans le diabète de type 2. L'analyse des résultats – obtenus chez des patients présentant une surcharge pondérale et traités à la metformine après qu'un régime alimentaire se fut avéré insuffisant à lui seul – a révélé:
·dans le groupe sous metformine, une réduction significative du risque absolu de subir une complication en rapport avec le diabète (29,8 événements sur 1000 patients-années) par rapport au régime alimentaire seul (43,3 événements sur 1000 patients-années), p = 0,0023, ainsi que par rapport aux groupes combinés sous monothérapie par sulfonylurée ou insuline (40,1 événements sur 1000 patients-années), p = 0,0034;
·une réduction significative du risque absolu de mortalité en rapport avec le diabète: metformine 7,5 décès sur 1000 patients-années, régime alimentaire seul 12,7 décès sur 1000 patients-années, p = 0,017;
·une réduction significative du risque absolu de mortalité totale: metformine 13,5 décès sur 1000 patients-années par rapport au régime alimentaire seul 20,6 sur 1000 patients-années (p = 0,011) et par rapport aux groupes combinés de monothérapie par sulfonylurée ou insuline 18,9 sur 1000 patients-années (p = 0,021);
·une réduction significative du risque absolu de subir un infarctus du myocarde: metformine 11 événements sur 1000 patients-années, régime alimentaire seul 18 décès sur 1000 patients-années (p = 0,01).
Étude de sécurité cardiovasculaire TECOS
L'étude TECOS (Trial Evaluating Cardiovascular Outcomes with Sitagliptin) était randomisée et incluait 14 671 patients de la population en intention de traiter présentant des valeurs HbA1c de ≥6,5 à 8,0% et une maladie cardiovasculaire documentée. Les patients ont reçu soit 100 mg par jour de sitagliptine (7332) (ou 50 mg par jour si le DFGe initial était ≥30 et <50 ml/min/1,73 m2), soit un placebo (7339), donné en complément du traitement conventionnel avec des valeurs cibles correspondant aux standards régionaux en termes d'HbA1c et de facteurs de risque cardiovasculaire. Les patients présentant un DFGe <30 ml/min/1,73 m2 n'ont pas été inclus dans l'étude. L'étude incluait 2004 patients âgés de ≥75 ans et 3324 patients insuffisants rénaux (DFGe <60 ml/min/1,73 m2).
Les patients du groupe sitagliptine ont reçu moins d'antihyperglycémiants que ceux du groupe placebo (Hazard Ratio 0,72; IC à 95%, 0,68-0,77; p ≤0,001). Par ailleurs, les patients ne recevant pas d'insuline au début de l'étude étaient moins susceptibles de démarrer une insulinothérapie chronique (Hazard Ratio 0,70; IC à 95%, 0,63-0,79; p <0,001). Le critère d'évaluation cardiovasculaire primaire était composé de la première survenue d'un décès d'origine cardiovasculaire, d'un infarctus du myocarde non fatal, d'un accident vasculaire cérébral (AVC) non fatal ou d'une hospitalisation en raison d'une angine de poitrine instable. Les critères d'évaluation cardiovasculaires secondaires étaient la première survenue d'un décès d'origine cardiovasculaire, d'un infarctus du myocarde non fatal ou d'un AVC non fatal; la première survenue d'un des composants du critère d'évaluation primaire; la mortalité totale; et les hospitalisations en raison d'une insuffisance cardiaque.
Après une période d'observation médiane de trois ans, le risque d'événements cardiovasculaires indésirables sévères ou d'hospitalisation en raison d'une insuffisance cardiaque n'a pas augmenté lorsque la sitagliptine était administrée chez les patients diabétiques de type 2 en complément du traitement conventionnel (tableau 6).
Tableau 6:
Taux d'événements cardiovasculaires et événements secondaires importants
|
|
Sitagliptine 100 mg
|
Placebo
|
Hazard Ratio
(IC à 95%)
|
Valeur p†
| |
N (%)
|
Taux d'incidence pour 100 patients-années*
|
N (%)
|
Taux d'incidence pour 100 patients-années
| |
Analyse de la population en intention de traiter
| |
Nombre de patients
|
7332
|
7339
|
0,98 (0,89-1,08)
|
<0,001
| |
Critère d'évaluation primaire composite
(décès cardiovasculaire, infarctus du myocarde non fatal, AVC non fatal ou hospitalisation en raison d'une angine de poitrine instable)
|
839 (11,4)
|
4,1
|
851 (11,6)
|
4,2
| |
Critère d'évaluation secondaire composite
(décès cardiovasculaire, infarctus du myocarde non fatal ou AVC non fatal)
|
745 (10,2)
|
3,6
|
746 (10,2)
|
3,6
|
0,99 (0,89-1,10)
|
<0,001
| |
Événements secondaires
| |
Décès cardiovasculaires
|
380 (5,2)
|
1,7
|
366 (5,0)
|
1,7
|
1,03 (0,89-1,19)
|
0,711
| |
Tous les infarctus du myocarde (fatals et non fatals)
|
300 (4,1)
|
1,4
|
316 (4,3)
|
1,5
|
0,95 (0,81-1,11)
|
0,487
| |
Tous les AVC (fatals et non fatals)
|
178 (2,4)
|
0,8
|
183 (2,5)
|
0,9
|
0,97 (0,79-1,19)
|
0,760
| |
Hospitalisations en raison d'une angine de poitrine instable
|
116 (1,6)
|
0,5
|
129 (1,8)
|
0,6
|
0,90 (0,70-1,16)
|
0,419
| |
Décès toutes causes
|
547 (7,5)
|
2,5
|
537 (7,3)
|
2,5
|
1,01 (0,90-1,14)
|
0,875
| |
Hospitalisations en raison d'une insuffisance cardiaque‡
|
228 (3,1)
|
1,1
|
229 (3,1)
|
1,1
|
1,00 (0,83-1,20)
|
0,983
|
* Le taux d'incidence pour 100 patients-années a été calculé selon la formule 100× (nombre total de patients présentant ≥1 événement pendant la période d'exposition décisive sur le nombre total de patients-années de l'observation).† D'après le modèle de Cox stratifié par région. Pour les critères d'évaluation composites, les valeurs p correspondent à un test de non-infériorité dont l'objectif est de montrer que le Hazard Ratio est inférieur à 1,3. Pour tous les autres critères d'évaluation, les valeurs p correspondent à un test de différence des Hazard Rates.‡ L'analyse des hospitalisations en raison d'une insuffisance cardiaque a été ajustée pour l'antécédent d'insuffisance cardiaque à l'inclusion dans l'étude.
Traitement d'appoint par la sitagliptine chez les patients pédiatriques présentant un contrôle insuffisant avec la metformine avec ou sans insuline
Au total, 220 patients pédiatriques âgés de 10 à 17 ans, atteints de diabète de type 2 et présentant un contrôle glycémique insuffisant avec la metformine avec ou sans insuline ont participé à deux études randomisées en double aveugle, contrôlées par placebo, en groupes parallèles, pendant 54 semaines. L'administration supplémentaire de 100 mg de sitagliptine (administrée sous forme de sitagliptine + metformine ou de sitagliptine + metformine à libération prolongée [XR]) a été comparée avec l'administration de placebo en supplément de la metformine ou de la metformine XR.
Bien qu'une analyse poolée de ces deux études à la semaine 20 ait montré une supériorité en termes de baisse du taux d'HbA1c pour sitagliptine + metformine / sitagliptine + metformine XR par rapport à la metformine, les résultats des différentes études étaient incohérents. Par ailleurs, l'efficacité de sitagliptine + metformine ou de sitagliptine + metformine XR n'était pas supérieure à celle de la metformine à la semaine 54. Janumet ne doit donc pas être utilisé chez les patients pédiatriques âgés de 10 à 17 ans en raison de son efficacité insuffisante.
Dans les études cliniques réalisées avec la sitagliptine chez des patients pédiatriques âgés de 10 à 17 ans atteints de diabète sucré de type 2, le profil d'effets indésirables était généralement comparable à celui observé chez les adultes. Chez les patients pédiatriques traités ou non par de l'insuline basale, la sitagliptine était associée à un risque accru d'hypoglycémies.
|



