CompositionPrincipes actifs
Altéplase (produite par la technique de l'ADN recombinant dans une lignée cellulaire d'ovaire de hamster chinois (CHO)).
Excipients
·Dans le flacon de lyophilisat: Argininum, Acidum phosphoricum, Polysorbatum 80.
Indications/Possibilités d’emploiPour la recanalisation (pour l'aspiration de sang et la perfusion de solutions) de cathéters veineux centraux occlus par un thrombus, y compris ceux utilisés dans l'hémodialyse.
Le flacon de 2 mg d'altéplase est la seule présentation recommandée pour cette indication.
Posologie/Mode d’emploiL'utilisation d'Actilyse Cathflo 2 mg doit intervenir aussi rapidement que possible après une occlusion thrombotique des cathéters à chambre, des cathéters à lumière unique ou multiple, y compris les cathéters d'hémodialyse. Une deuxième dose peut être instillée si la perméabilité de l'accès veineux central ne peut pas être restaurée au bout de 120 minutes après la première dose.
Posologie
Chez les patients pesant 30 kg ou plus, chaque instillation doit comporter une dose totale allant jusqu'à 2 mg d'altéplase dans 2 ml de solution reconstituée.
Chez les patients d'un poids corporel inférieur à 30 kg, le volume de la solution d'altéplase reconstituée devant être instillé dans l'accès veineux central obstrué doit correspondre à 110 % du volume de la lumière interne de l'accès et la dose totale d'altéplase par instillation ne doit pas dépasser 2 mg.
Mode d'emploi
La solution reconstituée est instillée dans la lumière de l'accès veineux central obstrué. La solution reconstituée est destinée à l'usage immédiat.
Instructions pour l'instillation de la solution d'Actilyse Cathflo 2 mg:
1.Reconstituer le contenu d'un flacon afin d'obtenir une concentration finale de 1 mg d'altéplase par ml (voir «Remarques concernant la manipulation»: mode d'emploi pour la reconstitution d'Actilyse Cathflo 2 mg). Pour les cathéters dont la lumière est d'un volume supérieur à 2 ml, la solution reconstituée peut être diluée davantage avec une solution stérile de chlorure de sodium 0,9 % pour préparations injectables afin d'obtenir le volume désiré (voir le mode d'emploi pour la reconstitution d'Actilyse Cathflo 2 mg sous « Remarques particulières »).
2.Instiller la dose appropriée d'altéplase dans l'accès veineux central obstrué.
3.Après 30 minutes de contact, évaluer la fonctionnalité du cathéter en essayant d'aspirer du sang. Si la perméabilité du cathéter est rétablie, poursuivre à l'étape 6. Si le cathéter est toujours obstrué, poursuivre à l'étape 4.
4.Après 120 minutes de contact, évaluer la fonctionnalité du cathéter en essayant d'aspirer du sang et le contenu du cathéter. Si la perméabilité du cathéter est rétablie, poursuivre à l'étape 6. Si le cathéter est toujours obstrué, poursuivre à l'étape 5.
5.Si la fonctionnalité du cathéter n'est pas rétablie après la première dose, une seconde dose équivalente peut être instillée. Répéter l'ensemble de la procédure depuis l'étape 1. Si après la seconde dose d'altéplase la fonctionnalité du cathéter n'est toujours pas rétablie, envisager la mise en place d'un nouvel accès.
6.Si la perméabilité du cathéter a été restaurée, aspirer 4-5 ml de sang (chez les patients pesant au moins 10 kg) ou 3 ml (chez les patients pesant moins de 10 kg) afin de retirer Actilyse Cathflo 2 mg et le caillot résiduel. Irriguer ensuite lentement le cathéter avec une solution stérile de chlorure de sodium (0,9 %) pour préparations injectables.
Traçabilité
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Enfants et adolescents
Le schéma posologique général décrit ci-dessus s'applique aux enfants et aux adolescents.
Contre-indicationsHypersensibilité au principe actif altéplase ou à l'un des excipients.
Mises en garde et précautionsLes causes non thrombotiques de l'occlusion du cathéter doivent être exclues avant l'utilisation d'Actilyse Cathflo 2 mg, entre autres:
·mauvais positionnement
·compression du cathéter
·précipités
La présentation d'altéplase appropriée doit être choisie avec soin en fonction de l'usage. Le flacon de lyophilisat à 2 mg n'est pas approprié à l'utilisation dans les indications infarctus du myocarde aigu, embolie pulmonaire aiguë ou accident vasculaire cérébral ischémique aigu (du fait d'un risque de sous-dosage considérable). Pour ces indications, seuls les flacons de 10 mg, 20 mg et 50 mg d'altéplase sont indiqués.
Mises en garde et précautions particulières pour le traitement des accès veineux centraux occlus:
Utilisation en association à l'héparine:
L'utilisation concomitante d'héparine avec Actilyse Cathflo 2 mg n'a pas mis en évidence une amélioration du taux de restauration de la fonction du cathéter et est, par conséquent, déconseillée. Si l'héparine est considérée nécessaire pour empêcher une nouvelle occlusion, celle-ci doit être utilisée séparément après la restauration de la fonction du cathéter.
Lésion de la paroi vasculaire et affaissement du cathéter:
Outre la formation d'un thrombus, différentes autres causes peuvent être à l'origine d'un dysfonctionnement du cathéter, telles qu'un mauvais positionnement du cathéter, une défaillance mécanique, une constriction due à une suture ou des dépôts lipidiques, resp. des précipités de restes de médicaments à l'intérieur de la lumière du cathéter. En raison du risque de lésions de la paroi vasculaire ou d'affaissement de la paroi des cathéters souples, il faut éviter de procéder à des aspirations vigoureuses lors de l'évaluation de la perméabilité du cathéter. Toute pression excessive doit être évitée lors de l'instillation d'Actilyse Cathflo 2 mg dans le cathéter. Une trop forte pression peut provoquer la rupture du cathéter ou l'expulsion du caillot dans la circulation.
Une prudence particulière est de rigueur lorsque des seringues de petit volume (≤1 ml) sont utilisées pour l'instillation, en particulier lorsqu'il s'agit de cathéters de petit volume tels qu'ils sont généralement utilisés en pédiatrie.
Saignements:
L'effet indésirable le plus fréquent, associé à tous les thrombolytiques, dans l'ensemble des indications autorisées est le saignement. Actilyse Cathflo 2 mg n'a pas été étudié chez les patients avec un cathéter occlus, connus pour présenter des risques d'événements hémorragiques susceptibles d'être associés à l'utilisation de thrombolytiques. La prudence est de rigueur chez les patients présentant des saignements internes actifs ou ayant subi l'une des interventions suivantes dans les 48 heures précédant l'instillation: chirurgie, accouchement, biopsie percutanée de viscères ou de tissus profonds, ou ponction de vaisseaux non compressibles. La prudence est également de rigueur chez les patients présentant une thrombocytopénie, d'autres anomalies hémostatiques (notamment les anomalies secondaires à une affection hépatique ou rénale sévère), ou tout autre état pour lequel les saignements constituent un risque significatif ou sont susceptibles d'être particulièrement difficiles à prendre en charge en raison de sa localisation, ou présentant un risque élevé de complications emboliques (p.ex. thrombose veineuse localisée près du cathéter). Des cas de décès et d'invalidité permanente ont également été signalés chez des patients qui ont présenté un accident vasculaire cérébral ou d'autres événements hémorragiques graves lors d'une administration de doses pharmacologiques d'un thrombolytique. En cas de survenue d'un saignement grave localisé à un emplacement critique (p.ex. intracrânien, gastro-intestinal, rétropéritonéal, péricardique), le traitement par Actilyse Cathflo 2 mg doit être arrêté et la solution instillée retirée du cathéter.
Infections:
L'utilisation d'Actilyse Cathflo 2 mg chez les patients dont les cathéters sont obstrués par des thrombi infectés est susceptible de libérer des micro-organismes dans la circulation générale, conduisant à une septicémie.
Comme pour toutes les opérations de cathétérisme, une technique d'asepsie doit être soigneusement maintenue et un traitement antibiotique adapté doit être utilisé, si nécessaire.
Administration répétée:
Par événement occlusif, une dose unitaire d'altéplase de maximum 2 mg peut être utilisée jusqu'à deux fois (4 mg au total) (voir «Posologie/Mode d'emploi»). La dose totale d'altéplase ne doit pas dépasser 2 mg dans le cas d'un poids corporel inférieur à 30 kg. En cas de persistance d'un mauvais fonctionnement du cathéter, d'autres causes expliquant ce dysfonctionnement doivent être recherchées. Les occlusions ultérieures pourront être traitées de façon similaire ; il convient cependant de noter que la survenue fréquente de nouvelles occlusions peut indiquer la nécessité d'un remplacement du cathéter.
Hypersensibilité:
La formation d'anticorps chez les patients qui ont reçu une ou plusieurs doses d'altéplase dans la restauration des accès veineux centraux dysfonctionnels n'a pas été étudiée.
Des réactions d'hypersensibilité associées à l'utilisation d'Actilyse Cathflo 2 mg peuvent être provoquées par le principe actif altéplase ou l'un des excipients (voir «Contre-indications»).
En cas d'apparition d'une réaction d'hypersensibilité sévère, l'instillation doit être interrompue et un traitement approprié doit être instauré immédiatement.
Il n'existe pas de données suffisantes concernant l'emploi chez les enfants de moins de 2 ans.
InteractionsAucune étude d'interaction formelle n'a été menée avec Actilyse Cathflo 2 mg.
Médicaments agissant sur la coagulation/la fonction plaquettaire
Les médicaments qui influencent la coagulation ou la fonction plaquettaire peuvent accroître le risque d'hémorragie avant, pendant ou après le traitement par Actilyse Cathflo 2 mg.
Inhibiteurs de l'ECA
Le traitement concomitant par inhibiteurs de l'ECA peut augmenter le risque d'une réaction d'hypersensibilité.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'emploi d'Actilyse Cathflo chez la femme enceinte. Les études expérimentales réalisées chez l'animal avec des doses plus élevées que celles utilisées chez l'humain ont montré non seulement les effets pharmacologiques connus, mais également des troubles du développement fœtal et/ou une embryotoxicité (voir «Données précliniques»).
En cas de maladie aiguë menaçant le pronostic vital, il convient d'évaluer le bénéfice par rapport au risque potentiel.
Allaitement
On ignore si l'altéplase est excrétée dans le lait maternel.
Fertilité
On ne dispose pas de données sur Actilyse Cathflo 2 mg concernant la fertilité. Des études non cliniques portant sur l'altéplase n'ont révélé aucun effet négatif sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesLa fréquence des effets indésirables est déterminée en utilisant la convention MedDRA*.
*Convention MedDRA:
Très fréquents ≥1/10
Fréquents ≥1/100 - <1/10
Occasionnels ≥1/1'000 - <1/100
Rares ≥1/10'000 - <1/1'000
Très rares < 1/10'000 y compris les cas isolés.
En principe, tous les effets indésirables survenant en cas d'administration systémique d'altéplase (voir l'information professionnelle d'Actilyse) peuvent aussi survenir en cas de traitement de cathéters occlus lorsque Actilyse Cathflo 2 mg pénètre dans la circulation générale (p.ex. hémorragies, embolies, réactions d'hypersensibilité, réactions anaphylactoïdes, diminution de la pression artérielle, nausées, vomissements, augmentation de la température corporelle), bien qu'à cette dose aucune concentration plasmatique physiologiquement importante ne soit atteinte. Cependant, les données pharmacocinétiques indiquent que, dans le cadre d'un usage correct, des concentrations plasmatiques notables sur le plan physiologique ne devraient pas être atteintes. Dans les études cliniques menées dans le traitement des cathéters occlus avec Actilyse Cathflo 2 mg, les effets indésirables suivants ont été observés:
Infections et Infestations
Occasionnels: septicémie.
Troubles généraux et anomalies au site d'administration
Occasionnels: complications liées au cathéter.
Rares: pyrexie.
Lors de l'utilisation systémique d'Actilyse, c.-à-d. à des doses élevées en cas d'indication thromboembolique, les effets indésirables suivants ont été observés:
Troubles du système immunitaire
Réactions anaphylactoïdes qui sont généralement d'intensité légère, mais qui peuvent dans certains cas menacer le pronostic vital. Les symptômes suivants peuvent survenir: éruption cutanée, urticaire, bronchospasme, œdème de Quincke, hypotension, choc et tout autre symptôme associé à une réaction d'hypersensibilité.
Les troubles du système immunitaire qui ont été mentionnés sont considérés comme dose-dépendants et n'ont jusqu'à présent pas été observés dans les études cliniques portant sur Actilyse Cathflo 2 mg.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSymptômes
Bien que l'altéplase soit un agent relativement spécifique de la fibrine, un surdosage peut entraîner une diminution marquée du fibrinogène et d'autres facteurs de coagulation.
Traitement
En règle générale, on pourra attendre la reprise physiologique de la synthèse de ces facteurs, après l'arrêt du traitement par l'altéplase. Si une hémorragie massive venait à se manifester dans ce contexte, on aura recours à du plasma frais congelé ou à du sang frais, et, pour autant que ce soit nécessaire, également à des antifibrinolytiques de synthèse.
Propriétés/EffetsCode ATC
B01AD02
Mécanisme d'action / Pharmacodynamique
L'altéplase est une glycoprotéine humaine recombinante qui active directement la conversion du plasminogène en plasmine. Après administration IV, l'altéplase reste pratiquement inactive dans la circulation jusqu'à sa fixation sur la fibrine du thrombus. Activé par sa fixation à la fibrine, l'altéplase induit la conversion du plasminogène en plasmine, provoquant ainsi la lyse du caillot de fibrine.
En raison de la relative spécificité de l'altéplase pour la fibrine, l'administration d'une dose totale de 100 mg entraîne une diminution modérée des valeurs de fibrinogène circulant à env. 60 % au bout de 4 heures, mais avec un rétablissement à 80 % au bout de 24 heures. Les concentrations de plasminogène et d'alpha-2-antiplasmine chutent à 20 %, respectivement 35 % après 4 heures ; elles remontent au bout de 24 heures jusqu'à plus de 80 %. Une diminution marquée et prolongée des taux sanguins de fibrinogène ne s'observe que chez un petit nombre de patients.
Efficacité clinique
Accès veineux centraux occlus, y compris ceux utilisés dans l'hémodialyse:
Lors de deux études cliniques, plus de 1100 patients, principalement adultes, présentant des problèmes de dispositifs d'accès veineux central ne fonctionnant pas correctement ont été traités par l'altéplase. Les taux de rétablissement de la fonction du cathéter ont été compris entre 74 % et 77 % après une dose et entre 87 % et 90 % après deux doses d'altéplase. Le taux de réocclusion était de 26 %.
Dans les études portant sur les cathéters utilisés dans l'hémodialyse, faisant appel à des durées comprises entre plus de 2 heures et le temps écoulé jusqu'à la séance de dialyse suivante, des taux de rétablissement comparables ont été rapportés.
Population pédiatrique
Dans une étude portant sur 310 enfants, le taux global de rétablissement de la perméabilité du cathéter de 83 % a été similaire au taux observé chez les adultes après deux doses maximum d'altéplase.
Dans les études pivots évaluant le rétablissement de la perméabilité des cathéters, un total de 432 patients âgés de moins de 17 ans ont reçu une dose pouvant atteindre 2 mg d'altéplase administrée jusqu'à deux fois au maximum. Les résultats globaux de sécurité et d'efficacité ont été similaires chez les patients pédiatriques et adultes.
PharmacocinétiqueDistribution
Le temps de demi-vie pertinente T½ alpha est de 3,5 à 5 minutes, ce qui signifie qu'après 20 minutes, moins de 10% de la dose administrée se retrouvent dans le plasma. On a mesuré un temps de demi-vie bêta d'environ 40 minutes pour la fraction résiduelle du compartiment profond.
Le volume de distribution est de 2,8 à 4,4 litres (V1), respectivement de 8 à 9 litres (Vss).
Élimination
L'altéplase est rapidement éliminée de la circulation sanguine; elle est principalement métabolisée par voie hépatique (clairance plasmatique de 550 à 680 ml/min).
En cas d'utilisation correcte d'altéplase en vue du rétablissement de la fonction d'un accès veineux central occlus, il ne faut pas s'attendre à ce que les taux plasmatiques d'altéplase circulante atteignent des concentrations efficaces sur le plan pharmacologique. Si une dose de 2 mg d'altéplase devait être injectée directement dans la circulation systémique par une injection sous forme de bolus (au lieu d'être instillée dans le cathéter), il faudrait s'attendre à ce que la concentration en altéplase circulante revienne en dessous de la limite décelable dans les 30 à 60 minutes.
Données précliniquesMutagénicité
Les tests de mutagénicité n'ont pas mis en évidence de potentiel mutagène.
Toxicité sur la reproduction
Aucun effet tératogène n'a été observé après perfusion intraveineuse de doses pharmacologiquement actives chez des animaux gravides. L'administration de plus de 3 mg/kg/jour a induit une embryotoxicité (mortalité embryonnaire, retard de croissance) chez les lapins. Chez les rats, aucun effet sur le développement périnatal et postnatal ou sur les paramètres de fertilité n'a été observé à des doses allant jusqu'à 10 mg/kg/jour.
Remarques particulièresIncompatibilités
La solution reconstituée de 1 mg/ml ne doit pas être diluée davantage avec de l'eau pour préparations injectables ou des solutions de perfusion contenant des hydrates de carbone (p.ex. le dextrose) en raison de l'augmentation de la turbidité de la solution reconstituée (voir également la rubrique « Remarques concernant la manipulation »).
Actilyse Cathflo 2 mg ne doit ni être mélangé avec d'autres médicaments ni être administré dans le même cathéter (également valable pour l'héparine).
Stabilité et remarques particulières concernant le stockage
A conserver dans l'emballage d'origine afin de protéger le contenu de la lumière.
Conserver au réfrigérateur (2 – 8°C).
Tenir hors de la portée et de la vue des enfants.
Une stabilité chimique et physique de 24 heures à 2-8 °C et de 8 heures à 30 °C a été démontrée pour la solution reconstituée.
En raison des risques de contamination microbiologique, il est recommandé d'utiliser la solution immédiatement après sa reconstitution. Si la reconstitution a été effectuée dans des conditions d'asepsie, la conservation ne doit généralement pas excéder 24 heures à 2-8 °C.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention « EXP » sur le récipient.
Remarques concernant la manipulation
Le contenu d'un flacon de lyophilisat d'Actilyse Cathflo 2 mg doit être dilué avec 2,2 ml d'eau pour préparations injectables dans des conditions aseptiques, de manière à obtenir une concentration de 1 mg d'altéplase par millilitre. Chaque flacon contient un excédent afin d'assurer le prélèvement de 2 mg d'altéplase dans 2 ml. Le solvant doit être introduit avec une seringue avec une précision de mesure adaptée (p.ex. graduée en 0,1 ml) dans le flacon contenant le principe actif.
|
Instructions pour la reconstitution d'Actilyse Cathflo 2 mg
| |
1
|
Procéder à la reconstitution immédiatement avant l'utilisation.
|
|
| |
2
|
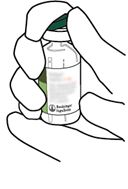
Retirer le capuchon protecteur du flacon de lyophilisat d'Actilyse Cathflo 2 mg en soulevant le capuchon avec le pouce.
|
|
| |
3
|
Essuyer le haut du bouchon en caoutchouc à l'aide d'un tampon imbibé d'alcool.
|
|

| |
4
|
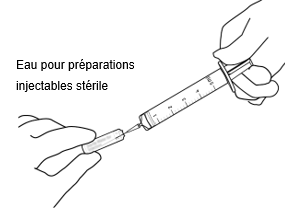
Dans des conditions aseptiques, prélever 2,2 ml d'eau pour préparations injectables stérile au moyen d'une seringue.
|
|
| |
5
|
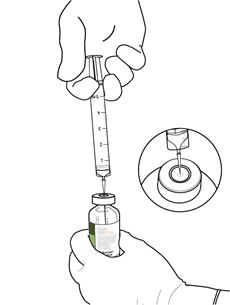
Introduire l'aiguille en position verticale au centre du bouchon en caoutchouc du flacon de poudre d'Actilyse Cathflo 2 mg et injecter 2,2 ml d'eau pour préparations injectables stérile dans le flacon.
|
|
| |
6
|
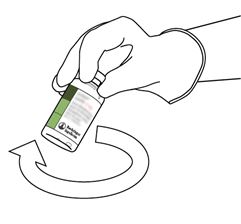
Avec la main, remuer doucement le flacon avec la solution d'Actilyse Cathflo 2 mg reconstituée afin de dissoudre la poudre restante. Ne pas agiter afin d'éviter la formation de mousse.
En cas de formation de bulles, laisser reposer la solution quelques minutes et attendre la disparition des bulles.
|
|
|

| |
7
|
La solution reconstituée se compose de 1 mg/ml d'altéplase. Elle doit être limpide et incolore, voire jaune pâle et ne doit pas contenir de particules.
| |
8
|
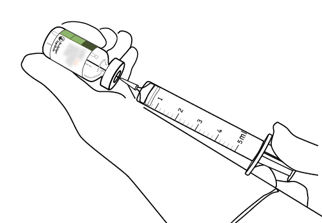
Prélever la quantité nécessaire en utilisant une seringue et une aiguille.
|
|
| |
9
|
Utiliser immédiatement (voir ci-dessous si une dilution supplémentaire de la solution reconstituée est envisagée).
Éliminer toute solution non utilisée.
|
La solution reconstituée de 1 mg/ml doit être examinée visuellement avant usage quant à sa couleur et à la présence de particules.
La solution reconstituée de 1 mg/ml peut encore être diluée avec une solution de chlorure de sodium de 9 mg/ml stérile (0,9 %) jusqu'à une concentration minimale de 0,2 mg/ml.
La survenue d'une turbidité de la solution prête à l'emploi ne peut pas être exclue en cas de dilution supplémentaire.
Numéro d’autorisation58665 (Swissmedic)
PrésentationEmballage de 5 flacons à 2 mg de principe actif.
Catégorie de remise: B
Titulaire de l’autorisationBoehringer Ingelheim (Schweiz) GmbH, Bâle
Mise à jour de l’informationOctobre 2023
|








