CompositionPrincipes actifs
Leuprorelini acetas.
Excipients
Microcapsules retard: Mannitolum, Acidum polylacticum (PLA).
Compartiment avec le solvant (1 ml): Mannitolum, Carmellosum natricum corresp. sodium max. 0,54 mg/ml, Polysorbatum 80, Acidum aceticum glaciale, Aqua ad injectabilia.
Indications/Possibilités d’emploiTraitement symptomatique du carcinome de la prostate hormono-dépendant à un stade avancé. Comme traitement alternatif lorsqu'une orchitectomie ou d'autres mesures thérapeutiques médicales ne sont pas indiquées ou encore ne sont pas raisonnablement applicables aux patients.
Posologie/Mode d’emploiL'administration de Lucrin Dépôt 6 mois en cas de cancer de la prostate ne doit s'effectuer que sous la surveillance d'un médecin expérimenté en oncologie.
Le site d'injection est à changer chaque fois (plis abdominaux, fesses, cuisses).
Posologie usuelle
Tous les six mois, 1 seringue à double compartiment de 30,0 mg d'acétate de leuproréline par voie sous-cutanée.
En phase initiale de traitement, l'administration complémentaire d'un anti-androgène approprié est recommandée afin d'atténuer les conséquences éventuelles de l'élévation initiale de la testostérone et l'aggravation des symptômes cliniques. Le traitement par un analogue de la GnRH chez les patients présentant un cancer de la prostate est normalement poursuivi même après apparition d'une résistance à la castration. Il convient de respecter les directives pertinentes.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique et rénale
Une adaptation de la dose n'est pas nécessaire (cf. «Pharmacocinétique»).
Patients âgés
Une adaptation de la dose en fonction de l'âge n'est pas nécessaire.
Enfants et adolescents
L'efficacité et la sécurité d'emploi de Lucrin Dépôt 6 mois n'ont pas été évaluées chez l'enfant et l'adolescent. Il n'y a aucune indication à l'administration du produit dans ce groupe d'âge.
Contre-indicationsHypersensibilité au principe actif, aux non peptidiques ou décapeptides similaires ou à l'un des excipients indiqués dans la composition.
Lucrin n'est pas indiqué en cas de carcinome prostatique non hormono-dépendant avéré.
Mises en garde et précautionsL'injection intra-artérielle doit absolument être évitée.
Apoplexie hypophysaire:
Pendant la surveillance du marché (pharmacovigilance), de rares cas d'apoplexie hypophysaire (syndrome clinique secondaire d'un infarctus de l'hypophyse) ont été rapportés après l'administration d'agonistes de la GnRH (Gonadotropin-Releasing-Hormon). Dans la plupart de ces cas, un adénome de l'hypophyse a été diagnostiqué. La majorité de ces cas d'apoplexie hypophysaire sont survenus dans un délai de deux semaines, quelques-uns au cours de la première heure après l'administration de la première dose. L'apoplexie hypophysaire s'est alors manifestée par des céphalées brutales, des vomissements, des anomalies visuelles, une ophtalmoplégie, une modification de l'état mental et parfois un collapsus cardio-vasculaire. Le recours immédiat à un traitement médical a été nécessaire.
C'est la raison pour laquelle l'administration d'un agoniste de la GnRH n'est pas indiquée en cas d'adénome hypophysaire connu.
Risque de suicide:
Les patients qui présentent une dépression préexistante peuvent présenter un risque de suicide.
Densité osseuse/risque de fracture:
Les agonistes de la GnRH peuvent entraîner une réduction de la minéralisation osseuse. Le risque de fracture peut être augmenté par une carence en androgènes qui résulte du traitement du cancer de la prostate.
Convulsions:
Dans le cadre de la surveillance du marché, on a rapporté la survenue de convulsions, en particulier chez la femme et l'enfant. Il s'agissait à cet égard en partie de patients qui présentaient d'autres facteurs de risque de convulsions (comme par exemple, anamnèse d'épilepsie, tumeur intracrânienne, comédication avec des médicaments pour lesquels un risque de convulsions est connu). Toutefois, il existe également des rapports de patients qui ne présentent pas ces facteurs de risque.
Réactions d'hypersensibilité retardées:
Des réactions d'hypersensibilité retardées, y compris des réactions cutanées graves (SCAR) du syndrome de Stevens-Johnson (SSJ) et de la nécrolyse épidermique toxique (NET), ont été très rarement rapportées après la commercialisation en lien avec un traitement par acétate de leuproréline (voir «Effets indésirables»). Dès les premiers signes ou symptômes d'une réaction d'hypersensibilité retardée, le traitement par acétate de leuproréline doit être interrompu et les patients doivent être traités conformément à la pratique clinique habituelle.
Modifications métaboliques:
L'administration d'un traitement de privation androgénique (TPA), y compris des agonistes de la GnRH, peut être associée à un risque accru de modifications du métabolisme, tels que l'hyperglycémie, le diabète, l'hyperlipidémie et la stéatose hépatique non alcoolique (NAFLD). L'hyperglycémie peut impliquer le développement d'un diabète ou une dégradation du contrôle glycémique chez les patients diabétiques. Les patients qui reçoivent un agoniste de la GnRH doivent être surveillés pour déceler toute apparition de signes et symptômes du syndrome métabolique, y compris par un contrôle des lipides, de la glycémie et/ou de l'hémoglobine glyquée (HbA1c), et être traités conformément à la pratique clinique habituelle (voir «Effets indésirables»).
Facteurs de risque cardio-vasculaire/maladies cardio-vasculaires:
Sous traitement par agonistes de la GnRH, on a rapporté un risque accru de diabète sucré et/ou d'événements cardio-vasculaires. En particulier, dans plusieurs études épidémiologiques importantes chez des patients présentant un cancer de la prostate, on a observé un risque accru de 20 % environ d'infarctus du myocarde et d'accident vasculaire cérébral. Chez les patients chez lesquels d'autres facteurs de risque cardio-vasculaire (par exemple, hypertension artérielle, hyperlipidémie) existent ou qui présentent des maladies cardio-vasculaires préexistantes, une évaluation soigneuse du rapport bénéfice/risque doit être effectuée.
Avant l'instauration d'un traitement par la leuproréline, la pression artérielle, la glycémie et le profil lipidique doivent être déterminés. Pendant le traitement, une surveillance s'impose chez les patients pour lesquels ces facteurs de risque ainsi que les symptômes pouvant y être liés laissent présumer du développement d'une maladie cardio-vasculaire. Des facteurs de risque déjà présents (diabète sucré, hypercholestérolémie, hypertension artérielle) doivent être traités de façon appropriée, c'est-à-dire selon chacune des directives.
Effet sur l'intervalle QT:
La privation androgénique peut prolonger l'intervalle QT. Chez les patients présentant des antécédents ou des facteurs de risques de l'allongement de l'intervalle QT ainsi que chez les patients recevant de manière concomitante des médicaments susceptibles d'allonger l'intervalle QT (voir «Interactions»), il faut évaluer le rapport bénéfice-risque en tenant compte du risque potentiel de torsades de pointe avant d'initier un traitement par acétate de leuproréline.
De plus, en relation avec l'utilisation d'agonistes de la GnRH, on a rapporté chez l'homme un risque accru de mort subite d'origine cardiaque.
Pendant la première semaine de traitement par Lucrin Dépôt 6 mois, il se produit une augmentation de courte durée du taux sérique de testostérone, pouvant entraîner une aggravation passagère des symptômes de la maladie comme une augmentation des douleurs osseuses pouvant être traitées de façon symptomatique, une faiblesse musculaire dans les jambes ou un lymphœdème. Dans des cas isolés, on a rapporté la survenue d'une obstruction des voies urinaires et d'une compression de la colonne vertébrale pouvant entraîner une paralysie, accompagnée éventuellement d'une issue fatale. Les patients qui présentent un risque de complications neurologiques, des métastases vertébrales ou une obstruction des voies urinaires doivent de ce fait, autant que possible, rester sous observation constante à l'hôpital pendant les premières semaines du traitement.
L'augmentation initiale des douleurs rétrocède spontanément généralement sans arrêt du traitement par Lucrin Dépôt 6 mois. Par la suite, surviennent des symptômes liés au sevrage de la testostérone (cf. «Effets indésirables»).
Des évaluations périodiques du taux sérique de testostérone et de l'antigène prostatique spécifique sont conseillés pour exclure un échappement dans la deuxième moitié de l'intervalle de traitement, en particulier lorsque l'effet clinique et l'effet biochimique attendus ne semble pas être atteints (par exemple en cas d'amélioration des effets indésirables de la castration ou signes d'une progression tumorale).
Après castration chirurgicale, Lucrin n'entraîne aucune diminution supplémentaire du taux de testostérone.
En cas de réactions locales prononcées, la résorption de la leuproréline à partir du dépôt peut être diminuée. Dans ce cas, le taux de testostérone doit être déterminé.
Pseudotumor cerebri / hypertension intracrânienne idiopathique:
Chez les patients traités par acétate de leuproréline, la survenue de cas de pseudotumor cerebri (PTC) / hypertension intracrânienne idiopathique a été rapportée. Les patients doivent être surveillés pour déceler les symptômes de PTC, y compris les maux de tête, les œdèmes papillaires, la vision trouble, la vision double, la perte de vue, les douleurs derrière les yeux ou en cas de mouvement oculaire, les acouphènes, les vertiges et les nausées. Il convient d'adresser les patients à un ophtalmologue afin de confirmer le diagnostic d'œdème papillaire. Si le diagnostic de PTC est confirmé, il convient de traiter le patient conformément aux directives thérapeutiques et d'arrêter durablement l'utilisation de l'acétate de leuproréline.
Utilisation chez l'enfant et l'adolescent
La sécurité d'emploi et l'efficacité de Lucrin Dépôt 6 mois n'ont pas été évaluées chez l'enfant et l'adolescent.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par seringue préremplie à double compartiment, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsAucune connue à ce jour.
Aucune étude de Lucrin Dépôt 6 mois portant sur les interactions n'a eu lieu. Le métabolisme de Lucrin Dépôt 6 mois rend des interactions peu probables, la biotransformation de ce principe actif s'effectuant essentiellement par des peptidases et non par la voie du cytochrome P 450 et une liaison aux protéines plasmatiques faible de 46% environ persiste.
Cancer de la prostate
Puisqu'une privation androgénique peut entraîner une prolongation de l'intervalle QT, il faut soigneusement évaluer le risque d'une administration concomitante d'acétate de leuproréline et de médicaments pouvant provoquer des torsades de pointes comme les antiarythmiques de la classe IA (p.ex. quinidine, disopyramide) ou de la classe III (p.ex. amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc. Voir «Mises en garde et précautions», Effets sur l'intervalle QT.
Grossesse, allaitementLucrin Dépôt 6 mois n'est pas prévu pour être utilisé chez la femme.
Des études animales ont montré des effets indésirables sur le fœtus, et il n'existe pas d'études dans l'espèce humaine.
Lucrin Dépôt 6 mois est contre-indiqué chez la femme enceinte ou celle qui le devient en cours de traitement.
On ne sait pas si la leuproréline est excrétée dans le lait maternel.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLucrin peut diminuer la vitesse de réaction, de sorte que l'aptitude à la participation active au trafic routier et à l'utilisation de machines pourrait en être affectée. La consommation d'alcool renforce cet effet.
Effets indésirablesEn début de traitement, on observe régulièrement une augmentation passagère du taux sérique de testostérone pouvant entraîner une aggravation transitoire de certains symptômes de la maladie (survenue ou intensification des douleurs osseuses, de l'obstruction des voies urinaires ou de ses conséquences, compression de la moelle épinière, faiblesse musculaire des jambes, lymphœdèmes). Par la suite se manifestent les symptômes d'un sevrage en testostérone.
Les effets indésirables les plus fréquents observés sous traitement par acétate de leuproréline sont vasodilatation/bouffées de chaleur, augmentation des sueurs, modifications pondérales, baisse de la libido et dysfonction sexuelle.
Dans ce qui suit figurent les effets indésirables observés sous traitement par Lucrin Dépôt en fonction des systèmes d'organes pendant l'observation du marché, pharmacovigilance. Les fréquences sont définies comme suit: très fréquent (≥1/10), fréquent (de ≥1/100 à <1/10); occasionnel (de ≥1/1'000 à <1/100); rare (de ≥1/10'000 à <1/1'000); très rare (<1/10'000); non connu, à l'exclusion de rapports pendant la surveillance du marché, la fréquence précise ne peut être donnée.
Infections et infestations
Fréquent: rhinite.
Rare: infections urinaires, candidose.
Non connu: pharyngite, pneumonie.
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
Non connu: cancer cutané.
Affections hématologiques et du système lymphatique
Fréquent: anémie.
Occasionnel: éosinophilie.
Non connu: augmentation ou diminution du nombre de leucocytes, diminution du nombre de thrombocytes, augmentation du temps de prothrombine, allongement du temps partiel de thromboplastine.
Affections du système immunitaire
Occasionnel: réactions d'hypersensibilité.
Non connu: réactions anaphylactiques.
Affections endocriniennes
Très rare: infarctus hypophysaire (cf. «Mises en garde et précautions»).
Non connu: goître.
Troubles du métabolisme et de la nutrition
Très fréquent: prise de poids (22%).
Fréquent: augmentation ou réduction de l'appétit, hypercalcémie, hyperglycémie, augmentation de AP.
Occasionnel: déshydratation, hypoglycémie.
Non connu: perte de poids, hypokaliémie, augmentation du taux d'urée, augmentation de la créatinine, hypoprotéinémie, hyperphosphatémie, hyperuricémie, hyperlipidémie, diabète sucré.
Affections psychiatriques
Très fréquent: baisse de la libido (47%).
Fréquent: dépression.
Occasionnel: insomnie.
Non connu: nervosité, variations de l'humeur, léthargie, augmentation de la libido, angoisse, hallucinations, suicidalité.
Affections du système nerveux
Fréquent: céphalées, somnolence, paresthésies.
Rare: vertiges, tremblement, troubles de la marche.
Très rare: troubles du goût.
Non connu: hypoesthésies, amnésie, syncope, crise convulsive, neuropathie périphérique, neuromyopathie, attaque ischémique transitoire, apoplexie, paralysie, perte de conscience, pseudotumor cerebri / hypertension intracrânienne idiopathique.
Affections oculaires
Non connu: sécheresse oculaire, troubles visuels (par exemple, vision brouillée), amblyopie.
Affections de l'oreille et du labyrinthe
Fréquent: douleurs de l'oreille.
Non connu: acouphènes, hypoacousie.
Affections cardiaques
Fréquent: arythmie, extrasystoles ventriculaires, angor, insuffisance cardiaque.
Occasionnel: bradycardie, bloc auriculo-ventriculaire.
Non connu: souffle cardiaque, modifications de l'électrocardiogramme (par exemple, signe d'ischémie myocardique), tachycardie, infarctus du myocarde, mort subite d'origine cardiaque (cf. «Mises en garde et précautions»), prolongation de l'intervalle QT (voir «Mises en garde et précautions» et «Interactions»).
Affections vasculaires
Très fréquent: vasodilatation (57%), bouffées de chaleur (52%), Flush (34%).
Fréquent: hypertension artérielle, lymphœdème.
Non connu: hypotension orthostatique, thrombose, embolie pulmonaire.
Affections respiratoires, thoraciques et médiastinales
Fréquent: dyspnée, hémoptysie, œdème pulmonaire aigu.
Occasionnel: toux.
Non connu: épistaxis, frottement pleural, épanchement pleural, infiltration pulmonaire, fibrose pulmonaire, pneumopathie interstitielle.
Affections gastro-intestinales
Fréquent: nausées, flatulence, diarrhée, constipation.
Non connu: sécheresse buccale, vomissements, dysphagie, ulcère gastroduodénal, hémorragie gastro-intestinale, polypes rectaux.
Affections hépatobiliaires
Très fréquent: augmentation du taux de LDH dans le sérum (29%), augmentation des AST (20%).
Fréquent: augmentation des ALT, augmentation des gamma-GT.
Occasionnel: lésion hépatocellulaire, hépatite cholestatique.
Non connu: lésion hépatique grave, hyperbilirubinémie, ictère, stéatose hépatique non alcoolique.
Affections de la peau et du tissu sous-cutané
Fréquent: éruption cutanée (y compris exanthème maculopapuleux), prurit.
Occasionnel: hypotrichose, modification de la pilosité (en particulier, augmentation ou diminution de la pilosité corporelle).
Rare: alopécie.
Non connu: sécheresse cutanée, ecchymoses, urticaire, érythème polymorphe, dermatose, dermatose bulleuse, dermatite exfoliative, syndrome de Stevens-Johnson, nécrolyse épidermique toxique, troubles de la croissance pileuse, troubles de la pigmentation, réactions de photosensibilité, lésions cutanées.
Affections musculosquelettiques et du tissu conjonctif
Très fréquent: douleurs osseuses (14%), faiblesse musculaire (11%).
Fréquent: douleurs dorsales, douleurs des extrémités, myalgies, arthralgies.
Rare: crampes musculaires.
Non connu: réduction de la densité osseuse, gonflement osseux, arthropathie, ténosynovite, spondylite ankylosante.
De plus, une ostéoporose a été rapportée au cours de traitement de longue durée (6-12 mois).
Affections du rein et des voies urinaires
Très fréquent: nycturie (17%).
Fréquent: pollakiurie, dysurie, hématurie.
Occasionnel: rétention urinaire.
Rare: troubles mictionnels, incontinence urinaire.
Non connu: augmentation des envies d'uriner impérieuses, spasmes de la vessie, obstruction des voies urinaires.
Affections des organes de reproduction et du sein
Très fréquent: impuissance (45%).
Fréquent: gynécomastie, atrophie testiculaire, augmentation du PSA.
Occasionnel: douleurs testiculaires.
Très rare: sensation de tension ou douleur des seins, douleurs dans la région prostatique, gonflement du pénis.
Troubles généraux et anomalies au site d'administration
Très fréquent: augmentation des sueurs (42%), érythème au site d'injection (13%), fatigue (13%), œdèmes périphériques (12,5%).
Fréquent: autres réactions au site d'injection (comme gonflement, prurit, induration, douleur, hématome, inflammation), asthénie, frisson, œdème, douleur thoracique.
Occasionnel: sécheresse des muqueuses, malaise, sueurs nocturnes.
Non connu: augmentation de la sensation de soif, fièvre, fibrose pelvienne.
Lors de l'utilisation d'autres préparations contenant de la leuproréline chez des femmes ou chez des enfants présentant une puberté précoce traités par acétate de leuproréline, on a rapporté en outre les effets indésirables suivants: sensation de chaleur, séborrhée, acné, érythème, eczéma, irritabilité, palpitations, dysphonie, douleurs abdominales, gingivite, stomatite, hémorragie gingivale, flatulence, dyspepsie, gastrite, stéatose hépatique, sensibilité à la pression du foie, douleurs de la nuque, raideur de la nuque, tressaillements musculaires, œdème du visage, œdème généralisé.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes signes d'intoxication n'ont pas été observés jusqu'ici.
Dans les études cliniques, des doses chez l'adulte allant jusqu'à 20 mg/jour ont été administrées pendant 2 ans. Les effets indésirables observés sous l'administration de ces doses élevées ne se différencient pas de celles notées avec l'administration de 1 mg/jour.
En cas de surdosage, le patient devrait être surveillé. Le cas échéant, un traitement symptomatique et des mesures de soutien sous contrôle médical sont indiqués.
Propriétés/EffetsCode ATC
L02AE02
Mécanisme d'action
Pharmacodynamique
L'acétate de leuproréline est un analogue synthétique de la gonadoréline naturelle (analogue de la GnRH) qui contrôle la libération de la LH (hormone lutéinisante) et de la FSH (hormone folliculostimulante) du lobe antérieur de l'hypophyse. Ces hormones contrôlent à leur tour la synthèse des stéroïdes sexuels.
À la différence de la gonadoréline physiologique qui est libérée de façon pulsatile par l'hypothalamus, l'acétate de leuproréline bloque les récepteurs à la gonadoréline de l'hypophyse lors de l'utilisation thérapeutique prolongée. L'administration continue d'acétate de leuproréline entraîne une diminution du nombre et/ou de la sensibilité des récepteurs présents dans l'hypophyse (régulation négative) qui a pour conséquence une chute du taux de LH et de FSH ainsi qu'une diminution de la concentration de testostérone à des valeurs comparables à celles observées après une castration. À la suite de la castration chimique se produit une inhibition de la croissance du carcinome.
On a montré également dans les études réalisées chez l'animal l'effet de l'inhibition hormonale et de l'inhibition de la croissance tumorale du cancer de la prostate.
En cas de non injection de Lucrin Dépôt 6 mois, on observe une première réaugmentation du taux de testostérone en moyenne au bout de 200 jours.
En cas d'administration réitérée, on note une diminution soutenue du taux de testostérone à des valeurs comparables à celles observées après une castration, sans que le taux de testostérone ne présente une augmentation passagère comme après une première injection.
Fertilité chez l'homme:
Des études cliniques et pharmacologiques réalisées chez l'homme ont montré que la suppression de la fertilité était complètement réversible au plus tard 24 semaines après l'arrêt d'une administration continue d'acétate de leuproréline.
Efficacité clinique
L'efficacité de la formulation de Lucrin Dépôt 6 mois a été évaluée dans deux études réalisées au total chez 358 patients présentant un cancer de la prostate, âgés de 58 à 85 ans.
La suppression du taux sérique de testostérone à des valeurs comparables à celles observées après une castration (≤50 mg/dl) a pu être montrée, et le taux sérique est resté pendant 26 semaines à ce faible niveau. Tous les patients ont montré une augmentation initiale du taux de testostérone au cours des 2 premières semaines; les valeurs observées après une castration ont été atteintes dans la plupart des cas après 4 semaines. Chez 96% des patients traités, une suppression satisfaisante a été maintenue pendant une durée totale de 6 mois.
L'augmentation du taux sérique de testostérone après la fin de l'étude a montré la réversibilité de la suppression.
Cancer de la prostate résistant à la castration
Dans les études cliniques, les bénéfices de l'administration d'un principe actif supplémentaire comme l'acétate d'arbiratérone et l'enzalutamide, inhibiteurs de l'axe androgène, les taxanes docétaxel et cabazitaxel ainsi que le radiopharmaceutique Ra-223 en complément des agonistes de la GnRH comme l'acétate de leuproréline ont pu être démontrés chez les patients présentant un cancer métastatique de la prostate résistant à la castration.
PharmacocinétiqueAbsorption
L'acétate de leuproréline est libéré après injection de Lucrin Dépôt 6 mois continuellement à partir d'un polymère d'acide lactique pendant une durée de 6 mois. Le copolymère est alors résorbé comme du matériel de suture chirurgicale.
Le taux de leuproréline dans le sérum augmente rapidement après une administration unique sous-cutanée de Lucrin Dépôt 6 mois et atteint son maximum au bout de 1,8 heures avec un taux moyen de 102 ng/ml. Après quelques jours, le taux diminue en plateau et jusqu'à >26 semaines (chez quelques patients jusqu'à 30 semaines) après administration, des concentrations au-dessus de la limite de mise en évidence ont été mesurées.
Distribution
La liaison aux protéines plasmatiques de l'acétate de leuproréline in vitro est de 43-49%.
Le volume de distribution de la leuproréline chez l'homme est de 36 l.
Métabolisme
Dans des études animales, la leuproréline marquée au 14C à été métabolisée en peptides inactifs plus petits comme suit: peptide (métabolite-I), tripeptide (M-II et M-III), dipeptide (M-IV). Les fragments peptidiques ont été encore éventuellement décomposés ultérieurement.
On a mesuré chez 5 patients atteints de cancer de la prostate, de 2 à 6 heures après injection de la suspension d'acétate de leuproréline dépôt, des concentrations plasmatiques maximales du principal métabolite (M-I). Cette concentration correspond environ à 6% de la concentration maximale d'acétate de leuproréline. Une semaine après l'injection, la concentration plasmatique moyenne de M-I était encore environ 20% de la concentration moyenne de leuproréline.
Élimination
La clairance totale est de 139,6 ml/min (mesure par administration de Lucrin Dépôt 3 mois). Après injection intraveineuse d'un bolus de 1 mg de leuproréline, la demi-vie terminale dans un modèle à 2 compartiments chez des sujets sains de sexe masculin était environ de 3 heures.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique et rénale
On a mesuré parfois des taux sériques de leuproréline plus élevés après l'administration de Lucrin Dépôt 6 mois chez des patients atteints d'insuffisance rénale et par contre des taux plus faibles chez des patients présentant une insuffisance hépatique. Cette observation ne paraît pas avoir d'importance clinique.
Patients âgés
La pharmacocinétique chez les patients âgés n'est pas significativement différente de celle d'adultes plus jeunes.
Données précliniquesMutagénicité
La recherche du mutagénicité (sur bactéries et cellules de mammifères) n'a fourni aucun signe d'un potentiel mutagène de la leuproréline.
Carcinogénicité
Les études de carcinogénicité ont compris l'administration de leuproréline à des souris et des rats pendant 2 ans. Après 24 mois d'administration sous-cutanée de 0,6 à 4 mg/kg chez des rats, une augmentation dose-dépendante d'hyperplasies et d'adénomes hypophysaires bénins a été observée. Par ailleurs, on a constaté une augmentation non dose-dépendante d'adénomes de cellules insulaires pancréatiques chez la rate et de cellules interstitielles testiculaires chez le rat mâle. Chez la souris, des doses jusqu'à 60 mg/kg, administrées également pendant 2 ans, n'ont causé aucune tumeur ni anomalie de l'hypophyse induite par la leuproréline.
Chez les patients traités trois ans par 10 mg par jour ou deux ans par 20 mg par jour, aucune anomalie hypophysaire ne s'est manifestée.
Toxicité sur la reproduction
Des études comprenant l'administration sous-cutanée de jusqu'à 10 µg/kg de leuproréline à des rats et de jusqu'à 1 µg/kg à des lapins n'ont fourni aucun indice d'un potentiel tératogène. Des effets embryotoxiques et embryolétaux ont été observés chez la rate à la dose de 10 µg/kg et chez la lapine à des doses supérieures à 0,1 µg/kg.
Remarques particulièresIncompatibilités
Aucune connue jusqu'ici.
Influence sur les méthodes de diagnostic
Aucune connue jusqu'ici.
Stabilité
Le médicament ne peut être utilisé que jusqu'à la date figurant après la mention «EXP» sur l'emballage.
Ne plus utiliser le produit lors d'une coloration de la substance sèche et/ou d'un trouble du solvant.
Remarques particulières concernant le stockage
Tenir hors de portée des enfants.
Conserver à température ambiante (15 - 25°C). Ne pas congeler. Conserver dans l'emballage d'origine afin de le protéger de la lumière.
Remarques concernant la manipulation
Préparation de la suspension
Seringue à double compartiment: La mise en suspension se fait exclusivement au moyen du solvant joint. Sous pression lente du piston dans le cylindre, ce solvant est vidé dans le compartiment contenant les microparticules. Une suspension laiteuse homogène se forme en mélangeant soigneusement.
Si la suspension n'est pas administrée immédiatement après sa préparation, elle doit être jetée, étant donné que Lucrin Dépôt 6 mois ne contient aucun agent conservateur.
Numéro d’autorisation58805 (Swissmedic).
Présentation1 seringue à double compartiment et 1 tampon imbibé d'alcool. (A)
Titulaire de l’autorisationAbbVie AG, 6330 Cham
Mise à jour de l’informationNovembre 2023
Lucrin Dépôt seringue à double compartiment
Pour une manipulation correcte de la seringue pré-remplie à double compartiment de Lucrin Dépôt, nous vous prions de lire les instructions suivantes et de les suivre scrupuleusement.
|
|
|
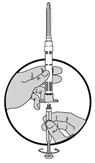
1.Pour préparer l'injection, visser le piston blanc dans le butoir d'extrémité jusqu'à ce que le butoir commence à tourner.
Ne pas oublier de resserrer le mécanisme Luer-Lock en faisant tourner l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'il ne bouge plus. Ne pas trop serrer!
| |
|
|
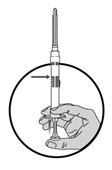
2.Tenir la seringue en position verticale et libérer le diluant en enfonçant lentement le piston jusqu'à ce que le premier butoir se trouve au niveau de la ligne bleue, au milieu du cylindre.
| |
|
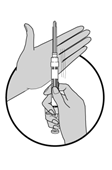
|
3.Tourner la seringue pour mélanger parfaitement les particules afin d'obtenir une suspension uniforme. La suspension doit avoir une apparence laiteuse.
4.Si les microsphères (particules) adhèrent au butoir, tapoter la seringue contre un doigt.
| |
|
|
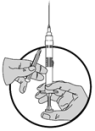
5.Retirer ensuite la garde de l'aiguille et enfoncer le piston pour expulser l'air contenu dans la seringue.
| |
|
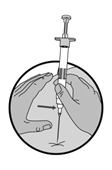
|
6.Injecter la totalité du contenu de la seringue par voie sous-cutanée immédiatement après la préparation comme pour une injection normale. La suspension sédimente très rapidement. Pour cette raison, la suspension de Lucrin doit être utilisée immédiatement.
| |
|
ATTENTION: Une aspiration de sang serait identifiable par l'apparition de sang juste en dessous du raccord Luer-Lock.
7.Jeter la seringue après utilisation selon les règles d'hygiène habituelles.
|
|





