CompositionPrincipes actifs
Tropicamide, chlorhydrate de phényléphrine.
Excipients
Copolymère d'ammonio méthacrylate (type A), dispersion de polyacrylate à 30%, dibéhénate de glycérol, éthylcellulose.
Indications/Possibilités d’emploiMydriasert est indiqué pour l'obtention d'une mydriase préopératoire.
Posologie/Mode d’emploiRéservé à l'usage des professionnels de la santé.
Posologie
Un insert ophtalmique par œil concerné, au maximum 2 heures avant l'intervention chirurgicale.
Enfants et adolescents
Mydriasert est contre-indiqué chez l'enfant âgé de moins de 12 ans (voir rubrique «Contre-indications»).
Il n'existe pas de données chez l'enfant âgé de 12 à 18 ans. Mydriasert n'est donc pas recommandé chez ces patients.
Contre-indicationsHypersensibilité aux principes actifs ou à l'un des autres constituants.
Risque de glaucome par fermeture de l'angle: patients souffrant d'un glaucome à angle fermé (non traité préalablement par iridectomie) et patients chez lesquels un glaucome peut être déclenché par des mydriatiques.
Enfants âgés de moins de 12 ans (voir rubrique «Mises en garde et précautions»).
Mises en garde et précautionsCe médicament entraînant des troubles visuels persistants, il sera conseillé au patient de se faire accompagner à la consultation (voir sous «Effets indésirables»).
Protéger l'œil contre la lumière de forte intensité après l'intervention/l'examen.
Une hyperhémie oculaire peut augmenter l'absorption des principes actifs contenus dans l'insert.
Précautions d'emploi particulières
Le déplacement, ou, plus rarement, l'expulsion de l'insert est possible. Dans ce cas, ne pas réutiliser l'insert, mais en prendre un nouveau (voir sous «Posologie/Mode d'emploi»).
Mydriasert ne doit pas être laissé dans le cul-de-sac conjonctival plus de 2 heures. Dans les cas où Mydriasert avait été oublié, des réactions indésirables locales ont été observées (voir sous «Effets indésirables»).
Du fait d'une irritation possible, quoique peu fréquente, de la conjonctive, une attention particulière sera de mise chez les patients souffrant de sécheresse oculaire (l'utilisation de Mydriasert chez certains patients peut nécessiter l'addition d'une goutte de solution saline pour améliorer la tolérance).
Tous les agents mydriatiques sont susceptibles de déclencher une crise de glaucome par obstruction mécanique des voies d'élimination de l'humeur aqueuse chez les sujets présentant un angle irido-cornéen étroit.
Du fait de l'action alpha-sympathomimétique de la phényléphrine, la prudence s'impose chez les patients atteints d'hypertension artérielle, d'affections cardiaques, d'hyperthyroïdie, de troubles prostatiques ou d'athérosclérose ainsi que chez tous les sujets pour lesquels l'utilisation d'amines vasopressives est contre-indiquée.
L'attention des sportifs et athlètes doit être attirée sur le fait que ce médicament contient un principe actif (phényléphrine) susceptible d'induire une réaction positive aux tests pratiqués lors des contrôles anti-dopage.
Le port de lentilles de contact hydrophiles souples n'est pas recommandé durant le traitement.
Si, après l'insertion de Mydriasert, l'administration d'autres mydriatiques ne peut être évitée, tenir compte des doses contenues dans l'insert, à savoir environ 1 goutte de solution de phényléphrine à 10% et environ 1 goutte de solution de tropicamide à 0,5%.
Il n'y a pas de données disponibles concernant l'utilisation de Mydriasert chez l'enfant et l'adolescent. Mydriasert n'est donc pas recommandé chez ces patients.
Enfants et adolescents
L'utilisation chez l'enfant âgé de moins de 12 ans est contre-indiquée, car l'utilisation de médicaments ophtalmiques contenant de la phényléphrine et de la tropicamide peut entraîner des effets indésirables systémiques graves (par exemple, des troubles cardiovasculaires avec une hypertension sévère, des altérations du rythme cardiaque et des œdèmes pulmonaires), en particulier chez les enfants et les adolescents.
Comparé à l'adulte, l'enfant âgé de moins de 12 ans paraît plus sensible.
L'utilisation chez l'enfant âgé de 12 à 18 ans n'est pas recommandée car il manque l'expérience clinique adéquate.
InteractionsAucune étude préclinique ou clinique d'interaction n'a été réalisée avec Mydriasert.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'utilisation de la phényléphrine et du tropicamide chez la femme enceinte. Les études sur l'animal n'apportent pas de données suffisantes pour ce qui est des effets sur la gestation, le développement embryonnaire ou fœtal, l'accouchement ou le développement post-natal (voir sous «Données précliniques»).
Bien que le passage systémique attendu soit négligeable, une faible exposition systémique ne peut être exclue.
Mydriasert ne devrait donc être administré durant la grossesse qu'en cas d'absolue nécessité.
Allaitement
Il n'existe pas de données concernant le passage de la phényléphrine ou du tropicamide dans le lait maternel. La phényléphrine étant cependant faiblement absorbée oralement, l'absorption par le nouveau-né devrait être négligeable. Par ailleurs, les nouveau-nés peuvent être très sensibles aux anticholinergiques; malgré l'exposition systémique négligeable escomptée, le tropicamide n'est donc pas recommandé pendant l'allaitement.
En conséquence, Mydriasert ne devrait pas être utilisé pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesMydriasert a une influence importante sur l'aptitude à la conduite ou l'utilisation de machines.
L'attention des patients sera attirée sur les risques liés aux agents mydriatiques et cycloplégiques, pouvant engendrer troubles visuels, obnubilation, somnolence ou manque de concentration. L'application de l'insert ophtalmique Mydriasert engendre une mydriase gênante pendant plusieurs heures et donc des troubles visuels. En conséquence, après administration, le patient doit être avisé de ne pas conduire et/ou utiliser des machines et/ou ne pas effectuer d'autres activités à risque tant que les troubles visuels persistent.
Effets indésirablesLes effets transitoires suivants ont été rapportés pendant les études cliniques:
Affections du système nerveux
Très rares (<1/10'000): convulsions.
Affections oculaires
Fréquents (>1/100): sensation de brûlure, vision floue, troubles visuels.
Occasionnels (>1/1000, <100): larmoiement, irritation, mydriase gênante due à la dilatation prolongée de la pupille, photophobie, kératite ponctuée superficielle.
Rares (<1/1000): blépharite, conjonctivite, risque de glaucome aigu par fermeture de l'angle, hypertension intra-oculaire.
De très rares cas d'ulcère cornéen et d'œdème cornéen ont été observés lorsque l'insert avait été oublié.
Bien qu'administré par voie locale, les agents mydriatiques contenus dans cet insert peuvent causer les effets systémiques suivants, dont il faut tenir compte: élévation de la pression sanguine, tachycardie et, très rarement, des incidents majeurs tels qu'arythmie cardiaque, tremblements, pâleur, céphalées, sécheresse buccale.
Enfants et adolescents:
Affections oculaires
Fréquence inconnue (ne peut être estimée sur la base des données disponibles): pâleur périorbitaire chez les prématurés.
Affections respiratoires, thoraciques et médiastinales
Fréquence inconnue (ne peut être estimée sur la base des données disponibles): œdème pulmonaire.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageBien que peu probable du fait de l'administration d'une dose unique de Mydriasert, un risque de surdosage existe cependant en cas d'instillation de collyres mydriatiques additionnels.
Symptômes et traitement
Les symptômes d'un surdosage par la phényléphrine comprennent une fatigue extrême, des sueurs, une obnubilation, un ralentissement de la fréquence cardiaque et le coma. Les réactions toxiques graves à la phényléphrine étant d'installation très rapide et de très faible durée, le traitement est essentiellement symptomatique. L'injection immédiate d'un inhibiteur alpha-adrénergique à action rapide comme la phentolamine (à la dose de 2 à 5 mg i.v.) est recommandée.
Les symptômes d'un surdosage par le tropicamide administré par voie ophtalmique incluent des maux de tête, une accélération du rythme cardiaque, une sécheresse de la bouche et de la peau, une somnolence inhabituelle et des bouffées de chaleur. En cas de surdosage et d'apparition d'effets locaux tels qu'une mydriase prolongée, on administrera de la pilocarpine ou de la physostigmine à 0,25%.
Propriétés/EffetsCode ATC
S01FA56
Propriétés pharmacodynamiques
Mécanisme d'action
Classe pharmaco-thérapeutique: mydriatiques et cycloplégiques, tropicamide, associations.
Pharmacodynamique
Voir rubrique «Mécanisme d'action»
Efficacité clinique
Mydriasert est un insert ophtalmique combinant deux agents mydriatiques de synthèse (la phényléphrine qui est un alpha-sympathomimétique et le tropicamide qui est un anticholinergique). Des études cliniques ont montré que le temps nécessaire à l'obtention d'une mydriase stable et suffisante se situait entre 45 et 90 minutes. La mydriase maximale (diamètre pupillaire de 9 mm) a été obtenue dans les 90 à 120 minutes.
La mydriase obtenue s'est maintenue pendant au moins 60 minutes.
Le réflexe pupillaire complet est réapparu en moyenne au bout de 90 minutes.
PharmacocinétiqueAbsorption
Après administration d'un insert chez 138 patients dans le cadre d'une chirurgie de la cataracte, les concentrations des principes actifs mesurées dans l'humeur aqueuse étaient très faibles: 1,9 ± 3,4 µg/ml pour la phényléphrine et 0,85 ± 2,06 µg/ml pour le tropicamide. Les quantités cumulées de principes actifs libérées en 2 heures par l'insert représentent moins de 40% des doses contenues dans l'insert.
Dans les mêmes conditions, les taux plasmatiques de phényléphrine mesurés pendant 6 heures chez des volontaires sains n'étaient pas détectables (<0,5 ng/ml).
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesDes études de toxicité, de génotoxicité et des études conventionnelles de reproduction n'ont pas été conduites avec la phényléphrine, la tropicamide ou l'association des 2 principes actifs.
Il n'existe pas d'étude concernant la cinétique et la tolérance systémique.
Chez le rat, l'administration de phényléphrine (12,5 mg/kg, s.c.) a entraîné une diminution du débit sanguin utérin (86,8% de réduction en 15 minutes environ), montrant ainsi des propriétés foetotoxiques et co-tératogéniques.
Une étude de tolérance locale de 14 jours a été réalisée chez le lapin, en plaçant l'insert pendant 6 heures par jour. Cette étude a démontré un faible effet irritant sur la conjonctive au site d'administration.
Remarques particulièresIncompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
À usage unique. Ne pas réutiliser l'insert, ni pour un autre patient, ni pour l'autre œil du même patient.
À utiliser immédiatement après ouverture du sachet. Jeter l'insert immédiatement après utilisation.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25°C.
Remarques concernant la manipulation
Des instructions détaillées se trouvent à la fin de l'information professionnelle après la rubrique «Mise à jour de l'information».
Numéro d’autorisation59035 (Swissmedic).
PrésentationMydriasert insert ophtalmique 1. (B)
Mydriasert insert ophtalmique 20. (B)
Titulaire de l’autorisationTHEA Pharma S.A., 8200 Schaffhouse.
Mise à jour de l’informationJuillet 2022.
Remarques concernant la manipulation
Mode d'administration
Avant d'utiliser le médicament, vérifier que le sachet n'est pas endommagé. Si la fermeture du sachet est endommagée, la stérilité n'est plus assurée, il faut alors utiliser un autre insert provenant d'un emballage intact.
Découper le bord scellé le long de la ligne pointillée, ouvrir le sachet et retirer l'insert de la manière suivante: prendre l'insert à l'aide de la pince stérile jetable aux extrémités arrondies fournie dans l'emballage, en prenant soin de ne pas endommager l'insert.
|
|
|
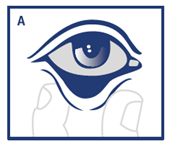
Tirer la paupière inférieure en la pinçant entre le pouce et l'index (A).
| |
|
|
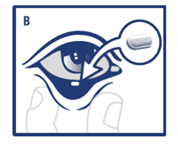
Placer l'insert ophtalmique, à l'aide de la pince stérile jetable, dans le cul-de-sac conjonctival inférieur (B).
| |
|
|
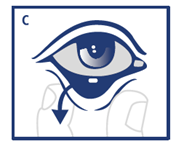
Avant l'opération ou l'examen, et dès que la mydriase souhaitée a été obtenue, l'insert ophtalmique doit être retiré du cul-de-sac conjonctival inférieur à l'aide soit d'une pince chirurgicale stérile, soit d'une compresse stérile, soit d'une solution stérile d'irrigation ou de lavage, en abaissant la paupière inférieure. (C).
|
Conseils d'utilisation
Ne pas laisser l'insert ophtalmique plus de 2 heures dans le cul-de-sac conjonctival inférieur. Le praticien peut retirer l'insert ophtalmique dès que la mydriase est jugée suffisante pour l'opération ou l'examen qui sera pratiqué, au plus tard toutefois, dans la demi-heure suivante.
En cas d'inconfort, vérifier que l'insert a été placé correctement à la base du cul-de-sac conjonctival.
La manipulation de l'insert doit se faire de manière aseptique. Il est recommandé d'éviter les manipulations excessives des paupières.
| 


