Propriétés/EffetsCode ATC
C01BD07
Mécanisme d'action
Le mécanisme d'action précis de la dronédarone chez l'homme n'est pas connu. La dronédarone possède les propriétés anti-arrhythmiques des quatre classes de Vaughan-Williams, mais la contribution sur l'effet clinique de chacune de ces activités n'est pas connue. Chez les animaux, la dronédarone prévient la fibrillation auriculaire ou normalise le rythme sinusal selon le modèle utilisé. Elle prévient également la tachycardie et la fibrillation ventriculaires dans plusieurs modèles animaux. Ces effets résultent très vraisemblablement de ses propriétés électrophysiologiques, qui relèvent de chacune des quatre classes de Vaughan-Williams. La dronédarone bloque de multiples canaux en inhibant les flux de potassium (y compris IK(Ach), IKur, IKr, IKs) et en prolongeant ainsi le potentiel d'action cardiaque et les périodes réfractaires (Classe III). Elle inhibe également les flux de sodium (Classe I) et de calcium (Classe IV). Enfin, elle entrave les activités adrénergiques de façon non compétitive (Classe II).
Pharmacodynamique
Dans les modèles animaux, la dronédarone ralentit la fréquence cardiaque, allonge le phénomène de Wenckebach, ainsi que les intervalles AH, PQ, QT, sans modifier notablement les intervalles QTc, HV et QRS ou en les allongeant faiblement. Elle prolonge les périodes réfractaires de l'oreillette, du nœud auriculo-ventriculaire et du ventricule avec un degré minime de «reverse-use dependency».
La dronédarone diminue la pression artérielle et la contractilité myocardique (dP/dt max) sans modifier la fraction d'éjection ventriculaire gauche, et réduit la consommation en oxygène du myocarde.
La dronédarone présente des propriétés vasodilatatrices, plus prononcées au niveau des artères coronaires (par activation de la voie de l'oxyde nitrique) qu'à celui des artères périphériques.
La dronédarone exerce des effets anti-adrénergiques indirects; elle réduit la réaction alpha-adrénergique de la tension artérielle à l'épinéphrine, ainsi que les réactions bêta 1 et bêta 2 à l'isoprotérénol.
Efficacité clinique
Réduction du risque d'hospitalisation d'origine cardiovasculaire ou de décès
L'efficacité de la dronédarone dans la réduction du risque d'hospitalisation d'origine cardiovasculaire ou de décès de toute cause a été démontrée par ATHENA, une étude multicentrique, multinationale, à double insu, randomisée et contrôlée par placebo chez des patients atteints de FA ou de FLA ou présentant des antécédents correspondants ainsi que d'autres facteurs de risque.
Les patients comptaient au moins un facteur de risque (tels que: âge, hypertension, diabète, antécédent d'AVC, diamètre de l'oreillette gauche ≥50 mm ou FEVG < 0,40), avec des épisodes de FA/FLA et de rythme sinusal documentés au cours des 6 mois précédents. Les patients pouvaient être en FA/FLA ou en rythme sinusal après conversion spontanée ou à la suite d'une autre procédure.
Quatre mille six cent vingt-huit (4628) patients ont été randomisés pour recevoir, pendant des périodes allant jusqu'à 30 mois maximum (suivi médian: 22 mois) soit de la dronédarone, 400 mg deux fois par jour (2301 patients), soit un placebo (2327 patients), en plus d'un traitement classique comprenant des bêtabloquants (71 %), des IECA ou ARA II (69 %), des digitaliques (14 %), des antagonistes calciques (14 %), des statines (39 %), des anticoagulants oraux (60 %), une thérapie antiplaquettaire chronique (5 %) et/ou des diurétiques (54 %).
Le critère d'évaluation primaire de l'étude était le délai de première hospitalisation d'origine cardiovasculaire ou de décès de toute cause.
Les critères d'évaluation secondaires étaient le délai de décès de toute cause, le délai de première hospitalisation d'origine cardiovasculaire, ou le délai de décès pour cause cardiovasculaire.
Le délai de mort subite a également été évalué.
Les patients étaient âgés de 23 à 97 ans, et 42 % d'entre eux avaient plus de 75 ans. Quarante-sept pour cent (47 %) des patients étaient de sexe féminin, et la majorité était d'origine caucasienne (89 %).
La plupart des sujets souffraient d'hypertension (86 %) et d'une maladie cardiaque structurelle (60 %) (y compris maladie coronaire: 30 %; insuffisance cardiaque congestive (ICC): 30 %; dysfonction ventriculaire gauche avec fraction d'éjection < 45 %: 12 %). Vingt-cinq pour cent (25 %) présentaient une FA à l'inclusion dans l'étude.
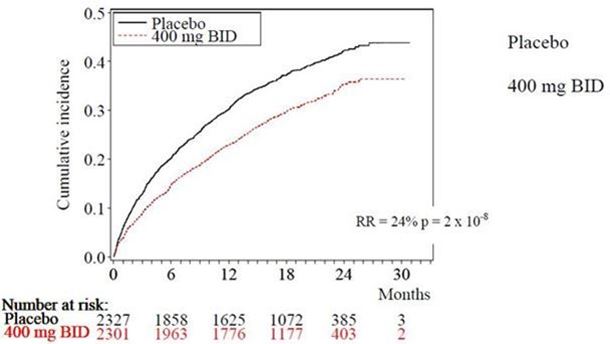
La dronédarone a réduit l'incidence des hospitalisations d'origine cardiovasculaire ou de décès de toute cause de 24,2 % par rapport au placebo (p = 2 x 10-8).
La figure 1 représente les courbes d'incidence cumulée des événements. Ces courbes se sont séparées précocement, pour continuer à diverger pendant les 30 mois de la période de suivi.
Figure 1 – Courbes d'incidence cumulée selon Kaplan-Meier, allant de la randomisation à la première hospitalisation d'origine cardiovasculaire ou au décès de toute cause
La diminution des hospitalisations d'origine cardiovasculaire ou des décès de toute cause a été du même ordre dans tous les sous-groupes, indépendamment des caractéristiques de départ ou des médicaments utilisés (IECA ou ARA II; bêtabloquants, digitaliques, statines, antagonistes calciques, diurétiques) (voir figure 2).
Figure 2 – Estimations du risque relatif (dronédarone 400 mg deux fois par jour, par rapport au placebo) avec 95 % d'intervalle de confiance, en fonction du choix des caractéristiques à l'inclusion - première hospitalisation d'origine cardiovasculaire ou décès de toute cause

a Déterminé à partir d'un modèle de régression de Cox.
b Valeur de p d'une interaction entre les caractéristiques de départ et le traitement, calculée à partir d'un modèle de régression de Cox.
c Anticalciques dotés d'effets bradycardisants limités aux diltiazem, vérapamil et bépridil.
Des résultats similaires ont été observés sur le plan de l'incidence des hospitalisations d'origine cardiovasculaire, avec une réduction du risque de 25,5 % (p = 9 x 10-9).
Bien qu'une réduction des hospitalisations pour FA ait été prépondérante, le risque de première hospitalisation d'origine cardiovasculaire autre que FA/FLA était significativement diminué de 14,5 % dans le groupe dronédarone par comparaison au placebo (p = 0,0162).
On observait également dans le groupe dronédarone un nombre inférieur d'hospitalisations pour aggravation d'une ICC [3,4 % contre 4,0 % (placebo)], infarctus du myocarde ou angor instable [2,1 % contre 2,6 % (placebo)] ou d'un AIT/AVC [1,2 % contre 1,5 % (placebo)].
Les taux d'hospitalisations pour hémorragie majeure [0,9 % contre 1 % (placebo)], syncope [0,9 % contre 1 % (placebo)] ou arythmie ventriculaire (y compris extrasystoles, tachycardie, fibrillation et autres arythmies ventriculaires) [0,4 % contre 0,3 % (placebo)] étaient similaires dans les deux groupes.
En outre, la durée totale d'hospitalisation sous dronédarone était inférieure à celle sous placebo [9995 nuitées contre 13 986 (placebo)], avec une forte réduction (47 %) du nombre de nuits d'hospitalisation d'origine cardiovasculaire en unités de soins intensifs / unité de soins cardiologiques.
Le nombre de décès était moindre dans le groupe dronédarone 400 mg deux fois par jour [n = 116 contre 139 (placebo), réduction du risque 15,6 %, p = 0,176], avec une nette diminution de 30,2 % du risque de décès d'origine cardiovasculaire [p = 0,025; 2,8 % contre 4,0 % (placebo)]. La raison principale de ce phénomène résidait en une réduction de 59,5 % du risque de mort subite d'origine cardiaque [p = 0,0031; 0,6 % contre 1,5 % (placebo)] et une réduction de 38,3 % du risque de décès par accident vasculaire cérébral [p = 0,2021; 0,5 % contre 0,8 % (placebo)].
Les courbes d'incidence cumulée selon Kaplan-Meier (voir figures 3 et 4) couvrant la période allant de la randomisation au décès cardiovasculaire indiquent un effet précoce et soutenu dans le temps de la dronédarone sur la mortalité.
Figure 3 - Courbes d'incidence cumulée selon Kaplan-Meier de la randomisation au décès cardiovasculaire durant l'étude

Figure 4 - Courbes d'incidence cumulée selon Kaplan-Meier des morts cardiaques subites durant l'étude

Maintien du rythme sinusal
Dans EURIDIS et ADONIS, un total de 1237 personnes avec antécédent de FA ou de FLA ont été randomisés en ambulatoire pour recevoir soit la dronédarone 400 mg deux fois par jour (n = 828) ou soit un placebo (n = 409) en plus de traitements conventionnels (comprenant anticoagulants oraux, bêtabloquants, IECA ou ARA II, agents antiplaquettaires, diurétiques, statines, digitaliques et anticalciques). Ces patients avaient présenté au moins un épisode de FA ou FLA prouvé par ECG au cours des 3 mois précédents, étaient en rythme sinusal depuis au moins une heure et ont été suivis pendant 12 mois.
Ils étaient âgés de 20 à 88 ans, en majorité d'origine caucasienne (97 %) et de sexe masculin (69 %). Les comorbidités les plus fréquentes étaient l'hypertension (56,8 %) et une maladie cardiaque structurelle (41,5 %), y compris une maladie coronarienne (21,8 %).
Les données tant cumulées que séparées d'EURIDIS et ADONIS ont révélé que la dronédarone allongeait de façon équilibrée le délai de première récidive de FA ou FLA (critère d'évaluation primaire). Par comparaison au placebo, la dronédarone réduisait de 25,5 % le risque de première récidive de FA ou FLA au cours des 12 mois de l'étude (p = 0,00007). Le délai médian entre la randomisation et cette première récidive de FA ou FLA dans le groupe dronédarone était de 116 jours, c'est-à-dire 2,2 fois supérieur à celui observé dans le groupe placebo (53 jours). La majorité (60 %) des premières rechutes étaient symptomatiques. La dronédarone allongeait également le délai de première récidive symptomatique de FA ou FLA dans les deux études (p = 0,0003). Sous dronédarone 400 mg deux fois par jour, la proportion de patients n'ayant pas présenté de première récidive symptomatique de FA ou FLA atteignait 62,3 % au bout d'un an.
Dans le cadre de DAFNE, où la dronédarone était instaurée avant la cardioversion, le délai médian de récidive de FA, diagnostiquée par surveillance ECG à 12 dérivations transtéléphoniques (TTEM), était de 60 jours sous dronédarone 400 mg deux fois par jour contre 5 jours dans le groupe placebo. La dronédarone 400 mg deux fois par jour abaissait de 55 % (p = 0,001) le risque de première récidive de FA par rapport aux résultats observés sous placebo au cours des 6 mois de l'étude.
Etude ANDROMEDA
Des patients hospitalisés peu auparavant pour une insuffisance cardiaque symptomatique et une dysfonction systolique grave du ventricule gauche (indice de mobilité de la paroi ≤1,2) ont été randomisés pour recevoir soit Multaq, 400 mg deux fois par jour, soit un placebo adéquat, avec un critère d'évaluation principal composé de la mortalité de toutes causes et des hospitalisations pour insuffisance cardiaque. Après le recrutement de 627 des 1000 patients prévus (310 et 317 dans les groupes dronédarone et placebo, respectivement) et un suivi médian de 63 jours, l'étude a été arrêtée en raison d'un excès de mortalité dans le groupe dronédarone.
Vingt-cinq (25) patients du groupe dronédarone (8,1 %) contre 12 dans le groupe placebo (3,8 %) sont décédés, (RR 2,13; IC 95 %: 1,07 à 4,25; p = 0,027). La principale cause de décès a consisté en une aggravation de l'insuffisance cardiaque. Un nombre supérieur d'hospitalisations pour raisons cardiovasculaires a également été constaté dans le groupe dronédarone (71 contre 51 sous placebo) (voir «Contre-indications»).
Les populations recrutées dans les études ANDROMEDA et ATHENA étaient significativement différentes. Les patients admis dans ANDROMEDA souffraient d'une insuffisance cardiaque relativement grave et avaient été hospitalisés ou envoyés à une consultation spécialisée pour une aggravation de leurs symptômes d'insuffisance cardiaque, notamment une dyspnée. L'état clinique de ces patients pouvait s'être amélioré au moment de l'admission, et c'est l'évolution de leur décompensation qui les caractérisait. Les patients admis dans ANDROMEDA appartenaient principalement aux classes NYHA II (40 %) et III (57 %), et seuls 38 % comptaient des antécédents de fibrillation ou de flutter auriculaire (FA/FLA) (25 % présentaient une FA au moment de la randomisation). En revanche, l'étude ATHENA comptait 71 % de patients sans insuffisance cardiaque, 25 % d'individus appartenant aux classes NYHA I ou II et seulement 4 % de sujets de classe III. Tous les patients présentaient un antécédent de FA/FAL.
Patients présentant une fibrillation auriculaire permanente
L'étude PALLAS était une étude randomisée, contrôlée contre placebo, destinée à investiguer le bénéfice clinique de la dronédarone (400 mg, 2 fois par jour) ajoutée au traitement habituel chez des patients présentant une fibrillation auriculaire permanente et des facteurs de risque cardiovasculaires (environ 68 % des patients présentaient une insuffisance cardiaque, 41 % une maladie coronarienne, 28 % des antécédents d'accident vasculaire cérébral ou d'accident ischémique transitoire, 21 % une fraction d'éjection systolique ventriculaire gauche ≤40 % et 18 % des patients de ≥75 ans avait un diabète et une hypertension). L'étude a dû être interrompue prématurément après randomisation de 3236 patients en raison de l'augmentation significative des insuffisances cardiaques (HR 2,16: 1,57 – 2,98), des accidents vasculaires cérébraux (HR 2,32: 1,11 – 4,88) et des décès d'origine cardiovasculaire (HR 2,11: 1,00 – 4,49) dans le groupe traité par dronédarone. (Voir «Contre-indications» et «Mises en garde et Précautions»).
|




