CompositionPrincipes actifs
Humalog, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*).
Humalog Mix 25, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*),
Insulinum solutum, Insulinum isophanum.
Humalog Mix 50, 100 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*),
Insulinum solutum, Insulinum isophanum.
Humalog, 200 I.E./ml
Insulinum Lisprum ([Lys (B28), Pro (B29)] humanum insulinum analogum*).
* Insuline lispro est une insuline analogue obtenue par génie génétique en utilisant Escherichia coli.
Excipients
Humalog, 100 U.I./ml
Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus , Metacresolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad solutionem pro 1 ml.
Teneur totale en sodium: 0,5 mg/ml
Humalog Mix 25, 100 U.I./ml
Protamini sulfas, Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus, Metacresolum, Phenolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad suspensionem pro 1 ml.
Teneur totale en sodium: 0,8 mg/ml
Humalog Mix 50, 100 U.I./ml
Protamini sulfas, Glycerolum, Zinci oxidum, Dinatrii phosphas heptahydricus, Metacresolum, Phenolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad suspensionem pro 1 ml.
Teneur totale en sodium: 0,8 mg/ml
Humalog, 200 U.I./ml
Glycerolum, Zinci oxidum, Trometamolum, Metacresolum, Natrii hydroxidum, Acidum hydrochloridum, Aqua ad iniectabile q.s. ad solutionem pro 1 ml.
Teneur totale en sodium: 0,2 mg/ml
Indications/Possibilités d’emploiTraitement du diabète insulinodépendant chez l'adulte et l'enfant. Humalog est également indiqué pour la stabilisation initiale du diabète.
Posologie/Mode d’emploiLa posologie sera fixée par le médecin traitant en fonction du métabolisme du patient.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Posologie usuelle
Humalog est une insuline à effet rapide qui peut être utilisée en association avec une insuline humaine ayant une durée d'action plus longue.
Humalog 100 U.I./ml ou 200 U.I./ml, Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 peuvent être administrés peu de temps avant les repas. Si nécessaire, les préparations peuvent être injectées juste après les repas.
Humalog 100 U.I./ml ou 200 U.I./ml, Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 ne devraient être administrés que par voie sous-cutanée. Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 ne peuvent pas être injectés par voie intraveineuse.
Si nécessaire, Humalog 100 U.I./ml peut aussi être administré par voie intraveineuse.
Humalog 200 U.I./ml KwikPen solution pour injection ne doit pas être administré par voie intraveineuse.
Sur recommandation médicale, Humalog 100 U.I./ml et Humalog 200 U.I./ml peuvent être administrés en association avec Huminsulin Basal.
Humalog 100 U.I./ml KwikPen, Humalog 100 U.I./ml Mix 25 KwikPen, Humalog 100 U.I./ml Mix 50 KwikPen et Humalog 200 U.I./ml KwikPen permettent de sélectionner des doses de 1 à 60 unités avec une incrémentation de 1 unité (1 unité par graduation).
Humalog 100 U.I./ml Junior KwikPen permet de sélectionner des doses de 0.5 à 30 unités avec une incrémentation de 0.5 unité.
Humalog 200 U.I./ml KwikPen est conçu pour le traitement des patients atteints de diabète qui ont besoin de plus de 20 unités d'insuline d'action rapide par jour. La solution d'insuline lispro 200 U.I./ml ne doit pas être retirée du stylo pré-rempli (KwikPen) ou être mélangée avec d'autres insulines (voir «Mises en garde et précautions» et «Remarques particulières»).
Passage d'une insuline à une autre insuline
Le passage à une autre insuline, respectivement à l'insuline humaine, doit être fait avec précaution et seulement sous contrôle médical. Des modifications de la concentration, de l'origine du produit commercialisé (fabricant), du type d'insuline (insuline normale, Basal, Long, etc.), de l'espèce (insuline animale, insuline humaine, analogue d'insuline humaine) et/ou du procédé de fabrication (insuline produite par génie génétique versus insuline animale) peuvent nécessiter une adaptation de la posologie.
Enfants et adolescents
Les enfants et les adolescents doivent être suivis par un diabétologue pédiatre. En particulier chez les enfants encore jeunes, la réduction du risque d'épisodes hypoglycémiques est un objectif prioritaire du traitement à côté de la réduction des pics glycémiques postprandiaux. On recommande ici différentes associations d'insulines selon l'âge du patient. Il est donc nécessaire de mesurer la glycémie à intervalles fréquents (4 à 6 fois par jour) chez l'enfant.
Mode d'administration
Les patients traités pour la première fois doivent être éduqués rigoureusement concernant le maniement et l'utilisation (recommandations pour les mélanges, hygiène, changement du site d'injection).
Les préparations d'Humalog et d'Humalog Mix sont administrées par voie sous-cutanée. Humalog, mais non Humalog Mix, peut cependant, dans des cas exceptionnels, être aussi injecté par voie intramusculaire.
Les injections sous-cutanées se pratiquent dans la région des bras (parti haute), des cuisses, des fesses ou de l'abdomen. Le site d'injection doit être modifié à chaque administration, afin qu'un même site ne soit pas utilisé plus d'une fois par mois. Comme pour toutes les insulines, il faut changer de site d'injection à chaque injection au sein d'une région d'injection pour réduire le risque de lipodystrophie ou d'amylose cutanée.
En application sous-cutanée, il faut veiller à ce que Humalog, Humalog Mix 25 ou Humalog Mix 50 ne pénètrent pas directement dans la circulation sanguine. Ne pas masser le point d'injection après injection.
Humalog KwikPen (stylo pré-rempli) est disponible en deux concentrations.
Humalog 100 U.I./ml KwikPen et Junior KwikPen
Humalog 200 U.I./ml KwikPen
Dans les deux cas la dose requise est ajustée en unités. Quelle que soit la concentration, l'indicateur de dose indique toujours le nombre d'unités, donc lorsqu'un patient passe à une nouvelle concentration, aucune conversion de dose ne doit être effectuée.
Les patients doivent être avisés de vérifier l'étiquetage de leur insuline avant chaque injection afin d'éviter toute confusion entre les deux différentes concentrations d'Humalog, ainsi que toute confusion avec une autre préparation d'insuline.
La solution injectable d'insuline lispro de 200 U.I./ml ne doit pas être transférée du stylo pré-rempli, le KwikPen, dans une seringue. La graduation de la seringue à insuline ne reflèterait pas correctement la dose. De ce fait, un surdosage pourrait survenir, entraînant une hypoglycémie sévère.
Application d'Humalog à l'aide d'une pompe à perfusion
Humalog 100 U.I./ml, mais non Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50, peut en outre être perfusé dans le cadre d'une thérapie par perfusion s.c. continue à l'aide d'une pompe. Les patients doivent être incités à suivre exactement le mode d'emploi du fabricant de la pompe.
La solution pour injection du Humalog 200 U.I./ml KwikPen ne doit pas être utilisé au moyen d'une pompe à insuline.
Contre-indicationsHypoglycémie.
Insulinome.
Humalog 100 U.I./ml Mix 25, Humalog 100 U.I./ml Mix 50 ou Humalog 200 U.I./ml KwikPen ne doivent en aucun cas être injectés par voie intraveineuse.
Hypersensibilité à l'insuline ou à d'autres composants d'Humalog.
Mises en garde et précautionsUne grave allergie à l'insuline (de type immédiat) doit susciter une nouvelle conception de la thérapie du diabète.
En cas d'hypersensibilité à l'insuline spécifique d'une espèce animale, il faut tout d'abord contrôler la tolérance aux insulines humaines par des tests cutanés (intracutanés). Une réaction immunologique croisée entre l'insuline humaine et animale est possible.
L'hypoglycémie et l'hypokaliémie font partie des effets indésirables cliniques potentiels connus pour toutes les insulines. La prudence est de mise chez les patients pour lesquels ce risque potentiel pourrait jouer un rôle cliniquement significatif (par exemple patients qui jeûnent, qui souffrent d'une neuropathie autonome, qui prennent des antidiabétiques oraux ou qui utilisent de façon concomitante des médicaments susceptibles de baisser le taux sanguin de potassium ou d'être influencés par le taux sanguin de potassium).
Le risque principal chez les diabétiques traités à l'insuline est celui d'une hypoglycémie légère ou sévère. Celle-ci peut influencer la vigilance et en particulier la sécurité lors de la conduite automobile ou l'utilisation de machines. C'est surtout le cas en début de traitement, lors d'une substitution de produit, d'injections à intervalles irréguliers ou d'alimentation irrégulière, ainsi qu'en général lors d'un métabolisme non optimal qui entraîne de fortes fluctuations de la glycémie et surtout des hypoglycémies. Les patients doivent donc en être informés et aussi savoir que la consommation d'alcool accentue le risque.
En cas d'hypoglycémie grave dans le passé, le risque d'apparition d'une hypoglycémie est également plus élevé.
Afin de pouvoir réagir rapidement en cas d'hypoglycémie, il faut informer le patient d'avoir toujours sur lui du glucose ou un morceau de sucre. Il doit également toujours être en possession de sa carte de diabétique.
Certaines circonstances telles qu'un diabète présent depuis longtemps, une insulinothérapie intensive, une néphropathie diabétique ou un traitement par des bêtabloquants peuvent faire en sorte que les symptômes annonciateurs précoces d'une hypoglycémie prennent un aspect différent ou moins prononcé.
Certains patients, chez qui une hypoglycémie est apparue suite au passage de l'insuline animale à l'insuline humaine, ont rapporté que les premiers symptômes annonciateurs étaient moins accentués que sous l'insuline utilisée précédemment, ou totalement différents de ces derniers. Des réactions hypoglycémiques ou hyperglycémiques non traitées peuvent conduire à des pertes de connaissance, au coma ou même au décès (voir aussi «Effets indésirables»).
L'administration de dosages insuffisants ou l'interruption du traitement, surtout chez les diabétiques insulinodépendants, peut provoquer des hyperglycémies et des acidocétoses diabétiques menant finalement au décès.
En cas de lésion rénale, le besoin en insuline peut être diminué. Il peut être diminué aussi chez des patients dont la fonction hépatique est affectée en raison d'une diminution de la capacité de gluconéogenèse et d'une dégradation réduite de l'insuline; toutefois, chez des patients souffrant de troubles hépatiques chroniques, une résistance élevée à l'insuline peut aussi entraîner un besoin élevé en insuline.
Les maladies ou les troubles psychiques peuvent augmenter le besoin en insuline.
Il peut être également nécessaire d'adapter la dose d'insuline en cas d'augmentation de l'activité physique ou d'erreurs diététiques.
Un effort physique pratiqué immédiatement après un repas peut augmenter le risque d'hypoglycémie. Les propriétés pharmacodynamiques des analogues de l'insuline d'action rapide ont comme conséquence que, par rapport à l'insuline humaine, une hypoglycémie peut intervenir plus rapidement.
On n'administrera Humalog aux enfants, à la place de l'insuline normale, que si un délai d'action plus rapide est souhaitable, par exemple lors du choix du moment le plus propice de l'injection par rapport à un repas.
Les bêtabloquants peuvent affaiblir ou masquer les signaux annonciateurs habituels de l'hypoglycémie.
La consommation d'alcool peut augmenter le risque d'hypoglycémie (inhibition de la gluconéogenèse hépatique).
La consommation de marijuana peut éventuellement provoquer une détérioration de la tolérance au glucose.
(D'autres substances illégales n'ont pas été testées; autres interactions: voir «Interactions»).
Humalog contient du métacrésol qui peut dans de rares cas provoquer des réactions allergiques.
Thiazolidinediones (TZDs) combinées avec l'insuline:
Les TZDs combinées avec l'insuline sont associées à un risque accru d'œdème et d'insuffisance cardiaque, particulièrement chez les patients présentant une maladie cardiaque sous-jacente.
Prévention des erreurs de médication lors de l'utilisation de Humalog 200 U.I./ ml KwikPen (voir également «Posologie/Mode d'emploi»)
La solution injectable contenant 200 U.I./ml d'insuline lispro ne doit pas être transférée du stylo pré-rempli, KwikPen, à une autre seringue. La graduation sur la seringue d'insuline ne mesurera pas correctement la dose. Cela peut entraîner un surdosage pouvant provoquer une hypoglycémie grave. La solution injectable contenant 200 U.I./ml d'insuline lispro ne doit pas être transférée du KwikPen à tout autre dispositif d'administration d'insuline, y compris les pompes à perfusion d'insuline.
La prudence est de mise en cas de changement de traitement vers une autre forme pharmaceutique et/ou un autre médicament contenant le même principe actif. Le patient doit alors faire l'objet d'une surveillance adaptée.
Les patients doivent être informés de changer continuellement de site d'injection dans la zone d'injection recommandée afin de réduire le risque de développer une lipodystrophie ou une amylose cutanée. L'injection dans une zone affectée par une lipodystrophie ou une amylose cutanée risque de retarder l'absorption de l'insuline. Un changement soudain du site d'injection (vers une zone non affectée) peut entraîner une hypoglycémie.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par unité de dose, c'est-à-dire qu'il est essentiellement «sans sodium».
Interactions1. Les besoins en insuline peuvent être diminués en présence de substances qui potentialisent l'effet de l'insuline (élévation de la sensibilité à l'insuline), augmentent la sécrétion d'insuline, inhibent la gluconéogenèse hépatique ou affectent l'absorption intestinale du glucose. Ainsi, pour une quantité constante d'insuline, il y a un risque accru d'hypoglycémie en cas de prise simultanée de:
antidiabétiques oraux; alcool; inhibiteurs de l'ECA (p.ex. captopril et énalapril); antagonistes des récepteurs de l'angiotensine II; antiarythmiques comme le disopyramide; alphabloquants et clonidine; inhibiteurs spécifiques de la recapture de la sérotonine (SSRI); fenfluramine; inhibiteurs de la MAO; antidépresseurs tricycliques; salicylates et (rarement) autres AINS; fibrates; tétracyclines; pentamidine (hypoglycémie; parfois suivie d'une hyperglycémie); antipaludiques (quinine, chloroquine, méfloquine); sulfonamides (p.ex. co-trimoxazole); cimétidine et ranitidine.
2. Les besoins en insuline peuvent être accrus en cas d'administration simultanée des substances et groupes de substances suivants:
contraceptifs oraux et autres médicaments à base d'œstrogènes et de progestatifs; corticostéroïdes et ACTH; hormone de croissance (somatotropine); danazole; hormones thyroïdiennes; sympathomimétiques (surtout les β2-sympathomimétiques comme la ritodrine, le salbutamol, la terbutaline, mais aussi les sympathomimétiques α-sélectifs et non sélectifs comme l'épinéphrine); diazoxide; acide nicotinique et dérivés; chlorpromazine (surtout à doses élevées) et autres dérivés de la phénothiazine; diurétiques (p.ex. les diurétiques thiazidiques, l'indapamide et le furosémide); antirétroviraux; immunosupresseurs (ciclosporine, tacrolimus, sirolimus); neuroleptiques atypiques.
3. L'administration des substances suivantes peut, selon la dose, augmenter ou diminuer l'effet de l'insuline:
dérivés de l'octréotide et de l'acide salicylique, sels de lithium (rarement).
Les bêtabloquants peuvent entraîner une augmentation de la résistance à l'insuline, mais aussi, dans certains cas, une hypoglycémie. En outre, les symptômes annonciateurs de l'hypoglycémie peuvent être atténués ou masqués.
On n'a pas étudié le mélange de Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 avec d'autres insulines. On prendra l'avis du médecin avant d'administrer un autre médicament à côté de Humalog 100 U.I./ml ou 200 U.I./ml, Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 (voir «Mises en garde et précautions» et «Remarques particulières, Incompatibilités»).
Grossesse, allaitementGrossesse
Les études chez l'animal avec l'insuline lispro n'ont pas montré d'effet tératogène. Les résultats sur des femmes enceintes exposées au risque (étude rétrospective sur 533 grossesses et étude de suivi prospective de 192 grossesses) ne permettent pas de conclure à la présence d'effets indésirables de Humalog sur la grossesse ou la santé du fœtus ou du nouveau-né. On n'a pour l'instant aucun autre résultat épidémiologique pertinent. La prudence est de mise en cas d'emploi pendant la grossesse.
Il est absolument nécessaire qu'une patiente traitée à l'insuline (insulinodépendante ou avec diabète gestationnel) soit suivie de très près durant sa grossesse. Les patientes diabétiques doivent immédiatement consulter leur médecin si elles sont enceintes ou désirent le devenir. Un contrôle précis de la glycémie ainsi qu'un bon état de santé général sont d'une très grande importance pour les femmes enceintes souffrant de diabète. On devra contrôler la glycémie des nouveau-nés.
Premier trimestre
Le besoin d'insuline baisse généralement durant les trois premiers mois de la grossesse.
Deuxième trimestre
Le besoin d'insuline remonte à partir du quatrième mois.
Allaitement
Durant l'allaitement, il peut s'avérer nécessaire d'adapter soit le dosage de l'insuline, soit le régime, soit les deux à la fois.
Effet sur l’aptitude à la conduite et l’utilisation de machinesUne hypoglycémie peut diminuer les capacités de concentration et de réaction d'un patient. Ceci peut présenter un risque dans des situations où ces capacités jouent un rôle très important (par exemple, dans la conduite d'une automobile ou l'utilisation de machines).
On conseillera au patient de prendre les mesures nécessaires pour éviter de tomber en hypoglycémie en conduisant des véhicules utilitaires. Ceci est particulièrement important pour des patients qui ont de fréquents épisodes d'hypoglycémie ou qui ne font pas, ou peu, attention aux signes annonciateurs d'une hypoglycémie. Dans de tels cas, on peut se demander s'il est vraiment recommandable de conduire un véhicule utilitaire.
Effets indésirablesLes effets indésirables lors des essais cliniques et les données post-marketing sont présentés ci-dessous selon le système de classe d'organe MedDRA, et classés par ordre décroissant de gravité.
Classification des fréquences: Très fréquent (≥1/10), fréquent (≥1/100, <1/10), occasionnel (≥1/1000, <1/100), rare (≥1/10000, <1/1000), très rare (<1/10000).
Affections du système immunitaire
Allergies systémiques généralisées envers l'insuline.
Elles peuvent provoquer des exanthèmes sur tout le corps (urticaire), de l'essoufflement (dyspnée), des râles, une chute de tension (hypotension artérielle), un pouls accéléré (tachycardie) ou des sueurs. Dans les cas sévères, les allergies généralisées peuvent engager le pronostic vital.
Troubles du métabolisme et de la nutrition
Hypoglycémie, hyperglycémie.
Affections oculaires
Altération de l'acuité visuelle.
Troubles généraux et anomalies au site d'administration
Des réactions allergiques localisées peuvent également apparaître occasionnellement chez certains patients, telles que rougeur, tuméfaction et démangeaison au point d'injection.
Affections de la peau et du tissu sous-cutanés
Inconnue: amylose cutanée.
Des cas d'œdème ont été rapportés en début de traitement avec l'insuline, en particulier si un mauvais contrôle métabolique précédent est amélioré par une insulinothérapie intensive. Ils sont transitoires et régressent généralement par eux-mêmes durant le traitement.
Une perte ou une augmentation du tissu graisseux (lipodystrophie) peut s'observer dans des cas isolés au niveau du site d'injection. Ces manifestations peuvent être réduites ou totalement évitées par un changement constant du site d'injection.
Informer le patient des symptômes qui doivent absolument l'inciter à prévenir immédiatement son médecin, par exemple lors d'un rash (rougeur) important, associé à un prurit et à une urticaire et s'étendant rapidement au-delà du site d'injection.
Dans certains cas, les réactions allergiques locales peuvent avoir d'autres causes que l'insuline, comme par exemple un désinfectant de la peau à base de composants irritants ou une mauvaise technique d'injection.
Description de certains effets indésirables
Hypoglycémie
L'hypoglycémie (chute de la glycémie <2–3 mmol/l) est l'effet indésirable qui apparaît le plus fréquemment chez une personne diabétique. Les signes précurseurs sont:
a) Signes neurovégétatifs: sueurs, sensation de faim, tremblements, pâleur, palpitations cardiaques, céphalées.
b) Signes neuroglycopéniques: troubles de la concentration, comportement inhabituel (agitation, irritabilité, agressivité, confusion, etc.), troubles de la conscience, troubles de la coordination, de la vision et du langage. Ces signes peuvent aller de la torpeur et la somnolence jusqu'à la perte de connaissance et même le coma. L'hypoglycémie peut également déclencher des crises d'épilepsie ou même une attaque cérébrale, avec par ex. hémiparésie (le plus souvent passagère), aphasie, signe de Babinski positif.
c) Signes annonciateurs atténués/modifiés: L'équilibrage vers des taux particulièrement bas de sucre sanguin (par ex. injections répétées sur le principe de basal-bolus), mais également un diabète prolongé (entre autres avec neuropathie), un changement de produit, peuvent modifier les symptômes annonciateurs de l'hypoglycémie et atténuer les symptômes neurovégétatifs ou retarder leur apparition. Certains patients ont également fait cette observation lors du passage de l'insuline animale à l'insuline humaine, ou même quelquefois lors d'une substitution de produit.
Il faut donc informer les diabétiques traités par l'insuline et leur entourage que les signes annonciateurs d'une hypoglycémie peuvent tout d'abord être des signes de type neuroglycopénique tels que troubles de la concentration, agitation, troubles du comportement et de la conscience qui ne semblent pas justifier la prise d'un morceau de sucre.
Le passage à une autre préparation d'insuline doit se faire uniquement sous contrôle médical scrupuleux et selon des instructions sévères.
La dose et l'horaire d'injection ne doivent être modifiés qu'après discussion avec le médecin ou sur sa prescription.
Les causes éventuelles d'une hypoglycémie peuvent être: omission d'un repas, vomissements, diarrhée, activité physique inhabituelle, surdosage d'insuline, maladies endocriniennes telles qu'insuffisance surrénale, hypothyroïdie, etc.
La consommation d'alcool peut aggraver une hypoglycémie (voir «Interactions»).
Thérapie de l'hypoglycémie: voir «Surdosage».
Il faut contrôler l'équilibrage du diabète après chaque hypoglycémie sévère; il faut avertir le patient qu'il doit informer son médecin de toute hypoglycémie sévère.
Il faut recommander au patient d'informer son entourage (amis, collègues de travail) de son diabète ainsi que de la conduite à tenir; en particulier comment appliquer du glucagon en injection sous-cutanée.
Hyperglycémie
Un taux trop élevé de sucre dans le sang peut déclencher un coma diabétique. Les causes éventuelles peuvent être: l'omission ou la réduction des injections d'insuline ou un besoin accru d'insuline suite à une infection ou à une autre maladie.
Le coma diabétique évolue très lentement, sur des heures et des jours. Les signes annonciateurs sont: soif, urines abondantes, manque d'appétit, fatigue, peau desséchée, respiration rapide et profonde, ainsi que des taux élevés de glucose et d'acétone dans l'urine. Ici aussi, il faut recommander au patient d'informer immédiatement le médecin de ces troubles.
Affections de la peau et du tissu sous-cutanés
Comme avec toute insulinothérapie, une lipodystrophie et une amylose cutanée peuvent survenir au site d'injection, ce qui peut retarder la résorption locale de l'insuline. Une rotation continue des sites d'injection dans une zone donnée peut aider à diminuer ou à éviter ces réactions (voir également la rubrique «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageTraitement
Traitement de l'hypoglycémie: prendre immédiatement du glucose ou du sucre (au moins 2–4 morceaux), les déposer éventuellement entre la joue et les dents, ou consommer des aliments riches en hydrates de carbone. En cas de perte de connaissance injecter 20 g de glucose i.v. (par ex. 40 ml de glucose à 50%), suivis d'une perfusion de glucose (par ex. 1 l de glucose à 5% pendant une demi-heure à plusieurs heures) tout en contrôlant la glycémie. Eventuellement injection s.c. ou i.v. de 0,5–1 mg de glucagon (si les réserves en glycogène du foie sont intactes), suivie d'une perfusion de glucose.
Lors de toute perte de connaissance d'origine indéfinie, il faut immédiatement mesurer la glycémie.
Il peut être nécessaire de continuer à prendre des hydrates de carbone et de poursuivre l'observation car le rétablissement peut n'être qu'apparent et une nouvelle hypoglycémie peut survenir.
Propriétés/EffetsCode ATC
A10AB04 (Humalog 100 U.I./ml et Humalog 200 U.I./ml) et A10AD04 (Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50)
Mécanisme d'action
Humalog contient l'insuline lispro qui est un analogue de l'insuline humaine produit par génie génétique. Par rapport à l'insuline humaine naturelle, l'ordre de deux acides aminés de la chaîne B est inversé, (l'insuline naturelle a la séquence Pro (B28), Lys (B29), c'est-à-dire que l'insuline lispro a la séquence Lys (B28), Pro (B29)). En conséquence, Humalog se distingue des insulines ordinaires par une cinétique légèrement différente; ni son efficacité pharmacodynamique ni son mécanisme d'action ne sont affectés par cette inversion.
L'effet principal de l'insuline lispro est la régulation du métabolisme du glucose.
En outre, les insulines ont de nombreux effets anaboliques et anti-cataboliques dans des tissus nombreux et variés. Dans les tissus musculaires, ceci se manifeste par une augmentation de la synthèse du glycogène, des acides gras, du glycérol et des protéines, ainsi que par une augmentation de l'absorption des acides aminés; simultanément, il y a réduction de la glycogénolyse, de la gluconéogenèse, de la cétogenèse, de la lipolyse, du catabolisme des protéines et du transport des acides aminés hors de la cellule.
L'insuline lispro a un délai d'action rapide (env. 15 minutes), permettant ainsi de l'administrer plus près des repas (entre 15 minutes avant et 15 minutes après un repas) que l'insuline ordinaire (30–45 minutes avant un repas).
En comparaison avec l'insuline ordinaire, l'effet de l'insuline lispro est plus rapide et dure moins longtemps (durée d'action 2–5 heures).
(Pour l'évolution de l'effet de Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50, voir plus bas.)
Tant chez les diabétiques de type 1 que chez ceux de type 2, les essais cliniques ont démontré une diminution de l'hypoglycémie postprandiale avec l'insuline lispro par rapport à l'insuline normale. Avec les insulines d'action rapide, chaque patient prenant également de l'insuline «basale» doit optimiser le dosage des deux insulines afin de parvenir à un meilleur contrôle du glucose sur l'ensemble de la journée.
Tant chez les diabétiques de type 1 que chez ceux de type 2, les essais cliniques ont démontré une diminution de l'hypoglycémie postprandiale avec Humalog 100 U.I./ml Mix 25 par rapport à l'insuline humaine prémélangée 30/70.
L'évolution de l'effet de l'insuline lispro peut varier d'un individu à l'autre ou d'un moment à l'autre pour un même individu; elle dépend aussi du site d'injection, de la vascularisation, de la température et de l'activité physique. L'évolution typique de l'effet après injection sous-cutanée est présentée sur le graphique suivant:
Illustration 1

Le graphique ci-dessus (illustration 1) montre la quantité relative de glucose nécessaire, au cours du temps, au maintien d'une glycémie voisine des valeurs à jeun chez un sujet sain. Cette quantité relative est une mesure de l'effet de ces insulines (100 U.I./ml) sur le métabolisme du glucose durant un intervalle de temps donné.
Au cours d'études cliniques, on a comparé l'insuline lispro et l'insuline normale dans le traitement d'enfants (61 patients entre 2 et 11 ans) ainsi que dans celui d'enfants et d'adolescents (481 patients entre 9 et 19 ans). Le profil pharmacodynamique de l'insuline lispro chez l'enfant est semblable à celui observé chez l'adulte.
L'administration de l'insuline lispro dans un traitement sous-cutané par mini-pompe a montré que, par rapport à l'insuline normale, on atteignait des taux plus faibles d'hémoglobine glycosylée. Dans une étude en double aveugle avec cross-over, l'insuline lispro a abaissé le taux d'hémoglobine glycosylée de 0,37 point de pour-cent comparés à 0,03 point de pour-cent avec l'insuline normale (p= 0,004), ceci après administration pendant 12 semaines.
Des études ont montré que chez les diabétiques de type 2 traités avec une sulfonylurée à très haute dose l'administration concomitante d'insuline lispro réduisait significativement les valeurs de HbA1c, par rapport à l'administration de la sulfonylurée seule. On doit aussi s'attendre à une réduction de HbA1c avec d'autres insulines comme l'insuline soluble ou l'insuline isophane.
Des études cliniques impliquant des diabétiques de types 1 et 2 ont montré une diminution des épisodes hypoglycémiques nocturnes sous l'insuline lispro par rapport à l'insuline humaine. Dans quelques études, la réduction du nombre des épisodes hypoglycémiques nocturnes était liée à une augmentation du nombre des épisodes diurnes.
Evolution de l'effet de Humalog 100 U.I./ml Mix 25 et de Humalog 100 U.I./ml Mix 50
L'administration sous-cutanée de Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50 est également accompagnée d'un délai d'action rapide et d'un maximum précoce de l'activité de l'insuline lispro. La suspension protaminique Lisprum PS/insuline lispro (NPL) présente une évolution de l'effet qui est très semblable à celle de l'insuline «basale» (NPH) sur un intervalle de temps de près de 15 heures.
Les figures ci-dessous présentent la pharmacodynamie de Humalog 100 U.I./ml Mix 25 et de NPL:
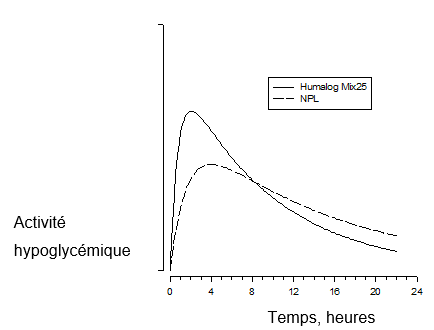
et celle de Humalog 100 U.I./ml Mix 50 et NPL:.

La réaction glucodynamique à l'insuline lispro n'est pas influencée par d'éventuels troubles fonctionnels au niveau des reins ou du foie. Les différences d'ordre glucodynamique entre l'insuline lispro et l'insuline humaine soluble, telles que mesurées lors d'un «clamp de glucose», se conservent sur un large domaine fonctionnel rénal.
On a pu montrer que, sur une base molaire, l'insuline lispro est équipotente à l'insuline humaine, mais qu'elle a un délai d'action plus rapide et une durée d'activité plus courte.
Pharmacodynamique
Sans objet.
Efficacité clinique
Sans objet.
PharmacocinétiqueAbsorption
La pharmacocinétique de l'insuline lispro est celle d'une substance qui est très rapidement absorbée et qui atteint son maximum plasmatique en 30–70 minutes après injection sous-cutanée. Si l'on considère la pertinence clinique de cette cinétique, il paraît d'autant plus judicieux d'étudier la courbe de l'utilisation du glucose (voir discussion sous «Propriétés/Effets»).
Humalog 200 U.I./ml KwikPen
La solution pour injection d'insuline lispro 200 U.I./ml était équivalente à la solution injectable d'insuline lispro 100 U.I./ml en administration sous-cutanée unique d'une dose de 20 unités chez des sujets sains. Le temps pour atteindre la concentration maximale était également similaire pour les deux formulations.
Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50 sont des suspensions prémélangées contenant de l'insuline lispro (analogue rapide de l'insuline humaine) et une suspension protaminique d'insuline lispro (analogue insulinique de rapidité moyenne).
La rapidité d'action et le pic d'activité maximale précoce de l'insuline lispro ont aussi été constatés après injection s.c. d'Humalog 100 U.I./ml Mix 25 et d'Humalog 100 U.I./ml Mix 50.
La pharmacocinétique de la suspension protaminique d'insuline lispro est comparable à celle d'une insuline à vitesse d'action moyenne comme par exemple la «Basale» (NPH). La pharmacocinétique de Humalog 100 U.I./ml Mix 25 et de Humalog 100 U.I./ml Mix 50 correspond aux propriétés pharmacocinétiques des deux composants isolés.
La durée d'action de chaque insuline peut varier considérablement d'un patient à l'autre ou d'un moment à l'autre chez un même patient.
Le délai et la durée d'action de toutes les insulines dépendent du site d'injection, de la vascularisation, de la température corporelle et de l'activité physique, de la dose administrée et également de la méthode d'évaluation choisie. Sur la base d'une dose cliniquement significative de 0,3 U/kg, les valeurs moyennes suivantes ont été observées pour Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50:
|
Formule
|
Délai d'action
en heures env.
|
Durée d'action
en heures env.
|
Pic d'activité
en heures env.
| |
Humalog Mix 25
|
0.25 - 0.75
|
8 – 24
|
2.25 - 3.5
| |
Humalog Mix 50
|
0.25 - 0.5
|
7 – 16
|
1.75 - 2.75
|
Distribution
Sans objet.
Métabolisme
Sans objet.
Élimination
Sans objet.
Troubles de la fonction hépatique
L'absorption et l'élimination plus rapides de l'insuline lispro par rapport à celles de l'insuline humaine soluble sont conservées chez les patients qui présentent un dérèglement de la fonction hépatique.
Troubles de la fonction rénale
L'absorption plus rapide de l'insuline lispro par rapport à celle de l'insuline humaine soluble est conservée chez les patients qui présentent un dérèglement de la fonction rénale. En règle générale, les différences de pharmacocinétique entre l'insuline lispro et l'insuline humaine soluble se retrouvent chez les patients diabétiques de type 2 sur un large domaine fonctionnel rénal et sont indépendantes du fonctionnement du rein.
Données précliniquesDans les études in vitro, l'effet de l'insuline lispro et celui de l'insuline humaine étaient très semblables, y compris la liaison aux récepteurs de l'insuline et l'effet sur la croissance des cellules. Des études démontrent aussi que la dissociation du récepteur de l'insuline était équivalente pour l'insuline lispro et pour l'insuline humaine. Des études de toxicité aiguë sur un à douze mois n'ont pas mis en évidence d'effet de nature toxicologique notable.
Mutagénicité
Les expériences sur l'animal, tant sur les rats que sur les lapins, n'ont donné aucun indice d'un effet tératogène.
Toxicité sur la reproduction
Les expériences sur l'animal, tant sur les rats que sur les lapins, n'ont donné aucun indice d'un effet sur la fertilité.
Remarques particulièresLe patient doit être averti que lors d'un changement imprévu de médecin (accident ou maladie pendant un voyage), il doit informer le médecin traitant de son diabète.
Incompatibilités
Humalog 100 U.I./ml ne doit pas être mélangé à des insulines d'origine animale ou à des insulines provenant d'autres fabricants.
Humalog 200 U.I./ml KwikPen ne doit pas être mélangé à d'autres insulines ou d'autres médicaments. Humalog 200 U.I./ml KwikPen ne doit pas être dilué.
Le mélange d'Humalog 100 U.I./ml Mix 25 ou d'Humalog 100 U.I./ml Mix 50 avec d'autres insulines n'a pas été étudié. En l'absence d'études de compatibilité, ces médicaments ne doivent pas être mélangés avec un autre médicament.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Lors de l'utilisation, c.-à-d. après ouverture des flacons perforables, après la mise en place des cartouches dans le stylo et après la première utilisation du stylo pré-rempli (Humalog KwikPen) la durée de conservation est au maximum de 4 semaines (28 jours) à température ambiante (15-25°C). Eviter l'exposition directe au soleil.
Ensuite, la préparation ne doit plus être utilisée, même s'il reste de l'insuline (Humalog).
Remarques particulières concernant le stockage
A protéger de la chaleur et de la lumière du soleil.
Conserver au réfrigérateur (2-8°C).
Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Afin d'éviter une éventuelle transmission de maladies, chaque KwikPen ou cartouche ne doit être utilisée que par une seule personne, même si l'aiguille a été changée.
Lorsque Humalog 100 U.I./ml est combiné avec d'autres insulines, l'Humalog, de durée d'action plus courte, doit être aspiré en premier dans la seringue afin d'empêcher que le flacon soit contaminé par l'insuline à action la plus longue. Les deux insulines ne doivent être mélangées qu'immédiatement avant l'injection
Flacons perforables
Les préparations contenant 100 U.I./ml doivent être utilisées uniquement avec des seringues conçues pour 100 U.I./ml.
Cartouches
Les cartouches d'Humalog 100 U.I./ml, Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50 devraient être utilisées uniquement avec un stylo de Lilly approprié. Avant l'utilisation, on s'assurera que Humalog ou les cartouches de Lilly sont mentionnées dans le mode d'emploi du stylo joint à l'emballage. Le mode d'emploi du stylo doit être scrupuleusement respecté. Après leur utilisation, les cartouches ne peuvent pas être remplis à nouveau.
Humalog KwikPen
Le mode d'emploi du Humalog KwikPen doit être suivi exactement.
Après leur utilisation, les stylos pré-remplis Humalog KwikPen ne peuvent pas être remplis à nouveau mais ils doivent être éliminés ou recyclés.
Humalog 100 U.I./ml Mix 25 et Humalog 100 U.I./ml Mix 50:
Les cartouches et les stylos pré-remplis (Humalog KwikPen), qui contiennent Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 doivent être roulés environ 10 fois entre les paumes des mains puis renversés 10 fois (avec un angle de 180°) jusqu'à ce qu'ils paraissent uniformément troubles ou laiteux. Dans le cas contraire, répéter l'opération ci-dessus jusqu'à ce que le contenu soit bien mélangé. Ne pas agiter vivement car ceci peut provoquer la formation de mousse et perturber le dosage correct.
Avant l'emploi, les cartouches doivent être inspectées et elles ne doivent pas être utilisées si elles contiennent des agrégats ou si des particules blanches adhèrent au fond ou aux parois de la cartouche, donnant l'impression que la préparation est «gelée».
Les cartouches Humalog 100 U.I./ml Mix 25 ou Humalog 100 U.I./ml Mix 50 ne sont pas prévues pour être mélangées avec une quelconque autre insuline dans la cartouche.
Numéro d’autorisation53290, 53553, 54762, 54763, 59354, 59355, 59356 (Swissmedic).
PrésentationHumalog solution pour injection à 100 U.I./ml:
Flacons perforables de 10 ml: 1 (B)
Cartouches (3,0 ml) pour stylo de 3,0 ml: 5 (B)
Humalog KwikPen, (3,0 ml): 5 (B)
Humalog Junior KwikPen (3,0 ml): 5 (B)
Humalog solution pour injection à 200 U.I./ml:
Humalog KwikPen (3,0 ml): 5 (B)
Humalog Mix 25 Suspension à 100 U.I./ml:
Cartouches (3,0 ml) pour stylo de 3,0 ml: 5 (B)
Humalog KwikPen (3,0 ml): 5 (B)
Humalog Mix 50 Suspension à 100 U.I./ml:
Cartouches (3,0 ml) pour stylo de 3,0 ml: 5 (B)
Humalog KwikPen (3,0 ml): 5 (B)
Titulaire de l’autorisationEli Lilly (Suisse) SA Vernier/Genève.
Mise à jour de l’informationFévrier 2022
|



