CompositionPrincipes actifs
Degarelixum ut degarelixi acetas
Excipients
Praeparatio cryodesiccata: mannitolum (E421)
Solvens: aqua ad injectabilia
Indications/Possibilités d’emploiPour le traitement de patients atteints d’un cancer de la prostate hormono-dépendant à un stade avancé. A titre d’alternative, lorsqu’une castration ou l’administration d’œstrogènes ne sont pas indiquées ou sont difficiles à imposer au patient.
Posologie/Mode d’emploiPosologie pour un homme adulte
L’utilisation ne devrait se faire que sous la surveillance d’un cancérologue expérimenté.
Firmagon est destiné exclusivement à un usage souscutané; il ne doit pas être administré par voie i.v.
Après une dose initiale de 2 injections s.c. de 120 mg (3ml) chacune en deux sites abdominaux différents, on procédera à un mois d’intervalle à de nouvelles injections s.c. de 80mg (4 ml) dans la peau de l’abdomen.
L’effet thérapeutique de Firmagon devra être vérifié par le contrôle des paramètres cliniques; en cas d’amélioration des douleurs consécutives à la castration ou lorsque la réponse tumorale est inadéquate, on contrôlera le taux de testostérone. On devrait également surveiller le PSA (antigène spécifique de la prostate) sérique.
Au début du traitement, point n’est besoin d’administrer de l’antiandrogène.
Firmagon est administré par injection s.c. abdominale. On changera régulièrement de site d’injection. Les injections doivent être réalisées dans une partie du corps non exposée à la pression, par exemple à distance de la taille, de la ceinture ou des côtes.
Instructions posologiques particulières
Patients âgés ou insuffisants hépatiques resp. rénaux
Chez les patients âgés ou chez les patients présentant une insuffisance hépatique ou rénale faible ou modérée, on n’aura pas besoin d’ajuster la dose (voir la section Pharmacocinétique). Les patients atteints d’une insuffisance hépatique ou rénale sévère n’ont pas encore été étudiés; on usera donc de prudence en leur administrant Firmagon.
Firmagon n’ayant pas été étudié chez la femme, il ne doit pas lui être administré (voir les Contre-indications).
Enfants et adolescents
Il n’existe pas d’indication correspondante chez l’enfant et l’adolescent (voir les Contre-indications).
Contre-indicationsHypersensibilité au dégarélix ou à l’un des constituants du produit.
Chez la femme et chez le patient pédiatrique, l’administration de Firmagon est contre-indiquée.
Mises en garde et précautionsAltération de l’intervalle QT/QTc
Lors de la privation au long cours d'androgène, un allongement de l'intervalle QT survient chez env. 20% des patients (voir Propriétés/Effets). Le médecin traitant devra évaluer soigneusement si les avantages d'une déprivation androgénique l'emportent sur le risque éventuel chez les patients présentant des valeurs initiales QT >450 ms (par exemple prolongation congénitale de QT) ou chez les patients ayant des antécédents ou des facteurs de risque de torsade de pointes.
Une comédication comportant des substances allongeant l’intervalle QT (comme par exemple les antiarythmiques de la classe IA [p.ex. quinidine, procaïnamide] et de la classe III [p.ex. amiodarone, sotalol]) est à éviter. Pour d'autres informations concernant l'efficacité clinique, voir la rubrique Propriétés/Effets.
Modifications de la densité osseuse
Les essais cliniques du dégarélix n’ont pas étudié la densité osseuse. Chez des patients sous traitement par des agonistes de la GnRH ainsi que chez des orchiectomisés, une diminution de la densité osseuse a été observée. Il convient d’en déduire qu’une suppression à long terme de la testostérone par dégarélix peut aussi influencer la densité osseuse.
InteractionsOn ne dispose pas d’études cliniques sur les interactions avec d’autres principes actifs.
Le dégarélix n’est pas un substrat pour le système CYP450 de l’être humain; in vitro, on n’a pas pu démontrer d’induction resp. d’inhibition de CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ou CYP3A4/5. Par ailleurs, aucune interaction de dégarélix avec les transporteurs pertinents testés d'efflux et d'absorption de médicaments n'a été observée. Ainsi, il apparaît que des interactions pharmacocinétiques cliniquement significatives avec d’autres principes actifs sont improbables.
Grossesse, allaitementFirmagon ne doit pas être administré aux femmes enceintes ou allaitantes (voir Contre-indications).
En raison des propriétés pharmacologiques, l’administration de Firmagon en cours de grossesse peut léser le fœtus.
Effet sur l’aptitude à la conduite et l’utilisation de machinesFirmagon a une légère influence sur l’aptitude à la conduite ou l’utilisation de machines.
Aucune étude n’a été réalisée quant à l’effet de Firmagon sur l’aptitude à la conduite et à l’utilisation de machines.
Toutefois, au titre d’effets indésirables, fatigue et sensations de vertige ont été fréquemment observées qui pourraient diminuer l’aptitude à la conduite et à l’utilisation de machines.
Effets indésirablesLa plupart des effets indésirables observés sous dégarélix sont la conséquence de la suppression de la testostérone.
Les effets secondaires les plus fréquents lors de l’essai comparatif de phase III (n= 409) ont été les bouffées de chaleur (25%) et la prise de poids (7%), effets physiologiques de la suppression de la testostérone. Par ailleurs, les réactions au site d’injection étaient très fréquentes chez les patients, surtout douleurs (28%) et érythème (17%), ainsi que tuméfaction (6%), induration (4%) et formation d’une nodosité (3%). Ces événements étaient plus fréquents en début de traitement. De très rares cas de réactions graves au site d’injection ont été rapportés telles qu’une infection, un abcès ou une nécrose, nécessitant un traitement chirurgical ou un drainage.
Les effets indésirables figurant ci-dessous ont été observés dans les essais cliniques de phase II et III, au cours desquels 1259 patients en tout ont été exposés au dégarélix, soit une durée d’exposition totale de 1781 années-patients. Parmi ces patients, 803 ont été exposés pendant un an ou plus au dégarélix, 359 pendant 2 ans et plus et 153 pendant 3 ans et plus.
Lors de l’évaluation des effets indésirables, les fréquences sont définies de la manière suivante: très fréquent ≥1/10, fréquent ≥1/100 et <1/10, occasionnel ≥1/1000 et <1/100, rare ≥1/10’000 et <1/1000. Dans chaque groupe de fréquence, les effets secondaires figurent par ordre de gravité.
Affections hématologiques et du système lymphatique
Fréquent: anémie.
Rare: fièvre neutropénique.
Affections du système immunitaire
Rare: réactions d’hypersensibilité telles qu'anaphylaxie, angiœdème.
Troubles du métabolisme et de la nutrition
Fréquent: prise de poids.
Occasionnel: hyperglycémie/diabète, taux de cholestérol élevé, perte de poids, perte d’appétit, modification du calcium sérique.
Rare: hyperkaliémie.
Affections psychiatriques
Fréquent: insomnie.
Occasionnel: libido diminuée, dépression, troubles psychiques.
Très rares: anxiété, variations d’humeur.
Affections du système nerveux
Fréquent: vertiges, céphalées.
Occasionnel: hypoesthésies.
Affections oculaires
Occasionnel: vision trouble.
Affections cardiaques
Occasionnel: palpitations, arythmies (y compris fibrillation auriculaire), allongement QT.
Rare: infarctus du myocarde, insuffisance cardiaque congestive.
Affections vasculaires
Très fréquent: bouffées de chaleur (31%).
Occasionnel: hypertension, réaction vasovagale (hypotension comprise).
Affections respiratoires, thoraciques et médiastinales
Occasionnel: dyspnée.
Affections gastro-intestinales
Fréquent: nausées, diarrhée.
Occasionnel: constipation, douleurs abdominales, sécheresse buccale, vomissements.
Affections hépatobiliaires
Fréquent: augmentation des transaminases.
Occasionnel: élévation du taux de bilirubine, augmentation de la phosphatase alcaline.
Affections de la peau et du tissu sous-cutané
Fréquent: hyperhidrose (sudation nocturne incluse), éruption cutanée.
Occasionnel: érythème, prurit, urticaire, nodosités, alopécie.
Affections musculosquelettiques et du tissu conjonctif
Fréquent: douleurs musculaires.
Occasionnel: arthralgie, faiblesse musculaire, tuméfaction/raideur articulaire, crampes musculaires, ostéopénie/ostéoporose.
Rare : rhabdomyolyse.
Affections du rein et des voies urinaires
Occasionnel: urgence mictionnelle plus fréquente, pollakiurie, nycturie, dysurie, incontinence, trouble de la fonction rénale.
Affections des organes de reproduction et du sein
Fréquent: gynécomastie, dysfonction érectile, atrophie testiculaire.
Occasionnel: douleurs de la poitrine, irritation des organes génitaux, douleurs testiculaires, douleurs abdominales, troubles éjaculatoires.
Troubles généraux et anomalies au site d’administration
Très fréquent: réactions au site d’injection (26%) (p.ex. douleurs, érythème, tuméfaction).
Fréquent: fatigue, fièvre avec frissons, symptômes para grippaux.
Occasionnel: malaise, œdème périphérique.
Très rare: réactions graves au site d'injection, telles qu'infections, abcès ou nécrose.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n’a été rapporté à ce jour.
En présence d’un surdosage, on surveillera le patient en prenant le cas échéant les mesures de soutien qui conviennent.
Propriétés/EffetsCode ATC
L02BX02
Mécanisme d’action
Le dégarélix est un antagoniste sélectif des récepteurs de la GnRH, qui se fixe de manière compétitive et réversible sur les récepteurs de la GnRH de l’hypophyse, bloquant de la sorte rapidement la libération des gonadotrophines. Il s’ensuit une castration hormonale.
Une dose unique de Firmagon 240 mg, suivie d’une dose d’entretien mensuelle de 80 mg, permet une baisse rapide de la LH et de la FSH, puis de la testostérone. Le taux plasmatique de la dihydrotestostérone (DHT) diminue de façon analogue à celui de la testostérone.
Contrairement aux agonistes de la GnRH, le dégarélix, un antagoniste de la GnRH, n’induit pas une augmentation initiale de la LH et de la testostérone.
Sous dégarélix, les taux de testostérone ont été abaissés au-dessous du taux de castration de 0,5 ng/ml; on a montré que la dose d’entretien mensuelle de 80 mg entraîne chez 97% des patients une suppression durable de la testostérone sur un an. Le taux moyen de testostérone après un an de traitement est de 0,087 ng/ml (intervalle interquartile 0,06–0,15), n= 167.
Pharmacodynamique
Voir la rubrique « Mécanisme d’action ».
Efficacité clinique
L’efficacité du dégarélix a été étudiée pendant un an au cours d’un essai clinique de phase III randomisé, ouvert, en trois bras, chez n= 620 patients de 47 à 98 ans. Le dégarélix en administration sous-cutanée à la dose initiale de 240 mg suivie de doses mensuelles de 160 mg ou 80 mg, a été comparé à la leuproréline intramusculaire à raison de 7,5 mg/mois. Le carcinome de la prostate était local chez 31% des patients randomisés, local avancé chez 29% et métastatique chez 20%; chez 7%, l’état métastatique n’était pas connu, et 13% avaient été prostatectomisés ou irradiés.
Un total de 504 patients (81%) a terminé l’étude. Dans le bras de traitement sous dégarélix 240 mg/80 mg, 41 patients (20%) ont abandonné l’étude, contre 32 patients (16%) dans le groupe de la leuproréline. Le critère principal de jugement était la preuve que le médicament entraînait une suppression de la testostérone (à <0,5 ng/ml) durant plus de 12 mois. Sous dégarélix, ce critère a été rempli à 97,2% (93,5; 98,8%), sous leuproréline à 96,4% (92,5; 98,2%). La différence entre le dégarélix (deux bras) et la leuproréline était de 1,9% (IC 97,5%: –1,8; 5,7); de la sorte, les critères de non-infériorité étaient satisfaits.
Chez aucun des patients traités par le dégarélix, on n’a relevé une élévation de la testostérone; au jour 3, le taux de testostérone avait chuté en moyenne de 94%.
Le taux de PSA entre autres servait de critère secondaire de jugement. Deux semaines après l’application du dégarélix, le PSA avait diminué de 64%, après un mois de 85% et après trois mois de 95% pour rester supprimé pendant toute la durée d’un an du traitement (diminution d’env. 97% de la valeur initiale). Aux jours 14 et 28, le taux de PSA sous dégarélix (240 mg/80 mg) se situait significativement plus bas que sous leuproréline (p <0,001). Au jour 56, on n’observait plus de différence entre le dégarélix et le comparateur. La grosseur de la tumeur n’a pas été mesurée directement pendant les essais cliniques.
Réversibilité de la sécrétion de testostérone
Dans une étude ayant inclus des patients avec PSA en progression après traitement local (principalement prostatectomie et radiothérapie), Firmagon a été administré pendant sept mois, suivi par une période de surveillance de sept mois. Le temps médian écoulé jusqu’à la normalisation des valeurs de la testostérone (>0,5 ng/ml, au dessus du seuil de castration) après l’arrêt du traitement était 112 jours (calculé à partir du début de la période de surveillance, soit 28 jours après la dernière injection). La durée médiane pour atteindre un taux sérique de testostérone >1,5 ng/ml (au dessus de la limite inférieure des taux normaux) était de 168 jours.
Effet sur le volume de la prostate
Un traitement de trois mois avec dégarélix (240/80 mg schéma posologique) a entraîné une réduction de 37% du volume de la prostate, mesuré par échographie transrectale (TRUS) chez des patients nécessitant une hormonothérapie avant la radiothérapie ou chez des patients chez lesquels une castration médicale était prévue. La réduction du volume de la prostate était similaire à celle atteinte avec la goséréline, associée à un antiandrogène, pour prévenir le flare-up.
Temps QT
Dans l’étude comparant Firmagon à la leuproréline, des ECG ont été réalisés périodiquement. Des intervalles QT/QTc supérieurs à 450 ms ont été observés chez environ 20% des patients avec les deux traitements. Entre l’inclusion et la fin de l’étude, l’allongement médian a été de 12,3 ms (3,2%) avec Firmagon et de 16,7 ms (3,5%) avec la leuproréline.
Une investigation approfondie de l’intervalle QT a montré qu’il n’y avait pas d’effet intrinsèque de dégarélix sur l’intervalle QT/QTc. L’absence d’effets intrinsèques de dégarélix sur la repolarisation cardiaque (QTcF), le rythme cardiaque, la conduction auriculo-ventriculaire, la dépolarisation cardiaque, et la morphologie de l’onde T ou de l’onde U a été confirmée dans une population des volontaires sains (N = 80) ayant reçu une perfusion i.v. de dégarélix de 60 minutes, atteignant une Cmax moyenne de 222 ng/ml. Ceci représente approximativement 3 à 4 fois la Cmax obtenue pendant le traitement du cancer de la prostate.
Anticorps contre le dégarélix
L’apparition d’anticorps antidégarélix a été observée chez 10% des patients au cours du traitement par Firmagon d’une durée d’un an et des anticorps antidégarélix ont été observés chez 29 % des patients traités par dégarélix pendant une durée pouvant aller jusqu’ à 5,5 ans. On ne dispose pas d’indications démontrant que la sécurité d’emploi et l’efficacité de Firmagon soient altérées par la formation d’anticorps après 5,5 années de traitement. Des résultats concernant les anticorps n’ont pas été examinés au-delà d’un an de traitement.
PharmacocinétiqueAbsorption
Après administration sous-cutanée, Firmagon constitue un dépôt d’où le dégarélix est introduit dans la circulation.
Avec la dose initiale de 240 mg, une Cmax de 53,4 ng/ml est atteinte en 1–2 jours. A l’état d’équilibre, la concentration médiane minimale est de 10,9 ng/ml.
Distribution
Chez l’homme âgé en bonne santé, le volume de distribution est d’environ 1 l/kg. La liaison aux protéines plasmatiques est évaluée à environ 90%.
Métabolisme
Le dégarélix est dégradé en peptides dans le foie; il est éliminé principalement dans les fèces sous forme de fragments peptidiques. On ne détecte pas de métabolites significatifs dans le plasma.
Élimination
Environ 20% de la dose sont excrétés par les reins sous forme de dégarélix inchangé. Chez l’homme âgé en bonne santé, la clairance est d’environ 35–50 ml/h/kg. L’élimination s’effectue en deux phases avec une demi-vie terminale d’environ 43 jours pour la dose initiale et de 28 jours pour la dose d’entretien.
Cinétique pour certains groupes de patients
Troubles de la fonction rénale
Aucune étude n’a été effectuée chez les patients à fonction rénale diminuée.
Troubles de la fonction hépatique
Les patients dont la fonction hépatique était légèrement ou moyennement diminuée n’ont pas présenté une augmentation notable de l’exposition par rapport aux personnes saines. Le dégarélix n’a pas été étudié chez les insuffisants hépatiques sévères (Child Pugh C).
Patients âgés
L’analyse pharmacocinétique de la population de patients atteints de carcinome de la prostate n’a montré que de faibles différences de clairance du dégarélix en fonction de l’âge et du poids.
Données précliniquesDans les études de reproduction, le dégarélix a entraîné chez les animaux mâles une infertilité qui est due à l’effet pharmacologique.
Des études de reproduction portant sur le dégarélix chez l’animal femelle ont donné les résultats auxquels on pouvait s’attendre vu les propriétés pharmacologiques du médicament. Celui-ci a allongé de manière dose-dépendante le temps s’écoulant jusqu’à l’accouplement et à la grossesse tout en réduisant le nombre des corps jaunes et en augmentant les pertes pré- et postimplantatoires, en augmentant le taux des avortements, des pertes précoces d’embryons et de fœtus, des naissances précoces et en augmentant la durée des accouchements.
Basées sur les études conventionnelles traitant de la pharmacologie sécuritaire, de la toxicité de doses répétées, de la toxicité de reproduction, de la génotoxicité et du potentiel cancérogène, les données ne fournissent aucune indication particulière relative à des dangers courus par l’être humain.
Les études de la toxicité aiguë, subaiguë et chronique chez le rat et le singe après l’administration s.c. de dégarélix n’ont pas révélé de toxicité pour les organes-cibles. De fortes doses s.c. de dégarélix ont provoqué chez l’animal une irritation locale due au principe actif.
Le dégarélix n’a pas montré de potentiel mutagène.
Remarques particulièresIncompatibilités
Aucune étude de tolérance n’ayant été effectuée, ce médicament ne doit pas être mélangé à d’autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Stabilité après ouverture
Après la reconstitution (voir la description ci-dessous), le produit doit être injecté sur-le-champ.
La préparation ne contient pas de conservateur. Sa stabilité chimique et physique « in use » a été démontrée pendant 1 heure à 25°C. Pour des raisons microbiologiques, la préparation prête à l’emploi doit être utilisée immédiatement après ouverture.
Remarques particulières concernant le stockage
Conserver hors de portée des enfants.
Conserver à température ambiante (15-25°C).
Ne pas congeler.
Remarques concernant la manipulation
On évitera d’administrer le médicament à une posologie différente. La suspension préparée devrait former une solution limpide sans particules non dissoutes.
Préparation du médicament prêt à l’emploi
REMARQUE IMPORTANTE
Après avoir introduit l’eau stérile dans le flacon concernant le lyophilisat:
– Ne jamais secouer le flacon.
Mode d’emploi pour la préparation du médicament prêt à l’emploi :
Firmagon 120 mg – dose initiale
L’emballage contient deux sets de lyophilisat et 2 seringues préremplies avec solvant devant être reconstitué pour l’injection sous-cutanée. Cela signifie que chacune des étapes suivantes doit être effectuée deux fois.
Après reconstitution, la concentration est de 40 mg/ml.
|
|
|
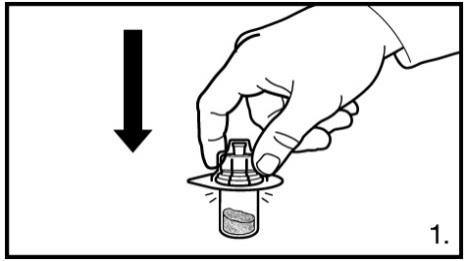
1. Enlever l’emballage des adaptateurs pour flacons. Fixer l’adaptateur sur le flacon perforable de lyophilisat. A cette fin, exercer une pression sur l’adaptateur jusqu’à ce que la pointe perce le bouchon en caoutchouc, et qu’un déclic indique la mise en place de l’adaptateur.
| |
2.Préparer la seringue préremplie en fixant la tige de piston.
| |
|
|
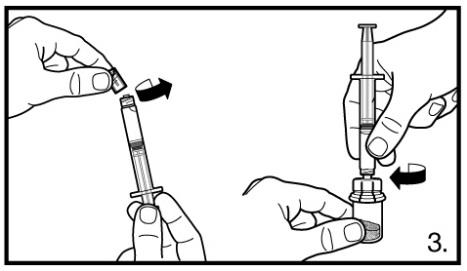
3.Retirer le capuchon de protection de la seringue préremplie. Visser la seringue sur l’adaptateur du flacon perforable de lyophilisat. Comprimer doucement l’eau stérile pour préparations injectables dans le flacon perforable contenant la poudre lyophilisée.
| |
|
|
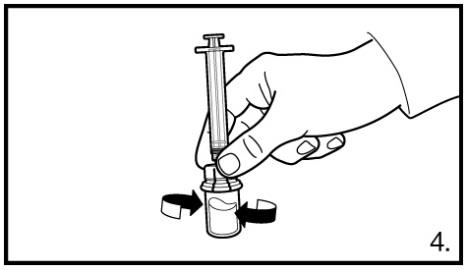
4 Laisser la seringue sur l’adaptateur et faire tourner très prudemment le flacon jusqu’à ce que la solution apparaisse limpide et ne présente ni reste de poudre ni particule. Si de la poudre reste sur la paroi du flacon au-dessus du liquide, le flacon peut être incliné légèrement. NE PAS AGITER POUR EVITER LA FORMATION DE MOUSSE.
Un anneau de petites bulles d’air à la surface du liquide ne pose pas problème. Dans la plupart des cas, la préparation de la suspension est rapide, mais peut parfois durer jusqu’à 15 minutes.
| |
|
|
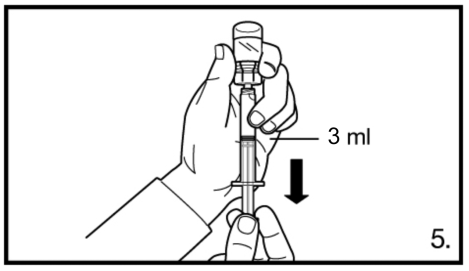
5. Retourner le flacon et le tenir à la verticale, prélever avec la seringue 3,0 ml de solution Firmagon 120 mg (marquage sur la seringue).
Il faut s’assurer de prélever le volume exact. Si nécessaire, le flacon peut s’incliner légèrement à cet effet. Eliminer avec précaution d’éventuelles bulles d’air.
| |
6. Retirer la seringue de l’adaptateur du flacon et placer sur elle l’aiguille à cône orange (25G/0,5× 25 mm) pour injection sous-cutanée profonde. Eliminer avec précaution d’éventuelles bulles d’air.
| |
|

|
7. Saisir la peau de l’abdomen avec le tissu sous-cutané et la soulever. Pratiquer une injection sous-cutanée profonde. Pour ce faire, insérer profondément l’aiguille à un angle d’au moins 45°.
Surtout ne pas injecter dans une veine. Retirer le piston avec précaution pour vérifier l’absence de sang. Si du sang devait apparaître dans la seringue, le médicament ne doit pas être appliqué. Dans ce cas, interrompre le processus et éliminer l’aiguille et la seringue. Préparer une nouvelle dose pour le patient.
Injecter 3,0 ml de Firmagon 120 mg immédiatement après la préparation.
Répéter la reconstitution pour la deuxième dose. Choisir un autre site pour la deuxième injection et injecter 3,0 ml provenant du deuxième flacon.
| |
8. À noter: Les injections doivent être pratiquées là où le patient n’est pas exposé à des pressions, c’est-à-dire pas trop près de la taille, de la ceinture et pas non plus à proximité des côtes.
|
Mode d’emploi de Firmagon 80 mg
L’emballage contient 1 set de lyophilisat et 1 seringue préremplie avec solvant devant être reconstitué avant l’injection sous-cutanée.
Après reconstitution, la concentration est de 20 mg/ml.
|
|

|
1. Enlever l’emballage des adaptateurs pour flacons. Fixer l’adaptateur sur le flacon perforable de lyophilisat. A cette fin, exercer une pression sur l’adaptateur jusqu’à ce que la pointe perce le bouchon en caoutchouc, et qu’un déclic indique la mise en place de l’adaptateur.
| |
2. Préparer la seringue préremplie en fixant la tige de piston.
| |
|
|
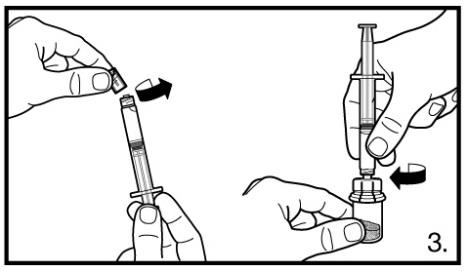
3. Retirer le capuchon de protection de la seringue préremplie. Visser la seringue sur l’adaptateur du flacon perforable de lyophilisat. Comprimer doucement l’eau stérile pour préparations injectables dans le flacon perforable contenant la poudre lyophilisée.
| |
|
|
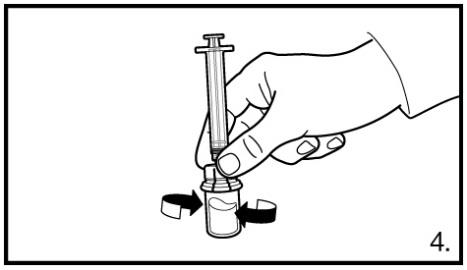
4. Laisser la seringue sur l’adaptateur et faire tourner très prudemment le flacon jusqu’à ce que la solution apparaisse limpide et ne présente ni reste de poudre ni particule. Si de la poudre reste sur la paroi du flacon au-dessus du liquide, le flacon peut être incliné légèrement. NE PAS AGITER POUR EVITER LA FORMATION DE MOUSSE.
Un anneau de petites bulles d’air à la surface du liquide ne pose pas problème. Dans la plupart des cas, la préparation de la suspension est rapide, mais peut parfois durer jusqu’à 15 minutes.
| |
|
|
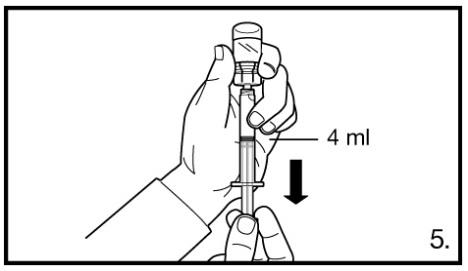
5. Retourner le flacon et le tenir à la verticale, prélever avec la seringue 4,0 ml de solution Firmagon 80 mg (marquage sur la seringue).
Il faut s’assurer de prélever le volume exact. Si nécessaire, le flacon peut s’incliner légèrement à cet effet. Eliminer avec précaution d’éventuelles bulles d’air.
| |
6. Retirer la seringue de l’adaptateur du flacon et placer sur elle l’aiguille à cône orange (25G/0,5× 25 mm) pour injection sous-cutanée profonde. Eliminer avec précaution d’éventuelles bulles d’air.
| |
|

|
7. Saisir la peau de l’abdomen avec le tissu sous-cutané et la soulever. Pratiquer une injection sous-cutanée profonde. Pour ce faire, insérer profondément l’aiguille à un angle d’au moins 45°.
Surtout ne pas injecter dans une veine. Retirer le piston avec précaution pour vérifier l’absence de sang. Si du sang devait apparaître dans la seringue, le médicament ne doit pas être appliqué. Dans ce cas, interrompre le processus et éliminer l’aiguille et la seringue. Préparer une nouvelle dose pour le patient.
Injecter 4,0 ml de Firmagon 80 mg immédiatement après la préparation.
| |
8. À noter: Les injections doivent être pratiquées là où le patient n’est pas exposé à des pressions, c’est-à-dire pas trop près de la taille, de la ceinture et pas non plus à proximité des côtes.
|
Élimination
Il n’y a pas d’exigences particulières d’élimination. Les produits non utilisés ou les déchets doivent être éliminés conformément aux prescriptions locales.
Numéro d’autorisation59455 (Swissmedic)
PrésentationFirmagon 120 mg est disponible en emballage contenant 2 flacons de lyophilisat et 2 seringues préremplies avec solvant, 2 adaptateurs pour flacons, ainsi que 2 aiguilles (A).
Firmagon 80 mg est disponible en emballage contenant 1 flacon de lyophilisat et 1 seringue préremplie avec solvant, 1 adaptateur pour flacon, ainsi que 1 aiguille (A).
Titulaire de l’autorisationFerring AG, 6340 Baar
Mise à jour de l’informationMai 2020
|










