CompositionPrincipes actifs
Rotavirus humain vivant atténué, souche RIX4414* (≥106,0 DICC50/dose).
* Produite sur cellules Vero.
Excipients
Saccharose (1073 mg, voir «Mises en garde et précautions»), adipate disodique, milieu Eagle modifié de Dulbecco (DMEM), Aqua ad iniectabilia ad 1,5 ml.
Indications/Possibilités d’emploiRotarix est indiqué dans l'immunisation active des enfants à partir de l'âge de 6 semaines pour la prévention d'une gastro-entérite due à des rotavirus (RV).
L'efficacité contre les rotavirus des types G1P[8], G2P[4], G3P[8], G4P[8] et G9P[8] a pu être démontrée dans des études cliniques (voir «Propriétés/Effets»).
Posologie/Mode d’emploiPosologie usuelle
L'immunisation de base comprend deux doses. L'intervalle entre les deux doses doit être au moins de 4 semaines. La première dose peut être administrée à partir de l'âge de six semaines. La deuxième dose devrait être administrée avant l'âge de 16 semaines et doit être administrée avant l'âge de 24 semaines. L'administration de Rotarix est contre-indiquée après la fin de la 24ème semaine de vie.
Rotarix peut être administré à la même posologie à des nourrissons nés prématurés (voir «Effets indésirables» et «Propriétés/Effets»).
Aucune dose de remplacement n'a été administrée dans le cadre des études cliniques si, pendant ou après la prise du vaccin, un enfant a dû cracher, régurgiter ou vomir. Si le cas rare devait se présenter où un enfant a craché, régurgité ou vomi pendant ou après la prise du vaccin, une dose unique de remplacement peut être administrée le cas échéant au même moment.
Il est recommandé chez l'enfant ayant reçu une première dose de Rotarix de terminer l'immunisation de base par le même vaccin (Rotarix). Il n'existe pas de données de tolérance, d'immunogénicité ou d'efficacité quand Rotarix est administré comme 1ère dose et un autre vaccin à rotavirus comme seconde dose ou vice versa.
Mode d'administration
Rotarix est destiné uniquement à l'usage oral.
ROTARIX NE DOIT JAMAIS ÊTRE INJECTÉ.
Il n'y a aucune restriction concernant la consommation de nourriture ou de liquides (y compris le lait maternel) par le nourrisson, que ce soit avant ou après la vaccination.
Contre-indicationsRotarix ne doit pas être utilisé chez les enfants présentant une hypersensibilité connue à l'un des composants du vaccin ou chez les enfants ayant présenté des signes d'hypersensibilité après une administration antérieure de Rotarix.
Rotarix ne doit pas être utilisé chez les enfants ayant des antécédents d'invagination intestinale ou chez les enfants ayant une malformation congénitale de l'appareil gastro-intestinal prédisposant à une invagination intestinale (comme p.ex. le diverticule de Meckel).
Rotarix ne doit pas être utilisé chez les enfants ayant une ImmunoDéficience Combinée Sévère (IDCS ou SCID, Severe Combined Immunodeficiency) (voir «Effets indésirables»).
Comme pour d'autres vaccins, la vaccination doit être différée chez les enfants ayant une maladie fébrile sévère aiguë. Une infection bénigne, comme p.ex. un refroidissement, ne constitue pas une contre-indication.
L'administration de Rotarix doit être différée chez les enfants souffrant de diarrhée ou de vomissements.
Rotarix ne doit plus être administré après la fin de la 24ème semaine de vie.
Mises en garde et précautionsROTARIX NE DOIT JAMAIS ÊTRE INJECTÉ.
La vaccination doit être précédée d'une recherche des antécédents médicaux, notamment concernant la tolérance de vaccinations antérieures et les éventuelles contre-indications.
Le vaccin contient du saccharose comme excipient. Les patients porteurs de maladies rares et héréditaires, telles qu'intolérance au fructose, malabsorption du glucose-galactose ou insuffisance en sucrase-isomaltase ne doivent pas prendre ce vaccin.
Il n'y a pas de données cliniques de tolérance et d'efficacité de Rotarix chez les enfants ayant des pathologies gastro-intestinales ou des troubles de la croissance. L'administration de Rotarix n'est pas conseillée chez ces enfants.
Le risque d'invagination intestinale a été évalué dans le cadre d'une grande étude de sécurité conduite en Amérique Latine et en Finlande, à laquelle 63'225 nourrissons ont participé. Cette étude clinique n'a pas mis en évidence de risque plus élevé d'invagination intestinale après la prise de Rotarix par rapport au placebo.
Des invaginations intestinales surviennent spontanément dans le monde entier, avec des fréquences variables en fonction de la région géographique et de l'appartenance ethnique. L'étude PASS du Mexique (Velàzquez 2012) a examiné environ 1,5 million d'enfants après vaccination par Rotarix dans la période de janvier 2008 à octobre 2010 et a enregistré 701 cas d'invagination intestinale au total. Rotarix a conduit à un risque significativement plus élevé, multiplié par 6,49 (IC à 95%: 4,17-10,1) 7 jours après administration de la 1ère dose et multiplié par 1,75 (IC à 95%: 1,24-2,48) 31 jours après la 1ère dose. Après administration de la 2ème dose de Rotarix, il n'a pas été observé de risque significativement plus élevé, avec des valeurs de 1,29 (IC à 95%: 0,80-2,11) à 7 jours et 1,06 (IC à 95%: 0,75-1,48) à 31 jours. Une analyse cumulative de 5 études de sécurité post-commercialisation de 4 pays différents, dont l'étude PASS du Mexique, a montré un risque significativement plus élevé d'invagination intestinale de 5,39 (IC à 95%: 3,92-7,41) 7 jours après l'administration de la 1ère dose de Rotarix et de 1,81 (IC à 95%: 1,31-2,49) 7 jours après l'administration de la 2ème dose. Jusqu'à 6 cas supplémentaires d'invagination intestinale par an sur 100'000 nourrissons ont été observés aux États-Unis et en Australie. Une publication de 2013 a estimé pour l'Australie une augmentation annuelle de 14 invaginations intestinales supplémentaires en nombre absolu en rapport avec différents vaccins contre les rotavirus, en supposant une couverture vaccinale de 85%. On ne dispose pas d'estimations du risque relatif en Suisse. Pour l'évaluation du bénéfice de Rotarix en Suisse, il faut considérer qu'aucun cas d'infection à rotavirus de type sauvage ayant conduit au décès n'a été officiellement documenté en Suisse entre 1995 et 2005. Le plan de vaccination suisse de 2014 indique que les infections à rotavirus en Suisse n'ont pratiquement jamais une issue fatale.
Les professionnels de santé doivent ainsi par mesure de précaution surveiller tout symptôme évocateur d'une invagination intestinale (douleurs abdominales sévères, vomissements persistants, présence de sang dans les selles, ballonnements abdominaux et/ou fièvre élevée). Il doit être recommandé aux parents de rapporter immédiatement de tels symptômes.
Voir sous «Effets indésirables», expérience post-commercialisation.
Pour des informations sur les personnes ayant une prédisposition à une invagination intestinale, voir sous «Contre-indications».
Une altération de la tolérance ou de l'efficacité de Rotarix n'est pas attendue dans le cas d'une infection par le VIH asymptomatique ou légèrement symptomatique. Une étude clinique réalisée chez un nombre limité de nourrissons séropositifs au VIH et asymptomatiques ou légèrement symptomatiques n'a montré aucun problème apparent de tolérance (voir «Effets indésirables»).
L'administration de Rotarix à des nourrissons ayant une immunodéficience connue ou suspectée doit être soigneusement évaluée compte tenu des bénéfices et des risques potentiels.
Une excrétion du virus vaccinal dans les selles est observée après vaccination; elle dure en moyenne pendant 10 jours, avec un pic d'excrétion vers le septième jour (voir «Propriétés/Effets»). Dans les études cliniques, des cas de transmission des virus vaccinaux excrétés d'enfants vaccinés à des personnes contactes séronégatives ont été observés, cependant sans apparition de symptômes cliniques. Rotarix doit être administré avec prudence chez les personnes en contact proche avec des personnes immunodéprimées, telles que des personnes atteintes d'affections malignes ou des personnes dont l'immunosuppression est due à une autre cause ou des personnes recevant un traitement immunosuppresseur.
Il doit être recommandé aux personnes en contact avec des enfants récemment vaccinés de veiller à leur hygiène personnelle (p.ex. se laver les mains après avoir changé les couches du nourrisson).
Comme pour tous les vaccins, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les enfants vaccinés (voir «Propriétés/Effets»).
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des doses de primovaccination chez les grands prématurés (nés avant la fin de la 28ème semaine de grossesse) et particulièrement chez ceux ayant des antécédents d'immaturité pulmonaire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Dans les études cliniques, l'efficacité a été démontrée contre les rotavirus des types G1P[8], G2P[4], G3P[8], G4P[8] et G9P[8]. Cependant, les données disponibles à l'heure actuelle ne permettent pas encore d'établir l'étendue de la protection que Rotarix pourrait conférer contre les infections dues à d'autres types G. Les études cliniques d'efficacité ont été effectuées en Europe (Rota-036, N=3'874) et en Amérique Centrale et du Sud (Rota-023, N=17'867).
Rotarix ne protège pas contre les gastro-entérites qui ne sont pas dues aux rotavirus.
Aucune donnée n'est disponible concernant l'utilisation de Rotarix en prophylaxie post-exposition.
InteractionsRotarix peut être administré simultanément avec l'un des vaccins monovalents ou combinés suivants (incluant le vaccin hexavalent DTPa-HBV-IPV+Hib): vaccin diphtérie-tétanos-coqueluche à germes entiers (DTPw), vaccin diphtérie-tétanos-coqueluche acellulaire (DTPa), vaccin Haemophilus influenzae de type b (Hib), vaccin poliomyélitique inactivé (IPV), vaccin hépatite B (HBV), vaccin contre les pneumocoques et les méningocoques du sérotype C. Des études cliniques ont montré que les réponses immunitaires et les profils de tolérance des vaccins administrés n'étaient pas modifiés. L'administration concomitante de Rotarix et du vaccin poliomyélitique oral (VPO) n'affecte pas la réponse immunitaire aux antigènes poliomyélitiques. Bien que l'administration concomitante du vaccin VPO puisse faiblement réduire la réponse immunitaire au vaccin rotavirus, la protection clinique contre les gastro-entérites à rotavirus sévères est conservée.
Il n'y a aucune restriction concernant l'alimentation ou les habitudes de boire de l'enfant, que ce soit avant ou après la vaccination.
Grossesse, allaitementRotarix n'est pas destiné à l'usage chez l'adulte. Il n'y a pas de données cliniques concernant l'utilisation du vaccin pendant la grossesse ou l'allaitement et des études de reproduction chez l'animal n'ont pas été effectuées.
D'après les données issues des essais cliniques, l'allaitement n'affecte pas la protection conférée par Rotarix contre une gastro-entérite à rotavirus. L'allaitement peut être poursuivi, aussi pendant l'immunisation avec Rotarix.
Efficacité du vaccin chez les sujets allaités et les sujets qui ne sont pas allaités:
|
Statut de l'allaitement
|
Gastro-entérite à rotavirus tout grade
|
Gastro-entérite à rotavirus sévère
| |
|
Efficacité
|
IC 95%
|
Efficacité
|
IC 95%
| |
Allaitement (pendant au minimum une dose)
|
86,0%
|
76,8; 91,9
|
95,7%
|
88,2; 98,9
| |
Pas d'allaitement
|
90,8%
|
72,5; 97,7
|
96,2%
|
74,1; 99,9
|
Effet sur l’aptitude à la conduite et l’utilisation de machinesRotarix n'est pas destiné à l'emploi chez l'adulte.
Effets indésirablesDonnées des études cliniques
La convention suivante a été choisie pour la classification des effets indésirables selon leur fréquence: «très fréquent» (≥1/10), «fréquent» (< 1/10, ≥1/100), «occasionnel» (< 1/100, ≥1/1000), «rare» (< 1/1000, ≥1/10'000), «très rare» (< 1/10'000).
Le profil de sécurité décrit ci-dessous repose sur les données issues des études cliniques réalisées, soit avec la formulation lyophilisée, soit avec la formulation liquide de Rotarix.
Dans 23 études cliniques au total (y compris 2 études de phase III, Rota-023 et Rota-036), environ 106'000 doses de Rotarix (formulation lyophilisée ou liquide) ont été administrées à environ 51'000 nourrissons.
Dans en tout 4 études cliniques, environ 3'800 doses de Rotarix liquid ont été administrées à environ 1'900 nourrissons. Ces études ont montré que le profil de sécurité de la formulation liquide est comparable à celui de la formulation lyophilisée.
Dans 3 études cliniques contrôlées contre placebo (Finlande N=250 (200 sujets ont reçu Rotarix), Inde N=363 (182 sujets ont reçu Rotarix) et Bangladesh N=294 (196 sujets ont reçu Rotarix)), dans lesquelles Rotarix a été administré seul (l'administration des vaccins pédiatriques de routine a été décalée), l'incidence et la sévérité des événements indésirables sollicités (rapportés dans les 8 jours post-vaccination; diarrhée, vomissements, perte d'appétit, fièvre, irritabilité et toux/écoulement nasal) n'étaient pas significativement différentes dans le groupe recevant Rotarix comparé au groupe placebo. Aucune augmentation de l'incidence ou de la sévérité de ces événements n'a été observée après la seconde dose.
Dans une analyse poolée de 17 études cliniques contrôlées contre placebo (y compris 2 études de phase III, Rota-023 et Rota-036) (Europe, Amérique du Nord, Amérique Latine, Asie, Afrique) incluant les études dans lesquelles Rotarix était co-administré avec les vaccins pédiatriques habituels (voir «Interactions»), les effets indésirables suivants (rapportés dans les 31 jours post-vaccination) ont été considérés comme possiblement liés à la vaccination.
Affections gastro-intestinales
Fréquents: diarrhées.
Occasionnels: flatulences, douleurs abdominales, perte d'appétit.
Affections de la peau et du tissu sous-cutané
Occasionnels: dermatite.
Troubles généraux et anomalies au site d'administration
Fréquents: irritabilité.
Occasionnels: fièvre.
Le risque d'invagination intestinale a été évalué dans le cadre d'une large étude clinique (Rota-023) réalisée en Finlande et en Amérique Latine chez 63'225 nourrissons. Les résultats de cette étude, dont la majorité des enfants vaccinés étaient originaires d'Amérique Latine, montraient qu'il n'existe pas de preuve d'une augmentation du risque d'invagination intestinale dans le groupe Rotarix comparé au groupe placebo. Voir le tableau suivant:
|
Invagination intestinale dans les 31 jours après administration de la:
|
Rotarix
n = 31'673
|
Placebo
n = 31'552
|
Risque relatif
(intervalle de confiance 95%)
| |
première dose vaccinale
|
1
|
2
|
0,50 (0,07; 3,80)
| |
deuxième dose vaccinale
|
5
|
5
|
0,99 (0,31; 3,21)
|
Un cas d'invagination intestinale est survenu dans l'étude de phase III Rota-036 (en Europe) 8 jours après l'administration de la deuxième dose de Rotarix.
Tolérance chez les nourrissons nés prématurés
Dans une étude clinique chez des nourrissons prématurés nés entre 27 et 36 semaines de grossesse, 670 nourrissons prématurés ont reçu Rotarix et 339 un placebo. La première dose a été administrée à partir de l'âge de six semaines après la naissance. Des événements indésirables graves ont été observés chez 5,1% des nourrissons ayant reçu Rotarix et chez 6,8% des nourrissons ayant reçu un placebo. Les troubles sollicités et non-sollicités ont été observés à des fréquences similaires dans le groupe Rotarix et le groupe placebo. Aucun cas d'invagination intestinale n'a été rapporté.
Tolérance chez les enfants infectés par le VIH (virus de l'immunodéficience humaine)
Dans une étude clinique, 100 nourrissons infectés par le VIH ont reçu du Rotarix ou un placebo. Le profil de sécurité était similaire dans les deux groupes.
Effets indésirables après commercialisation
Très rares: PTI sévère.
Affections respiratoires, thoraciques et médiastinales
Apnée chez les grands prématurés (nés avant la fin de la 28ème semaine de grossesse) (voir «Mises en garde et précautions»).
Affections gastro-intestinales
Rares: présence de sang dans les selles (hématochézie ou rectorragie); gastroentérite avec excrétion du virus vaccinal chez les enfants ayant une ImmunoDéficience Combinée Sévère (IDCS).
Très rares: invagination intestinale (y compris décès) (voir «Mises en garde et précautions» et ci-dessous «Description de certains effets indésirables – Invagination intestinale»).
Description de certains effets indésirables
Invagination intestinale
L'étude PASS du Mexique (Velàzquez 2012) a examiné environ 1,5 million d'enfants après vaccination par Rotarix dans la période de janvier 2008 à octobre 2010 et a enregistré 701 cas d'invagination intestinale au total. Rotarix a conduit à un risque significativement plus élevé, multiplié par 6,49 (IC à 95%: 4,17-10,1) 7 jours après administration de la 1ère dose et multiplié par 1,75 (IC à 95%: 1,24-2,48) 31 jours après la 1ère dose. Après administration de la 2ème dose de Rotarix, il n'a pas été observé de risque significativement plus élevé, avec des valeurs de 1,29 (IC à 95%: 0,80-2,11) à 7 jours et 1,06 (IC à 95%: 0,75-1,48) à 31 jours. Une analyse cumulative de 5 études de sécurité post-commercialisation de 4 pays différents, dont l'étude PASS du Mexique, a montré un risque significativement plus élevé d'invagination intestinale de 5,39 (IC à 95%: 3,92-7,41) 7 jours après l'administration de la 1ère dose de Rotarix et de 1,81 (IC à 95%: 1,31-2,49) 7 jours après l'administration de la 2ème dose. Jusqu'à 6 cas supplémentaires d'invagination intestinale par an sur 100'000 nourrissons ont été observés aux États-Unis et en Australie. Une publication de 2013 a estimé pour l'Australie une augmentation annuelle de 14 invaginations intestinales supplémentaires en nombre absolu en rapport avec différents vaccins contre les rotavirus, en supposant une couverture vaccinale de 85%. On ne dispose pas d'estimations du risque relatif en Suisse. Pour l'évaluation du bénéfice de Rotarix en Suisse, il faut considérer qu'aucun cas d'infection à rotavirus de type sauvage ayant conduit au décès n'a été officiellement documenté en Suisse entre 1995 et 2005. Le plan de vaccination suisse de 2014 indique que les infections à rotavirus en Suisse n'ont pratiquement jamais une issue fatale.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage ont été rapportés. En général, le profil d'événements indésirables rapporté dans ces cas était similaire à celui observé après l'administration de la dose recommandée de Rotarix.
Propriétés/EffetsCode ATC
J07BH01
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Efficacité clinique de la formulation lyophilisée de Rotarix
Les études cliniques sur l'efficacité de Rotarix contre une gastro-entérite à rotavirus ont été conduites en Europe (Rota-036 notamment) et en Amérique Latine (Rota-023 notamment).
Une étude clinique réalisée en Europe a examiné Rotarix administré selon différents schémas vaccinaux européens (2e et 3e mois, 2e et 4e mois, 3e et 4e mois, 3e et 5e mois) chez 4'000 enfants. La sévérité de la gastro-entérite a été établie au moyen de l'échelle à 20 points de Vesikari. Cette méthode permet l'évaluation du tableau clinique complet de la gastro-entérite à RV tout en tenant compte du degré de gravité et de la durée des diarrhées et des vomissements, de la sévérité de la fièvre et de la déshydratation ainsi que de la nécessité de recourir à un traitement.
Le tableau suivant présente l'efficacité protectrice observée après 2 doses de Rotarix au cours de la 1ère et de la 2ème année de vie ainsi que le résultat cumulé des 2 années:
|
|
1ère année de vie
Rotarix N=2'572
Placebo N=1'302††
|
2ème année de vie
Rotarix N=2'554
Placebo N=1'294††
|
1ère et 2ème année de vie combinées
Rotarix N=2'572
Placebo N=1'302††
| |
Efficacité du vaccin (%) contre les gastro-entérites à rotavirus de tout grade et les gastro-entérites à rotavirus sévères
[IC 95%]
| |
Type
|
Tout grade
|
Sévère†
|
Tout grade
|
Sévère†
|
Tout grade
|
Sévère†
| |
G1P[8]
|
95,6*
[87,9;98,8]
|
96,4*
[85,7;99,6]
|
82,7*
[67,8;91,3]
|
96,5*
[86,2;99,6]
|
89,5*
[82,5;94,1]
|
96,4*
[90,4;99,1]
| |
G2P[4]
|
62,0
[<0,0;94,4]
|
74,7
[<0,0;99,6]
|
57,1*
[<0,0;82,6]
|
89,9*
[9,4;99,8]
|
58,3*
[10,1;81,0]
|
85,5*
[24,0;98,5]
| |
G3P[8]
|
89,9*
[9,5;99,8]
|
100*
[44,8;100]
|
79,7*
[<0,0;98,1]
|
83,1
[<0,0;99,7]
|
84,8*
[41,0;97,3]
|
93,7*
[52,8;99,9]
| |
G4P[8]
|
88,3*
[57,5;97,9]
|
100*
[64,9;100]
|
69,6
[<0,0;95,3]
|
87,3*
[<0,0;99,7]
|
83,1*
[55,6;94,5]
|
95,4*
[68,3;99,9]
| |
G9P[8]
|
75,6*
[51,1;88,5]
|
94,7*
[77,9;99,4]
|
70,5*
[50,7;82,8]
|
76,8*
[50,8;89,7]
|
72,5*
[58,6;82,0]
|
84,7*
[71,0;92,4]
| |
Souches contenant le génotype P[8]
|
88,2*
[80,8;93,0]
|
96,5*
[90,6;99,1]
|
75,7*
[65,0;83,4]
|
87,5*
[77,8;93,4]
|
81,8*
[75,8;86,5]
|
91,9*
[86,8;95,3]
| |
Souches de rotavirus circulantes
|
87,1*
[79,6;92,1]
|
95,8*
[89,6;98,7]
|
71,9*
[61,2;79,8]
|
85,6*
[75,8;91,9]
|
78,9*
[72,7;83,8]
|
90,4*
[85,1;94,1]
| |
Efficacité du vaccin (%) contre les gastro-entérites à rotavirus nécessitant une prise en charge médicale
[IC 95%]
| |
Souches de rotavirus circulantes
|
91,8*
[84;96,3]
|
76,2*
[63,0;85,0]
|
83,8*
[76,8;88,9]
| |
Efficacité du vaccin (%) contre les gastro-entérites à rotavirus nécessitant une hospitalisation
[IC 95%]
| |
Souches de rotavirus circulantes
|
100*
[81,8;100]
|
92,2*
[65,6;99,1]
|
96,0*
[83,8;99,5]
|
† Gastro-entérite sévère définie par un score ≥11 sur l'échelle de Vesikari
†† Cohorte per protocole pour la détermination de l'efficacité
* Statistiquement significatif (p < 0,05)
L'efficacité pendant la 1ère année de vie augmenta progressivement avec la sévérité de la maladie, en atteignant 100% (IC 95%: 84,7; 100) pour les scores de Vesikari > 17.
Une efficacité a été observée dès la 1ère dose, bien que Rotarix soit un vaccin administré en 2 doses. En Europe, l'efficacité contre une gastro-entérite à RV a été de 89,8% (IC 95%: 8,9; 99,8) entre la 1ère et la 2ème dose, quel que soit le sérotype étudié.
Une étude clinique conduite en Amérique Latine a évalué Rotarix chez plus de 20'000 nourrissons. Après 2 doses vaccinales, l'efficacité protectrice contre une gastro-entérite à RV sévère nécessitant une hospitalisation et/ou un traitement par réhydratation était de 84,7% (IC 95%: 71,1; 92,4). L'efficacité protectrice de Rotarix s'est maintenue pendant la 2ème année de vie et était de 79% (IC 95%: 66,4; 87,4) contre une gastro-entérite à RV sévère.
Efficacité de Rotarix en fonction du sérotype en Amérique Latine (Rota-023):
|
Type
|
Contre une gastro-entérite à rotavirus sévère dans la 1ère année de vie*
|
Contre une gastro-entérite à rotavirus sévère dans la 2ème année de vie#
| |
|
n
|
Efficacité (%)
|
IC 95%
|
n
|
Efficacité (%)
|
IC 95%
| |
G1P[8]
|
3/36
|
91,8
|
74,1 – 98,4
|
7/25
|
72,4
|
34,5 – 89,9
| |
G3P[8]
|
1/8
|
87,7
|
8,3 – 99,7
|
2/7
|
71,9
|
-47,7 – 97,1
| |
G9P[8]
|
2/21
|
90,6
|
61,7 – 98,9
|
7/56
|
87,7
|
72,9 – 95,3
| |
Souches contenant le génotype P[8]
|
6/64
|
90,9
|
79,2 – 96,8
|
21/101
|
79,5
|
67,0 – 87,9
| |
G4P[8]
|
1/2
|
50,8
|
-844 – 99,2
|
6/16
|
63,1
|
0,7 – 88,2
| |
G2P[4]
|
6/10
|
41,0
|
-79,2 – 82,4
|
1/1
|
1,6
|
-7'626,1 – 98,7
|
n = nombre de gastro-entérites à rotavirus signalées (groupe Rotarix/groupe placebo).
* Cohorte de protocole dans la première année: 9'009 sujets dans le groupe Rotarix et 8'858 sujets dans le groupe placebo.
# Cohorte de protocole dans la deuxième année: 7'175 sujets dans le groupe Rotarix et 7'062 sujets dans le groupe placebo
Efficacité clinique de Rotarix liquid
Etant donné que la réponse immunitaire observée après 2 doses de Rotarix liquid était comparable à la réponse immunitaire observée après 2 doses de la formulation lyophilisée, l'efficacité observée avec la formulation lyophilisée peut être transposée à Rotarix liquid.
Réponse immunitaire
Le mécanisme immunologique qui est à la base de l'efficacité de Rotarix contre une gastro-entérite à RV n'est pas tout à fait élucidé. Un lien entre la réponse en anticorps après vaccination contre le rotavirus et la protection contre la gastro-entérite à RV n'a pas été établi. Le tableau suivant montre le pourcentage des enfants vaccinés ayant un taux sérique en anticorps IgA anti-rotavirus ≥20 U/ml (ELISA) après la deuxième dose de la formulation lyophilisée, répertorié selon les schémas vaccinaux.
Nombre de sujets séropositifs après 2 doses de Rotarix (Rota-023 et Rota-036):
|
Schéma vaccinal
|
Etude réalisée en
|
Vaccin
(n=794)
|
Placebo
(n=422)
| |
2e et 3e mois
|
France
|
84,3%
|
14,0%
| |
|
Allemagne
|
82,1%
|
6,0%
| |
2e et 4e mois
|
Espagne
|
85,5%
|
12,4%
| |
3e et 5e mois
|
Finlande
|
94,6%
|
2,9%
| |
|
Italie
|
92,3%
|
11,1%
| |
3e et 4e mois
|
République Tchèque
|
84,6%
|
2,2%
|
|
Schéma vaccinal
|
Etude en Amérique Latine
|
Vaccin
(n=393)
|
Placebo
(n=341)
| |
2e et 3e à 4e mois
|
11 pays
|
77,9%
|
15,1%
|
Dans trois essais comparatifs contrôlés, la réponse immunitaire obtenue avec Rotarix liquid était comparable à celle obtenue avec la formulation lyophilisée.
Réponse immunitaire chez les nourrissons nés prématurés
Dans une étude clinique réalisée chez des nourrissons nés prématurés à au moins 27 semaines de grossesse, l'immunogénicité de Rotarix a été évaluée dans un sous-groupe de 147 prématurés et a montré que Rotarix est immunogène dans ce groupe; 85,7% (IC 95%: 79,0; 90,9) des nourrissons prématurés ont atteint des titres sériques en anticorps IgA anti-rotavirus ≥ 20 U/ml (par méthode ELISA), un mois après la seconde dose de vaccin.
Tolérance chez les nourrissons infectés par le VIH
Dans une étude en double aveugle, randomisée, contrôlée contre placebo de phase II chez des nourrissons ayant une infection à VIH asymptomatique ou légèrement symptomatique (N=100), la réactogénicité et le profil de sécurité de Rotarix semblaient similaires à ceux du placebo.
Une excrétion du virus vaccinal dans les selles est observée après vaccination; elle dure en moyenne pendant 10 jours, avec un pic d'excrétion vers le septième jour. Des fragments antigéniques viraux détectés par ELISA ont été retrouvés dans environ 50% des prélèvements de selles après la première dose et dans environ 4% des prélèvements de selles après la seconde dose. Le virus vaccinal vivant a été retrouvé dans 17% de ces prélèvements.
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueUne évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes résultats des études précliniques n'indiquent aucun risque particulier pour l'homme.
Remarques particulièresIncompatibilités
Rotarix ne doit pas être mélangé à d'autres vaccins.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (+2°C-+8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Ne pas congeler!
Remarques concernant la manipulation
Le vaccin se présente sous la forme d'un liquide limpide, incolore, exempt de particules visibles, pour administration orale.
Le vaccin est prêt à l'emploi (pas de reconstitution ou dilution nécessaire).
Le vaccin doit être administré oralement et ne doit pas être mélangé à d'autres vaccins ou solutions.
Le vaccin doit être inspecté visuellement pour détecter la présence de toute particule étrangère et/ou altération de l'aspect physique. En cas de non-conformité, le vaccin est à jeter.
Tout vaccin non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Instruction pour l'administration du vaccin:
Applicateur en verre
|
|
|
|
|
|

| |
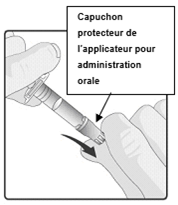
1. Retirez le capuchon protecteur de l'applicateur pour administration orale.
|
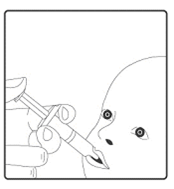
2. Ce vaccin est destiné exclusivement à l'administration orale. L'enfant doit être assis en position inclinée. Administrez oralement tout le contenu de l'applicateur pour administration orale (dans la bouche de l'enfant, sur la face interne de la joue).
|
3. Ne pas injecter.
|
Tube en plastique
Veuillez lire les consignes d'emploi entièrement avant de commencer l'administration du vaccin.
|
A. Ce dont il faut tenir compte avant l'administration de Rotarix
·Contrôlez la date de péremption.
·Assurez-vous que le tube n'est pas endommagé ou déjà ouvert.
·Assurez-vous que le liquide est limpide et incolore et ne présente aucune particule.
N'utilisez pas le vaccin si vous remarquez une quelconque anomalie.
·Ce vaccin est administré par voie orale, directement à partir du tube.
·Il est prêt à l'emploi et ne doit pas être mélangé avec d'autres composants.
|
|
|
|
B. Préparation du tube
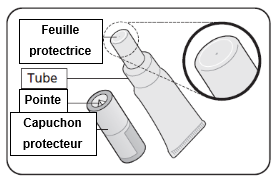
1. Retirez le capuchon protecteur
·Ne jetez pas le capuchon protecteur - vous en aurez besoin pour transpercer la feuille protectrice.
·Tenez le tube à la verticale.
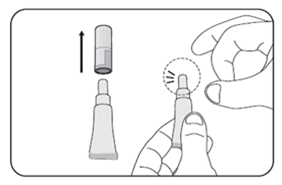
2. Tapotez plusieurs fois l'extrémité du tube pour éliminer le liquide
·Tapotez légèrement la partie la plus étroite du tube pour éliminer le liquide ayant pu s'accumuler à cet endroit.
|
|
| |
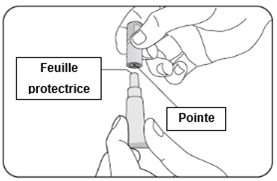
3. Positionnement du capuchon protecteur pour ouvrir le tube
·Continuez à tenir le tube à la verticale.
·Tenez fermement le tube latéralement.
·La partie supérieure du capuchon protecteur est munie d'une pointe en son milieu.
·Retournez le capuchon protecteur afin que sa partie supérieure soit en bas (de 180°).
|
|
| |
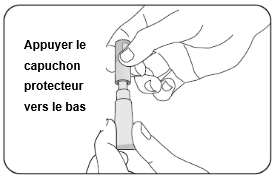
4. Ouverture du tube
·Aucun mouvement rotatif n'est nécessaire. Appuyez le capuchon protecteur vers le bas pour percer la feuille protectrice.
Puis retirez à nouveau le capuchon protecteur.
|
|
|
|
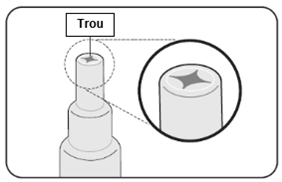
C. Contrôle de l'ouverture correcte du tube
1. Vérifiez que la feuille protectrice a été transpercée
·L'extrémité du tube doit comporter un trou.
2. Si la feuille protectrice n'a pas été transpercée
·Si la feuille protectrice n'a pas été transpercée, répétez les étapes 2, 3 et 4 du paragraphe B.
|
|
|
|
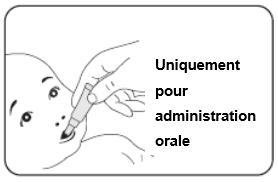
D. Administration du vaccin
·Assurez-vous après l'ouverture du tube que le liquide est limpide et ne présente aucune particule.
N'utilisez pas le vaccin si vous remarquez une quelconque anomalie.
·Administrez le vaccin immédiatement après l'ouverture du tube.
1. Positionnement de l'enfant pour l'administration du vaccin
·Asseyez l'enfant, en l'inclinant légèrement en arrière.
2. Administration du vaccin
·Appuyez doucement sur le tube pour faire couler le liquide vers la face interne de la joue de l'enfant.
·Il faut éventuellement appuyer plusieurs fois sur le tube pour administrer tout le contenu; la persistance d'une goutte à l'extrémité du tube est acceptable.
|
|
|
Numéro d’autorisation60150 (Swissmedic)
PrésentationSeringue en verre: 1,5 ml de suspension orale en emballage de 1 [B].
Tube en plastique: 1,5 ml de suspension orale en emballage de 1 et de 10 [B].
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationAoût 2020
|









