CompositionPrincipes actifs
Dexamethasonum.
Excipients
Poly(D,L-lactide-co-glycolide) 50:50 avec des groupes terminaux ester, poly(D,L-lactide-co-glycolide) 50:50 avec des groupes terminaux acide.
Indications/Possibilités d’emploiOZURDEX est indiqué dans le traitement des patients adultes présentant:
·une baisse d'acuité visuelle due à un œdème maculaire diabétique (OMD), chez des patients pseudophaques, ou considérés comme insuffisamment répondeurs à un traitement non corticoïde ou pour lesquels un traitement non corticoïde ne convient pas.
·un œdème maculaire suite à une occlusion de la branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR).
·une inflammation du segment postérieur de l'œil de type uvéite non infectieuse.
Posologie/Mode d’emploiOZURDEX doit être administré par un ophtalmologiste expérimenté dans les injections intravitréennes.
Posologie habituelle
Adultes
La dose recommandée est d'un implant OZURDEX à administrer dans le vitré de l'œil atteint. L'administration simultanée dans les deux yeux n'est pas recommandée.
OMD
Une nouvelle administration peut être envisagée chez les patients traités par OZURDEX qui ont présenté une réponse initiale au traitement et qui, selon l'avis de leur médecin, pourraient bénéficier une nouvelle fois de ce traitement, sans être exposés à un risque significatif.
Une nouvelle administration peut être réalisée après environ six mois si le patient présente une baisse d'acuité visuelle et/ou une augmentation de l'épaisseur rétinienne, secondaire à la récidive ou à l'aggravation de l'œdème maculaire diabétique.
À ce jour, il n'y a aucune donnée concernant l'efficacité ou la tolérance suite à l'administration répétée au-delà de sept implants d'OZURDEX.
Occlusion veineuse rétinienne et uvéite
Une administration ultérieure peut être envisagée chez les patients qui présentent une réponse au traitement suivie d'une perte d'acuité visuelle et qui, selon l'avis de leur médecin, pourraient bénéficier d'un nouveau traitement, sans être exposés à un risque significatif (voir «Propriétés/Effets»).
Les patients chez qui une amélioration de la vision est maintenue ne doivent pas être traités à nouveau. Les patients présentant une détérioration de leur vision, qu'OZURDEX ne parvient pas à ralentir, ne doivent pas être traités à nouveau.
Les données concernant une administration répétée dans un délai inférieur à six mois sont très limitées (voir «Propriétés/Effets»). Voir «Effets Indésirables» pour des informations relatives aux expériences disponibles à ce jour concernant la sécurité d'administration de doses répétées au-delà de 2 implants dans les indications d'uvéite non infectieuse du segment postérieur et d'occlusion veineuse rétinienne.
Les patients doivent faire l'objet d'une surveillance après l'injection pour assurer un traitement précoce en cas d'infection ou d'augmentation de la pression intraoculaire.
Mode d'administration
Implant intravitréen à usage unique dans un applicateur réservé à la voie intravitréenne uniquement. Chaque applicateur ne peut être utilisé qu'une seule fois pour le traitement d'un seul œil.
La procédure d'injection intravitréenne doit être réalisée en conditions d'asepsie contrôlées incluant le port de gants stériles, l'utilisation d'un champ stérile et d'un spéculum à paupières stérile (ou équivalent).
Avant et après chaque injection, un antibiotique de large spectre doit être administrée quotidiennement pendant 3 jours. Avant l'injection, la peau périoculaire, les paupières et la surface oculaire doivent être désinfectées (par exemple avec quelques gouttes d'une solution à base de povidone iodée à 5% sur la conjonctive, comme lors des essais cliniques pour l'autorisation d'OZURDEX) et une anesthésie locale adaptée doit être administrée.
Retirer le sachet en aluminium de la boîte et vérifier qu'il n'est pas endommagé (voir «Remarques particulières»). Puis, sur un champ stérile, ouvrir le sachet et placer délicatement l'applicateur sur un plateau stérile. Retirer le capuchon de l'applicateur avec précaution. Une fois le sachet ouvert, l'applicateur doit être utilisé immédiatement.
Tenir l'applicateur dans une main, puis tirer sur la languette de sécurité jusqu'à ce qu'elle s'en détache. Ne pas tordre ou plier la languette. En maintenant le biseau de l'aiguille vers le haut, à l'opposé de la sclère, insérer l'aiguille dans la sclère sur environ 1 mm, puis la rediriger vers le centre de l'œil dans la cavité vitréenne, jusqu'à ce que la gaine de silicone soit en contact avec la conjonctive. Exercer une pression lente sur le bouton déclencheur jusqu'à entendre un clic. Avant de retirer l'applicateur de l'œil, s'assurer que le bouton déclencheur a été correctement actionné et qu'il est bloqué au ras de la surface de l'applicateur. Retirer l'aiguille en maintenant la même position que pour l'insertion dans le vitré.
Pour une présentation graphique de l'application d'OZURDEX, voir Remarques concernant la manipulation sous «Remarques particulières».
Immédiatement après l'injection d'OZURDEX, procéder à une ophtalmoscopie indirecte dans le quadrant d'injection afin de confirmer la mise en place de l'implant. Dans la grande majorité des cas, la visualisation est possible. Dans les cas rares où l'implant n'est pas visible, prendre un coton-tige stérile et appuyer légèrement sur la zone du site d'injection pour faire apparaître l'implant.
À la suite de l'injection intravitréenne, les patients doivent continuer à recevoir un traitement antibiotique à large spectre.
Instructions posologiques particulières
Patients âgés (≥65 ans)
Aucune adaptation de la dose n'est nécessaire chez les patients âgés.
Enfants et adolescents
Il n'y a pas d'utilisation justifiée d'OZURDEX chez l'enfant et l'adolescent présentant
·un œdème maculaire diabétique
·un œdème maculaire suite à une occlusion de la veine centrale de la rétine ou de la branche veineuse rétinienne.
La tolérance et l'efficacité d'OZURDEX dans le traitement de l'uvéite chez l'enfant et l'adolescent n'ont pas été établies. Aucune étude n'est disponible.
Contre-indicationsOZURDEX est contre-indiqué dans les situations suivantes:
·Infection périoculaire ou oculaire active ou suspectée, incluant notamment la plupart des maladies virales de la cornée et de la conjonctive, dont la kératite épithéliale active à Herpès simplex (kératite dendritique), la vaccine, la varicelle, les infections mycobactériennes et les mycoses.
·Glaucome avancé ne pouvant être correctement maîtrisé par la seule prise de médicaments.
·Hypersensibilité au principe actif ou à l'un des excipients conformément à la composition.
·Œil aphaque avec rupture de la capsule postérieure du cristallin.
·Œil avec implant intraoculaire dans la chambre antérieure et rupture de la capsule postérieure du cristallin*.
·Œil avec implant intraoculaire à fixation iridienne ou transsclérale et rupture de la capsule postérieure du cristallin*.
* à cause de la relation entre la migration de l'implant dans la chambre antérieure et de l'œdème consécutive de la cornée.
Mises en garde et précautionsLes injections intravitréennes, y compris celles d'OZURDEX, peuvent engendrer une hémorragie conjonctivale (saignements), une endophtalmie, une inflammation intraoculaire, une augmentation de la pression intraoculaire et un décollement de la rétine. Il convient de toujours appliquer les techniques d'asepsie appropriées à l'injection. De plus, les patients doivent faire l'objet d'une surveillance après l'injection pour permettre un traitement précoce en cas d'infection ou d'augmentation de la pression intraoculaire. Le suivi peut consister en une vérification de la perfusion de la tête du nerf optique immédiatement après l'injection, une tonométrie dans les 30 minutes suivant l'injection et une biomicroscopie entre deux et sept jours après l'injection.
La tolérance et l'efficacité d'OZURDEX administré simultanément dans les deux yeux n'ont pas été étudiées. Un traitement bilatéral de façon simultanée n'est donc pas recommandé.
Endophthalmite
Les patients doivent être informés que tout symptôme évocateur d'une endophtalmie ou toute autre pathologie citée précédemment doit être signalé sans délai par exemple douleur oculaire, vision trouble, etc. (voir «Effets indésirables»).
Migration de l'implant
Tous les patients dont la capsule postérieure du cristallin est manquante ou déchirée (par exemple suite à une intervention chirurgicale de la cataracte), ou ceux qui présentent un défaut de l'iris (par exemple suite à une iridectomie ou à une trabéculectomie) avec ou sans antécédents de vitrectomie, ou les patients présentant une déhiscence des fibres de la zonule et de la capsule postérieure du cristallin ont un risque de migration de l'implant du corps vitré vers la chambre antérieure. La migration de l'implant vers la chambre antérieure peut entraîner un œdème de la cornée. Un œdème de la cornée sévère persistant peut évoluer jusqu'à nécessiter une greffe de cornée.
OZURDEX doit être administré avec prudence, en l'absence de contre-indication (voir «Contre-indications») et uniquement après une évaluation soigneuse des risques et des bénéfices, chez les patients dont la capsule postérieure du cristallin est manquante ou déchirée pour lesquels un traitement est envisagé. Ces patients doivent faire l'objet d'une surveillance étroite afin que toute migration de l'implant puisse être diagnostiquée et traitée suffisamment tôt.
Corticostéroïdes
L'administration de corticostéroïdes, y compris OZURDEX, peut provoquer des cataractes (y compris des cataractes sous-capsulaires postérieures), une augmentation de la pression intraoculaire, un glaucome stéroïdien, et entraîner des infections oculaires secondaires.
Comme attendu avec les traitements corticostéroïdes oculaires et les injections intravitréennes, une augmentation de la pression intraoculaire (PIO) peut être observée. L'augmentation de la PIO est généralement contrôlée par des médicaments visant à diminuer la PIO (voir «Effets indésirables»). Parmi les patients présentant une augmentation de la PIO ≥10 mmHg par rapport à la pression intraoculaire initiale, la grande majorité présentait cette augmentation entre 45 et 60 jours après l'injection. Par conséquent, une surveillance régulière de la PIO, quelle que soit la PIO initiale, est nécessaire et toute augmentation de la pression intraoculaire après l'injection doit être prise en charge de manière adaptée. Les patients âgés de moins de 45 ans présentant un œdème maculaire suite à une occlusion veineuse rétinienne ou une inflammation du segment postérieur de l'œil sous forme d'uvéite non-infectieuse sont plus susceptibles de présenter une augmentation de la PIO.
Les corticostéroïdes doivent être utilisés avec prudence chez les patients présentant des antécédents d'infection oculaire virale (par exemple par Herpès simplex) oculaire et ne doivent pas être utilisés en cas d'Herpès simplex oculaire actif.
Cataracte
Dans les études cliniques dans l'OMD sur trois ans, 59% des patients dont l'œil phaque a été traité par OZURDEX ont subi une chirurgie de la cataracte de l'œil étudié (voir «Effets indésirables»).
Suite à la première injection, l'incidence de la cataracte apparaît plus élevée chez les patients présentant une uvéite non-infectieuse du segment postérieur par comparaison aux patients présentant une OBVR/OVCR. Dans les études cliniques portant sur des occlusions de la branche veineuse rétinienne ou de la veine centrale de la rétine, la cataracte a été rapportée plus fréquemment chez les patients phaques recevant une seconde injection (voir «Effets indésirables»). Un seul patient sur 368 a dû subir une intervention chirurgicale de la cataracte au cours du premier traitement et trois patients sur 302 durant le second traitement. Dans l'étude portant sur l'uvéite non infectieuse, un patient sur les 62 patients phaques a subi une intervention chirurgicale de la cataracte à la suite d'une seule injection.
Hémorragie conjonctival
La prévalence d'une hémorragie conjonctivale chez les patients présentant une uvéite non-infectieuse du segment postérieur apparaît plus élevée par comparaison aux patients présentant une OBVR/OVCR et un OMD. Ceci pourrait être imputable à la procédure d'injection intravitréenne ou à l'utilisation concomitante de traitements anti-inflammatoires à base de corticostéroïdes ou non-stéroïdiens locaux et/ou systémiques. Aucun traitement n'est nécessaire dans la mesure où la résolution est spontanée.
Des médicaments antiplaquettaires, tels que le clopidogrel, ont été utilisés chez jusqu'à 56% des patients, lors des études cliniques. Chez les patients recevant de façon concomitante un traitement antiagrégant plaquettaire, des événements indésirables hémorragiques ont été rapportés avec un pourcentage légèrement plus élevé dans le groupe OZURDEX (jusqu'à 29%) par rapport au groupe d'injection simulée (jusqu'à 23%), et ce indépendamment de l'indication ou du nombre de traitement. L'événement indésirable hémorragique le plus fréquemment signalé était l'hémorragie conjonctivale (jusqu'à 24%).
OZURDEX doit être utilisé avec précaution chez les patients traités par anticoagulants ou antiagrégant plaquettaires.
OVR
OZURDEX n'a pas été étudié chez les patients souffrant d'un œdème maculaire consécutif à une occlusion de la veine rétinienne (OVR) avec ischémie rétinienne significative.
Dans des études cliniques avec l'occlusion veineuse rétinienne, un traitement anticoagulant a été utilisé par 2% des patients traités par OZURDEX et aucun effet indésirable hémorragique n'a été rapporté. Il existe cependant des rapports de cas isolés d'effets indésirables hémorragiques pendant l'administration après la mise sur le marché (post-marketing).
Diabète
Un nombre limité de patients atteints de diabète de type 1 a été suivi dans le cadre d'études de phase III, et la réponse à OZURDEX chez ces patients n'était pas significativement différente de celle des patients diabétiques de type 2.
OMD
Dans l'OMD, un traitement anticoagulant était utilisé par 8% des patients traités. Parmi les patients traités par anticoagulants, la fréquence des événements indésirables hémorragiques a été similaire dans le groupe traité par OZURDEX et dans les groupes d'injection simulée (29% contre 32%). Parmi les patients non traités par anticoagulants, 27% des patients traités par OZURDEX ont rapporté des événements indésirables hémorragiques contre 20% dans le groupe d'injection simulée. Une hémorragie du vitré a été signalée dans une proportion plus élevée de patients traités par OZURDEX que ceux qui étaient sous anticoagulants (11%) par rapport aux patients non traités par anticoagulants (6%).
Des troubles de la vision
Des troubles de la vision peuvent survenir lors de l'utilisation systémique et topique de corticostéroïdes. Si un patient présente des symptômes tels qu'une vision floue ou d'autres problèmes de vision, un examen ophtalmologique ultérieur du patient doit être envisagé pour évaluer les causes possibles. Ceux-ci incluent, mais ne sont pas limitées à la cataracte, au glaucome ou aux maladies rares telles que chorioréthinopathie séreuse centrale (CSC) rapportée après l'utilisation de corticostéroïdes systémiques ou topiques.
InteractionsAucune étude d'interaction n'a été réalisée.
L'absorption systémique est minime et aucune interaction n'est attendue.
Grossesse, allaitementDes études chez l'animal ont montré des effets tératogènes après administration topique oculaire (voir «Données précliniques»). Il n'existe pas de données suffisantes relatives à l'administration par voie intravitréenne de la dexaméthasone chez la femme enceinte. Chez l'homme, les concentrations systémiques de dexaméthasone étaient faibles. OZURDEX ne doit être utilisé pendant la grossesse qu'en cas d'absolue nécessité.
On ignore si une application intravitréenne de dexaméthasone peut produire des concentrations démontrables dans le lait de la mère. La dexaméthasone administrée par voie systémique est excrétée dans le lait maternel. OZURDEX n'est pas recommandé durant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes patients peuvent présenter une diminution temporaire de leur vision après l'injection intravitréenne d'OZURDEX (voir «Effets indésirables»). Ils ne doivent pas conduire de véhicules ou utiliser de machines jusqu'à ce que leur vision soit rétablie.
Effets indésirablesLes effets indésirables considérés comme étant liés au traitement par OZURDEX au cours des études cliniques de phase III (OMD, OBVR/OVCR et uvéite) et lors de notifications spontanées ont été définis selon les classes de systèmes d'organes MedDRA: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10 000 à <1/1000), très rares (<1/10 000). Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Affections du système nerveux
Fréquents: maux de tête.
Occasionnels: migraine.
Affections oculaires
Très fréquents: pression intraoculaire augmentée (31%), cataracte (38%), hémorragie conjonctivale* (21%).
Fréquents: hypertension oculaire, cataracte sous-capsulaire, hémorragie du vitré*, acuité visuelle réduite*, trouble/altération de la vision, décollement du vitré*, corps flottants du vitré*, opacités du vitré*, blépharite, douleur oculaire*, photopsie*, œdème conjonctival*, hyperémie conjonctivale*.
Occasionnels: rétinite nécrosante, endophthalmite*, glaucome, décollement de la rétine*, déchirure rétinienne*, hypotonie de l'œil*, choriorétinopathie séreuse centrale, inflammation de la chambre antérieure*, effet tyndall cellulaire*, sensation anormale dans l'œil*, prurit de la paupière, hyperémie sclérale*.
Troubles généraux et anomalies au site d'administration
Occasionnels: déplacement du dispositif* (migration de l'implant) avec ou sans œdème de la cornée (voir également «Mises en garde et précautions»), complication de l'insertion du dispositif entraînant des lésions des tissus oculaires* (mauvais positionnement de l'implant).
*Effets indésirables considérés comme liés à la procédure d'injection intravitréenne (la fréquence de ces effets indésirables est proportionnelle au nombre de traitements reçus).
Œdème maculaire diabétique
La tolérance clinique d'OZURDEX chez des patients présentant un œdème maculaire diabétique a été évaluée dans deux études de phase III, randomisées, en double aveugle et contrôlées versus des injections simulées. Dans les 2 études, un total de 347 patients a été randomisés et ont reçu OZURDEX et 350 patients ont reçu une injection simulée.
Pendant toute la durée de l'étude, la cataracte et l'augmentation de la pression intraoculaire (PIO) étaient les effets indésirables les plus fréquemment rapportés chez les patients ayant reçu OZURDEX (voir ci-dessous).
Dans les études cliniques de l'OMD sur trois ans, 87% des patients dont l'œil phaque a été traité par OZURDEX présentaient à l'inclusion un certain degré d'opacification du cristallin/de cataracte précoce. Pour l'ensemble des études sur trois ans, l'incidence de tous les types de cataracte observés (p. ex., cataracte corticale, cataracte diabétique, cataracte nucléaire, cataracte sous-capsulaire, cataracte lenticulaire, cataracte) était de 68% chez les patients dont l'œil phaque a été traité par OZURDEX tout au long de l'étude. 59% des patients dont l'œil phaque a été étudié, ont dû subir une chirurgie de la cataracte avant la visite finale à trois ans, la majorité des interventions ayant été réalisée au cours des 2e et 3e années.
La PIO moyenne dans l'œil étudié était la même à l'inclusion dans les deux groupes de traitement (15,3 mmHg). L'augmentation moyenne par rapport à la PIO initiale n'a pas dépassé 3,2 mmHg à toutes les visites dans le groupe traité par OZURDEX; la PIO moyenne étant maximale lors la visite réalisée 1,5 mois après l'injection et retrouvant environ sa valeur à l'inclusion dans les 6 mois suivants l'injection. Le taux et l'amplitude de l'augmentation de la PIO suite à un traitement par OZURDEX n'ont pas augmenté suite à une nouvelle injection.
Chez 28% des patients traités par OZURDEX, l'augmentation de la PIO était ≥10 mmHg par rapport à la valeur initiale lors d'une ou de plusieurs visites de l'étude. À l'inclusion 3% des patients ont eu recours à un ou plusieurs médicaments visant à diminuer la PIO. Dans l'ensemble 42% des patients ont eu recours à des médicaments visant à réduire la PIO à un moment ou à un autre au cours des études sur trois ans, avec une majorité de patients recevant plus d'un traitement. L'utilisation maximale (33%) a eu lieu au cours des 12 premiers mois et est restée similaire d'une année sur l'autre.
Au total, 4 patients (1%) traités par OZURDEX ont subi une intervention de l'œil étudié pour traiter une augmentation de la PIO. Un patient a dû subir une intervention chirurgicale par incision (trabéculectomie) suite à une augmentation de la PIO cortisonique; un patient a subi une trabéculectomie suite à la présence de fibrine dans la chambre antérieure qui bloquait l'évacuation de l'humeur aqueuse, provoquant ainsi une augmentation de la PIO. Un patient a subi une iridotomie pour un glaucome à angle fermé et un patient a subi une iridectomie secondaire à une chirurgie de la cataracte. Aucun patient n'a eu recours à un retrait de l'implant par vitrectomie pour contrôler la PIO.
OBVR/OVCR
La tolérance clinique d'OZURDEX chez les patients présentant un œdème maculaire suite à une occlusion de la veine centrale de la rétine ou de la branche veineuse rétinienne a été évaluée par deux études de phase III contrôlées, randomisées en double aveugle versus des injections simulées. Au total, 427 patients ont été randomisés pour recevoir OZURDEX et 426 pour recevoir des injections simulées au cours de ces deux études de phase III. Au total, 401 patients (94%) randomisés et traités par OZURDEX ont complété la période initiale de traitement (jusqu'au 180e jour).
47,3% des patients ont présenté au moins un effet indésirable. L'augmentation de la pression intraoculaire (24%) et l'hémorragie conjonctivale (14,7%) étaient les effets indésirables les plus fréquemment rapportés chez les patients ayant reçu OZURDEX.
Le profil d'effets indésirables chez les patients souffrant d'une OBVR était similaire à celui observé chez les patients souffrant d'une OVCR. Toutefois, l'incidence globale des effets indésirables était plus importante dans le sous-groupe de patients atteints d'OVCR.
L'augmentation de la pression intraoculaire (PIO) avec OZURDEX, atteignait son maximum au 60e jour pour retrouver son niveau initial au 180e jour. Les augmentations de la PIO n'ont pas nécessité de traitement ou ont été prises en charge au moyen de traitements locaux administrés de façon temporaire, visant à diminuer la PIO. Pendant la période initiale de traitement, 0,7% (3/421) des patients ayant reçu OZURDEX ont nécessité une intervention au laser ou chirurgicale pour le traitement de l'élévation de la PIO, contre 0,2% (1/423) des patients ayant reçu des injections simulées.
Le profil des effets indésirables chez les 341 patients suivis après une seconde injection d'OZURDEX était similaire à celui faisant suite à la première injection. En tout, 54% des patients ont présenté au moins un effet indésirable. L'incidence de l'augmentation de la PIO (24,9%) était similaire à celle observée à la suite de la première injection, et de la même manière, la PIO a retrouvé sa valeur initiale au 180e jour, le jour de démasquage. L'incidence globale des cataractes était plus élevée après 1 an qu'après les 6 premiers mois de traitement.
La sécurité clinique a été examinée complémentairement d'une étude multicentrique observationnelle après mise sur le marché menée sur 24 mois étudiant le traitement d'œdème maculaire suite à une occlusion veineuse rétinienne et une uvéite non-infectieuse touchant le segment postérieur de l'œil. Les effets indésirables plus fréquents observés pendant cette étude correspondaient aux effets indésirables plus fréquents observés dans les études cliniques. L'évaluation concernant la fréquence des injections a révélé une incidence plus élevée des effets indésirables chez les patients qui avaient reçu > 2 injections comparés aux patients qui avaient reçu ≤2 injections. Chez les patients qui ont reçus plus de 2 injections l'apparition en particulier d'une cataracte (formation de la cataracte chez 24,7% [44/178] et progression de la cataracte chez 32,0% [57/178] des patients avec un œil phaque en début du traitement), hémorragie du vitré chez 6,0% [17/283] et élévation de la pression intraoculaire chez 24,0% [68/283] étaient plus fréquents en comparaison avec les patients qui avaient reçus ≤2 injections.
Uvéite
La tolérance clinique d'OZURDEX chez des patients présentant une inflammation du segment postérieur de l'œil de type uvéite non-infectieuse a été évaluée par une seule étude, multicentrique, masquée et randomisée.
Au total, 77 patients ont été randomisés pour recevoir OZURDEX et 76 pour recevoir une injection simulée. Au total, 73 patients (95%) randomisés et traités par OZURDEX ont terminé l'étude, d'une durée de 26 semaines.
L'hémorragie conjonctivale (30,3%), l'augmentation de la pression intraoculaire (25,0%) et la cataracte (11,8%) étaient les effets indésirables les plus fréquemment rapportés chez les patients ayant reçu OZURDEX.
La sécurité clinique a été examinée complémentairement d'une étude multicentrique observationnelle après mise en marché menée sur 24 mois étudiant le traitement d'œdème maculaire suite à une occlusion veineuse rétinienne et une uvéite non-infectieuse touchant le segment postérieur de l'œil (voir «OBVR/OVCR»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté à ce jour.
Propriétés/EffetsCode ATC
S01BA01
Mécanisme d'action
Dexaméthasone, un corticostéroïde puissant, supprime des inflammations en inhibant l'œdème, les dépôts de fibrine, les fuites capillaires et la migration phagocytaire de la réponse inflammatoire. Le facteur de croissance de l'endothélium vasculaire (VEGF) est une cytokine qui atteint des concentrations élevées lors du développement de l'œdème maculaire. C'est un promoteur puissant de la perméabilité vasculaire. Il était démontré que les corticostéroïdes inhibent l'expression du VEGF. De plus, les corticostéroïdes empêchent la sécrétion de prostaglandines, dont certaines ont été identifiées comme des médiateurs de l'œdème maculaire cystoïde.
Pharmacodynamique
Aucune information.
Efficacité clinique
Œdème maculaire diabétique
L'efficacité d'OZURDEX a été évaluée dans deux études cliniques de trois ans, multicentriques, en groupes parallèles, randomisées, en double aveugle et contrôlées versus une injection simulée dont la méthodologie était identique et qui ont inclus au total 1'048 patients (études 206207-010 et 206207-011). 351 patients ont reçu OZURDEX, 347 ont reçu de la dexaméthasone 350 μg et 350 patients ont reçu une injection simulée.
Les patients étaient éligibles pour une nouvelle administration lorsque l'épaisseur rétinienne dans la sous-zone centrale était > 175 microns selon les mesures par tomographie en cohérence optique (OCT) ou selon l'interprétation de l'OCT par les investigateurs visant à déterminer tout signe d'œdème rétinien résiduel composé de kystes rétiniens ou toute augmentation de l'épaisseur rétinienne à l'intérieur ou à l'extérieur de la sous-zone centrale. Les patients ont reçu jusqu'à sept traitements à intervalles réguliers, souvent inférieurs à six mois.
Un traitement de secours était autorisé à tout moment pendant l'étude, à la discrétion des investigateurs, mais devait entrainer la sortie du patient des études.
Au total, 36% des patients traités par OZURDEX sont sortis de l'étude, toutes raisons confondues, contre 57% des patients recevant une injection simulée. Les taux de sortie d'étude suite à un événement indésirable étaient similaires dans les groupes traités et dans les groupes d'injections simulées (13% versus 11%). Le taux de sortie d'étude pour manque d'efficacité était plus faible dans le groupe OZURDEX que dans le groupe d'injection simulée (7% versus 24%).
Les critères principaux et secondaires d'évaluation des études 206207-010 et -011 sont répertoriés dans le tableau ci-dessous. L'amélioration de la vision dans le groupe sous DEX 700 a été confondue par l'apparition d'une cataracte. L'amélioration de la vision a été rétablie après ablation de la cataracte.
Efficacité dans les études 206207-010 et 206207-011 (population ITT)
|
Critère d'évaluation
|
Étude 206207-010
|
Étude 206207-011
|
Études poolées 206207-010
et 206207-011
| |
|
DEX 700
N = 163
|
Injection simulée
N = 165
|
DEX 700
N = 188
|
Injection simulée
N = 185
|
DEX 700
N = 351
|
Injection simulée
N = 350
| |
Variation moyenne de la MAVC à 3 ans, approche ASC (lettres)
|
4,1
|
1,9
|
2,9
|
2,0
|
3,5
|
2,0
| |
Valeur de p
|
0,016
|
0,366
|
0,023
| |
Amélioration ≥15 lettres de la MAVC par rapport à la valeur initiale à 3 ans/visite finale (%)
|
22,1
|
13,3
|
22,3
|
10,8
|
22,2
|
12,0
| |
Valeur de p
|
0,038
|
0,003
|
< 0,001
| |
Variation moyenne de la MAVC par rapport à la valeur initiale à 3 ans/
visite finale (lettre)
|
4,1
|
0,8
|
1,3
|
-0,0
|
2,6
|
0,4
| |
Valeur de p
|
0,020
|
0,505
|
0,054
| |
Variation moyenne de l'épaisseur rétinienne mesurée par OCT dans le sous-champ central à 3 ans, approche ASC (µm)
|
-101,1
|
-37,8
|
-120,7
|
-45,8
|
-111,6
|
-41,9
| |
Valeur de p
|
< 0,001
|
< 0,001
|
< 0,001
|
Les critères d'évaluation principaux et les importants critères d'évaluation secondaires pour l'analyse poolée portant sur les patients pseudophaques sont répertoriés dans le tableau ci-dessous.
Efficacité chez les patients pseudophaques (études poolées 206207-010 et 206207-011)
|
Critère d'évaluation
|
DEX 700
N = 86
|
Injection simulée
N = 101
|
Valeur de p
| |
Variation moyenne de la MAVC à 3 ans, approche ASC (lettres)
|
6,5
|
1,7
|
< 0,001
| |
Amélioration ≥15 lettres de la MAVC par rapport à la valeur initiale à 3 ans/visite finale (%)
|
23,3
|
10,9
|
0,024
| |
Variation moyenne de la MAVC par rapport à la valeur initiale à 3 ans/visite finale (lettre)
|
6,1
|
1,1
|
0,004
| |
Variation moyenne de l'épaisseur rétinienne mesurée par OCT dans le sous-champ central à 3 ans, approche ASC (µm)
|
-131,8
|
-50,8
|
< 0,001
|
Les critères d'évaluation principaux et les importants critères d'évaluation secondaires pour l'analyse poolée portant sur les patients ayant pris un traitement antérieur, quel qu'il soit, sont répertoriés dans le tableau ci-dessous.
Efficacité chez les patients ayant pris un traitement antérieur, quel qu'il soit (études poolées 206207-010 et 206207-011)
|
Critère d'évaluation
|
DEX 700
N = 247
|
Injection simulée
N = 261
|
Valeur de p
| |
Variation moyenne de la MAVC à 3 ans, approche ASC (lettres)
|
3,2
|
1,5
|
0,024
| |
Amélioration ≥15 lettres de la MAVC par rapport à la valeur initiale à 3 ans/visite finale (%)
|
21,5
|
11,1
|
0,002
| |
Variation moyenne de la MAVC par rapport à la valeur initiale à 3 ans/visite finale (lettre)
|
2,7
|
0,1
|
0,055
| |
Variation moyenne de l'épaisseur rétinienne mesurée par OCT dans le sous-champ central à 3 ans, approche ASC (µm)
|
-126,1
|
-39,0
|
< 0,001
|
OBVR/OVCR
L'efficacité d'OZURDEX a été évaluée dans le cadre de deux études multicentriques, parallèles, randomisées en double aveugle versus des injections simulées dont le schéma était identique et qui ont inclus au total 1267 patients randomisés pour recevoir un traitement par implant à la dexaméthasone 350 µg ou 700 µg ou des injections simulées (études 206207-008 et 206207-009). 427 patients ont reçu OZURDEX, 414 de la dexaméthasone 350 µg et 426 patients ont reçu des injections simulées.
D'après les résultats d'analyses poolées, le groupe traité par un implant d'OZURDEX a montré un taux supérieur, statistiquement significatif, de patients répondeurs (définis comme présentant une amélioration par rapport à la valeur initiale ≥15 lettres de la Meilleure Acuité Visuelle Corrigée (MAVC), 90 jours après l'injection d'un implant par rapport au groupe traité par l'injection simulée (p < 0,001).
Le tableau ci-dessous indique la proportion de patients, qui ont atteint le point final de l'évaluation d'efficacité (amélioration ≥15 lettres par rapport à la valeur initiale de la MAVC après injection d'un seul implant). On a observé un effet du traitement dès la première visite de contrôle au 30e jour. L'efficacité maximale du traitement a été observée au 60e jour et une différence statistiquement significative en faveur d'OZURDEX a été observée pour le taux de répondeurs par comparaison à l'injection simulée, à tous les points de mesure jusqu'au 90e jour suivant l'injection. Au 180e jour, le taux de répondeurs présentant une amélioration ≥15 lettres par rapport à la valeur initiale de la MAVC, restait numériquement plus important pour le groupe traité par OZURDEX, que pour le groupe traité par l'injection simulée.
Proportion de patients ayant présenté une amélioration de 15 lettres ou plus par rapport à la valeur initiale de la Meilleure Acuité Visuelle Corrigée (MAVC) lors de l'étude oculaire (combinée, ITT population)
|
Consultation
|
OZURDEX
N = 427
|
Injection simulée
N = 426
| |
30e jour
|
21,3%a
|
7,5%
| |
60e jour
|
29,3%a
|
11,3%
| |
90e jour
|
21,8%a
|
13,1%
| |
180e jour
|
21,5%
|
17,6%
|
a Proportion significativement plus importante avec OZURDEX par comparaison avec l'injection simulée (p < 0,001)
La variation moyenne de la MAVC par rapport à la valeur initiale était significativement plus importante avec OZURDEX en comparaison avec l'injection simulée, à tous les points de mesure.
Dans les deux études de phase III et dans l'analyse poolée, le délai d'amélioration ≥15 lettres (3 lignes) dans les courbes de réponse cumulées relatives à la mesure de la MAVC était significativement différent entre OZURDEX, et l'injection simulée (p < 0,001). Les patients traités par OZURDEX atteignaient cette amélioration d'acuité visuelle de 3 lignes plus tôt que les patients ayant reçu l'injection simulée.
OZURDEX était numériquement supérieur à l'injection simulée dans la prévention de la perte de vision. En effet, une proportion plus faible de patients présentait une détérioration de la vision ≥15 lettres dans le groupe OZURDEX au cours de la période d'évaluation de 6 mois.
Dans les deux études de phase III et dans l'analyse poolée, l'épaisseur moyenne de la rétine était significativement inférieure et la réduction moyenne par rapport à la mesure initiale était significativement plus importante avec OZURDEX (-207,9 microns) qu'avec l'injection simulée (-95,0 microns) au 90e jour (p < 0,001, données poolées). L'effet du traitement évalué par la mesure de la MAVC au 90e jour est donc conforté par ces données anatomiques. Au 180e jour, la réduction de l'épaisseur moyenne de la rétine n'était pas significative (-119,3 microns), en comparaison avec l'injection simulée.
Les patients ayant une valeur de MAVC < 84 ou présentant une épaisseur rétinienne >250 microns, mesurée par tomographie en cohérence optique (OCT), et qui selon l'investigateur ne présentaient pas de risque, ont pu poursuivre le traitement par OZURDEX dans le cadre d'une extension de l'étude en ouvert. Parmi les patients traités lors de cette extension ouverte, 98% d'entre eux ont reçu une injection d'OZURDEX 5 à 7 mois après le traitement initial.
Comme lors du traitement initial, la réponse maximale a été observée au 60e jour de la phase ouverte. Les taux de réponses cumulées étaient supérieurs lors de la période en ouvert chez les patients ayant reçu deux injections consécutives d'OZURDEX, par comparaison avec les patients n'ayant pas reçu d'injection d'OZURDEX durant la période initiale.
La proportion de répondeurs à chaque point de mesure restait toujours plus importante après le second traitement qu'après le premier traitement. En revanche, lorsque le traitement est retardé de 6 mois on observe une proportion plus faible de répondeurs, à tous les points de mesure de la phase ouverte, par rapport aux patients ayant reçu une seconde injection d'OZURDEX.
Uvéite
L'efficacité clinique d'OZURDEX dans le traitement d'une inflammation oculaire non-infectieuse du segment postérieur chez des patients atteints d'uvéite a été évaluée par une seule étude multicentrique, masquée et randomisée.
Au total, 229 patients ont été randomisés pour recevoir des implants à la dexaméthasone 350 μg ou 700 μg ou des injections simulées. Sur ces 229 patients, 77 ont été randomisés pour recevoir OZURDEX, 76 pour recevoir de la dexaméthasone 350 μg et 76 patients pour recevoir des injections simulées. Au total, 95% des patients ont terminé l'étude, d'une durée de 26 semaines.
La proportion de patients présentant un score de voile vitréen de 0 dans l'œil étudié à la semaine 8 (principal critère d'évaluation) était 4 fois supérieure avec OZURDEX (46,8%) qu'avec des injections simulées (11,8%), p < 0,001. La supériorité statistique a été maintenue jusqu'à la semaine 26 comprise (p ≤0,014), comme le montre le tableau suivant.
Les courbes des taux de réponse cumulées (délai d'obtention d'un score de voile vitréen de 0) étaient significativement différentes pour le groupe OZURDEX par rapport au groupe d'injection simulée (p < 0,001), les patients ayant reçu de la dexaméthasone présentant un délai d'action plus rapide et une meilleure réponse au traitement.
La réduction du voile vitréen s'accompagnait d'une amélioration de l'acuité visuelle. La proportion de patients présentant une amélioration d'au moins 15 lettres par rapport à la valeur initiale de la MAVC pour l'œil étudié à la semaine 8 était plus de 6 fois supérieure avec OZURDEX (42,9%) qu'avec une injection simulée (6,6%), p < 0,001. La supériorité statistique a été obtenue à la semaine 3 et maintenue jusqu'à la semaine 26 comprise (p ≤0,001), comme le montre le tableau suivant.
La proportion de patients ayant besoin de traitements de secours depuis la période initiale jusqu'à la semaine 8 était près de 3 fois inférieure avec OZURDEX (7,8%) qu'avec l'injections simulée (22,4%), p = 0,012.
Proportion de patients ayant présenté un score de voile vitréen de zéro et une amélioration de 15 lettres ou plus par rapport à la valeur initiale de la meilleure acuité visuelle corrigée lors de l'étude oculaire (population en intention de traiter)
|
Consultation
|
Score de voile vitréen de zéro
|
Amélioration de 15 lettres ou plus par rapport à la valeur initiale de la MAVC
| |
|
DEX 700
N = 77
|
Injection simulée
N = 76
|
DEX 700
N = 77
|
Injection simulée
N = 76
| |
Semaine 3
|
23,4%
|
11,8%
|
32,5%a
|
3,9%
| |
Semaine 6
|
42,9%a
|
9,2%
|
41,6%a
|
7,9%
| |
Semaine 8
|
46,8%a
|
11,8%
|
42,9%a
|
6,6%
| |
Semaine 12
|
45,5%a
|
13,2%
|
41,6%a
|
13,2%
| |
Semaine 16
|
40,3%b
|
21,1%
|
39,0%a
|
13,2%
| |
Semaine 20
|
39,0%c
|
19,7%
|
40,3%a
|
13,2%
| |
Semaine 26
|
31,2%d
|
14,5%
|
37,7%a
|
13,2%
|
a p < 0,001; b p = 0,010; c p = 0,009; d p = 0,014
PharmacocinétiqueAbsorption
Chez un sous-groupe de 21 patients issus des deux études d'efficacité sur 6 mois, les concentrations plasmatiques ont été mesurées avant administration et aux 7e, 30e, 60e et 90e jours suivant la mise en place d'un seul implant intravitréen contenant 350 µg ou 700 µg de dexaméthasone. 95% des concentrations plasmatiques en dexaméthasone mesurées pour le groupe ayant reçu un dosage à 350 µg et 86% de ces concentrations pour le groupe ayant reçu un dosage à 700 µg étaient en dessous de la limite inférieure de quantification (0,05 ng/ml). La valeur la plus élevée de la concentration plasmatique (0,094 ng/ml) a été observée chez un sujet du groupe ayant reçu un dosage à 700 µg. La concentration plasmatique en dexaméthasone ne semblait pas liée à l'âge, au poids ou encore au sexe des patients.
Les concentrations plasmatiques ont été obtenues auprès d'un sous-groupe de patients dans les deux études pivots portant sur l'OMD avant l'administration du produit et aux jours 1, 7 et 21, ainsi qu'aux mois 1,5 et 3, suivant l'injection intravitréenne d'un seul implant intravitréen contenant 350 μg ou 700 μg de dexaméthasone. 100% des concentrations plasmatiques en dexaméthasone mesurées pour le groupe ayant reçu une dose de 350 μg et 90% de ces concentrations pour le groupe ayant reçu une dose de 700 μg étaient en dessous de la limite inférieure de quantification (0,05 ng/ml). La valeur la plus élevée de la concentration plasmatique (0,102 ng/ml) a été observée chez un sujet du groupe ayant reçu la dose de 700 μg. La concentration plasmatique en dexaméthasone ne semblait pas être liée à l'âge, au poids ou encore au sexe des patients.
Distribution
Dans une étude de 6 mois réalisée chez le singe, après une seule injection intravitréenne d'OZURDEX, la concentration maximale (Cmax) en dexaméthasone de l'humeur vitrée était de 100 ng/ml au 42e jour suivant l'injection et de 5,57 ng/ml au 91e jour. La dexaméthasone était toujours décelable dans le vitré 6 mois après l'injection. La concentration en dexaméthasone se classait ainsi: rétine > iris > corps ciliaire > humeur vitrée > humeur aqueuse > plasma. Dexaméthasone était sécrétée dans le corps vitré de singes pendant 6 mois.
Métabolisme
Dans une étude de métabolisme in vitro, après incubation pendant 18 heures de dexaméthasone marquée au 14C avec des échantillons humains de cornée, d'iris, de corps ciliaire, de choroïde, de rétine, d'humeur vitrée et de tissu scléral, aucun métabolite n'a été retrouvé. Ces résultats sont en accord avec ceux provenant d'autres études sur le métabolisme oculaire chez le lapin et le singe.
La dexaméthasone est transformée en métabolites liposolubles et hydrosolubles pouvant être excrétés dans la bile et l'urine.
Élimination
La matrice d'OZURDEX se dégrade progressivement en acide lactique et acide glycolique par simple hydrolyse, qui se décomposent ensuite en dioxyde de carbone et en eau.
Cinétique pour certains groupes de patients
Aucune information.
Données précliniquesAucune donnée relative à la mutagénicité et à la cancérogénicité n'est disponible pour OZURDEX.
Dans des expériences menées avec des souris, des rats, des hamsters, des lapins et des chiens, la dexaméthasone entraîne des fentes palatines et, dans une moindre mesure, d'autres malformations.
Remarques particulièresIncompatibilités
Aucune information.
Influence sur les méthodes de diagnostic
Aucune information.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «Exp» sur le récipient.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C). Ne pas congeler.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
OZURDEX est à usage unique.
Chaque applicateur ne peut être utilisé qu'une seule fois pour le traitement d'un seul œil.
Si le sachet contenant l'applicateur est endommagé, ne pas l'utiliser.
|
1.Maintenir l'axe longitudinal de l'applicateur parallèle au limbe.
|
|

| |
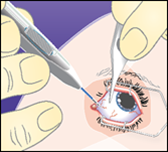
2.Approcher l'applicateur jusqu'à pénétrer la sclère selon un angle oblique; le biseau de l'aiguille doit être orienté vers le haut, à l'opposé de la sclère. Insérer l'aiguille dans la sclère sur environ 1 mm, en la maintenant prallèle au limbe.
|
|
| |
3.Rediriger l'aiguille vers le centre de l'œil dans la cvité vitréenne pour créer une voie sclérale temporaire. Enfoncer l'aiguille jusqu'à ce qu'elle pénètre la cavité vitréenne.
Ne pas enfoncer l'aiguille au-delà du point de contact entre la gaine et la conjoncte.
|
|

| |
4.Exercer une pression lente sur le bouton déclencheur jusqu'à entendre un clic. Avant de retirer l'applicateur de l'œil, s'assurer que le bouton déclencheur a été correctement actionné et qu'il est bloqué au ras de la surface de l'applicateur.
|
|

| |
5.Retirer l'applicateur en maintenant la même position que pour l'insertion dans le vitré.
|
|

| |
6.Immédiatement après le traitement, éliminer l'applicateur dans un récipient approprié.
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Numéro d’autorisation60324 (Swissmedic)
PrésentationOZURDEX contient: 1 implant stérile de 0,7 mg dans un applicateur. [A]
Titulaire de l’autorisationAbbVie AG, Cham
Mise à jour de l’informationNovembre 2023
|





