Propriétés/EffetsCode ATC
N05AX13
Xeplion contient un mélange racémique de palipéridone (+) et (-).
Mécanisme d'action / Pharmacodynamique
La palipéridone, le principe actif de Xeplion, est un agent psychotrope qui appartient à la classe chimique des dérivés du benzisoxazole (antipsychotique atypique).
Le palmitate de palipéridone est hydrolysé en palipéridone (cf. «Données précliniques»). La palipéridone est un antagoniste des récepteurs dopaminergiques D2 à action centrale qui a une activité antagoniste marquée sur les récepteurs sérotoninergiques 5HT2A. La palipéridone exerce en outre un effet antagoniste sur les récepteurs adrénergiques α1 et α2 et sur les récepteurs histaminergiques H1. La substance ne présente aucune affinité pour les récepteurs cholinergiques muscariniques ni pour les récepteurs adrénergiques β1 et β2. L'activité pharmacologique des énantiomères (+) et (-) de la palipéridone est qualitativement et quantitativement similaire.
Tout comme le mécanisme d'action des autres médicaments efficaces dans le traitement de la schizophrénie, celui de la palipéridone est inconnu. Il a néanmoins été avancé que l'effet thérapeutique du médicament dans la schizophrénie pourrait être médié par un effet antagoniste s'exerçant à la fois sur les récepteurs dopaminergiques de type 2 (D2) et sur les récepteurs sérotoninergiques de type 2 (5HT2A). Un effet antagoniste sur des récepteurs autres que les récepteurs D2 et 5HT2A pourrait être responsable de certains autres effets de la palipéridone.
Efficacité clinique
L'efficacité de Xeplion dans le traitement aigu de la schizophrénie a été démontrée dans quatre études à court terme (une sur 9 semaines et trois sur 13 semaines) en double aveugle, randomisées, contrôlées contre placebo, à doses fixes, menées chez des patients adultes hospitalisés qui avaient présenté une récidive aiguë et répondaient aux critères DSM-IV pour la schizophrénie. Les doses fixes de Xeplion utilisées dans ces études ont été administrées aux jours 1, 8 et 36 dans l'étude de 9 semaines et en plus au jour 64 dans les études de 13 semaines, c.-à-d. à une semaine d'intervalle pour les deux premières doses et à quatre semaines d'intervalle pour les doses d'entretien.
L'efficacité a été évaluée à l'aide de l'échelle PANSS (Positive and Negative Syndrome Scale), un inventaire validé de plusieurs items portant sur cinq facteurs et utilisé pour évaluer les symptômes positifs, les symptômes négatifs, les pensées désorganisées, l'hostilité/excitation incontrôlée et l'anxiété/dépression. La capacité fonctionnelle a été étudiée sur l'échelle PSP (Personal and Social Performance). Le PSP est une échelle validée notée par le médecin, évaluant le fonctionnement personnel et social dans le domaine des activités sociales utiles. Dans une étude de 13 semaines (R092670-PSY-3007) (n= 636), ayant comparé trois doses fixes de Xeplion (injection de la dose initiale de 150 mg dans le muscle deltoïde, suivie de 3 doses de 25 mg/4 semaines, de 100 mg/4 semaines ou de 150 mg/4 semaines dans le muscle deltoïde ou fessier) à un placebo, les trois doses de Xeplion se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS. Dans cette étude, les groupes traités par 100 mg/4 semaines et 150 mg/4 semaines ont montré une supériorité statistique par rapport au placebo pour ce qui est du score PSP, mais non le groupe ayant reçu 25 mg/4 semaines.
Dans une autre étude de 13 semaines (R092670-PSY-3003) (n= 349), ayant comparé trois doses fixes de Xeplion (50 mg/4 semaines, 100 mg/4 semaines et 150 mg/4 semaines) à un placebo, seule la dose de 100 mg de Xeplion toutes les 4 semaines s'est avérée supérieure au placebo pour l'amélioration du score total PANSS. Dans cette étude, les groupes traités par 50 mg/4 semaines et 100 mg/4 semaines ont montré une supériorité par rapport au placebo quant à l'amélioration du score PSP. Bien qu'une dose de 150 mg ait été utilisée dans un groupe thérapeutique de cette étude, le nombre de patients ayant reçu cette dose était trop faible pour que l'on puisse tirer des conclusions définitives sur son efficacité.
Dans une troisième étude de 13 semaines (R092670-PSY-3004) (n= 513), ayant comparé trois doses fixes de Xeplion (25 mg/4 semaines, 50 mg/4 semaines et 100 mg/4 semaines) à un placebo, les trois doses de Xeplion se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS. Dans cette étude, aucun des groupes posologiques de la palipéridone n'a obtenu de significativité statistique par rapport au placebo quant à l'amélioration du score PSP.
Dans l'étude de 9 semaines (R092670-PSY-201) (n= 197), ayant comparé deux doses fixes de Xeplion (50 mg/4 semaines et 100 mg/4 semaines) à un placebo, les deux doses de Xeplion se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS.
L'efficacité de Xeplion à maintenir la maîtrise des symptômes de la schizophrénie et à retarder l'apparition de récidives schizophréniques a été démontrée dans une étude à plus long terme, en double aveugle, contrôlée contre placebo, à doses variables, menée chez 849 jeunes adultes ou adultes d'âge moyen répondant aux critères DSM-IV de la schizophrénie. Cette étude (R092670-PSY-3001) s'est composée d'une phase ouverte de traitement aigu (9 semaines), d'une phase de stabilisation (24 semaines) et d'une phase randomisée contrôlée contre placebo pour observer les récidives ainsi que d'une phase ouverte d'observation ultérieure de 52 semaines. Dans cette étude, Xeplion a été administré tous les mois à des doses de 25, 50, 75 et 100 mg, la dose de 75 mg n'ayant été autorisée que dans l'extension ouverte de 52 semaines. Les patients ont reçu initialement des doses flexibles (25-100 mg) de Xeplion pendant une période de transition de 9 semaines, suivie d'une période d'entretien de 24 semaines, au cours de laquelle les patients devaient avoir un score PANSS ≤75 pour pouvoir être inclus dans celle-ci. Des adaptations posologiques ont été autorisées uniquement pendant les douze premières semaines de la période d'entretien. Au cours de la phase en double aveugle de durée variable, les patients ont été randomisés pour recevoir soit la même dose de Xeplion (durée moyenne: 171 jours [1 jour-407 jours]) que celle qu'ils avaient également reçu pendant la phase de stabilisation toutes les 4 semaines, soit un placebo (durée moyenne: 105 jours [8 jours–441 jours]). Au total, 410 patients stabilisés ont été randomisés et traités dans les groupes Xeplion ou dans le groupe placebo jusqu'à la survenue d'une récidive des symptômes de schizophrénie. Une récidive était définie comme la durée jusqu'à la première survenue d'au moins un des symptômes ou événements suivants: hospitalisation en psychiatrie, augmentation ≥25% du score total PANSS (si le score initial était >40) ou de 10 points (si le score initial était ≤40) lors de deux évaluations successives, automutilation délibérée, comportement violent, tentative de suicide/homicide ou score ≥5 (si le score maximal initial était ≤3) ou ≥6 (si le score maximal initial était de 4) lors de deux évaluations successives des items individuels PANSS P1 (idées délirantes), P2 (pensées confuses), P3 (comportement hallucinatoire), P6 (méfiance/délire de persécution), P7 (hostilité) ou G8 (manque de coopération). Le critère d'efficacité primaire était le délai jusqu'à l'apparition de la récidive. Une analyse intermédiaire planifiée à l'avance (après la survenue de 68 événements de récidive) a mis en évidence un délai jusqu'à l'apparition d'une récidive significativement plus long chez les patients traités par Xeplion que chez les patients du groupe placebo (cf. figure 1). L'étude a été prématurément arrêtée, car le maintien de l'efficacité avait été démontré.
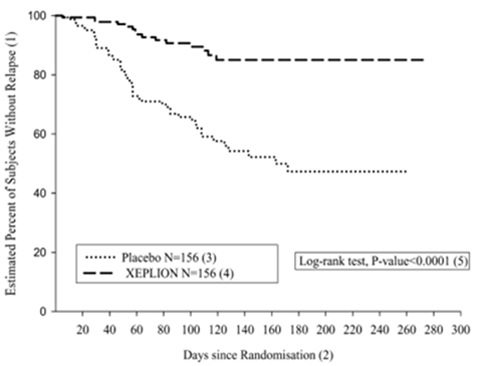
Figure 1: Courbe de Kaplan-Meier de l'intervalle sans récidive – Analyse intermédiaire (analyse intermédiaire en intention de traiter)
(1) Estimation du pourcentage des patients sans récidive
(2) Jours depuis la randomisation
(3) Placebo N= 156
(4) XEPLION N= 156
(5) Test du log-rank, valeur de p <0,0001
Le résultat des analyses basées sur les données finales, y compris sur toutes les données recueillies jusqu'à la fin de l'étude, a été concordant avec celui de l'analyse primaire d'efficacité basée sur les données intermédiaires.
Une analyse de sous-groupes de patients n'a pas mis en évidence de différences cliniquement significatives quant à la réponse en fonction du sexe, de l'âge ou de l'origine ethnique.
|

