CompositionPrincipes actifs
Ropivacaini hydrochloridum.
Excipients
Natrii chloridum, Natrii hydroxidum corresp. Natrium 3.4 mg/ml (Ropivacain Sintetica 2 mg/ml) resp. Natrium 3.2 mg/ml (Ropivacain Sintetica 5 mg/ml) resp. Natrium 3.0 mg/ml (Ropivacain Sintetica 7.5 mg/ml) resp. Natrium 2.8 mg/ml (Ropivacain Sintetica 10 mg/ml), Aqua ad iniectabile.
Indications/Possibilités d’emploiAnesthésie chirurgicale
-Anesthésie épidurale en vue d’interventions, y compris césarienne.
-Bloc intrathécal (anesthésie rachidienne).
-Blocages du plexus (membres supérieurs/inférieurs).
-Bloc de champ opératoire.
Traitement de douleurs aiguës chez l’adulte et l’adolescent >12 ans
-Perfusion épidurale continue (jusqu’à 72 h) ou injection en bolus intermittente (p.ex. douleurs postopératoires, douleurs de l’accouchement).
-Bloc de champ opératoire.
-Bloc de nerfs périphériques au moyen d’une perfusion ou injection intermittente, p.ex. pour l’antalgie postopératoire (jusqu’à 48 h).
Traitement de douleurs aiguës chez l’enfant (périopératoire et postopératoire)
-Anesthésie épidurale caudale (anesthésie caudale) chez l’enfant de 1 mois à 12 ans.
-Bloc nerveux périphérique chez l’enfant de 1 à 12 ans.
-Perfusion épidurale continue (jusqu’à 72 h) chez l’enfant de 1 mois à 12 ans.
Posologie/Mode d’emploiRopivacain Sintetica doit être utilisée uniquement sous le contrôle de médecins expérimentés en anesthésie régionale.
Les moyens nécessaires pour la surveillance ou les médicaments de réanimation doivent se trouver à disposition immédiate.
Si l’injection d’une dose élevée est nécessaire (p.ex. pour une anesthésie épidurale), une dose de test de 3–5 ml de lidocaïne 2% avec adrénaline (1 : 200'000) est recommandée.
Posologie usuelle (adultes et adolescents > 12 ans)
Des fluctuations individuelles peuvent se produire en ce qui concerne le début et la durée de l’anesthésie. Les doses moyennes prévues sont indiquées ci-dessous. Pour la recherche d’autres techniques d’anesthésie locale, consulter les traités de référence en matière d’anesthésie.
L’expérience du médecin, ainsi que l’état physique général du patient, sont déterminants dans le choix de la dose.
En général, des concentrations et des doses plus élevées sont utilisées dans l’anesthésie chirurgicale (p.ex. épidurale).
Dans l’analgésie, on recommande normalement Ropivacain Sintetica 2 mg/ml.
Pour des opérations chirurgicales del’abdomen, la demi-vie est plus courte.
Le tableau suivant indique les dosages nécessaires en moyenne pour réaliser des anesthésies régionales avec de la ropivacaïne et constitueune référence pour l’utilisation de Ropivacain Sintetica chez les adultes et les adolescents de >12 ans:
|
|
Conc.
(mg/ml)
|
Volume
(ml)
|
Dose
(mg)
|
Début de l’anesthésie
(min)
|
Durée de l’anesthésie
(h)
| |
Anesthésie chirurgicale
Anesthésie épidurale lombaire
| |
Chirurgie
|
7,5
|
15-25
|
113-188
|
10-20
|
3-5
| |
|
10,0
|
15-20
|
150-200
|
10-20
|
4-6
| |
Césarienne
|
7,5
|
15-20
|
113-150
|
10-20
|
3-5
| |
Anesthésie épidurale thoracique
| |
Pour l’antalgie post-opératoire
|
7,5
|
5-15
|
38-113
|
10-20
|
n/a
| |
Application intrathécale (anesthésie rachidienne)
| |
Chirurgie
|
5,0
|
3-4
|
15-20
|
1-5
|
2-6
| |
Blocage du plexus
| |
Membres supérieurs/inférieurs
|
5
7,5
|
35-50
10-40
|
175-2501
75-3001
|
15-30
10-25
|
5-8
6-10
| |
Bloc de champ opératoire
(p.ex. blocs de nerfs périphériques et infiltration)
|
5
7,5
|
1-40
1-30
|
5-200
7,5-225
|
1-15
1-15
|
2-6
2-6
| |
Traitement des douleurs aiguës
Anesthésie épidurale lombaire
| |
Bolus
|
2,0
|
10-20
|
20-40
|
10-15
|
0,5-1,5
| |
Injections intermittentes (top-up) (p.ex.douleurs de l’accouchement)
|
2,0
|
10-15 (intervalleminimum
30 min)
|
20-30
|
n/a
|
n/a
| |
Perfusion continue
(p.ex. douleurs de l’accouchement,
douleurs postopératoires)
|
2,0
2,0
|
6-10 ml/h
6-14 ml/h
|
12-20 mg/h
12-28 mg/h
|
n/a
n/a
|
n/a
n/a
| |
Anesthésie épidurale thoracique
| |
Perfusion continue
(p.ex. douleurs postopératoires)
|
2,0
|
6-14 ml/h
|
12-28 mg/h
|
n/a
|
n/a
| |
Bloc de champ opératoire
(p.ex. blocs de nerfs périphériques et infiltration)
|
2,0
|
1-100
|
2-200
|
1-5
|
2-6
| |
Bloc de nerfs périphériques
(bloc fémoral ou interscalénique)
| |
Perfusion continue ou injection intermittente (p.ex. pour l’antalgie postopératoire)
|
2,0
|
5-10 ml/h
|
10-20 mg/h
|
n/a
|
n/a
| |
*n/a = ne s’applique pas
Si un patient reçoit en plus de la ropivacaïne avec une autre technique, il ne faudra pas dépasser une dose totale de 225 mg.
1Pour le blocage d’un nerf principal, la dose doit être ajustée en fonction du site d’application et de l’état du patient. Des blocs interscaléniques ou supraclaviculaires peuvent provoquer des effets indésirables sévères indépendamment de l’anesthésique local utilisé (voir «Mises en garde et précautions»).
|
Utilisation correcte
Pour éviter une injection intravasculaire, il est conseillé de procéder prudemment à une aspiration avant et pendant l’injection (dose principale).
La dose principale doit être injectée lentement ou en injections répétées en bolus, à une vitesse de 25–50 mg/min. Les fonctions vitales du patient doivent être attentivement surveillées et le contact verbal doit être maintenu. Si la dose doit être appliquée par voie épidurale, il est recommandé d’injecter auparavant une dose de test de 3–5 ml de lidocaïne 1–2% avec de l’adrénaline. Une injection intravasculaire ou intrathécale accidentelle peut être identifiée par une augmentation transitoire de la fréquence cardiaque ou des signes d’un bloc spinal. Si des symptômes de toxicité apparaissent (voir «Surdosage»), l’injection doit être arrêtée immédiatement.
Une injection intrathécale ne doit être appliquée qu’après identification de l’espace sous-arachnoïdien et si le liquide cérébrospinal qui s’écoule de l’aiguille ou est aspiré, est clair.
Pour traiter les douleurs postopératoires, on recommande la technique suivante: une anesthésie épidurale peut être induite grâce à un cathéter épidural (posé avant l’opération) avec Ropivacain Sintetica 7,5 mg/ml.
L’analgésie peut être maintenue avec une perfusion de Ropivacain Sintetica 2 mg/ml.
Des études cliniques ont montré que dans la plupart des cas de douleurs postopératoires modérées à fortes, on peut, moyennant une vitesse de perfusion de 6–14 ml (12–28 mg) par heure, obtenir une analgésie suffisante ne s’accompagnant que d’un blocage moteur faible et nonprogressif. Cette technique a permis d’obtenir une réduction significative des quantités d’opioïdes sinon nécessaires avec d’autres méthodes.
Doses maximales
Des doses uniques allant jusqu’à 250 mg de ropivacaïne ont été utilisées dans des anesthésies épidurales en chirurgie, et bien tolérées.
Si on cherche à obtenir des anesthésies péridurales de longue durée par perfusion continue ou par des injections en bolus à répétition, il faut craindre des concentrations plasmatiques toxiques ou des lésions nerveuses locales. L’expérience dont on dispose à ce jour nous enseigne qu’une dose cumulative jusqu’à 800 mg de ropivacaïne, répartie sur 24 heures, est bien tolérée chez les adultes dans la chirurgie et l’analgésie postopératoire. De même, lors d’une perfusion continue postopératoire pour l’anesthésie péridurale, des doses pouvant aller jusqu’à 28 mg/heure pendant 72 heures sont bien tolérées par les adultes. Au cours d’études cliniques, des perfusions péridurales avec du chlorhydrate de ropivacain 2 mg/ml seul ou en association à Fentanyl 1 à 4 µg/ml ont été administrées pendant 72 heures au maximum pour le traitement postopératoire de la douleur. Le chlorhydrate de ropivacaine 2 mg/ml (6 à 14 ml/heure) a permis de limiter la douleur de manière suffisante chez la plupart des patients. L’association de ropivacaine et de fentanyl combat la douleur de manière plus puissante, mais provoque cependant des effets secondaires opioïdes associés.
Ni l’anesthésie rachidienne ni l’anesthésie épidurale n’ont été étudiées à des concentrations supérieures à 7,5 mg/ml pour la césarienne.
Si l’on cherche à obtenir des blocs de nerfs périphériques de longue durée par une perfusion continue ou par des injections répétées en bolus, il faut tenir compte du risque de concentrations plasmatiques toxiques ou de lésions nerveuses locales. Dans des études cliniques, un bloc fémoral a été obtenu par 300 mg de chlorhydrate de ropivacaine 7,5 mg/ml ou un bloc interscalénique par 225 mg de chlorhydrate de ropivacaine 7,5 mg/ml. Pour maintenir l’analgésie, une dose de 2,0 mg/ml était suffisante. Des taux de perfusion ou injections intermittentes de 10–20 mg/h permettent d’obtenir une analgésie adéquate pendant 48 heures.
Enfants
Posologie conseillée chez l’enfant
Les dosages indiqués sur le tableau suivant sont nécessaires pour obtenir un bloc efficace et constituent une référence pour l’utilisation chez l’enfant. Des variations individuelles peuvent survenir.
|
|
Conc.
(mg/ml)
|
Volume
(ml/kg PC)
|
Dose
(mg/kg PC)
| |
Traitement antalgique aigu
per et postopératoire
Anesthésie épiduralecaudale (single shot), chez l’enfant de 1 mois à 12 ans
|
2,0
|
1
|
2
| |
Blocage en dessous de T12 chez l’enfant d'un poids corporel allant jusqu’à 25 kg
|
|
|
| |
Bloc nerveux périphérique chez l’enfant de 1 à 12 ans
(p.ex. bloc de nerf ilioinguinal)
|
5,0
|
0,6
|
3
| |
Anesthésie épidurale en perfusion continue chez
l’enfant de 1 mois à 12 ans
| |
Enfants dont le poids corporel est <25 kg
1 à 6 mois
Bolusa
Perfusion de jusqu’à 72 h
6 à 12 mois
Bolusa
Perfusion de jusqu’à 72 h
1 à 12 ans*
Bolusb
Perfusion de jusqu’à 72 h
|
2,0
2,0
2,0
2,0
2,0
2,0
|
0,5-1
0,1 ml/kg/h
0,5-1
0,2 ml/kg/h
1
0,2 ml/kg/h
|
1-2
0,2 mg/kg/h
1-2
0,4 mg/kg/h
2
0,4 mg/kg/h
|
aLa dose plus faible est recommandée pour l’anesthésie épidurale thoracique, la dose plus forte pour l’anesthésie épidurale lombaire ou caudale.
bRecommandé pour l’anesthésie épidurale lombaire. Pour l’analgésie épidurale thoracique, la dose de l’injection en bolus est généralement réduite.
* Enfants jusqu’à 12 ans.
Chez les enfants obèses, une réduction progressive de la dose est souvent nécessaire. Le calcul de la dose doit se baser sur le poids idéal. Le volume de l’anesthésie épidurale caudale simple (une seule injection, «single shot») et des injections épidurales en bolus ne doit jamais dépasser 25 ml. Consulter la littérature standard au sujet des facteurs susceptibles d’exercer une influence dans certaines techniques spécifiques d’anesthésie ou chez des types particuliers de patients.
Pour éviter une injection intravasculaire, il est conseillé de procéder prudemment à une aspiration, avant et pendant l’injection (dose principale).
Les fonctions vitales de l’enfant traité doivent être surveillées en permanence par le personnel médical spécialisé. Si des symptômes de toxicité apparaissent (voir «Surdosage»), l’injection doit être arrêtée immédiatement.
Analgésie postopératoire chez l’enfant (de 1 mois à 12 ans)
Chez la plupart des patients, une seule injection épidurale caudale de Ropivacain Sintetica 2 mg/ml en dose de 1 ml/kg de PC, correspondant à 2 mg/kg de PC, suffit à induire une analgésie postopératoire efficace et fiable en dessous du niveau T12.
Pour obtenir une répartition différente de l’anesthésie sensorielle, le volume de l’injection épidurale caudale peut être ajusté en fonction des recommandations indiquées dans les traités de références en matière d’anesthésie.
Anesthésie ilioinguinale chez l’enfant (1 à 12 ans)
En cas d’anesthésie ilioinguinale, une seule injection de 3 mg/kg de poids corporel, (0,6 ml/kg de poids corporel) de Ropivacain Sintetica 5 mg/ml suffit à induire une analgésie efficace et fiable.
Quelle que soit la technique choisie, il est recommandé d'administrer l'injection de la dose d'anesthésique local calculée de façon fractionnée.
Les concentrations supérieures à 5 mg/ml n’ont pas été testées chez l’enfant.
L’administration intrathécale n’a pas été documentée chez l’enfant.
L’utilisation de Ropivacain Sintetica chez les prématurés n’a pas été documentée.
Contre-indicationsHypersensibilité au principe actif ropivacaïne ou à l’un des excipients selon la composition ou à
d’autres anesthésiques locaux de type amide. États de choc, infection du site d’injection.
Mises en garde et précautionsLa prudence est de mise en cas d'affections du myocarde, de diabète, de traitement anticoagulant ou d’insuffisance rénale et hépatique.
Il faut toujours choisir la dose et la concentration la plus faible permettant d’obtenir un bloc nerveux efficace.
Les méthodes d’anesthésie régionale ne devraient être utilisées qu’en des endroits disposant d’un équipement approprié et du personnel compétent. L’équipement et les médicaments nécessaires à la surveillance et, en cas d’urgence, à la réanimation du patient doivent être à disposition immédiate.
Les patients chez lesquels le blocage d’un nerf principal est prévu doivent présenter un état optimal, et il faudrait poser un accès i.v. avant le blocage. Le médecin responsable doit disposer de la formation et de l’expérience adéquates pour le diagnostic et le traitement d’ effets indésirables, d’une toxicité systémique et d’autres complications (voir «Surdosage»).
Lors d’un blocage périphérique d’un nerf principal dans des régions fortement vascularisées, une quantité importante d’anesthésique local peut s’avérer nécessaire. Les régions fortement vascularisées sont souvent localisées près de grands vaisseaux. Il existe donc un risque élevé en cas d’injection intravasculaire et/ou d’absorption systémique rapide, pouvant conduire à des concentrations plasmatiques trop élevées.
Lorsqu’on recourt à certains procédés d’anesthésie comme les injections dans la tête ou la nuque, le risque d’effets indésirables sérieux est accru, indépendamment de l’anesthésique local utilisé.
Bien qu’une anesthésie régionale soit souvent indiquée chez les patients dont l’état général est insatisfaisant (en raison de facteurs dus à l’âge ou d’autres facteurs qui agissent sur leur santé, tels qu’un bloc cardiaque partiel ou complet, une affection hépatique au stade avancé ou une insuffisance rénale grave), ces patients requièrent précisément une attention soutenue.
Après l’administration épidurale, un bloc sympathique haut ou une propagation intracrânienne de l’anesthésique local peut parfois provoquer, en particulier chez les femmes enceintes, un syndrome de Horner caractérisé par un myosis, une blépharoptose et une anhidrose. Ce syndrome est spontanément résolutif à l’arrêt du traitement. Une surveillance attentive des patients sous anesthésie péridurale est néanmoins recommandée afin de prévenir le risque potentiel d’arrêt cardiocirculatoire résultant d’un bloc sympathique haut.
Les patients traités par des antiarythmiques de classe III (comme p. ex. l’amiodarone) doivent être surveillés et un examen par ECG doit être pris en considération, car les effets cardiaques peuvent être additifs.
Des cas d’arrêt cardiaque lors d’administration épidurale ou de bloc nerveux périphérique avec de la ropivacaine ont été rarement rapportés, notamment en cas d’administration intravasculaire involontaire chez le patient âgé et chez le patient ayant une coronaropathie préexistante. Dans certains cas, une réanimation s’est révélée difficile. En cas d’arrêt cardiaque, les chances de succès peuvent être augmentées par une prolongation des mesures de réanimation.
Etant donné que la ropivacaine est métabolisée dans le foie, une prudence particulière est de mise chez les patients souffrant d’affections hépatiques sévères. Lors d’administrations répétées, il convient d’envisager une réduction adéquate de la dose en raison de l’élimination ralentie. Normalement, aucune adaptation de la dose n’est nécessaire pour une dose unique ou lors d’un traitement de courte durée chez les patients dont la fonction rénale est réduite. Une acidose et des concentrations réduites de protéines plasmatiques peuvent augmenter le risque de toxicité systémique chez les patients souffrant d’insuffisance rénale chronique (voir «Posologie/Mode d’emploi»).
Les anesthésies épidurales et rachidiennes peuvent provoquer une hypotension et une bradycardie. Le risque de réactions de ce type peut être reduit, p. ex par un remplissage vasculaire préalable ou par l’injection d’un agent vasopresseur. Une hypotension sera traitée immédiatement par, p.ex. une injection i.v. de 5 à 10 mg d’éphédrine, que l’on répétera en cas de nécessité. Une prudence particulière est de rigueur chez les nourrissons dès l’âge de 1 mois, car quelques organes et fonctions métaboliques n’ont pas encore atteint leur pleine maturité. Ceci est particulièrement important lors d’une perfusion épidurale continue. Chez l’enfant, la dose d’éphédrine doit être adaptée en fonction de l’âge et du poids corporel.
Les bradycardies doivent être traitées par l’administration de 0,5–1 mg d’atropine en i.v.
Suivant la posologie et l’intervalle entre les doses, en particulier aussi dans les anesthésies épidurales continues, les injections à répétition peuvent produire une accumulation de l’anesthésique local et, par
conséquent, un risque de toxicité. Après plusieurs injections, on observe une tachyphylaxie; ce phénomène est observé principalement au cours d’anesthésies épidurales de longue durée.
Une administration prolongée de ropivacaïne devrait être évitée chez les patients traités par des inhibiteurs puissants du CYP1A2 (p.ex. fluvoxamine, énoxacine, voir «Interactions»).
Chez les patients souffrant d’une porphyrie aiguë, Ropivacain Sintetica ne doit être administré que dans les cas urgents, car il pourrait avoir des effets porphyrinogènes. Il convient donc de prendre des mesures de précaution appropriées chez les patients à risque.
Une injection intrathécale involontaire se reconnaît par les signes d’un blocage spinal.
Il existe des rapports postcommercialisation signalant une chondrolyse chez des patients ayant reçu une perfusion intra-articulaire continue d’anesthésiques locaux en postopératoire. La majorité des cas signalés concernent l’articulation de l’épaule. Vu les multiples facteurs d’influence sur le mécanisme d’action et vu la disparité existant dans la littérature scientifique, le rapport entre les éléments considérés n’est pas démontré. La perfusion intra-articulaire continue n’est pas une indication homologuée de Ropivacain Sintetica.
Enfants
La posologie chez l’enfant doit être adaptée à l’âge et au poids corporel (voir le tableau sous «Posologie/Mode d’emploi», «Posologie conseillée chez l’enfant»).
Une prudence particulière peut être indiquée chez les nourrissons de moins de 6 mois, étant donné que leurs fonctions métaboliques n’ont pas encore atteint leur pleine maturité. Dans des études cliniques, les concentrations plasmatiques de la ropivacaïne ont varié fortement chez l’enfant de moins de 6 mois. Le risque d’une toxicité systémique est donc éventuellement accru dans cette tranche d’âge, en particulier pendant une perfusion épidurale continue.
Les recommandations posologiques pour les enfants de moins de 6 mois sont basées sur des données cliniques limitées.
Chez ces patients, la ropivacaïne ne doit être utilisée que sous surveillance constante de la toxicité systémique, de l’ECG, de la valeur de saturation sanguine en oxygène et des symptômes neurotoxiques localisés (p. ex. phase de rétablissement prolongée). En raison de la lenteur d’élimination de la ropivacaïne chez l’enfant de moins de 6 mois, ces contrôles doivent être poursuivis encore après la perfusion.
Sodium
Ropivacain Sintetica 2 mg/ml, solution injectable/pour perfusion
Ce médicament contient 34 mg de sodium par ampoule à 10 ml resp. 68 mg de sodium par ampoule à 20 ml ce qui équivaut à 1.7% (ampoule à 10 ml) resp. 3.4% (ampoule à 20 ml) de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
Ce médicament contient 340 mg de sodium par poche à 100 ml resp. 680 de sodium par poche à 200 ml resp. 1700 mg de sodium par poche à 500 ml ce qui équivaut à 17% (poche à 100 ml) resp. 34% (poche à 200 ml) resp. 85% (poche à 500 ml) de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
Ropivacain Sintetica 5 mg/ml, solution injectable
Ce médicament contient 32 mg de sodium par ampoule à 10 ml ce qui équivaut à 1.6 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
Ropivacain Sintetica 7.5 mg/ml, solution injectable
Ce médicament contient 30 mg de sodium par ampoule à 10 ml resp. 60 mg de sodium par ampoule à 20 ml ce qui équivaut à 1.5% (ampoule à 10 ml) resp. 3% (ampoule à 20 ml) de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
Ropicacain Sintetica 10 mg/ml, solution injectable
Ce médicament contient 28 mg de sodium par ampoule à 10 ml resp. 56 mg de sodium par ampoule à 20 ml ce qui équivaut à 1.4% (ampoule à 10 ml) resp. 2.8% (ampoule à 20 ml) de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
InteractionsAucune étude spécifique sur les interactions médicamenteuses n’a été effectuée.
Ropivacain Sintetica devrait être utilisé avec prudence chez les patients traités par d’autres anesthésiques locaux, ou d’autres principes actifs de structure apparentée aux anesthésiques de type amide (antiarythmique, p.ex. lidocaïne et mexilétine), étant donné que leurs effets toxiques systémiques sont additifs. Aucune étude d’interaction spécifique entre la lidocaïne et les antiarythmiques de classe III (p. ex. l’amiodarone) n’a été effectuée. La prudence est toutefois recommandée (voir «Mises en garde et précautions»).
L’administration simultanée de ropivacaïne et de narcotiques ou d’opiacés est susceptible de renforcer leurs effets réciproques, principaux ou secondaires. Chez les volontaires sains, une réduction de près de 70% de la clairance de la ropivacaïne a été notée en cas d’administration concomitante de fluvoxamine, un puissant inhibiteur du CYP1A2. Une administration au long cours de ropivacaïne devrait donc être évitée chez les patients traités par fluvoxamine et énoxacine (voir «Mises en garde et précautions»).
Grossesse, AllaitementGrossesse
On ne dispose pas d’études cliniques chez la femme enceinte. Dans ces conditions, le médicament ne devrait être administré qu’en cas de nécessité absolue. En revanche, l’utilisation de la ropivacaïne en obstétrique (anesthésie ou analgésie) est établie. Cependant, la ropivacaïne traverse le placenta (voir «Pharmacocinétique»). Elle peut diminuer la fréquence cardiaque du fœtus et provoquer une bradycardie fœtale. Une surveillance attentive de la fréquence cardiaque fœtale est donc recommandée.
Des études sur l’animal ont montré qu’elle n’exerce aucun effet toxique direct ou indirect sur la gestation, le développement embryonnaire ou fœtal, la naissance ou le développement postnatal (voir «Données précliniques»).
Accouchement
En cas de césarienne, l’administration intrathécale n’a pas été documentée.
Allaitement
Aucune étude n’a été réalisée concernant l’éventuel passage de la ropivacaïne ou de ses métabolites dans le lait maternel. Pendant l’allaitement, l’enfant est exposé à des concentrations de ropivacaïne beaucoup moins élevées qu’in utero, pendant la naissance sous anesthésie régionale/analgésie induite par ropivacaïne.
Effet sur l’aptitude à la conduite et l’utilisation de machinesEn dehors des conséquences directes d’une anesthésie, les anesthésiques locaux peuvent provoquer de légers troubles mentaux et coordinatifs, même en l’absence d’une toxicité manifeste au niveau central. C’est pourquoi la vigilance et la capacité motrice peuvent être affectées transitoirement.
Effets indésirablesLes effets indésirables de Ropivacain Sintetica sont semblables à ceux d’autres anesthésiques locaux de type amide.
Les effets indésirables dus au médicament en soi sont difficiles à distinguer des manifestations suivantes:
– effets physiologiques d’un bloc nerveux (p. ex. chute de tension, bradycardie),
– effets directs ou indirects de la ponction (p. ex. lésion nerveuse ou abcès épidural).
Un blocage spinal total peut survenir sous tout anesthésique local, y compris sous Ropivacain Sintetica, lorsqu’une dose épidurale est appliquée accidentellement par voie intrathécale ou lorsque la dose intrathécale administrée est trop élevée.
Les effets indésirables les plus fréquents chez l’enfant sont les vomissements, les nausées et le prurit.
Les fréquences sont indiquées comme suit :
« très fréquents » (≥1/10),
« fréquents » (≥1/100 à <1/10),
« occasionnels » (≥1/1000 à <1/100),
« rares » (≥1/10 000 à <1/1000),
« très rares » (<1/10 000).
« Fréquence inconnue (ne peut être estimée sur la base des données disponibles) ».
Affections du système immunitaire
Rares: réactions allergiques (réactions anaphylactiques, choc anaphylactique, œdème de Quincke et urticaire).
Affections psychiatriques
Occasionnels: états d’anxiété.
Affections du système nerveux
Fréquents: paresthésie, céphalées, vertiges, diminution de la sensibilité tactile.
Occasionnels: symptômes de toxicité du SNC (convulsions, crises de type grand mal, crises d’épilepsie, photosensibilité, paresthésie circumorale, insensibilité de la langue, hyperacousie, acouphènes, trouble visuels, dysarthrie, spasmes musculaires, tremblements), syndrome de Horner, hypoesthésie.
Rares: neuropathie et troubles fonctionnels de la moelle épinière (p. ex. syndrome de l’artère spinale antérieure, arachnoïdites, syndrome de la queue de cheval).
Frequénce inconnue: spasmes consécutifs à une injection intravasculaire accidentelle de 200 mg lors d’une tentative d’induire un bloc du plexus brachial.
Affections cardiaques
Fréquents: bradycardie, tachycardie.
Rares: arrêt cardiaque, arythmie.
Affections vasculaires
Très fréquents: hypotension (39%).
Fréquents: hypertension.
Occasionnels: syncopes.
Des réactions cardiovasculaires indirectes (hypotension, bradycardie) peuvent se manifester suite à une anesthésie épidurale, selon l’étendue du bloc sympathique accompagnant celle-ci.
Frequénce inconnue: complication ischémique après bloc pénien par ropivacaïne 0,75%.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: dyspnée.
Affections gastro-intestinales
Très fréquents: nausée (24,1%), vomissements (12%).
Affections musculosquelettiques et du tissu conjonctif
Fréquents: douleurs dorsales.
Affections du rein et des voies urinaires
Fréquents: rétention urinaire.
Troubles généraux et anomalies au site d’administration
Fréquents: température accrue, rigidité, frissons.
Occasionnels: hypothermie.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Toxicité systémique aiguë
Les réactions toxiques systémiques peuvent inclure le système nerveux central et cardiovasculaire.
Ces réactions sont dues à des concentrations élevées d’anesthésiques locaux qui:
sont administrés accidentellement par voie intravasculaire ou en surdosage ou
sont anormalement vite absorbés par des régions fortement vascularisées (voir «Mises en garde et précautions»).
Les réactions du SNC sont similaires pour tous les anesthésiques locaux de type amide, tandis que les réactions cardiaques dépendent davantage du médicament en termes de quantité et de qualité.
Des anesthésiques locaux administrés accidentellement par voie intravasculaire peuvent provoquer immédiatement (en l’espace de quelques secondes à quelques minutes) des réactions toxiques systémiques. En cas de surdosage, ces réactions apparaissent plus tardivement en raison de l’augmentation plus lente de la concentration sanguine des anesthésiques locaux (15–60 minutes après une injection).
Toxicité du système nerveux central
Évolue par étapes, avec des symptômes dont la gravité va croissant. Au début, les symptômes sont les suivants: photosensibilité, paresthésies circumorales, insensibilité de la langue, hyperacousie, acouphènes et troubles visuels. Une dysarthrie, des spasmes musculaires, des tremblements sont plus graves et peuvent précéder des convulsions générales. De tels signes ne doivent pas être confondus avec un comportement névrotique. Ils peuvent être suivis de perte de connaissance et de convulsions épileptiques (grand mal), lesquelles peuvent durer de quelques secondes à plusieurs minutes.
L’élévation de l’activité musculaire et la gêne respiratoire provoquées par les spasmes entraînent rapidement l’apparition d’hypercapnie et d’hypoxie. Dans les cas graves, une apnée peut survenir. L’acidose augmente les effets toxiques des anesthésiques locaux.
La guérison intervient à la suite d’une redistribution de l’anesthésique local à partir du SNC, suivie de sa métabolisation et de son élimination. Si l’anesthésique n’a pas été injecté en grande quantité, la guérison peut intervenir rapidement.
Toxicité du système cardiovasculaire
Des effets sur le système cardiovasculaire peuvent être observés dans les cas sévères. Les effets toxiques cardiovasculaires sont généralement précédés par des signes de toxicité du système nerveux central. Chez un patient sous sédatifs puissants ou sous anesthésie générale, il est possible que les signes précurseurs du SNC soient absents ou que l’identification des signes précoces d’une toxicité soit difficile. De fortes concentrations systémiques d’anesthésiques locaux peuvent provoquer une hypotension, une bradycardie, des arythmies et même un arrêt cardiaque. On a observé dans de rares cas un arrêt cardiaque sans signes précurseurs du SNC.
L’identification des signes précoces d’une toxicité systémique chez l’enfant est plus difficile, étant donné que les enfants ne peuvent éventuellement pas s’exprimer verbalement ou lorsqu’ils sont sous anesthésie générale.
Traitement de la toxicité aiguë
En cas de signes de toxicité systémique aiguë, l’injection de l’anesthésique local doit être arrêtée immédiatement.
En présence de symptômes du SNC (convulsions, dépression du SNC), on visera les objectifs thérapeutiques suivants:
Maintenir l’apport d’oxygène, stopper les convulsions et soutenir la circulation. Au besoin, on recourra à l’insufflateur et au masque ou initiera une intubation endotrachéale.
Un médicament spasmolytique doit être administré par voie i.v. si les convulsions ne disparaissent pas spontanément en l’espace de 15–20 secondes. Le thiopenthal sodique 1 à 3 mg/kg i.v. empêche rapidement les convulsions. Une autre possibilité est d’administrer du diazépam (0,1 mg/kg i.v.), bien que l’installation de l’effet soit moins rapide. Des spasmes continus peuvent compromettre la respiration et l’apport d’oxygène du patient. L’injection d’un myorelaxant (p.ex. succinylcholine 1 mg/kg) arrêtera rapidement les convulsions de sorte à faciliter la respiration et permettre un contrôle de l’apport d’oxygène. Dans ces cas, une intubation intratrachéale doit être envisagée. Si une dépression cardio-vasculaire devient manifeste (hypotension, bradycardie), on donnera un sympathomimétique (p. ex. éphédrine 5 à 10 mg i.v. ; répéter l’administration 2 à 3 minutes plus tard au besoin).
En cas de bradycardie, administrer de l’atropine (0,5–1 mg i.v.).
La dose d’éphédrine chez l’enfant doit être ajustée en fonction de l’âge et du poids corporel.
Lors d’une défaillance de la circulation, une réanimation cardiopulmonaire doit être faite rapidement: il est vital d’assurer un apport optimal d’oxygène et d’air (respiration artificielle), de stimuler la circulation et de traiter l’acidose.
En cas d’arrêt cardiaque, les chances de succès peuvent être augmentées par une prolongation des mesures de réanimation.
Propriétés/EffetsCode ATC
N01BB09
Mécanisme d’action / Pharmacodynamique
La ropivacaine est le premier anesthésique de type amide à action durable qui ait été développé sous la forme d’un énantiomère pur (énantiomère S-(-)).
Ropivacain Sintetica a un effet anesthésique et analgésique.
Administré à des concentrations élevées, Ropivacain Sintetica induit une anesthésie qui permet des interventions chirurgicales, tandis qu’à faible dose, il produit un blocage sensoriel (analgésie) accompagné d’un blocage moteur limité et non progressif.
La durée et l’intensité du blocage induit par la ropivacaïne ne sont pas augmentées par l’adjonction d’adrénaline.
Comme d’autres anesthésiques locaux, la ropivacaïne induit un blocage réversible de la conduction sensorielle le long des fibres nerveuses en inhibant le flux des ions sodium à travers la membrane cellulaire des fibres nerveuses.
Les anesthésiques locaux peuvent avoir des effets semblables sur d’autres membranes excitables, p.ex. au niveau du cerveau ou du myocarde. Dans le cas d’une grande quantité de Ropivacain Sintetica dans la circulation, des symptômes de toxicité procédant du système nerveux central et du système cardiovasculaire peuvent se manifester.
Les effets cardiovasculaires sont devancés par l’apparition de signes de toxicité émanant du système nerveux central (voir «Surdosage»), car les symptômes du système nerveux central peuvent déjà survenir sous l’effet de faibles concentrations plasmatiques. Des effets cardiovasculaires indirects (hypotension, bradycardie) peuvent survenir après une administration épidurale; ils dépendent toutefois du degré du bloc sympathique.
Efficacité clinique
Aucune donnée.
PharmacocinétiqueLa ropivacaïne a un centre chiral et est un énantiomère S-(-) pur.
Absorption
La concentration plasmatique de la ropivacaïne varie en fonction de la dose, de la zone d’application et du taux d’irrigation tissulaire au lieu d’injection. La ropivacaïne présente une pharmacocinétique linéaire et la concentration plasmatique maximale est proportionnelle à la dose.
L’absorption de la ropivacaïne à partir de l’espace épidural suit un mode biphasique complet, chez l’enfant également. Les demi-vies des deux phases sont de l’ordre de 14 minutes, respectivement de 4 heures.
Une augmentation de la concentration plasmatique totale a été observée pendant une perfusion épidurale et interscalénique continue. Celle-ci est liée à l’augmentation postopératoire du taux d’a1-glycoprotéine acide.
Les écarts ont été beaucoup plus faibles pour la concentration de la partie non liée, c.-à.-d. ayant le plus d’activité pharmacologique, que pour la concentration plasmatique totale.
Distribution
La ropivacaïne possède un pKa de 8,1 et un coefficient de partage de 141 (25 °C noctanol/solution-tampon phosphate pH 7,4).
A l’état d’équilibre, la ropivacaïne présente un volume de distribution de 47 litres (38–60) et une demi-vie finale de 1,8 heure après administration i.v.. La ropivacaïne a un coefficient d’extraction hépatique d’environ 0,4 (0,2–0,6). Elle est principalement liée, dans le plasma, à l’a1glycoprotéine acide; la fraction non liée est d’environ 6%, pour une fraction liée aux protéines plasmatiques s’élevant à 94%.
La ropivacaïne passe la barrière placentaire, et un équilibre des concentrations non liées est atteint rapidement. Le taux de liaison aux protéines plasmatiques est moins élevé chez le foetus que chez la mère (95% [nouveau-né = 30% de la mère]); il en résulte, pour le foetus, une concentration plasmatique totale inférieure à celle de la mère.
Métabolisme
La ropivacaïne est principalement métabolisée dans le foie, surtout par hydroxylation aromatique en 3-hydroxy-ropivacaïne (métabolite principal) au moyen du cytochrome P4501A2; par N-désalkylation en pipécoloxylidide (PPX) au moyen du CYP3A4. Après une administration IV unique, près de 37% de la dose totale sont éliminés par les urines, sous forme de 3-hydroxy-ropivacaïne aussi bien libre que conjuguée. De faibles concentrations de 3-hydroxy-ropivacaïne ont été retrouvées dans le plasma. Moins de 3% de PPX et d’autres métabolites ont été éliminés par les urines. Les 3-hydroxy- ropivacaïne et 4-hydroxy-ropivacaïne ont une efficacité anesthésique locale, bien qu’elle soit beaucoup plus faible que celle de la ropivacaïne.
Pendant une perfusion épidurale, les deux métabolites principaux, pipécoloxylidide (PPX) et 3-hydroxy-ropivacaïne, sont excrétés par les reins.
La concentration plasmatique totale de PPX s’élevait à environ la moitié de la dose de ropivacaïne administrée. Après une perfusion épidurale continue pendant 72 heures, la concentration moyenne de PPX libre était cependant 7–9 fois supérieure à la concentration de ropivacaïne libre.
Chez les rats, la valeur limite pour des concentrations plasmatiques de PPX libre toxiques pour le SNC était 12 fois plus élevée que celle de ropivacaïne libre.
Il n’existe aucun indice en faveur d’une racémisation in vivo de la ropivacaïne.
Un modèle comparable des métabolites principaux a été observé chez les enfants âgés de plus de 1 an.
Élimination
La lente absorption est le facteur déterminant pour la vitesse d’élimination de la ropivacaïne (flip-flop). C’est la raison pour laquelle la demi-vie d’élimination après utilisation épidurale est plus longue qu’après administration intraveineuse (4,2 h vs 1,7 h).
La ropivacaïne présente une clairance plasmatique médiane totale de 440 ml/min (387–501), une clairance plasmatique de 8 l/min pour le médicament non lié, et une clairance rénale de 1 ml/min.
Après administration intraveineuse, 86% de la dose sont éliminés par voie urinaire, dont seulement 1% environ sous forme non modifiée.
Le principal métabolite est la 3-hydroxy-ropivacaïne, qui est éliminée à raison d’environ 37% par les urines, en majorité sous forme conjuguée. L’élimination urinaire de la 4-hydroxy-ropivacaïne, désalkylée en N- ou en 4-hydroxy-, s’élève à 1–3%. Les formes conjuguées et non conjuguées de la 3-hydroxy-ropivacaïne ne se trouvent en concentrations détectables que dans le plasma.
Cinétique pour certains groupes de patients
Pédiatrie
La pharmacocinétique de la ropivacaïne a été analysée à partir des données cumulées de 6 études réalisées chez 192 enfants âgés de 0 à 12 ans. La ropivacaïne libre, la clairance de PPX et le volume de distribution de la ropivacaïne libre dépendent autant du poids corporel que de l’âge du patient jusqu’à ce que la fonction hépatique soit pleinement développée (après quoi ils dépendent essentiellement du poids corporel). La maturation pour la clairance de la ropivacaïne libre semble être atteinte à l’âge de 3 ans, celle pour la clairance de PPX à 1 an et celle pour le volume de distribution de la ropivacaïne libre à 2 ans. Le volume de distribution de PPX libre dépend uniquement du poids corporel.
La clairance de la ropivacaïne libre est de 2,4 à 3,6 l/h/kg chez le nouveau-né (0 à 1 mois) et augmente par la suite pour atteindre env. 8 à 16 l/h/kg chez l’enfant de plus de 6 mois. Ces valeurs se situent au niveau de celles de l’adulte. Les valeurs totales de clairance de la ropivacaïne par kg de poids corporel augmentent d’environ 0,1 l/h/kg chez le nouveau-né, à 0,15 l/h/kg chez l’enfant d’un mois et à 0,3 à 0,6 l/h/kg chez l’enfant de 6 mois. Le volume de distribution de la ropivacaïne libre par kg de poids corporel passe de 22 l/kg chez le nouveau-né à 26 l/kg chez l’enfant d’un mois et à 42 à 66 l/kg chez l’enfant de 6 mois. Le volume de distribution total par kg de poids corporel passe de 0,9 l/kg chez le nouveau-né à 1,0 l/kg chez l’enfant d’un mois et à 1,7 à 2,6 l/kg chez l’enfant de 6 mois. La demi-vie terminale de la ropivacaïne est plus longue chez le nouveau-né (6 h) et l’enfant d’un mois (5 h) que chez l’enfant plus âgé (3 h). De même, la demi-vie terminale (t½) de PPX est plus longue chez le nouveau-né (43 h) et chez l’enfant d’un mois (26 h) que chez l’enfant plus âgé (15 h).
La dose recommandée pour la perfusion épidurale continue change à l’âge de 6 mois. La clairance de la ropivacaïne libre atteint 34% de la valeur mature, celle de PPX libre 71%. L’exposition systémique est plus importante chez le nouveau-né et chez l’enfant de 1 à 6 mois que chez l’enfant plus âgé, ce qui est imputable au manque de maturité de la fonction hépatique. Cette particularité est toutefois partiellement compensée par la dose recommandée, plus faible de 50%, pour la perfusion épidurale continue chez l’enfant de moins de 6 mois.
Des simulations de la somme des concentrations plasmatiques de ropivacaïne libre et de PPX, basées sur les paramètres pharmacocinétiques et leur distribution dans l’analyse de la population, ont révélé pour le groupe des enfants les plus jeunes et le groupe de 1 à 10 ans que la dose recommandée pour une anesthésie caudale simple devrait être multipliée par 2,7 et par 7,4 respectivement pour atteindre la limite supérieure de l’intervalle de confiance à 90%, et donc une toxicité systémique. Pour la perfusion épidurale continue, la dose doit être multipliée de façon analogue par 1,8 et par 3,8 respectivement.
Une insuffisance rénale n’a aucune ou qu’une faible influence sur la pharmacocinétique de la ropivacaïne. La clairance rénale du PPX présente une corrélation significative avec la clairance de la créatinine. Le manque de corrélation entre l’exposition totale (exprimée par l’ASC) et la clairance de la créatinine montre que la clairance totale du PPX inclut une étape non rénale d’élimination en plus de l’élimination par voie rénale. Certains patients insuffisants rénaux peuvent avoir une exposition accrue au PPX en raison d’une faible clairance non rénale. Étant donné que le PPX présente une plus faible toxicité pour le SNC que la ropivacaïne, les conséquences cliniques sont sans importance pour le traitement de courte durée.
Grossesse
La ropivacaïne passe la barrière placentaire et l’équilibre relatif à la fraction libre, non liée, est suspendu. La liaison aux protéines plasmatiques est moins élevée chez le foetus que chez la mère; il en résulte pour le foetus une concentration plasmatique totale inférieure à celle de la mère.
Données précliniquesDes études sur la sécurité in vitro et sur l’animal n’ont révélé aucun risque pour l’humain en ce qui concerne la mutagénicité après administration unique et répétée, et la reproduction. Du point de vue de la sécurité pharmacologique, des symptômes SNC (convulsions précédant les effets cardiovasculaires) et une cardiotoxicité – un peu moins marqués que sous bupivacaïne – sont probables à des doses excessives.
La cardiotoxicité peut se traduire par une conduction ralentie, un effet inotrope négatif ainsi que des arythmies dose-dépendantes et un arrêt cardiaque. Les effets survenant à des doses intraveineuses élevées peuvent être évités par les mesures d’urgence correspondantes. Des brebis en gestation n’ont pas présenté de sensibilité accrue aux effets toxiques de la ropivacaïne par rapport à des animaux non gravides.
Remarques particulièresIncompatibilités
Le pH de la solution injectable Ropivacain Sintetica se situe entre 4,0 et 6,0. La solubilité de la ropivacaïne à un pH supérieur à 6 est limitée. Il faut en tenir compte lors de l’adjonction de solutions alcalines (p.ex. carbonates), vu qu’à des valeurs de pH plus élevées, une précipitation peut se produire. Le médicament ne doit être mélangé qu’avec les médicaments mentionnés dans la rubrique «Remarques concernant la manipulation».
.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
La solution ne contient pas d'agent conservateur. Pour des raisons microbiologiques, les préparations prêtes à l'emploi doivent être utilisées immédiatement après ouverture. Les poches pour perfusion épidurale sont prévues pour une utilisation qui ne doit pas dépasser 24 heures. Après utilisation, les quantités restantes doivent être jetées.
La stabilité chimique et physique d’un mélange avec les médicaments mentionnés à la rubrique «Remarques concernant la manipulation» a été démontrée pour une période de 30 jours à 30 C. Pour des raisons microbiologiques, les solutions préparées doivent être utilisées immédiatement.
Remarques particulières concernant le stockage
Conserver dans l’emballage d’origine, protégé de la lumière et à température ambiante (15-25°C). Tenir hors de portée des enfants .
Remarques concernant la manipulation
Les poches de Ropivacain Sintetica sont munies d'une sortie de perfusion et d'un site d'adjonction de médicaments. La solution pour perfusion (concentration de chlorhydrate de Ropivacain Sintetica 1-2 mg/ml) est compatible avec les substances suivantes: citrate de fentanyl (1,0-10,0 µg/ml), citrate de sufentanil (0,4-4,0 µg/ml), sulfate de morphine (20-100 µg/ml), chlorhydrate de clonidine (5,0-50,0 µg/ml).
N’utiliser que des solutions limpides et des emballages intacts.
Les ampoules s’adaptent à des seringues Luerlock et Luerfit.
Mode d’emploi des ampoules :
1.Vider le col de l’ampoule en agitant vigoureusement.

2.Tenir l’ampoule en position verticale. Ouvrir l’ampoule en tournant rapidement sa partie supérieure.
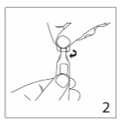
3.Placer la seringue verticalement dans l’ampoule. Tourner le tout de 180°. (L’ampoule s’adapte aux seringues Luerfit et Luerlock).
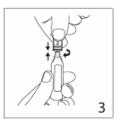
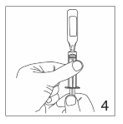
4.Remplir la seringue de solution sans presser l’ampoule. Oter l’ampoule sans modifier la position du piston de la seringue.
Numéro d’autorisation60488 (Swissmedic).
PrésentationRopivacain Sintetica 2 mg/ml :
Poche pour perfusion PP : 1, 10 × 100 ml; 1, 5 × 200 ml, 5 x 500
Ampoules PP : 10 × 10 ml, 10 × 20 ml
Ropivacain Sintetica 5 mg/ml :
Ampoules PP : 10 × 10 ml
Ampoules PP : 10 × 20 ml
Ropivacain Sintetica 7,5 mg/ml :
Ampoules PP : 10 × 10 ml, 10 × 20 ml
Ropivacain Sintetica 10 mg/ml :
Ampoules PP : 10 × 10 ml, 10 × 20 ml [B]
Titulaire de l’autorisationSintetica S.A., 6850 Mendrisio
Mise à jour de l’informationSeptembre 2024
|




