CompositionPrincipes actifs
Tobramycinum.
Excipients
1,2-distearoyl-sn-glycero-3-phosphatidylcholinum, calcii chloridum dihydricum, acidum sulfuricum (E513).
Indications/Possibilités d’emploiTobi Podhaler est indiqué pour le traitement des infections pulmonaires à Pseudomonas aeruginosa chez les patients à partir de l'âge de 6 ans atteints de mucoviscidose.
Posologie/Mode d’emploiPopulation cible générale: adultes et enfants à partir de 6 ans atteints de mucoviscidose et d'une infection pulmonaire à Pseudomonas aeruginosa
La dose de TOBI Podhaler est la même pour tous les patients, quels que soient leur âge ou leur poids corporel. La posologie recommandée est de quatre capsules (4 × 28 mg = 112 mg de tobramycine) deux fois par jour pendant 28 jours. Les deux doses de quatre capsules doivent être inhalées si possible exactement à 12 heures d'intervalle et cet intervalle ne doit pas être inférieur à six heures.
TOBI Podhaler est utilisé de manière cyclique, 28 jours avec le médicament, suivis de 28 jours sans le médicament.
Si le patient a oublié une dose et qu'il reste encore au moins 6 heures avant la dose suivante, celui-ci doit inhaler la dose dès que possible. Dans le cas contraire, le patient doit attendre l'inhalation suivante, mais il ne doit pas inhaler plus de capsules pour compenser la dose qu'il a oubliée.
La sécurité d'emploi et l'efficacité ne sont pas établies chez les patients de moins de 6 ans, les patients présentant un VEMS (volume expiratoire maximal seconde) <25% ou >80% de la valeur prédite, ainsi que chez les patients infectés par Burkholderia cepacia.
Utilisation dans des populations particulières de patients
Patients présentant des troubles de la fonction hépatique
Aucune étude n'a été réalisée chez des patients insuffisants hépatiques. La tobramycine n'étant pratiquement pas métabolisée, une insuffisance hépatique ne devrait pas avoir d'effet sur l'exposition à la tobramycine.
Patients présentant des troubles de la fonction rénale
La tobramycine étant essentiellement éliminée par les urines sous forme inchangée, il faut s'attendre à ce que la fonction rénale ait une influence sur l'exposition à la tobramycine. Aucun patient présentant une créatininémie ≥2 mg/dl et une azotémie (BUN) ≥40 mg/dl n'a été inclus dans les études cliniques et il n'existe aucune donnée permettant de recommander ou non une adaptation posologique de TOBI Podhaler chez ces patients (voir aussi «Mises en garde et précautions», «Néphrotoxicité»).
Patients âgés (≥65 ans)
Les données disponibles dans cette population sont insuffisantes pour recommander ou non une adaptation posologique. La fonction rénale doit être prise en compte lors de l'utilisation de TOBI Podhaler chez des patients âgés (voir «Mises en garde et précautions», «Néphrotoxicité»).
Enfants de moins de 6 ans
L'utilisation de TOBI Podhaler n'est pas indiquée dans ce groupe d'âge. Des enfants à partir de l'âge de 6 ans ont participé à des études cliniques avec TOBI Podhaler; TOBI Podhaler n'a pas été évalué chez des enfants plus jeunes.
Patients ayant subi une transplantation d'organe
Il n'existe pas de données suffisantes sur l'utilisation de TOBI Podhaler chez des patients ayant subi une transplantation d'organe.
Mode d'emploi
TOBI Podhaler est utilisé exclusivement par inhalation buccale et uniquement à l'aide de l'inhalateur T-326. Le médicament ne doit être administré par aucune autre voie et avec aucun autre inhalateur (voir «Remarques particulières», «Manipulation»). Ne pas avaler les capsules de TOBI Podhaler!
Si le patient inhale plusieurs médicaments et bénéficie d'une physiothérapie thoracique, il est recommandé que TOBI Podhaler soit inhalé en dernier.
Contre-indicationsTOBI Podhaler est contre-indiqué chez les patients présentant une hypersensibilité connue aux aminoglycosides ou à un autre composant.
Mises en garde et précautionsTolérance
Au cours des études cliniques ayant comparé la tolérance de TOBI Podhaler à celle de TOBI, un nombre plus élevé d'effets indésirables, tels que toux ou douleurs oropharyngées, a été rapporté.
La tolérance de TOBI Podhaler doit être évaluée régulièrement, tous les trois mois, par les patients. En cas d'intolérance continue liée au médicament, le traitement doit, en alternative, être poursuivi par TOBI.
Résistance microbiologique
Au cours des études cliniques menées avec TOBI Podhaler, certains patients ont présenté une augmentation de la CMI pour les isolats de P. aeruginosa testés. Cette augmentation de la CMI a été réversible dans la majorité des cas pendant les périodes sans traitement.
Il existe néanmoins un risque théorique que les patients traités par TOBI Podhaler puissent développer plus de souches de P. aeruginosa éventuellement résistantes à la tobramycine administrée par voie intraveineuse que les patients inhalant TOBI par nébuliseur. Ceci doit être surveillé régulièrement, au moins tous les trois mois. En cas d'augmentation significative de la CMI (au-delà des fluctuations observées chez le patient), il faut envisager un traitement par un autre antibiotique inhalé, à la lumière des effets cliniques obtenus jusqu'ici avec TOBI Podhaler chez le patient.
TOBI Podhaler doit être utilisé avec prudence chez les patients atteints d'une dysfonction rénale, auditive, vestibulaire ou neuromusculaire, connue ou suspectée, ou d'une hémoptysie active sévère.
Ototoxicité
Une ototoxicité caractérisée par une atteinte de l'audition ou de la fonction vestibulaire a été rapportée avec les aminoglycosides parentéraux. La toxicité vestibulaire peut se traduire par des vertiges, une ataxie ou une instabilité posturale. Des acouphènes pouvant être le principal symptôme de l'ototoxicité, la prudence est donc recommandée en cas de survenue de ce symptôme.
Dans les études cliniques menées avec TOBI Podhaler, des patients ont rapporté une perte de l'audition et des acouphènes (voir «Effets indésirables»). La prudence est recommandée lors de la prescription de TOBI Podhaler à des patients atteints de troubles de la fonction auditive ou vestibulaire, connus ou suspectés.
Chez les patients présentant des signes de troubles auditifs ou un facteur de risque prédisposant, un examen de l'audition doit être envisagé avant d'instaurer le traitement par TOBI Podhaler.
Risque d'ototoxicité lié aux variantes d'ADN mitochondrial
Des cas d'ototoxicité avec les aminoglycosides ont été observés chez des patients présentant certaines variantes dans le gène de l'ARNr 12S codé mitochondrialement (MT-RNR1), notamment la variante m.1555A>G. Certains patients ont présenté une ototoxicité, même lorsque les taux sériques d'aminoglycosides se situaient dans la fourchette recommandée. Les variantes de l'ADN mitochondrial varient en fonction de la population, mais sont estimées à environ 1-2% et la proportion de porteurs de variantes susceptibles de développer une ototoxicité ainsi que la gravité de cette ototoxicité sont inconnues. En cas d'ototoxicité connue due aux aminoglycosides dans les antécédents de la mère ou à une variante connue de l'ADN mitochondrial chez le patient, il convient d'envisager d'autres traitements que les aminoglycosides, à moins que le risque accru de perte auditive permanente ne soit compensé par la gravité de l'infection et le manque de traitements alternatifs sûrs et efficaces.
Si un patient se plaint d'acouphènes ou de perte auditive pendant le traitement par TOBI Podhaler, le médecin doit demander un bilan auditif.
Concernant la surveillance de la concentration sérique de tobramycine voir ci-dessous («Examens de laboratoire»).
Néphrotoxicité
Une néphrotoxicité a été rapportée avec les aminoglycosides administrés par voie parentérale. Aucune néphrotoxicité n'a été observée au cours des études cliniques menées avec TOBI Podhaler. La prudence est recommandée lors de la prescription de TOBI Podhaler à des patients présentant des troubles de la fonction rénale, connus ou suspectés (voir ci-dessous «Examens de laboratoire»).
Avant de commencer le traitement par TOBI Podhaler, il faut évaluer la fonction rénale. Les taux d'urée et de créatinine doivent être de nouveau mesurés après 6 cycles complets de traitement par TOBI Podhaler/TOBI solution pour inhalation.
Examens de laboratoire – Concentrations sériques
La concentration sérique de tobramycine doit être surveillée chez les patients présentant des troubles de l'audition ou de la fonction rénale, connus ou suspectés. En cas de survenue d'une ototoxicité ou d'une néphrotoxicité au cours d'un traitement par TOBI Podhaler, le traitement par la tobramycine doit être interrompu jusqu'à ce que la concentration sérique soit inférieure à 2 µg/ml.
Une heure après l'administration de TOBI Podhaler, la concentration de tobramycine est d'environ
1-2 µg/ml. Des concentrations sériques supérieures à 12 µg/ml sont associées à une toxicité de la tobramycine et le traitement doit être arrêté si les concentrations dépassent ce seuil.
Pour doser la concentration sérique de tobramycine, le sang doit être prélevé par ponction veineuse et non par piqûre au bout du doigt. Une contamination de la peau du doigt par la tobramycine peut être à l'origine de concentrations sériques faussement élevées de ce médicament. Le lavage des mains avant la prise de sang ne permet pas d'éviter complètement cette contamination.
Bronchospasme
Des bronchospasmes peuvent survenir lors de l'inhalation de médicaments et ont été rapportés avec TOBI Podhaler au cours des études cliniques. Tout bronchospasme doit faire l'objet d'un traitement médical approprié.
La première dose de TOBI Podhaler doit être administrée sous surveillance. Le VEMS doit être mesuré avant et après la première inhalation de TOBI Podhaler.
En cas de signes de bronchospasme induit par le traitement, le médecin doit évaluer soigneusement si le bénéfice d'une nouvelle utilisation de TOBI Podhaler est supérieur au risque encouru par le patient. En cas de suspicion de réaction allergique, TOBI Podhaler doit être arrêté.
Toux
Les médicaments inhalés peuvent déclencher une toux, ce qui a également été rapporté pour TOBI Podhaler dans des études cliniques. La toux n'était pas liée à un bronchospasme. Les enfants de moins de 13 ans peuvent être plus susceptibles de présenter une toux lors du traitement par TOBI Podhaler.
En cas de signes de persistance d'une toux induite par le traitement par TOBI Podhaler, le médecin doit envisager le recours à d'autres traitements.
Traitement antibiotique associé
La concentration sérique de tobramycine doit être surveillée chez les patients recevant simultanément un aminoglycoside parentéral (ou d'autres médicaments pouvant influencer l'excrétion rénale). De tels patients doivent faire l'objet d'une surveillance clinique appropriée tenant compte du risque de toxicité cumulative (voir ci-dessus «Examens de laboratoire»).
Troubles neuromusculaires
La prudence est recommandée lors de la prescription de TOBI Podhaler à des patients présentant une maladie neuromusculaire connue ou suspectée telle qu'une myasthénie ou une maladie de Parkinson. Les aminoglycosides peuvent aggraver la faiblesse musculaire en raison de leur effet curarisant potentiel sur la fonction neuromusculaire.
Hémoptysie
Les patients présentant une hémoptysie cliniquement significative ayant été exclus des études cliniques, aucune donnée sur l'utilisation de TOBI Podhaler n'est disponible chez de tels patients. Ceux-ci ne doivent recevoir TOBI Podhaler que si le médecin estime que le bénéfice du traitement est supérieur au risque de déclenchement de nouvelles hémorragies.
Diminution de la réponse à la tobramycine
Une augmentation de la concentration minimale inhibitrice des aminoglycosides pour les souches isolées de P. aeruginosa a été retrouvée chez certains patients traités par TOBI Podhaler au cours des études cliniques.
Il existe un risque théorique que les patients traités par TOBI Podhaler développent des souches de
P. aeruginosa résistantes à la tobramycine.
Les méthodes de test in vitro de la sensibilité aux agents antimicrobiens, utilisées pour le traitement parentéral par la tobramycine, conviennent aussi pour la surveillance de la sensibilité des isolats de
P. aeruginosa chez les patients atteints de mucoviscidose (voir aussi «Propriétés/Effets»).
InteractionsAucune étude clinique d'interactions n'a été réalisée avec TOBI Podhaler. Certains diurétiques peuvent augmenter la toxicité des aminoglycosides en modifiant les concentrations sériques et tissulaires d'antibiotiques. TOBI Podhaler ne doit pas être administré simultanément à l'acide éthacrynique, au furosémide, à l'urée ou au mannitol intraveineux.
Compte tenu du profil d'interactions de la tobramycine après administration intraveineuse et par aérosol, l'administration concomitante et/ou successive de TOBI Podhaler et d'autres médicaments présentant un potentiel neurotoxique, néphrotoxique ou ototoxique n'est pas recommandée.
Les autres médicaments pour lesquels une augmentation de la toxicité potentielle des aminoglycosides administrés par voie parentérale a été rapportée, sont:
·Amphotéricine B, céfalotine, ciclosporine, tacrolimus, polymyxines (risque d'augmentation de la néphrotoxicité).
·Composés à base de platine (risque d'augmentation de la néphrotoxicité et de l'ototoxicité).
·Anticholinestérases, toxine botulique (effets neuromusculaires).
Pendant la phase de traitement de l'étude EAGER, la proportion de patients ayant continué de recevoir de la dornase alfa, des bronchodilatateurs, des corticostéroïdes inhalés et des macrolides a été semblable dans le groupe TOBI Podhaler et dans le groupe TOBI.
Grossesse, allaitementGrossesse
Il n'existe pas de données appropriées concernant l'emploi de la tobramycine en inhalation chez la femme enceinte.
Les aminoglycosides peuvent provoquer des effets nuisibles chez le fœtus (p.ex. surdité congénitale) lorsque des concentrations systémiques élevées sont atteintes chez la femme enceinte.
TOBI Podhaler ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
Les patientes utilisant TOBI Podhaler pendant la grossesse ou qui débutent une grossesse pendant l'utilisation de TOBI Podhaler doivent être informées des risques éventuels pour le fœtus.
Allaitement
On ignore quelle quantité de tobramycine passe dans le lait maternel après l'inhalation. En raison du potentiel d'ototoxicité et de néphrotoxicité pour le nourrisson, TOBI Podhaler ne doit pas être utilisé pendant l'allaitement, sauf en cas de nécessité absolue.
Fertilité
Les données issues des expérimentations animales après une administration sous-cutanée de tobramycine n'ont pas montré de troubles ou de troubles potentiels de la fertilité chez les animaux mâles ou femelles (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesÉtant donné les effets indésirables rapportés, TOBI Podhaler ne devrait pas avoir d'effet sur l'aptitude à la conduite et l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
La sécurité de TOBI Podhaler a été évaluée chez 395 patients atteints de mucoviscidose ayant reçu au moins 1 dose de TOBI Podhaler, dont 273 patients traités pendant trois cycles (6 mois). Chaque cycle a compris 28 jours de traitement (112 mg deux fois par jour) et 28 jours sans traitement.
La population incluse dans l'analyse principale de sécurité a été randomisée selon un rapport planifié de 3:2 et était composée de 308 patients traités par TOBI Podhaler et de 209 patients traités par TOBI (300 mg/5 ml de solution de tobramycine pour nébulisation) dans l'étude EAGER, une étude ouverte ayant comparé TOBI Podhaler et TOBI pendant 3 cycles thérapeutiques. La durée moyenne d'exposition au médicament a été de 28-29 jours dans chaque cycle, aussi bien dans le groupe TOBI Podhaler que dans le groupe TOBI. Une population de sécurité supplémentaire comprenait 87 patients traités par TOBI Podhaler et 49 patients sous placebo dans l'étude EVOLVE [5,20]; celle-ci a été réalisée en double aveugle pendant le premier cycle thérapeutique, puis tous les patients ont été traités par TOBI Podhaler pendant 2 autres cycles.
Les effets indésirables observés le plus fréquemment dans l'étude EAGER ont concerné la classe de systèmes d'organes «Troubles respiratoires, thoraciques et médiastinaux». Les effets indésirables les plus fréquents (par terme préféré) ont été une toux et des troubles pulmonaires aussi bien dans le groupe traité par TOBI Podhaler que dans celui traité par TOBI.
Pendant le cycle contrôlé contre placebo de l'étude EVOLVE, l'incidence des effets indésirables rapportés dans le groupe traité par TOBI Podhaler a été globalement plus faible que celle dans le groupe sous placebo, à l'exception des douleurs pharyngo-laryngées, de la dysphonie et de la dysgueusie.
Aucun patient n'a fait état d'effets secondaires liés à des troubles auditifs dans l'étude EVOLVE. Une perte d'audition significative (définie comme une perte de 10-15 dB pour au moins deux fréquences consécutives ou 20 dB ou plus pour une seule fréquence) a été constatée chez deux patients lors de tests auditifs planifiés.
Dans l'étude EAGER, des troubles auditifs tels que des acouphènes ont été rapportés par environ 2% des patients. Dans un sous-groupe de patients de l'étude EAGER, une série de tests audiométriques a montré une perte d'audition par rapport à la valeur à l'inclusion lors d'au moins une visite de l'étude chez 25,6% des patients sous TOBI Podhaler et chez 15,6% des patients sous TOBI (l'examen de l'audition à l'inclusion présentait une valeur normale chez 80% des patients de ce sous-groupe). La majorité de ces modifications a cependant été passagère et s'est normalisée jusqu'à la fin de l'étude. Chez quatre patients du groupe traité par TOBI Podhaler, une perte d'audition importante a été observée, celle-ci a été passagère chez trois patients et persistante dans un cas. Une perte d'audition significative est survenue chez moins de 3% des patients de chacun des deux groupes thérapeutiques. Une ototoxicité (déterminée selon le critère: perte d'audition unilatérale de 10 dB sur 3 fréquences consécutives ou de 15 dB sur 2 fréquences consécutives ou de 20 dB sur une fréquence quelconque) a été retrouvée chez 3 patients traités par TOBI Podhaler et chez 2 patients traités par TOBI, ce qui correspond au rapport de randomisation.
La toux est un symptôme fréquent de la mucoviscidose et a été rapportée chez 42% des patients au début (à l'inclusion) de l'étude EAGER. La toux a été l'effet indésirable le plus fréquemment rapporté au cours des deux études cliniques. Il faut remarquer que la fréquence des bronchospasmes était semblable dans les groupes traités par TOBI Podhaler, par TOBI et par le placebo. Dans l'étude EVOLVE, la toux a été plus fréquente chez les patients ayant reçu le placebo (26,5%) que chez ceux traités par TOBI Podhaler (13%), tandis que dans l'étude EAGER, un pourcentage plus élevé de patients traités par TOBI Podhaler (48%) que de patients traités par TOBI (31%) a signalé une toux. [5] 12 patients (4%) traités par TOBI Podhaler ont arrêté l'étude EAGER en raison d'épisodes de toux; chez cinq de ces patients et chez deux patients (1%) du groupe traité par TOBI, la toux était un événement indésirable isolé. Sous TOBI Podhaler, la toux a été plus fréquente au cours de la phase de traitement de chacun des trois cycles thérapeutiques.
Tableau récapitulatif des effets indésirables rapportés au cours des études cliniques
Les effets indésirables rapportés au cours de l'étude EAGER (voir tableau 1) sont répertoriés par classe de systèmes d'organes MedDRA. Au sein de chaque classe de systèmes d'organes, les effets indésirables sont listés par ordre de fréquence décroissante et d'après la base de données. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre de fréquence décroissante. Par ailleurs, la catégorie de fréquence est également indiquée pour chaque effet indésirable selon la convention suivante (CIOMS III): «très fréquents» (≥1/10); «fréquents» (≥1/100, <1/10); «occasionnels» (≥1/1000, <1/100); «rares» (≥1/10'000, <1/1000); «très rares» (<1/10'000) y compris cas isolés.
Tableau 1: Effets indésirables survenus chez ≥2% des patients traités par TOBI Podhaler dans l'étude EAGER (comparaison de TOBI Podhaler et TOBI, étude ouverte), population de sécurité de tous les patients randomisés)
|
Classe de systèmes d'organes / terme préféré dans la terminologie MedDRA
|
TOBI Podhaler
(n = 308)
% de patients
|
TOBI
(n = 209)
% de patients
|
Catégorie de fréquence
| |
Infections et infestations
| |
Infection des voies respiratoires supérieures
|
6,8
|
8,6
|
Fréquents
| |
Affections du système nerveux
| |
Céphalées
|
11,4
|
12,0
|
Très fréquents
| |
Affections de l'oreille et du labyrinthe
| |
Acouphènes
|
1,9
|
2,4
|
Fréquents
| |
Surdité y compris surdité unilatérale (signalée comme perte auditive légère à modérée ou aggravation d'une perte auditive existante)
|
1,0
|
0,5
|
Fréquents
| |
Affections vasculaires
| |
Epistaxis
|
2,6
|
1,9
|
Fréquents
| |
Affections respiratoires, thoraciques et médiastinales
| |
Toux
|
48,4
|
31,1
|
Très fréquents
| |
Troubles pulmonaires
|
33,8
|
30,1
|
Très fréquents
| |
Toux productive
|
18,2
|
19,6
|
Très fréquents
| |
Dyspnée
|
15,6
|
12,4
|
Très fréquents
| |
Douleur oropharyngée
|
14,0
|
10,5
|
Très fréquents
| |
Dysphonie
|
13,6
|
3,8
|
Très fréquents
| |
Hémoptysie
|
13,0
|
12,4
|
Très fréquents
| |
Obstruction nasale
|
8,1
|
7,2
|
Fréquents
| |
Râles
|
7,1
|
6,2
|
Fréquents
| |
Respiration sifflante
|
6,8
|
6,2
|
Fréquents
| |
Gêne thoracique
|
6,5
|
2,9
|
Fréquents
| |
Irritation de la gorge
|
4,5
|
1,9
|
Fréquents
| |
Bronchospasme
|
1,6
|
0,5
|
Fréquents
| |
Aphonie
|
1,0
|
0
|
Fréquents
| |
Affections gastro-intestinales
| |
Nausées
|
7,5
|
9,6
|
Fréquents
| |
Vomissements
|
6,2
|
5,7
|
Fréquents
| |
Diarrhée
|
4,2
|
1,9
|
Fréquents
| |
Dysgueusie
|
3,9
|
0,5
|
Fréquents
| |
Affections de la peau et du tissu sous-cutané
| |
Éruption cutanée
|
2,3
|
2,4
|
Fréquents
| |
Affections musculo-squelettiques et systémiques
| |
Douleur thoracique musculo-squelettique
|
4,5
|
4,8
|
Fréquents
| |
Troubles généraux et anomalies au site d'administration
| |
Fièvre
|
15,6
|
12,4
|
Très fréquents
| |
Investigations
| |
Baisse des résultats aux explorations fonctionnelles pulmonaires
|
6,8
|
8,1
|
Fréquents
| |
Diminution du volume expiratoire maximal
|
3,9
|
1,0
|
Fréquents
| |
Hyperglycémie
|
2,9
|
0,5
|
Fréquents
|
Événements dans tous les cycles thérapeutiques avec ou sans traitement.
Les effets indésirables observés lors du cycle 1 contrôlé contre placebo de l'étude EVOLVE réalisée chez 46 patients traités par TOBI Podhaler et 49 patients traités par le placebo sont: douleur pharyngo-laryngée (10,9% TOBI Podhaler et 0% placebo, très fréquents) et dysphonie (4,3% TOBI Podhaler et 0% placebo, fréquents) dans la classe de système d'organes (SOC) troubles respiratoires, thoraciques et médiastinaux et dysgueusie (6,5% TOBI Podhaler et 2,0% placebo, fréquents) dans la SOC troubles gastro-intestinaux.
Effets indésirables issus de signalements spontanés et de cas de la littérature (fréquence inconnue)
Les effets indésirables suivants sont tirés des expériences avec TOBI Podhaler après la mise sur le marché à partir de cas signalés spontanément et dans la littérature. Puisque ces effets concernent une population de taille inconnue, il n'est pas possible d'en évaluer la fréquence de manière fiable. Celle-ci est donc classée comme inconnue.
Malaise, salive décolorée.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLa dose quotidienne maximale tolérée de TOBI Podhaler n'est pas connue. Le dosage de la concentration sérique de tobramycine peut être utile pour la surveillance en cas de surdosage.
Une toxicité aigüe nécessite l'arrêt immédiat de TOBI Podhaler et l'évaluation de la fonction rénale par rapport au début du traitement (baseline).
Il est peu probable que la prise accidentelle de capsules de TOBI Podhaler entraîne des manifestations toxiques, car la tobramycine n'est que faiblement absorbée dans un tractus gastro-intestinal intact.
Une hémodialyse peut être utile pour éliminer la tobramycine de l'organisme.
Propriétés/EffetsCode ATC
J01GB01
Mécanisme d'action
La tobramycine est un antibiotique de la famille des aminoglycosides produit à partir de Streptomyces tenebrarius. Elle agit principalement en bloquant la synthèse des protéines, ce qui entraîne une modification de la perméabilité de la membrane cellulaire, la rupture progressive de l'enveloppe cellulaire et enfin la mort de la cellule. Elle possède une action bactéricide à des concentrations égales ou légèrement supérieures à la concentration inhibitrice.
Pharmacodynamique
Propriétés pharmacodynamiques – Microbiologie
Dans l'étude EAGER, la distribution des concentrations minimales inhibitrices (CMI) de la tobramycine a été déterminée pour les isolats de P. aeruginosa d'après les biotypes suivants: mucoïdes, secs, variants à petites colonies et ensemble des biotypes. L'évaluation des expectorations dans cette étude a montré qu'au début de l'étude, 91% des patients du groupe traité par TOBI Podhaler avaient des isolats de P. aeruginosa présentant une CMI au moins 20 fois inférieure à la concentration moyenne observée dans les expectorations dans les 30 minutes après l'inhalation. À la fin du troisième cycle thérapeutique de 28 jours, la CMI des isolats de P. aeruginosa était au moins 30 fois inférieure à la concentration moyenne observée dans les expectorations dans les 30 minutes après l'administration chez 86% des patients traités par TOBI Podhaler et au moins 15 fois inférieure à cette concentration chez 89% des patients traités par TOBI Podhaler.
Dans deux études cliniques, le traitement par TOBI Podhaler pendant 25 semaines n'a pas eu d'influence sur la sensibilité de la majorité des isolats de P. aeruginosa examinés. Pour la plupart des échantillons, la CMI de la tobramycine était comprise entre 0,5 µg/ml et 8 µg/ml. L'étude EAGER n'a révélé aucune variation importante de la distribution des CMI pour la somme de tous les biotypes de P. aeruginosa au cours du traitement par TOBI Podhaler. La distribution des CMI est restée presque identique entre le début de l'étude et après 25 semaines de traitement pour les isolats mucoïdes et une faible variation, restée inférieure au seuil de résistance habituel de 8 µg/ml en cas d'exposition systémique, a été notée pour les biotypes secs. La CMI maximale de tous les biotypes est restée relativement constante pour chaque biotype pendant la durée de l'étude, dans les groupes traités par TOBI Podhaler et par TOBI.
La pertinence clinique des modifications de la CMI pour P. aeruginosa n'est pas encore clairement établie pour le traitement de patients atteints de mucoviscidose. Selon des études cliniques, une résistance microbiologique in vitro à l'antibiotique n'exclut pas forcément un bénéfice clinique pour le patient. Dans l'étude EAGER, le sous-groupe de patients avec une CMI à l'inclusion >8 µg/ml présentait une amélioration des valeurs mesurées du VEMS en % de la valeur prédite après 3 cycles de traitement par TOBI Podhaler.
Tests de sensibilité
Les méthodes de test in vitro de la sensibilité aux agents antimicrobiens utilisées pour le traitement parentéral par la tobramycine peuvent être utilisées pour la surveillance des souches de P. aeruginosa isolées chez des patients atteints de mucoviscidose. Les seuils de sensibilité établis pour l'administration parentérale de tobramycine ne s'appliquent pas à la tobramycine inhalée (voir «Propriétés/Effets», «Études cliniques»).
Efficacité clinique
Études cliniques
Le programme de développement clinique de la phase III était composé de deux études englobant 612 patients randomisés pour recevoir le médicament de l'étude et porteurs d'un diagnostic clinique de mucoviscidose qui a été confirmé comme suit: test quantitatif de la sueur par iontophorèse à la pilocarpine ou maladie bien caractérisée avec mutations dans chaque gène CFTR ou différence anormale de potentiel transépithélial nasal caractéristique de la mucoviscidose.
Tous les patients avaient ≥6 ans et présentaient au début de l'étude un VEMS compris entre ≥25% et ≤80% de la valeur normale prédite pour leur âge, sexe et taille d'après les critères de Knudson. De plus, tous les patients avaient une infection à P. aeruginosa, mise en évidence par une culture positive des expectorations ou des prélèvements pharyngés (ou du lavage broncho-alvéolaire) dans les 6 mois précédant le début de l'étude et par une culture des expectorations lors de la visite de sélection. Parmi les 395 patients traités par TOBI Podhaler, il y avait pratiquement autant de femmes que d'hommes, et pratiquement autant de patients de moins de 20 ans que de plus de 20 ans. Les patients présentaient au début de l'étude un VEMS moyen de 54% de la valeur normale prédite.
Les effets suivants sur la santé ont été mis en évidence.
Dans une étude multicentrique, randomisée, en double aveugle, contrôlée contre placebo (EVOLVE), TOBI Podhaler a été administré à la dose de 112 mg deux fois par jour (tous les matins et soirs à la même heure) pendant trois cycles composés de 28 jours de traitement et de 28 jours sans traitement (durée totale du traitement de 24 semaines). Les patients étaient tous âgés de moins de 22 ans (âge moyen de 13,3 ans) et n'avaient reçu aucun antibiotique anti-Pseudomonas inhalé dans les 4 mois précédant le début de l'étude; 55,8% étaient de sexe féminin et 84,2% étaient caucasiens. Les patients attribués par randomisation au traitement par placebo ont reçu celui-ci pendant le premier cycle thérapeutique, puis ont été traités par TOBI Podhaler pendant les deux cycles suivants.
TOBI Podhaler a entraîné une amélioration significative de la fonction pulmonaire par rapport au placebo, ce qui s'est traduit par une augmentation relative du VEMS en pourcentage de la valeur prédite après 28 jours de traitement (voir figure 1). L'amélioration de la fonction pulmonaire obtenue pendant le premier cycle thérapeutique s'est maintenue pendant les cycles suivants de traitement par TOBI Podhaler. Lorsque les patients du groupe placebo sont passés à TOBI Podhaler au début du deuxième cycle thérapeutique, la modification relative du VEMS en pourcentage de la valeur prédite par rapport à la valeur initiale a été aussi élevée que celle observée lors du premier cycle thérapeutique dans le groupe de patients traités par TOBI Podhaler et cette amélioration s'est également maintenue au cours du troisième cycle thérapeutique.
Figure 1: Étude EVOLVE: variation relative du VEMS en pourcentage de la valeur prédite pendant les cycles 1-3 par rapport à l'inclusion (avec et sans traitement), évaluée selon le groupe de traitement (population ITT totale)
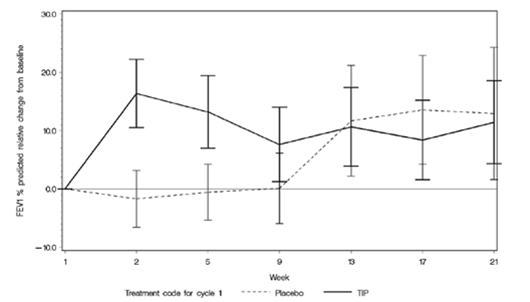
Les barres verticales représentent l'intervalle de confiance à 95%.
Phases sans traitement: semaines 5 à 9, semaines 13 à 17 et semaines 21 à 25.
L'axe des x n'est pas linéaire entre les semaines 1 et 5.
Dans une deuxième étude multicentrique ouverte (EAGER), les patients ont reçu soit TOBI Podhaler (112 mg) soit TOBI (300 mg deux fois par jour, tous les matins et soirs à la même heure) pendant trois cycles composés de 28 jours avec traitement et de 28 jours sans traitement (durée totale du traitement de 24 semaines). Les patients étaient majoritairement âgés de ≥20 ans (y compris 4 patients de plus de 60 ans) et n'avaient inhalé aucun antibiotique anti-Pseudomonas dans les 28 jours précédant l'administration du médicament à l'étude; 90% des patients étaient caucasiens et 55% de sexe masculin.
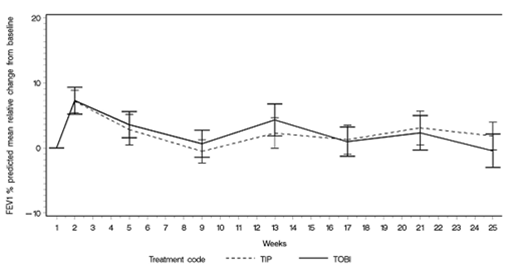
Le traitement par TOBI Podhaler ainsi que le traitement par TOBI ont entraîné une augmentation relative du VEMS en pourcentage de la valeur prédite par rapport à la valeur à l'inclusion, jusqu'au jour 28 du troisième cycle thérapeutique et ce, respectivement de 5,8% et de 4,7% (voir figure 2). L'amélioration du VEMS en pourcentage de la valeur prédite a été numériquement supérieure dans le groupe traité par TOBI Podhaler et a été statistiquement non inférieure à celle obtenue avec TOBI. L'amélioration de la fonction pulmonaire a certes été plus faible dans cette étude, mais ceci s'explique par le fait que cette population de patients avait précédemment été traitée par de la tobramycine inhalée.
Figure 2: Étude EAGER: variation relative du VEMS en pourcentage de la valeur prédite par rapport à la valeur initiale dans les cycles 1-3 (population ITT)
En ce qui concerne la suppression de l'infection à Pseudomonas aeruginosa (P. aeruginosa), une diminution de la densité de P. aeruginosa dans les expectorations a été retrouvée avec TOBI Podhaler dans les deux études (voir les deux figures suivantes). Le traitement par TOBI Podhaler pendant 28 jours a entraîné une réduction statistiquement significative de la densité de P. aeruginosa dans les expectorations (log10 UFC) par rapport au placebo (différence moyenne calculée à l'aide de la méthode des moindres carrés = 2,70, IC à 95%: -3,60, -1,79, p <0,001), la plus grande différence ayant été observée au 28e jour du traitement. Après le passage des patients du placebo à TOBI Podhaler, les résultats ont été généralement semblables dans les deux groupes thérapeutiques, la densité de
P. aeruginosa ayant eu tendance à augmenter après 28 jours sans traitement, tendance qui s'est inversée après une nouvelle période de 28 jours de traitement.
Figure 3: Comparaison des groupes thérapeutiques: variation de la densité de P. aeruginosa dans les expectorations (log10 UFC) par rapport à la valeur à l'inclusion – Étude EVOLVE (population ITT)
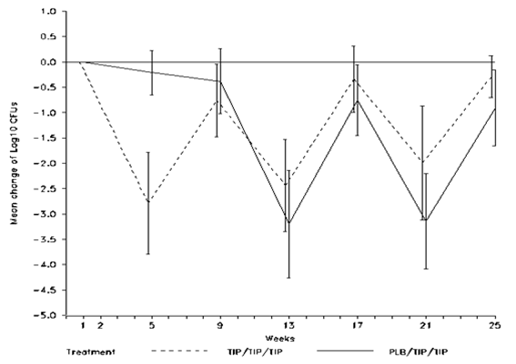
Les barres verticales représentent l'intervalle de confiance à 95%. La densité totale est utilisée, définie par la somme des biotypes (mucoïdes, secs et variants à petites colonies).
Dans l'étude EAGER, la diminution moyenne du log10 UFC par rapport à la valeur initiale a été plus élevée dans le groupe traité par TOBI Podhaler que dans le groupe traité par TOBI, notamment pendant le troisième cycle thérapeutique (modification moyenne de -1,61 log10 UFC dans le groupe traité par TOBI Podhaler versus -0,77 log10 UFC dans le groupe traité par TOBI) (voir figure 4). Comme dans l'étude précédente, la densité de P. aeruginosa a en partie de nouveau augmenté à la fin de la phase de 28 jours sans traitement dans les deux groupes thérapeutiques, mais cette tendance s'est inversée pendant la phase de traitement de chaque cycle.
Figure 4: Comparaison des traitements: variation de la densité dans les expectorations (log10 UFC) de P. aeruginosa – Étude EAGER (population ITT)
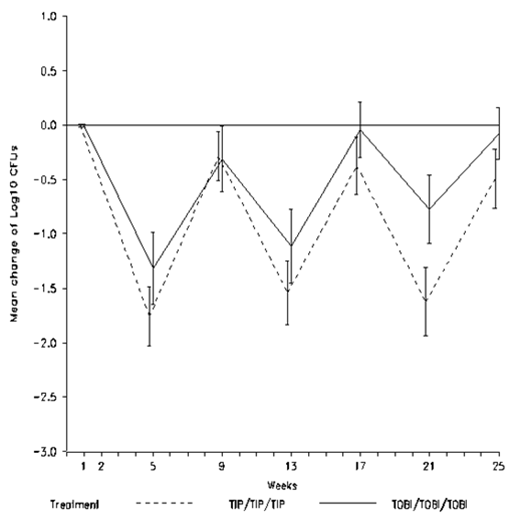
Dans les deux études cliniques, des variations négatives de la CMI maximale de la tobramycine par rapport à la valeur à l'inclusion ont été observées jusqu'à la fin de la période de traitement pour chaque biotype de P. aeruginosa. De manière générale, un pourcentage plus élevé de patients traités par TOBI Podhaler a présenté une augmentation de la CMI de la tobramycine qu'une diminution. Néanmoins, la CMI de la tobramycine a diminué d'un facteur ≥2 après 25 semaines par rapport au placebo chez proportionnellement environ deux fois moins de patients traités par TOBI Podhaler (40,5% des patients sous placebo et 20,0% des patients traités par TOBI Podhaler).
Le pourcentage de patients ayant reçu des antibiotiques anti-Pseudomonas dans le cycle 1 a été plus élevé dans le groupe placebo (20,4%) que dans le groupe traité par TOBI Podhaler (13,0%). En outre, ces antibiotiques ont été utilisés plus longtemps (18,2 jours) dans le groupe placebo que dans le groupe traité par TOBI Podhaler (13,3 jours). Dans le cycle 1, aucun patient du groupe traité par TOBI Podhaler mais 6 patients (12,2%) du groupe placebo ont été hospitalisés pour une maladie respiratoire, avec une durée d'hospitalisation moyenne de 12,3 jours. Dans l'étude EAGER, plus de la moitié des patients du groupe traité par TOBI Podhaler et du groupe traité par TOBI (64,9% vs 54,5%) ont nécessité de nouveaux antibiotiques anti-Pseudomonas au cours des trois cycles thérapeutiques et la durée d'utilisation a été semblable (30,9 vs 33,4 jours) dans les deux groupes. Une proportion semblable de patients traités par TOBI Podhaler et par TOBI a été hospitalisée pour des symptômes respiratoires (24,4% vs 22,0%) et la durée des hospitalisations (15,6 vs 15,3 jours) a été également semblable.
Médication associée
Dans les deux études cliniques, plus de 90% des patients ont reçu un traitement associé pour des indications en rapport avec la mucoviscidose. Comme les caractéristiques de la maladie le laissaient prévoir à l'inclusion dans l'étude et vu la population de patients atteints de mucoviscidose recrutée dans cette étude, les médicaments associés les plus utilisés ont été des préparations enzymatiques, des mucolytiques (en particulier la dornase alfa) et des agonistes β2-adrénergiques sélectifs. De plus, la majorité des patients avaient reçu par le passé des antibiotiques anti-Pseudomonas et des macrolides. Les principes actifs les plus souvent utilisés (tous modes d'administration confondus) étaient la tobramycine (seulement étude EAGER), l'azithromycine, la ciprofloxacine et la ceftazidime.
PharmacocinétiqueAbsorption
L'exposition systémique à la tobramycine après l'inhalation de TOBI Podhaler devrait provenir de la résorption pulmonaire de la fraction de la dose parvenue dans les poumons, car la tobramycine n'est pas notablement absorbée après une prise orale.
Concentration sérique: l'exposition systémique à la tobramycine a été évaluée avec TOBI Podhaler après l'inhalation d'une dose unique de 112 mg (4 capsules de 28 mg) et avec TOBI après l'inhalation d'une dose unique de 300 mg dans une étude de phase I. La comparaison a montré des résultats semblables. La durée moyenne pour atteindre la concentration sérique maximale (Tmax) a été de 1 heure avec TOBI Podhaler ainsi qu'avec TOBI. La Cmax a été de 1,02 ± 0,53 μg/ml (moyenne ± déviation standard) chez les patients ayant reçu une dose unique de 112 mg de TOBI Podhaler et de 1,04 ± 0,58 µg/ml chez ceux ayant reçu 300 mg de TOBI [3,28]. L'exposition systémique (AUC0,∞) a également été semblable pour la dose de 112 mg de TOBI Podhaler et pour la dose de 300 mg de TOBI (5,3 ± 2,6 vs 5,1 ± 2 µg h/ml).
Dans une autre étude, des patients ont été traités pendant 3 cycles thérapeutiques avec le schéma posologique recommandé. À la fin du premier cycle thérapeutique de 4 semaines, la concentration sérique de tobramycine a été de 1,39 ± 0,8 µg/ml (moyenne ± déviation standard) 0-2 heures après l'inhalation de TOBI Podhaler (112 mg deux fois par jour) et de 1,18 ± 0,72 µg/ml après celle de TOBI (300 mg 2 fois par jour); à la fin du cycle, la concentration sérique minimale de tobramycine a été de 0,47 ± 0,73 µg/ml avant l'inhalation suivante de TOBI Podhaler et de 0,21 ± 0,15 µg/ml avant celle de TOBI.
Concentration dans les expectorations: dans l'étude déjà mentionnée de Geller, la concentration a également été mesurée dans les expectorations (Geller et al, 2007). Après l'inhalation d'une dose unique de 112 mg de TOBI Podhaler (4 capsules de 28 mg), la Cmax de la tobramycine dans les expectorations a été de 1048 ± 1080 µg/g (moyenne ± déviation standard). Par contre, la Cmax dans les expectorations après l'inhalation d'une dose unique de 300 mg de TOBI (contrôle actif) a été de 737,3 ± 1028,4 µg/g [3,28]. La variabilité des paramètres pharmacocinétiques a été plus grande dans les expectorations que dans le sérum.
Distribution
Une analyse pharmacocinétique de population pour TOBI Podhaler chez des patients atteints de mucoviscidose a montré que le volume de distribution apparent estimé de la tobramycine dans le compartiment central était de 84,1 litres pour un patient type atteint de mucoviscidose. Une modification du volume a certes été mise en évidence en fonction du BMI (body mass index) et de la fonction pulmonaire (évaluée par le VEMS en % de la valeur prédite), mais des simulations basées sur un modèle ont montré que les variations du BMI ou de la fonction pulmonaire n'avaient pas d'influence importante sur les concentrations maximales (Cmax) et minimales (Ctrough).
La liaison de la tobramycine aux protéines sériques est négligeable.
Métabolisme
La tobramycine n'est pratiquement pas métabolisée et est essentiellement éliminée dans les urines sous forme inchangée.
Élimination
La tobramycine est principalement éliminée de la circulation systémique par filtration glomérulaire de la molécule inchangée.
La demi-vie sérique terminale apparente de la tobramycine après l'inhalation d'une dose unique de 112 mg de TOBI Podhaler a été d'environ 3 heures chez les patients atteints de mucoviscidose et a été cohérente avec la demi-vie de la tobramycine après l'inhalation de TOBI.
Une analyse pharmacocinétique de population pour TOBI Podhaler chez des patients atteints de mucoviscidose âgés de 6 à 66 ans a montré que la clairance sérique apparente estimée de la tobramycine est de 14 l/h. Cette analyse n'a montré aucune différence pharmacocinétique liée au sexe ou à l'âge.
Données précliniquesLes données précliniques issues des études de pharmacologie de sécurité, de toxicité à doses répétées, de génotoxicité et de toxicité de reproduction ont révélé que les principaux risques pour l'être humain sont une néphrotoxicité et une ototoxicité. En général, cette toxicité est observée à des concentrations systémiques de tobramycine plus élevées que celles pouvant être atteintes par inhalation à la dose cliniquement recommandée.
Les essais précliniques réalisés avec la tobramycine inhalée sur le potentiel carcinogène n'ont pas montré clairement de risque particulier pour l'être humain.
Aucune étude de toxicité de reproduction n'a été réalisée avec la tobramycine inhalée. L'administration sous-cutanée de tobramycine pendant l'organogenèse à une dose allant jusqu'à 100 mg/kg/jour chez la rate ou jusqu'à 20 mg/kg/jour chez la lapine n'a toutefois pas entrainé d'effets tératogènes. Une dose de tobramycine ≥40 mg/kg/jour chez la lapine a été fortement maternotoxique (néphrotoxicité avec avortements spontanés et mort) et n'a pas permis l'évaluation de la tératogénicité. Sur la base des données disponibles issues des expérimentations animales, un risque de toxicité (p.ex. d'ototoxicité) ne peut pas être exclu en cas d'exposition prénatale.
L'administration sous-cutanée d'une dose de tobramycine allant jusqu'à 100 mg/kg n'a pas eu d'influence sur le comportement d'accouplement et n'a pas affecté la fertilité des rats mâles ou femelles.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine, pas au-dessus de 30 °C et à l'abri de l'humidité. Conserver l'inhalateur dans son étui bien fermé lorsqu'il n'est pas utilisé.
Conserver TOBI Podhaler hors de portée des enfants, sauf pour l'utilisation thérapeutique qui doit se faire sous la surveillance appropriée d'un adulte.
Remarques concernant la manipulation
Seul l'inhalateur T-326 peut être utilisé avec les capsules de TOBI Podhaler; il n'est destiné à aucun autre médicament que TOBI Podhaler.
Chaque emballage hebdomadaire contient sept plaquettes de capsules (correspondant aux sept jours de la semaine) et chaque plaquette de capsules contient huit capsules (correspondant à une dose quotidienne: à savoir 4 capsules le matin et 4 capsules le soir).
Les capsules de TOBI Podhaler doivent toujours être conservées dans la plaquette de capsules et ne doivent être extraites de celle-ci qu'immédiatement avant l'emploi. Chaque inhalateur T-326 et son étui sont utilisés pendant sept jours, puis sont éliminés et remplacés.
Le mode d'emploi de base est le suivant
1.Lavez-vous les mains et séchez-les bien.
2.Juste avant l'utilisation, sortez l'inhalateur T-326 de son étui en le tenant par le bas et en tournant le capuchon dans le sens inverse des aiguilles d'une montre. Mettez le capuchon de côté et inspectez brièvement l'inhalateur pour vous assurer qu'il n'est pas endommagé souillé. Placez alors l'inhalateur dans la base de l'étui.
3.En tenant fermement le corps de l'inhalateur, dévissez l'embout buccal et posez-le sur une surface propre et sèche.
4.Séparez les deux moitiés de la plaquette de capsules contenant les capsules pour le matin et pour le soir. Retirez la feuille de la plaquette de capsules jusqu'à faire apparaître une capsule de TOBI Podhaler. Sortez la capsule de la plaquette.
5.Insérez immédiatement la capsule dans la chambre de l'inhalateur. Replacez l'embout buccal et vissez le jusqu'à sentir une résistance. Ne serrez pas trop fort.
6.Pour percer la capsule, tenez l'inhalateur en dirigeant l'embout buccal vers le bas, appuyez à fond sur le bouton avec le pouce, puis relâchez le bouton. Le médicament est alors prêt pour l'inhalation.
7.Expirez complètement en tenant l'inhalateur loin de votre bouche.
8.Tenez l'inhalateur en dirigeant l'embout buccal vers vous. Refermez les lèvres autour de l'embout buccal. Inspirez la poudre en une seule inspiration continue.
9.Retirez l'inhalateur de votre bouche et retenez votre respiration pendant environ cinq secondes. Puis respirez normalement en tenant l'inhalateur loin de votre bouche.
10.Après quelques respirations normales, faites une deuxième inhalation à partir de la même capsule, en répétant les étapes ci-dessus 7, 8 et 9.
11.Dévissez l'embout buccal et retirez la capsule de la chambre.
12.Inspectez la capsule utilisée. Elle devrait être percée et vide.
·Si la capsule est percée, mais contient encore un peu de poudre, remettez-la dans la chambre de l'inhalateur, côté percé vers l'avant, replacez l'embout buccal et inhalez encore deux fois le contenu de la capsule (répétez l'étape 5, puis les étapes 7 à 11). Inspectez la capsule une nouvelle fois.
·Si la capsule n'est pas percée, remettez-la dans la chambre de l'inhalateur, replacez l'embout buccal, appuyez à fond sur le bouton et inhalez encore deux fois le contenu de la capsule (répétez les étapes 5 à 11). Si après cela, la capsule est toujours pleine et n'est pas percée, utilisez l'inhalateur de réserve et essayez à nouveau (répétez les étapes 2, 3 et 5 à 11).
13.Jetez la capsule vide.
14.Répétez la procédure à partir de l'étape 4 avec les trois autres capsules qui composent la dose.
15.Replacez l'embout buccal et vissez-le jusqu'à sentir une résistance. Après avoir inhalé la dose complète (4 capsules), essuyez l'embout buccal avec un linge propre et sec.
16.Remettez l'inhalateur dans son étui de rangement et fermez-le bien. Ne lavez jamais l'inhalateur à l'eau.
Voir aussi «Posologie/Mode d'emploi».
Le personnel soignant doit aider les enfants qui commencent un traitement avec TOBI Podhaler, en particulier les enfants de 10 ans ou moins, et les surveiller jusqu'à ce qu'ils soient capables d'utiliser l'inhalateur Podhaler correctement sans aide.
Numéro d’autorisation60565 (Swissmedic).
PrésentationL'inhalateur TOBI Podhaler et son étui de rangement sont en plastique.
TOBI Podhaler est présenté en emballages mensuels contenant 4 boîtes hebdomadaires et un inhalateur de réserve dans son étui de rangement. Chaque boîte hebdomadaire contient 56 capsules de 28 mg (7 plaquettes de 8 capsules) et un inhalateur TOBI Podhaler dans son étui de rangement.
Conditionnements
Emballages de 224 (4 x 56) capsules et 5 inhalateurs (emballage mensuel multiple). [A]
Titulaire de l’autorisationViatris Pharma GmbH, 6312 Steinhausen.
Mise à jour de l’informationJuillet 2023.
Version 103 F
|





