CompositionPrincipes actifs
Filgrastimum (G-CSF). Préparé de manière biotechnologique à partir de bactéries E. coli modifiées par génie génétique.
G-CSF signifie: facteur de croissance granulocytaire humain méthionylé, recombinant et non glycosylé.
Excipients
Acidum glutamicum, polysorbatum 80, sorbitolum 25 mg (E 420), natrii hydroxidium (natrii: 0,22 mg), aqua ad iniectabilia.
Indications/Possibilités d’emploiZarzio est indiqué:
·dans la réduction de la durée et de la sévérité des neutropénies observées chez les patients (adultes et enfants) traités par une chimiothérapie cytotoxique à effet fortement myélosuppressif pour une affection maligne (exception faite de la leucémie myéloïde chronique et du syndrome myélodysplasique).
Chez l'enfant souffrant de leucémie myéloïde aiguë, il n'a pas été effectué d'étude randomisée, mais il existe des études séquentielles non contrôlées ou non randomisées.
·dans la réduction de la durée des neutropénies observées chez les patients traités par des chimiothérapies cytotoxiques à hautes doses et soumis par la suite à une autogreffe ou à une allogreffe de moelle osseuse.
·pour la mobilisation des cellules précurseurs du sang périphérique (PBPC).
·pour l'utilisation à long terme visant à accroître le nombre de granulocytes neutrophiles et à réduire les infections chez des enfants et des adultes ayant présenté des infections cliniquement significatives au cours des 12 derniers mois ainsi qu'une neutropénie ANC <0,5x 109/l documentée à trois reprises, s'inscrivant dans le cadre d'une neutropénie congénitale, d'une neutropénie cyclique ou d'une neutropénie idiopathique sévères.
·pour le traitement d'une neutropénie persistante (ANC ≤1,0x 109/l) chez les patients infectés par le VIH à un stade avancé afin de réduire le risque d'infection bactérienne lorsque d'autres options destinées à corriger la neutropénie sont inadéquates.
Posologie/Mode d’emploiPar des médecins spécialisés seulement.
Patients traités par chimiothérapie cytotoxique à cause d'une affection maligne
Posologie
La dose recommandée de Zarzio est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour. Le traitement par Zarzio doit être instauré au plus tôt 24 heures après l'administration d'une chimiothérapie cytotoxique.
Le contenu d'une seringue préremplie de Zarzio 30 MU/0,5 ml (60 millions d'unités/ml) correspond à la dose journalière nécessaire pour un patient pesant 60 kilogrammes. Le contenu d'une seringue préremplie de Zarzio 48 MU/0,5 ml correspond à la dose journalière nécessaire pour un patient pesant 96 kilogrammes:
|
Présentation
|
Volume de solution injectable par 60 kilogrammes de poids corporel
| |
Zarzio 30 MU/0,5 ml
Seringue préremplie
|
0,5 ml (1 seringue préremplie)
|
Durée du traitement
L'administration quotidienne de Zarzio doit être poursuivie jusqu'à ce que le nombre de neutrophiles attendu se soit de nouveau normalisé, une fois le taux le plus faible de neutrophiles (nadir) dépassé. Après une chimiothérapie standard validée pour tumeurs solides, lymphomes et leucémies lymphoïdes, la durée du traitement peut aller jusqu'à 14 jours. Après le traitement d'induction et de consolidation d'une leucémie myéloïde aiguë, la durée du traitement peut être nettement plus longue (jusqu'à 38 jours), en fonction du type, de la dose et du schéma posologique de la chimiothérapie cytotoxique administrée.
Chez les patients recevant une chimiothérapie cytotoxique, une hausse transitoire du nombre des neutrophiles est typiquement observée 1 à 2 jours après le début du traitement. Néanmoins, pour assurer un succès thérapeutique durable, Zarzio ne doit pas être interrompu avant que le nadir attendu (taux le plus faible) n'ait été dépassé et que le nombre de neutrophiles se soit normalisé. Un arrêt prématuré du traitement par Zarzio, à savoir avant l'atteinte du nadir attendu (taux le plus faible), n'est pas recommandé. Il convient d'arrêter le traitement lorsque le nombre de neutrophiles a atteint 1,0x 109/l, une fois le nadir (taux le plus faible) dépassé.
Mode d'emploi
Zarzio peut être administré en injection sous-cutanée quotidienne ou en perfusion intraveineuse quotidienne de 30 minutes après dilution dans une solution de glucose à 5% (voir «Instructions pour la dilution» sous «Remarques particulières»).
Dans la plupart des cas, l'administration sous-cutanée est préférable. Les résultats d'une étude portant sur l'administration de doses uniques donnent à penser qu'une administration par voie intraveineuse peut réduire la durée d'action. La signification clinique de cette observation dans le cas d'une administration répétée n'est pas établie.
Patients traités par chimiothérapie cytotoxique et soumis par la suite à une greffe de moelle osseuse
Posologie
La dose initiale recommandée de Zarzio est de 1,0 MU (10 µg) par kilogramme de poids corporel par jour. La première dose par Zarzio doit être instaurée au plus tôt 24 heures après l'administration de la chimiothérapie cytotoxique, mais dans les 24 heures suivant la greffe de moelle osseuse.
Durée du traitement
L'efficacité et l'innocuité de Zarzio administré pendant plus de 28 jours dans cette indication n'ont pas été établies.
Ajustement de la posologie/titration
Une fois passé le plus faible taux de neutrophiles (nadir), la dose quotidienne de Zarzio doit être adaptée selon le schéma suivant, en fonction des modifications de la formule sanguine:
|
Nombre de neutrophiles
|
Adaptation de la dose de Zarzio
| |
>1,0x 109/l pendant 3 jours consécutifs
|
Réduire à 0,5 MU (5 µg)/kg/jour
| |
Si l'ANC est >1,0x 109/l pendant 3 jours consécutifs supplémentaires
|
Arrêter le traitement par Zarzio
| |
Si l'ANC devient inférieur à 1,0x 109/l en cours de traitement, la dose de Zarzio devra être
réaugmentée selon schéma thérapeutique décrit ci-dessus.
|
ANC = nombre absolu de neutrophiles
Mode d'emploi
Zarzio est administré en perfusion intraveineuse de 30 minutes ou de 24 heures, ou en perfusion sous-cutanée continue de 24 heures. Zarzio doit être dilué dans 20 ml de solution de glucose à 5% (voir «Instructions pour la dilution» sous «Remarques particulières»).
Mobilisation des cellules précurseurs du sang périphérique (PBPC)
Mobilisation de cellules souches du sang périphérique chez des patients soumis à un traitement myélosuppressif suivi d'une transfusion de PBPC autologues, avec ou sans greffe de moelle osseuse, ou chez des patients soumis à un traitement aplasiant suivi d'une perfusion de PBPC
Posologie
La dose recommandée de Zarzio est de 1,0 MU (10 µg) par kilogramme de poids corporel par jour pendant 5 à 7 jours consécutifs.
Durée du traitement
Une ou deux leucaphérèses aux jours 5 et 6 sont souvent suffisantes. Dans d'autres circonstances, des leucaphérèses supplémentaires peuvent être nécessaires. Le traitement par Zarzio doit être poursuivi jusqu'à la dernière leucaphérèse.
Mode d'emploi
Zarzio est administré en perfusion sous-cutanée continue sur 24 heures ou sous forme d'injection sous-cutanée unique. Avant d'être perfusé, Zarzio doit être dilué avec 20 ml d'une solution de glucose à 5% (voir «Instructions pour la dilution» sous «Remarques particulières»).
Mobilisation de PBPC après chimiothérapie myélosuppressive
Posologie
La dose recommandée de Zarzio est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour à partir du premier jour suivant la fin de la chimiothérapie jusqu'à ce que le nombre de neutrophiles soit redevenu normal après le nadir attendu (taux le plus faible). La leucaphérèse doit avoir lieu au cours de la période pendant laquelle le nombre absolu de neutrophiles (ANC) passe de <0,5x 109/l à >5,0x 109/l. Chez les patients n'ayant pas été soumis antérieurement à une chimiothérapie intensive, une seule leucaphérèse est souvent déjà suffisante. Dans les autres cas, des leucaphérèses complémentaires sont recommandées.
Chez les patients ayant été soumis antérieurement à une chimiothérapie très intensive et auxquels Zarzio a été administré pour la mobilisation des PBPC, il se peut que le nombre de PBPC soit insuffisant pour que le gain minimal recommandé soit garanti (gain minimal global à partir des échantillons de leucaphérèse: ≥10 à 30x 104 GM-CFC/kg ou ≥1 à 2,5x 106 cellules CD34+/kg).
Mode d'emploi
Zarzio est administré par voie sous-cutanée.
Mobilisation des PBPC chez les donneurs sains pour la transplantation allogénique
La mobilisation des cellules progénitrices ne doit être entreprise que sous la surveillance de centres expérimentés dans la collecte de cellules progénitrices chez des donneurs sains.
Posologie
La dose recommandée de Zarzio est de 1,0 MU (10 µg) par kilogramme de poids corporel par jour pendant 4 à 5 jours consécutifs. Les leucaphérèses doivent être commencées au jour 5 et poursuivies jusqu'au jour 6 si nécessaire, afin de collecter une quantité de 4x 106 cellules CD34+ par kilogramme de poids corporel du receveur.
La sécurité et l'efficacité de Zarzio chez des donneurs sains <16 ans ou >60 ans n'ont pas été étudiées.
Mode d'emploi
Zarzio est administré par voie sous-cutanée.
Patients avec neutropénie congénitale, neutropénie cyclique ou neutropénie idiopathique sévères
Posologie
Neutropénie congénitale: La dose initiale recommandée de Zarzio est de 1,2 MU (12 µg) par kilogramme de poids corporel par jour, en dose unique ou en plusieurs doses.
Neutropénie idiopathique ou cyclique: La dose initiale recommandée de Zarzio est de 0,5 MU (5 µg) par kilogramme de poids corporel par jour en dose unique ou en plusieurs doses.
Ajustement de la posologie/titration
Chez chaque patient, la dose doit à tout prix être fixée individuellement, de manière à atteindre un ANC minimal de 1,5x 109/l.
L'administration quotidienne au long cours est indiquée pour maintenir un nombre de neutrophiles adéquat. La dose doit être doublée si, après 1−2 semaines, la valeur cible de 1,5x 109 ANC/l n'a pas été atteinte, et réduite de moitié si l'ANC dépasse 10,0x 109/l. Une augmentation plus rapide de la dose est indiquée chez les patients présentant des infections graves. Des doses supérieures à 14,5 MU (145 µg) par kilogramme de poids corporel par jour sont sûres et ont été bien tolérées.
Mode d'emploi
Zarzio est administré par voie sous-cutanée.
Patients infectés par le VIH
Posologie
Pour corriger la neutropénie
La dose initiale recommandée de Zarzio est de 0,1 MU (1 µg) par kilogramme de poids corporel par jour avec titrage jusqu'au maximum de 0,4 MU (4 µg) par kilogramme de poids corporel par jour, jusqu'à ce que le nombre des neutrophiles se soit normalisé et puisse se maintenir à ce niveau (ANC >2,0x 109/l). Au cours des études cliniques, plus de 90% des patients ont répondu à ce dosage et leur neutropénie s'est normalisée en 2 jours (médiane).
Chez un faible nombre de patients (<10%), des doses allant jusqu'à 1,0 MU (10 µg) par kilogramme de poids corporel par jour se sont avérées nécessaires pour corriger la neutropénie.
Pour maintenir un taux de neutrophiles normal
Dès que la neutropénie est corrigée, la dose minimale la plus efficace permettant de maintenir un nombre de neutrophiles normal doit être déterminée. On recommande un premier ajustement posologique avec une administration sous-cutanée de 300 µg par jour tous les deux jours. En fonction de l'ANC du patient, une adaptation posologique supplémentaire peut se révéler nécessaire pour que le nombre des neutrophiles reste supérieur à 2,0x 109/l. Au cours des études cliniques, il a été nécessaire d'administrer 300 µg par jour durant 1 à 7 jours par semaine pour maintenir l'ANC supérieur à 2,0x 109/l; la durée médiane d'administration de cette dose était de 3 jours par semaine. Un traitement à long terme peut s'avérer nécessaire pour maintenir un ANC de 2,0x 109/l.
Mode d'emploi
Zarzio est administré par voie sous-cutanée.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique ou rénale
Des études avec filgrastim chez des patients présentant une insuffisance rénale ou hépatique sévère ont montré que les profils pharmacocinétique et pharmacodynamique sont pratiquement similaires à ceux observés chez les sujets normaux (voir «Pharmacocinétique»). Un ajustement des doses n'est pas nécessaire chez ces patients.
Patients âgés
Etant donné que l'expérience acquise chez les patients âgés est encore peu importante, il n'est pas possible d'émettre des recommandations posologiques spéciales à l'intention de ce groupe de patients.
Enfants et adolescents
Les recommandations posologiques pour les patients pédiatriques qui reçoivent une chimiothérapie cytotoxique myélosuppressive ou pour des patients pédiatriques avec une neutropénie congénitale, une neutropénie cyclique ou une neutropénie idiopathique sévères sont identiques à celles valant pour les adultes.
Des données provenant d'études cliniques portant sur des patients pédiatriques montrent que la sécurité et l'efficacité de filgrastim sont comparables chez des adultes et des enfants qui avaient été soumis à une chimiothérapie myélosuppressive.
65% des patients traités dans le cadre d'études cliniques pour une neutropénie chronique sévère avaient moins de 18 ans. Le traitement par Zarzio dans ce groupe d'âge, qui comprenait essentiellement des patients souffrant de neutropénie congénitale, s'est révélé efficace. En ce qui concerne les patients pédiatriques traités pour une neutropénie chronique sévère, aucune différence n'a été constatée pour le profil de sécurité du produit par rapport aux adultes.
Contre-indicationsZarzio ne doit pas être administré aux patients présentant une hypersensibilité connue au principe actif ou à l'un des excipients conformément à la composition.
Mises en garde et précautionsMISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX RISQUES ET EFFETS INDÉSIRABLES GÉNÉRAUX
Hypersensibilité
Des cas de réactions d'hypersensibilité, incluant une anaphylaxie, ont été rapportés chez des patients traités par le filgrastim, lors du traitement initial ou des traitements suivants. Zarzio doit être arrêté de façon définitive chez les patients présentant une hypersensibilité cliniquement significative. Ne pas administrer Zarzio chez les patients ayant des antécédents d'hypersensibilité au filgrastim et pegfilgrastim.
Effets indésirables pulmonaires
Des effets indésirables pulmonaires, notamment une pneumonie interstitielle après administration de G-CSF ont été rapportés. Le risque peut être accru chez les patients ayant une anamnèse récente d'infiltrats pulmonaires ou de pneumonie. L'apparition de troubles pulmonaires, tels que toux, fièvre et dyspnée associés à des signes radiologiques d'infiltrats pulmonaires ainsi que la détérioration de la fonction pulmonaire peuvent être les premiers signes d'un syndrome de détresse respiratoire aigu (SDRA). Le traitement par Zarzio doit être arrêté et un traitement approprié doit être instauré.
Glomérulonéphrite
Des cas de glomérulonéphrite ont été signalés chez des patients ayant reçu le filgrastim et le pegfilgrastim. En règle générale, ces cas ont disparu après une réduction posologique ou l'arrêt du traitement par le filgrastim et le pegfilgrastim. Une surveillance des valeurs urinaires est recommandée.
Syndrome de fuite capillaire
Un syndrome de fuite capillaire, pouvant menacer le pronostic vital si le traitement est retardé, a été signalé après l'administration de facteurs de croissance de la lignée granulocytaire et est caractérisé par une hypotension, une hypoalbuminémie, des œdèmes et une hémoconcentration. Les patients développant des symptômes du syndrome de fuite capillaire doivent être étroitement surveillés et recevoir un traitement symptomatique standard, qui peut inclure la nécessité d'un traitement aux soins intensifs (voir «Effets indésirables»).
Splénomégalie et rupture splénique
Après l'administration de filgrastim à des patients et à des donneurs sains, des cas de splénomégalie qui ont généralement évolué de façon asymptomatique et des cas de ruptures de la rate ont été rapportés. Quelques cas de rupture splénique ont été d'issue fatale. C'est la raison pour laquelle la taille de la rate doit être surveillée étroitement (p.ex. par examen clinique, échographie). Le diagnostic de rupture de la rate devra être évoqué chez les donneurs et/ou chez les patients qui se plaignent de douleurs au niveau de l'hypochondre gauche ou de la région de l'épaule. Il a été constaté qu'une réduction de la dose de filgrastim a permis un ralentissement ou l'arrêt de l'évolution de la splénomégalie chez les patients présentant une neutropénie chronique sévère. Chez 3% des patients, une splénectomie a été nécessaire.
Croissance de cellules malignes
Les facteurs de croissance granulocytaire peuvent promouvoir in vitro la croissance non seulement de cellules myéloïdes, mais aussi de cellules non myéloïdes. Etant donné que des cellules de tumeurs non myéloïdes peuvent également exprimer des récepteurs de G-CSF, l'arrêt du traitement par le G-CSF doit être envisagé chez les patients présentant une réponse insuffisante à la chimiothérapie.
Leucémie myéloïde chronique ou syndrome myélodysplasique
La sécurité et l'efficacité de Zarzio chez les patients présentant un syndrome myélodysplasique ou une leucémie myéloïde chronique n'ont pas été déterminées. L'emploi de Zarzio n'est pas indiqué dans ces maladies. Il convient de faire preuve d'une prudence toute particulière lorsqu'il s'agit d'établir la distinction diagnostique entre la transformation aiguë d'une leucémie myéloïde chronique et une leucémie myéloblastique aiguë.
Thrombocytopénie
Une thrombocytopénie a été observée chez les patients traités par le filgrastim.
Le nombre des thrombocytes doit être surveillé étroitement, et ce tout particulièrement pendant les premières semaines du traitement par Zarzio. Un arrêt transitoire ou une réduction de la dose de Zarzio doivent être envisagés chez les patients présentant une neutropénie chronique sévère qui développent une thrombocytopénie (nombre de thrombocytes <100x 109/l).
Leucocytose
Une leucocytose de 100x 109/l ou plus a été observée occasionnellement chez des patients recevant filgrastim à des doses supérieures à 0,3 MU (3 µg) par kilogramme et par jour. Aucun effet indésirable directement imputable à ce degré de leucocytose n'a été signalé. Toutefois, en raison des risques que fait courir une hyperleucocytose, des contrôles réguliers de la formule leucocytaire doivent être réalisés à intervalles réguliers. Si le nombre de leucocytes dépasse 50x 109/l après le nadir attendu (taux le plus faible), Zarzio doit être arrêté immédiatement. Par ailleurs, si le nombre de leucocytes dépasse 70x 109/l pendant l'administration de Zarzio au titre de la mobilisation des PBPC, l'arrêt de Zarzio est nécessaire.
Une leucocytose transitoire (numération leucocytaire >50x 109/l) a été observée chez 41% des donneurs sains examinés. On a relevé une numération leucocytaire >75x 109/l chez 2% des donneurs sains.
Immunogénicité
Comme avec toutes les protéines thérapeutiques, il existe un risque potentiel d'immunogénicité.
L'incidence du développement d'anticorps fixant le filgrastim est de moins de 1% chez plus de 1000 sujets ayant reçu le filgrastim dans le cadre d'études cliniques réalisées; néanmoins, ces anticorps n'ont pas été associés à une action neutralisante ou à des conséquences cliniques indésirables.
Aortite
Une aortite a été signalée après administration de G-CSF (p.ex. filgrastim) chez des sujets sains et des patients atteints d'un cancer. Les symptômes ressentis comprenaient: fièvre, douleurs abdominales, malaise, maux de dos et augmentation des marqueurs inflammatoires (p.ex. protéine C-réactive et nombre de globules blancs). Dans la plupart des cas, l'aortite a été diagnostiquée par un examen TDM et a été résolue après l'arrêt du traitement par G-CSF (voir également «Effets indésirables»).
Hématurie et protéinurie
Une hématurie et une protéinurie ont été observées chez un petit nombre de patients. Il convient donc de procéder régulièrement à des analyses d'urine.
MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX COMORBIDITÉS
Ostéoporose
Un contrôle de la densité des os est recommandé chez les patients présentant déjà une ostéoporose et traités par Zarzio pendant plus de six mois en continu, car des cas d'ostéoporose ont été observés lors de traitements au long cours.
Précautions particulières chez les patients atteints d'une anémie falciforme
D'après les publications, un nombre élevé de leucocytes est défavorable chez les patients souffrant d'une anémie falciforme. Pour cette raison, le médecin ne doit utiliser Zarzio qu'avec prudence chez ces patients et doit surveiller étroitement les valeurs de laboratoire correspondantes. Il doit prendre en considération le rapport éventuel avec une splénomégalie et des crises vaso-occlusives.
Des crises de drépanocytose, ayant entraîné une issue fatale dans certains cas, ont été rapportées lors de l'utilisation de le filgrastim chez des patients atteints d'anémie falciforme. Le médecin doit être prudent lors de la prescription de Zarzio chez les patients porteurs du trait drépanocytaire ou atteints d'anémie falciforme.
MISES EN GARDE ET PRÉCAUTIONS RELATIVES À LA CHIMIOTHÉRAPIE
Risques associés à la chimiothérapie à hautes doses
Zarzio ne doit pas être utilisé pour augmenter la posologie de chimiothérapies cytotoxiques au-delà du schéma posologique recommandé. Des précautions particulières doivent être prises pour le traitement des patients sous chimiothérapie à hautes doses car d'une part, une amélioration de la réponse de tumeurs à un tel traitement n'a pas été démontrée jusqu'à présent et d'autre part, une chimiothérapie hautement dosée peut conduire à des effets toxiques accrus y compris des effets cardiaques, pulmonaires, neurologiques et dermatologiques (voir aussi l'information professionnelle des chimiothérapies respectives utilisées).
Chimiothérapie avec myélosuppression retardée
Les données relatives à l'efficacité de le filgrastim en cas de chimiothérapie induisant une myélosuppression retardée – par des nitroso-urées ou la mitomycine C, p.ex. ou impliquant l'administration de doses myélosuppressives d'antimétabolites tels que le 5-FU ou le cytosine-arabinoside sont encore insuffisantes.
Influence de la chimiothérapie sur les érythrocytes et les thrombocytes
Zarzio réduit significativement l'incidence des neutropénies sévères et fébriles.
Il reste néanmoins un risque, chez les patients traités selon un schéma de chimiothérapie myélotoxique, de développer une thrombopénie et une anémie. On recommande par conséquent de contrôler régulièrement le nombre de thrombocytes et l'hématocrite. Une prudence particulière est de rigueur pour l'utilisation avec les agents chimiothérapeutiques (associés ou en monothérapie) connus pour provoquer une thrombopénie sévère.
Syndrome myélodysplasique et leucémie myéloïde aiguë chez les patients atteints de cancer du sein et du poumon
Dans le cadre d'études observationnelles après commercialisation, le filgrastim associé à la chimiothérapie et/ou à la radiothérapie a été associé à l'apparition de cas de syndrome myélodysplasique (SMD) et de leucémie myéloïde aiguë (LMA) chez les patients atteints de cancer du sein et du poumon (voir «Effets indésirables»). Les patients traités dans ces conditions doivent être surveillés afin de détecter tout signe ou symptôme de SMD/LMA.
Thrombopénie
Les patients qui reçoivent Zarzio après l'administration de doses élevées d'une chimiothérapie myélosuppressive peuvent présenter un risque accru de développer une thrombopénie.
RECOMMANDATIONS EN MATIÈRE DE CONTRÔLE DE LA FORMULE SANGUINE
Le traitement par Zarzio seul n'empêche pas l'apparition d'une thrombopénie et d'une anémie sous médicaments myélosuppresseurs.
Comme, au cours du traitement par Zarzio, de tels médicaments peuvent par principe être administrés à hautes doses ou en grande quantité au patient, le risque de thrombopénie et d'anémie peut également augmenter. Il est recommandé de surveiller régulièrement la formule sanguine. Une anémie et une augmentation passagère des cellules souches myéloïdes sont d'autres manifestations hématologiques nécessitant également une étroite surveillance (voir aussi «MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX RISQUES ET EFFETS INDÉSIRABLES GÉNÉRAUX» et «Effets indésirables» «Thrombopénie» et «MISES EN GARDE ET PRÉCAUTIONS» «relatives à la chimiothérapie»).
Infections susceptibles d'entraîner une myélosuppression
L'origine d'une neutropénie peut être une infection opportuniste, par exemple due au complexe Mycobacterium avium qui infiltre la moelle osseuse, ou une atteinte maligne comme un lymphome. Chez les patients souffrant d'une infection infiltrant la moelle osseuse ou d'un cancer, un traitement adapté de la pathologie de base doit être envisagé en plus du traitement de la neutropénie par Zarzio. Le mécanisme d'action de le filgrastim sur la neutropénie en rapport avec les tableaux cliniques mentionnés n'est pas suffisamment connu.
GROUPES DE PATIENTS PARTICULIERS / INDICATIONS SPECIFIQUES
Précautions particulières chez les patients qui se soumettent à une mobilisation des PBPC
Estimation des rendements en cellules souches progénitrices
Il convient d'attacher une attention particulière à la méthode de quantification utilisée pour déterminer le taux de cellules progénitrices collectées chez les patients traités par Zarzio. Les résultats de la quantification des cellules CD34+ par cytométrie de flux varient suivant la précision de la méthode utilisée. Les recommandations de taux basées sur des études d'autres laboratoires doivent donc être interprétées avec prudence.
L'analyse statistique montre qu'il existe une relation complexe mais continue entre le nombre de CD34+ réinjectés et la rapidité de la récupération plaquettaire après chimiothérapie à haute dose.
La recommandation d'un rendement minimum de cellules CD34+ ≥2,0x 106 par kilogramme de poids corporel est basée sur les valeurs empiriques publiées qui ont entraîné une récupération hématologique correcte. Il semble que des rendements en CD34+ supérieurs à cette norme soient liés à une récupération plus rapide, et des rendements inférieurs à une récupération plus lente.
Mobilisation
Il n'y a pas d'étude comparative prospective randomisée des deux méthodes recommandées de mobilisation des cellules souches périphériques (filgrastim seul ou en association avec une chimiothérapie myélosuppressive) chez les mêmes populations de patients. Le degré de variation des taux de cellules CD34+ entre les patients et entre les dosages rend difficile la comparaison directe entre les études. Il est donc difficile de recommander la méthode idéale. Le choix de la méthode de mobilisation appropriée doit prendre en compte l'objectif thérapeutique global pour chaque patient.
Traitement préalable par des agents cytotoxiques et une mobilisation des PBPC
Les patients ayant reçu au préalable un traitement myélosuppresseur très intensif, puis traités par Zarzio pour une mobilisation des cellules souches périphériques peuvent ne pas présenter une mobilisation suffisante des cellules souches pour obtenir le rendement minimal recommandé (cellules CD34+ ≥2,0x 106 par kilogramme de poids corporel).
Certains agents cytotoxiques sont particulièrement toxiques pour les cellules souches sanguines et peuvent diminuer leur mobilisation. Des agents tels que le melphalan, la carmustine (BCNU) et le carboplatine peuvent réduire le rendement en cellules souches s'ils sont administrés pendant de longues périodes avant l'initiation de la mobilisation des cellules souches envisagée. En revanche, l'administration de ces produits associée à celle de filgrastim s'est montrée favorable pour la mobilisation de cellules souches. Si une greffe de cellules souches périphériques est envisagée, la mobilisation de ces cellules doit être réalisée dans une phase précoce du traitement du patient. Une attention particulière doit être apportée chez ces patients au nombre de cellules souches mobilisées avant l'administration de chimiothérapie à haute dose. Si des rendements insuffisants sont constatés, selon les critères définis ci-dessus, d'autres schémas de traitement ne nécessitant pas l'utilisation de cellules souches sanguines doivent être envisagés.
Précautions particulières chez les donneurs sains qui se soumettent à une mobilisation des PBPC
La mobilisation des cellules souches sanguines périphériques est sans bénéfice clinique direct pour le donneur sain et doit être envisagée uniquement dans le cadre d'une allogreffe de cellules souches.
La mobilisation des PBPC ne doit être envisagée que chez des donneurs qui répondent aux critères de sélection pour un don de cellules souches, à savoir des paramètres de laboratoire normaux, avec une attention particulière pour les valeurs hématologiques.
S'il est nécessaire de pratiquer plus d'une leucaphérèse, une attention particulière doit être accordée avant l'aphérèse aux donneurs dont le nombre de plaquettes est <100x 109/l.
En général, aucune aphérèse ne doit être effectuée si la numération plaquettaire est <75x 109/l.
Des thrombopénies transitoires (nombre de plaquettes <100x 109/l) ont été observées après administration de filgrastim et leucaphérèse chez 35% des donneurs sains examinés. Des cas isolés avec des valeurs <50x 109/l ont également été rapportés.
La leucaphérèse ne doit pas être effectuée chez les donneurs sous traitement anticoagulant ou présentant des troubles connus de l'hémostase.
L'administration de Zarzio doit être arrêtée ou la dose diminuée si le nombre de leucocytes dépasse 70x 109/l.
Les donneurs ayant reçu du facteur de croissance granulocytaire pour la mobilisation des cellules souches sanguines périphériques doivent être suivis jusqu'à ce que les paramètres hématologiques soient redevenus normaux.
Chez les donneurs sains, les données sur l'administration à long terme sont limitées.
Dans le cadre de la surveillance post-commercialisation, des effets indésirables pulmonaires (hémoptysie, infiltrats pulmonaires) ont été rapportés chez les donneurs sains.
Un suivi de sécurité à long terme des donneurs est en cours.
Au cours d'une période de surveillance allant jusqu'à 4 ans, aucune anomalie de l'hématopoïèse n'a été rapportée chez les donneurs sains. Néanmoins, le risque de développement d'un clone de cellules myéloïdes malignes ne peut être exclu.
Il est recommandé que chaque don de cellules souches fasse l'objet d'un rapport et d'un enregistrement systématiques par les centres d'aphérèses afin d'assurer le suivi de la sécurité à long terme.
Précautions particulières chez les receveurs de cellules souches sanguines périphériques allogéniques obtenues après mobilisation par filgrastim
Des cas de réaction du greffon contre l'hôte (GvHD) et des cas de décès ont été rapportés chez des patients ayant reçu du G-CSF après une greffe allogénique de moelle osseuse (voir «Propriétés/Effets»).
Précautions particulières chez des patients avec neutropénies congénitale, cyclique ou idiopathique sévères
La tolérance et l'efficacité de le filgrastim n'ont pas été établies chez le nouveau-né et les patients souffrant de neutropénie auto-immune.
Zarzio ne doit pas être utilisé chez les patients atteints de neutropénie congénitale sévère qui développent une leucémie ou présentent des signes d'évolution vers une leucémie.
Transformation en leucémie ou préleucémie
Une attention particulière doit être accordée au diagnostic différentiel d'une neutropénie chronique sévère afin de la distinguer d'autres troubles hématologiques tels que l'anémie aplastique, les syndromes myélodysplasiques et la leucémie myéloïde.
Une numération-formule sanguine complète avec numérations leucocytaire et plaquettaire ainsi qu'une évaluation de la morphologie et du caryotype de la moelle osseuse doivent être effectuées avant le traitement.
Chez des patients présentant une neutropénie congénitale et traités à long terme par filgrastim (12,1% pendant 5 ans), des cas de syndrome myélodysplasique ou de leucémie ont été enregistrés. Ces observations ont été faites uniquement chez des patients atteints de neutropénie congénitale. Les syndromes myélodysplasiques et la leucémie sont des complications naturelles de la maladie, dont la relation avec le traitement par filgrastim est incertaine. Chez un sous-groupe composé d'environ 12% des patients qui ne présentaient aucune anomalie cytogénétique lors de l'évaluation initiale, des contrôles de routine répétés ont mis en évidence des modifications anormales, notamment une monosomie 7. On ne sait pas encore très bien si la poursuite du traitement chez des patients présentant un trouble de la cytogénèse favorise la survenue d'anomalies cytogénétiques, de myélodysplasies ou d'une transformation leucémique. Il est recommandé d'effectuer, tous les 12 mois environ, des examens morphologiques et cytogénétiques de la moelle osseuse.
Précautions particulières chez les patients infectés par le VIH
Numération formule sanguine
Le nombre absolu des neutrophiles (ANC) doit être étroitement surveillé – particulièrement au cours des premières semaines de traitement par Zarzio. Selon les circonstances, certains patients réagissent très rapidement aux premières administrations de Zarzio par une élévation considérable du nombre des neutrophiles. Il est recommandé de mesurer quotidiennement l'ANC au cours des premiers jours où Zarzio est administré. Pendant les deux premières semaines, il est recommandé de mesurer l'ANC au moins deux fois par semaine, puis, pendant le traitement d'entretien, une fois par semaine ou une fois toutes les deux semaines. Durant l'administration intermittente de 300 µg/jour de filgrastim, l'ANC des patients peut considérablement varier dans le temps. Pour déterminer la valeur minimale de l'ANC d'un patient, on recommande de prélever les échantillons sanguins prévus pour cette mesure immédiatement avant l'administration de Zarzio.
Populations particulières de patients
L'expérience chez les patients souffrant de troubles sévères des fonctions hépatique et/ou rénale est limitée (voir «Pharmacocinétique» et «Posologie/Mode d'emploi»).
Les effets de filgrastim chez les patients présentant une baisse significative du nombre des cellules progénitrices myéloïdes n'ont pas encore été étudiés. Etant donné que filgrastim agit principalement sur la maturation des précurseurs de polynucléaires neutrophiles, et accroît ainsi le nombre des neutrophiles dans le sang, son effet peut être réduit chez les patients ayant un faible nombre de précurseurs (comme chez les patients ayant suivi une radiothérapie ou chimiothérapie intensives préalables).
MISES EN GARDE ET PRÉCAUTIONS RELATIVES AUX PROCÉDURES DIAGNOSTIQUES
Imagerie osseuse
Une augmentation de l'activité hématopoїétique de la moelle osseuse en réponse à un traitement par des facteurs de croissance a été associée à des résultats de scintigraphie osseuse transitoirement anormaux. Ce phénomène doit être pris en compte lors de l'interprétation des résultats de l'imagerie osseuse.
Mises en garde relatives aux autres composants
Allergie au latex
Le capuchon de la seringue préremplie contient du caoutchouc naturel sec (un dérivé du latex) susceptible de provoquer des réactions allergiques.
Sorbitol
Zarzio contient du sorbitol. L'effet additif des produits administrés concomitamment contenant du sorbitol (ou du fructose) et l'apport alimentaire de sorbitol (ou de fructose) doit être pris en compte. Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas recevoir ce médicament.
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par unité de dosage (48MU/0,5ml), c'est-à-dire qu'il est pratiquement «sans sodium».
InteractionsL'efficacité et l'innocuité de Zarzio en cas d'administration le même jour qu'un traitement chimiothérapique cytotoxique à effet myélosuppressif n'ont pas été établies de manière explicite. En raison de la sensibilité à la chimiothérapie cytotoxique myélosuppressive des cellules myéloïdes se multipliant rapidement, Zarzio ne doit pas être administré au cours des 24 heures précédant ou suivant la chimiothérapie. Il existe des indices permettant de penser que l'administration concomitante de Zarzio et de 5-fluorouracile peut parfois entraîner une aggravation aiguë de la neutropénie.
D'éventuelles interactions avec d'autres facteurs de croissance hématopoïétiques et d'autres cytokines n'ont jusqu'à présent pas été évaluées au cours d'études cliniques (voir aussi «Incompatibilités» sous «Remarques particulières»).
Etant donné que le lithium favorise le relargage des neutrophiles, il est vraisemblable qu'il potentialise l'effet de filgrastim. Bien que cette interaction n'ait pas été spécifiquement étudiée, il n'existe aucun indice de nocivité liée à cette interaction.
Grossesse, allaitementGrossesse
Il n'existe aucune donnée sur l'innocuité de Zarzio chez la femme enceinte. Il existe dans la littérature des observations montrant que le filgrastim traverse la barrière placentaire chez les femmes enceintes. Les expérimentations animales ont montré une toxicité de reproduction.
Chez le lapin ayant reçu des doses élevées (exposition très supérieure à l'exposition clinique habituelle), entraînant une toxicité maternelle, une incidence accrue de létalité embryonnaire a été observée. Zarzio ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Etant donné que l'on ignore dans quelle mesure filgrastim passe dans le lait maternel, ce médicament ne doit pas être administré aux femmes qui allaitent. Un risque pour le nouveau-né / enfant en bas âge ne peut pas être exclu. Il est nécessaire de décider s'il convient d'arrêter l'allaitement ou de s'abstenir / interrompre le traitement par Zarzio, en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la femme.
Effet sur l’aptitude à la conduite et l’utilisation de machinesFilgrastim peut avoir une légère influence sur l'aptitude à la conduite ou l'utilisation de machines. Des vertiges peuvent survenir après l'administration de filgrastim (voir «Effets indésirables»).
Aucune étude correspondante n'a été effectuée.
Effets indésirablesRésumé des effets indésirables
Les données figurant dans le tableau ci-dessous concernent les effets indésirables rapportés lors des études cliniques et dans le cadre des notifications spontanées. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
|
Classe de systèmes d'organes MedDRA
|
Effets indésirables
| |
Très fréquent
(≥1/10)
|
Fréquent
(≥1/100, <1/10)
|
Peu fréquent
(≥1/1'000, <1/100)
|
Rare
(≥1/10'000, <1/1'000)
| |
Infections et infestations
|
|
Septicémie
Bronchite
Infections des voies respiratoires supérieures
Infections des voies urinaires
|
|
| |
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
|
|
|
Syndrome myélodysplasiquea
Leucémie myéloïde aiguëa
|
| |
Affections hématologiques et du système lymphatique
|
Anémie (21,1%)
Thrombopénie (15,7%)a
|
Splénomégaliea
Diminution de l'hémoglobinémied
|
Leucocytosea
|
Rupture spléniquea
Anémie falciforme associée à une crisea
Hématopoïèse extramédullaire
| |
Affections du système immunitaire
|
|
|
Hypersensibilité médicamenteuse
Hypersensibilitéa
Réaction du greffon contre l'hôteb
|
Réaction anaphylactique
| |
Troubles du métabolisme et de la nutrition
|
|
Perte d'appétit
Elévation du taux de lactate déshydrogénase dans le sang
|
Hyperuricémie
Elévation de l'acide urique dans le sang
|
Diminution du glucose dans le sang
Chondrocalcinose pyrophosphate (Pseudogoutte)
Déséquilibre du volume liquidien
| |
Affections
psychiatriques
|
|
Insomnie
|
|
| |
Affections du système nerveux
|
Céphalées (13,9%)
|
Vertiges
Hypoesthésie
Paresthésie
|
|
| |
Affections vasculaires
|
|
Hypertension
Hypotension
|
Maladie veinoocclusive
|
Aortite
Angiopathie
Syndrome de fuite capillairea
| |
Affections respiratoires, thoraciques et médiastinales
|
|
Hémoptysie
Dyspnée
Toux
Douleurs oropharyngées
Epistaxis
|
Douleurs thoraciques non cardiaques
Syndrome de détresse respiratoire aiguëa
Insuffisance respiratoirea
Œdème pulmonairea
Hémorragie pulmonaire
Maladie pulmonaire interstitielle
Infiltrats pulmonaires
Hypoxie
|
Fibrose pulmonairea
Douleurs laryngo-pharyngées
| |
Affections gastro-intestinales
|
Vomissements (21,2%)
Nausées (19,5%)
Diarrhée (18,6%)
|
Douleurs buccalesd
Constipationd
|
|
| |
Affections hépatobiliaires
|
|
Hépatomégalie
Elévation des phosphatases alcalines dans le sang
|
Elévation des aspartates aminotransférases
Elévation des gammaglutamyl transférases
|
| |
Affections de la peau et du tissu sous-cutané
|
Alopécie (13,6%)
|
Erythème
Rash
|
Rash maculo-papuleux
|
Dermatose aiguë fébrile neutrophilique (syndrome de Sweet)
Vascularite cutanéea
| |
Affections musculosquelettiques et systémiques
|
Douleurs musculo-squelettiquesc (27,7%)
|
Spasmes musculaires
|
Ostéoporose
|
Diminution de la densité osseuse
Exacerbation de la polyarthrite rhumatoïde
| |
Affections du rein et des voies urinaires
|
|
Hématurie
Dysurie
|
Protéinurie
|
Troubles de la miction
Glomérulonéphrite
Anomalie urinaire
| |
Troubles généraux et anomalies au site d'administration
|
Fatigue (11,9%)
Inflammation des muqueuses (12,9%)
Fièvre (28,9%)
|
Asthénie
Douleurs
Malaised
Œdème périphériqued
|
Réaction au site d'injection
|
| |
Lésions, intoxications et complications d'interventions
|
|
Réaction à la transfusiond
|
|
|
a Voir «Description de certains effets indésirables»
b Des cas de GvHD et des décès ont été rapportés chez des patients après greffe allogénique de moelle osseuse
c Incluant douleur osseuse, douleur au dos, arthralgie, myalgie, douleur dans les extrémités, douleur musculo-squelettique, douleur musculo-squelettique de la poitrine, douleur du cou
d Effets indésirables avec les incidences les plus élevées chez les patients traités par filgrastim par rapport au placebo et associés aux séquelles de la malignité sous-jacente ou de la chimiothérapie cytotoxique
Description de certains effets indésirables
Réactions d'hypersensibilité aux médicaments
Des réactions d'hypersensibilité, notamment anaphylaxie, éruption cutanée, urticaire, angio-œdème, dyspnée et hypotension, ont été rapportés lors du premier traitement et lors de la poursuite du traitement au cours des études cliniques et après la commercialisation. Dans l'ensemble, ces symptômes ont été rapportés plus fréquemment après administration i.v. Parfois, la réadministration du produit a entraîné la réapparition des symptômes, suggérant ainsi une relation de cause à effet. Zarzio doit être définitivement arrêté en cas de réaction allergique grave.
Effets indésirables pulmonaires
Des cas d'effets indésirables pulmonaires incluant pneumonie interstitielle, œdème pulmonaire et infiltrats pulmonaires ont été rapportés au cours des études cliniques et après la commercialisation. Certains de ces cas ont entraîné une insuffisance respiratoire ou un syndrome de détresse respiratoire aigüe (SDRA) pouvant avoir une issue fatale (voir «Mises en garde et précautions»).
Syndrome de fuite capillaire
Des cas de syndrome de fuite capillaire ont été signalés après l'utilisation de facteurs de croissance de la lignée granulocytaire. Ces évènements sont généralement apparus chez des patients ayant des pathologies malignes à un stade avancé, une septicémie, traités par de multiples chimiothérapies ou ayant subi une aphérèse après mobilisation des PBPC (voir «Mises en garde et précautions»).
Splénomégalie et rupture splénique
Des cas de splénomégalie et rupture splénique ont été observés après l'administration de filgrastim. Certains cas de rupture splénique ont été d'issue fatale (voir «Mises en garde et précautions»).
Leucocytose et thrombocytopénie
Après l'administration de filgrastim, des cas de leucocytose et de thrombocytopénie ont été observés (voir «Mises en garde et précautions»).
Crises drépanocytaires
Après la commercialisation, des cas isolés de crises drépanocytaires ont été rapportés chez des patients porteurs du trait drépanocytaire ou atteints d'anémie falciforme (voir «Mises en garde et précautions»).
Vascularite cutanée
Des cas de vascularite cutanée ont été rapportés chez des patients traités par filgrastim.
Syndrome myélodysplasique et leucémie myéloïde aiguë
Des cas peu fréquents de syndrome myélodysplasique (SMD) et de leucémie myéloïde aiguë (LMA) ont été rapportés chez des patients atteints de cancer du sein et du poumon (voir «Mises en garde et précautions»).
Enfants et adolescents
Les données fournies par les études cliniques effectuées chez des enfants et des adolescents montrent que la sécurité et l'efficacité de filgrastim sont comparables chez les adultes et les enfants recevant des chimiothérapies cytotoxiques, suggérant l'absence de différence liée à l'âge dans la pharmacocinétique du filgrastim. Le seul effet indésirable systématiquement rapporté a été les douleurs musculo-squelettiques‚ ce qui n'est pas différent de l'expérience dans la population adulte.
Les données sont insuffisantes pour évaluer davantage l'utilisation de filgrastim chez les enfants et les adolescents.
Autres groupes particuliers de patients
Patients âgés
Aucune différence globale de sécurité ou d'efficacité n'a été observée entre les personnes âgées de plus de 65 ans et les adultes plus jeunes (>18 ans) recevant des chimiothérapies cytotoxiques. L'expérience clinique n'a identifié aucune différence dans les réponses obtenues chez les patients âgés et les patients adultes plus jeunes. Les données sont insuffisantes pour évaluer l'utilisation de filgrastim chez les personnes âgées dans d'autres indications approuvées.
Enfants et adolescents atteints de NCS
Des cas de diminution de la densité osseuse et d'ostéoporose ont été rapportés chez des enfants et adolescents atteints de neutropénie chronique sévère et traités de façon chronique par le filgrastim.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLes conséquences d'un surdosage en filgrastim ne sont pas encore connues. Des patients atteints de neutropénie chronique sévère et ayant reçu des doses supérieures à 14,5 MU (145 µg) par kilogramme de poids corporel par jour n'ont présenté aucun symptôme pathologique. Chez les patients ayant reçu une chimiothérapie cytotoxique suivie d'une greffe de moelle osseuse, des doses allant jusqu'à 7,0 MU (70 µg) par kilogramme de poids corporel se sont avérées bien tolérées.
En cas de surdosage, l'arrêt du traitement par filgrastim est habituellement suivi d'une chute de 50% du nombre de neutrophiles en 1 à 2 jours et d'une normalisation de leur taux en 1 à 7 jours.
Propriétés/EffetsCode ATC
L03AA02
Zarzio est un biosimilaire.
Mécanisme d'action
Le filgrastim est une protéine non glycosylée, hautement purifiée, composée de 175 acides aminés. Le filgrastim est produit à partir de souches d'E. coli modifiée génétiquement par l'adjonction du gène codant pour le facteur de croissance granulocytaire humain.
Le facteur de croissance granulocytaire humain est une glycoprotéine induisant la production et la libération de granulocytes neutrophiles fonctionnels à partir de la moelle osseuse.
Pharmacodynamique
Le G-CSF contenu dans Zarzio entraîne, au cours des 24 heures suivant son administration, une nette augmentation du nombre des neutrophiles circulant dans le sang, qui s'accompagne d'une légère élévation des monocytes. Chez certains patients atteints de neutropénie chronique sévère, Zarzio peut également accroître faiblement le nombre d'éosinophiles et de basophiles circulants jusqu'aux valeurs normales. Une éosinophilie ou basophilie s'observent chez certains patients avant même l'instauration du traitement. Aux posologies recommandées, l'augmentation du taux sanguin de neutrophiles est fonction de la dose administrée. Des études cliniques ont montré que les neutrophiles produits par le corps humain en réponse à un traitement par filgrastim présentent une faculté de phagocytose et de production de superoxydes normales ou accrues.
L'utilisation de Zarzio, seul ou après une chimiothérapie, mobilise la libération de précurseurs hématopoïétiques dans le sang périphérique. Ces cellules progénitrices du sang périphérique (PBPC) peuvent être isolées, puis reperfusées après un traitement cytotoxique aplasiant, soit à la place, soit en plus d'une greffe de moelle osseuse. Les PBPC peuvent aussi être administrées à titre de soutien après une chimiothérapie cytotoxique (fortement) myélosuppressive. La perfusion de PBPC accélère la récupération hématopoïétique, raccourcit la période de risque de complications hémorragiques et réduit la nécessité de transfuser des thrombocytes.
Chez des donneurs sains, une dose de filgrastim de 10 µg par kilogramme de poids de corporel par jour administrée par voie sous-cutanée durant 4 à 5 jours consécutifs génère, dans la majorité des cas un rendement ≥4x 106 cellules CD34+ par kilogramme de poids corporel du receveur après deux leucaphérèses.
Au terme du traitement par Zarzio, le nombre de neutrophiles dans le sang décroît d'environ 50% en 1 à 2 jours, et retrouve des valeurs normales en 1 à 7 jours. Le traitement par Zarzio entraîne une réduction significative de l'incidence, de la sévérité et de la durée tant de la neutropénie que des épisodes fébriles fréquemment observés après un traitement par une chimiothérapie cytostatique ou une chimiothérapie aplasiante suivie d'une greffe de moelle osseuse. Les patients sous chimiothérapie traités également par Zarzio doivent être hospitalisés moins souvent et moins longtemps. De plus, ils doivent avoir moins souvent recours aux traitements antibiotiques, que les patients ayant été soumis à une chimiothérapie sans traitement complémentaire.
Le traitement par Zarzio réduit significativement la durée de la neutropénie fébrile, le recours aux antibiotiques et les hospitalisations consécutives à une chimiothérapie d'induction chez des patients présentant une leucémie myéloïde aiguë. La survenue de fièvre et d'infections documentées n'a pas été réduite dans de telles conditions. L'efficacité du G-CSF n'a pas encore été établie chez les patients qui, par suite d'une diminution de leur réserve médullaire, présentent déjà une leucopénie avant l'instauration du traitement (p.ex. après radiothérapie étendue et/ou cycles répétés de chimiothérapie). Chez ces malades, le traitement par le G-CSF ne peut pas remplacer temporairement l'adaptation habituelle des doses de chimiothérapie.
Une étude européenne rétrospective a examiné l'utilisation du G-CSF après une greffe allogénique de moelle osseuse chez des patients souffrant d'une leucémie aiguë. Elle a indiqué que l'utilisation de G-CSF est associée à un risque accru de réaction du greffon contre l'hôte (GvHD), de mortalité associée au traitement (treatment related mortality, TRM) et de mortalité. Une autre étude rétrospective internationale auprès de patients souffrant d'une leucémie myéloïde aiguë ou chronique n'a constaté aucune influence sur la GvHD, la TRM et la mortalité. Une méta-analyse d'études sur la transplantation allogénique, incluant les résultats de neuf études randomisées prospectives, de huit études rétrospectives et d'une étude cas-témoins, n'a révélé aucune influence sur le risque de GvHD aiguë ou chronique ou de mortalité précoce due au traitement.
|
Risque relatif (CI à 95%) de réactions du greffon contre l'hôte (GvHD) et de mortalité associée au traitement (TRM) après un traitement par le G-CSF à la suite d'une greffe de moelle osseuse
| |
Publication
|
Période de l'étude
|
n
|
GvHD aiguë de grade II à IV
|
GvHD chronique
|
TRM
| |
Méta-analyse (2003)
|
1986−2001a
|
1198
|
1,08
(0,87; 1,33)
|
1,02
(0,82; 1,26)
|
0,70
(0,38; 1,31)
| |
Etude européenne rétrospective (2004)
|
1992−2002b
|
1789
|
1,33
(1,08; 1,64)
|
1,29
(1,02; 1,61)
|
1,73
(1,30; 2,32)
| |
Etude internationale rétrospective (2006)
|
1995−2000b
|
2110
|
1,11
(0,86; 1,42)
|
1,10
(0,86; 1,39)
|
1,26
(0,95; 1,67)
|
a L'analyse a inclus des études impliquant des greffes de moelle durant cette période; certaines études utilisaient du GM-CSF (granulocyte-macrophage colony-stimulating factor).
b L'analyse a inclus des patients recevant une greffe de moelle durant cette période.
Le traitement par Zarzio de l'enfant ou de l'adulte atteints de neutropénie chronique sévère (neutropénies congénitale, cyclique ou idiopathique sévères) induit une augmentation du nombre absolu de neutrophiles dans le sang périphérique ainsi qu'une diminution des infections et de leurs conséquences.
L'utilisation de Zarzio chez les patients infectés par le VIH maintient le nombre des neutrophiles dans les limites de la normale, ce qui permet d'administrer des médicaments antiviraux et/ou d'autres préparations myélosuppressives à leur dose habituelle. Rien n'indique que la prolifération du VIH est stimulée chez les patients infectés par le virus et traités par le filgrastim.
Comme pour d'autres facteurs de croissance hématopoïétique, le G-CSF a montré in vitro un effet stimulant sur la croissance des cellules endothéliales humaines.
Efficacité clinique
Aucune donnée.
PharmacocinétiqueAbsorption
Il existe une corrélation linéaire positive entre la dose et la concentration sérique du filgrastim, que filgrastim soit administré par voie intraveineuse ou par voie sous-cutanée. Des concentrations sériques maximales de filgrastim comprises entre 5 et 1840 ng/ml ont été mises en évidence après administration de doses uniques allant de 1,7 à 69,0 µg par kilogramme de poids corporel (perfusion i.v. brève de 30 minutes). Après l'administration sous-cutanée de la dose recommandé, des concentrations sériques atteignant au maximum 118 ng/ml ont été mesurées et elles sont demeurées supérieures à 10 ng/ml pendant 8 à 16 heures. Le volume de distribution calculé dans le sang était approximativement de 150 ml/kg.
Distribution
Aucune donnée.
Métabolisme
Aucune donnée.
Élimination
La clairance du filgrastim suit une cinétique de premier ordre après administration tant sous-cutanée qu'intraveineuse. La clairance totale déterminée a été de 0,6 ml/min/kg. La demi-vie moyenne d'élimination a été de 3,5 heures environ.
Lors de perfusions continues de filgrastim effectuées pendant une durée maximale de 28 jours chez des patients ayant subi une autogreffe de moelle osseuse, il n'a été constaté aucun signe d'accumulation du produit, la demi-vie étant demeurée comparable.
Le profil pharmacocinétique établi à la concentration de 0,96 mg/ml présente une différence négligeable liée à la concentration par rapport aux concentrations plus faibles de 0,6 mg/ml et 0,3 mg/ml. Cette différence n'a aucune influence sur la réponse pharmacodynamique globale (mesurée d'après la réponse des neutrophiles).
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique et rénale
Dans le cadre d'une étude portant sur 12 patients présentant différents degrés de fonction rénale, une augmentation de la Cmax et de l'AUC ainsi qu'une diminution du volume de distribution et de la clairance ont été observées chez les sujets atteints d'insuffisance rénale terminale en comparaison à des volontaires sains et à des patients atteints d'insuffisance rénale modérée. Dans la mesure où les profils des moyennes d'ANC étaient similaires entre les différents degrés de fonction rénale, y compris lors d'insuffisance rénale terminale, un ajustement de la dose de filgrastim n'est pas nécessaire chez les patients présentant une insuffisance rénale. Les résultats d'une étude portant sur 12 patients présentant une insuffisance hépatique montrent que la pharmacocinétique et la pharmacodynamique de filgrastim sont comparables chez les sujets présentant une insuffisance hépatique et chez les sujets sains. Par conséquent, un ajustement posologique n'est pas nécessaire chez les patients présentant une insuffisance hépatique.
Données précliniquesL'expression de récepteurs du facteur de croissance granulocytaire (G-CSF) a été mise en évidence dans certaines cellules malignes. On ne peut exclure que le filgrastim agisse éventuellement comme un facteur de croissance dans certains types de tumeurs.
Le potentiel cancérigène du filgrastim n'a pas été étudié. Le filgrastim n'a pas induit de mutations génétiques dans les bactéries, ni en présence, ni en l'absence d'un système enzymatique métabolisant le médicament. Le filgrastim n'a pas eu d'effet perceptible sur la fertilité du rat mâle ou femelle ou sur le temps de gestation des femelles à une dose allant jusqu'à 500 mcg/kg.
Remarques particulièresIncompatibilités
Zarzio ne doit pas être dilué dans des solutions salines. Pour la compatibilité de Zarzio avec des matériaux plastiques après dilution pour perfusion, voir «Remarques concernant la manipulation».
Stabilité
Les seringues préremplie de Zarzio sont à usage unique seulement. Jeter toute la solution restante non utilisée.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
La solution injectable doit être conservée au réfrigérateur (2–8°C) et hors de la portée des enfants.
La seringue peut être sortie du réfrigérateur et gardée à température ambiante durant une période unique pouvant aller jusqu'à 8 jours (pas au-dessus de 25°C). A l'issue de cette période, le produit ne doit plus être remis au réfrigérateur et doit être jeté.
Les solutions diluées de Zarzio ne doivent pas être préparées plus de 24 heures avant l'administration et doivent être conservées au réfrigérateur entre +2°C et +8°C.
Remarques concernant la manipulation
Avant toute utilisation, la solution doit être contrôlée visuellement. Seules les solutions limpides et dépourvues de particules peuvent être utilisées. Une exposition accidentelle à la congélation n'affecte pas la stabilité de Zarzio.
Zarzio ne contient aucun conservateur: du fait du risque de contamination microbienne, les seringues préremplies de Zarzio sont exclusivement à usage unique.
Dilution préalable à l'administration (optionnelle)
Si nécessaire, Zarzio peut être dilué dans une solution de glucose à 50 mg/mL (5 %) à des fins d'injection. Zarzio ne doit pas être dilué avec des solutions salines.
En aucun cas la concentration finale de Zarzio ne doit être < 0,2 MU/mL (2 μg/mL).
Pour les patients traités par le filgrastim dilué à des concentrations <1,5 MU/mL (15 µg/mL), il convient d'ajouter de l'albumine sérique humaine (SAH) afin d'obtenir une concentration finale de 2 mg/mL.
Exemple: pour un volume d'injection final de 20 mL, il faut ajouter aux doses de filgrastim inférieures à 30 MU (300 µg) 0,2 mL d'albumine sérique humaine Ph. Eur.à 200 mg/mL (20 %).
Le filgrastim peut être adsorbé sur du verre ou des plastiques à partir de la solution diluée.
Après dilution conformément à la réglementation dans une solution de glucose à 50 mg/mL (5 %), le filgrastim est compatible avec le verre et diverses matières plastiques, y compris le chlorure de polyvinyle, la polyoléfine (un copolymère de polypropylène et de polyéthylène) et le polypropylène.
Instructions pour pratiquer les injections
Cette rubrique présente les instructions permettant de vous administrer une injection de Zarzio. Zarzio est fourni avec une aiguille dispositif de sécurité.
Attention: ne pas utiliser si la seringue est tombée sur une surface dure ou si elle est tombée après le retrait du capuchon de l'aiguille.
1.Lavezvous les mains.
2.Sortez une seringue de l'emballage et retirez le capuchon protecteur de l'aiguille d'injection. Les seringues comportent des graduations qui permettent, si nécessaire, une utilisation partielle du contenu. Chaque graduation correspond à un volume de 0,1 mL. Si vous ne devez utiliser qu'une partie du contenu d'une seringue, éliminez la solution dont vous n'avez pas besoin avant l'injection.
3.Nettoyez la peau au niveau du site d'injection à l'aide d'une compresse imbibée d'alcool.
4.Pincez la peau entre le pouce et l'index pour former un pli.
5.Insérez l'aiguille dans le pli de peau d'un mouvement sec et rapide.
Utilisation de la seringue préremplie munie d'un protège aiguille de sécurité
Le protège aiguille de sécurité de l'aiguille couvre l'aiguille après l'injection pour prévenir toute blessure. Le protège aiguille de sécurité n'affecte en rien le fonctionnement normal de la seringue.
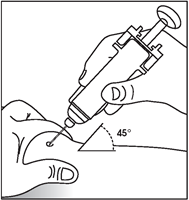
6.Tout en maintenant la peau pincée, appuyez doucement et régulièrement sur le piston jusqu'à ce que la dose entière ait été injectée et qu'il ne soit plus possible d'appuyer sur le piston. Ne relâchez pas la pression sur le piston!
7.Lorsque le liquide a été injecté, retirez l'aiguille tout en maintenant la pression sur le piston et relâchez la peau.
8.Relâchez le piston. Le protège aiguille de sécurité de l'aiguille se met rapidement en place pour couvrir l'aiguille.
9.Jetez tout produit inutilisé ou déchet. N'utilisez chaque seringue que pour une seule injection.
Numéro d’autorisation60579 (Swissmedic)
PrésentationZarzio 30 MU/0,5 ml: 5 seringues préremplie. [A]
Zarzio 48 MU/0,5 ml: 5 seringues préremplie. [A]
Titulaire de l’autorisationSandoz Pharmaceuticals SA, Risch; domicile: Rotkreuz
Mise à jour de l’informationJanvier 2024
|

