CompositionPrincipes actifs
Graminées
·Alutard SQ Mélange de 6 graminées et seigle :
extrait allergénique de pollen : fleurs de graminées (Avena elatior, Dactylis glomerata, Festuca pratensis, Phleum pratense, Poa pratensis, Lolium perenne) et seigle
·Alutard SQ Phleum pratense : extrait allergénique de pollen (Phleum pratense)
Arbres
·Alutard SQ Betula verrucosa : extrait allergénique de pollen (Betula verrucosa)
Excipients
Aluminium ut Aluminii hydroxidum hydricum ad adsorptionem, Natrii chloridum, Natrii hydrogenocarbonas, Natrii hydroxidum q.s., Phenolum 5,0 mg, Aqua ad iniectabilia q.s. ad suspensionem pro 1 ml corresp. Natrium 2,18-2,64 mg.
Indications/Possibilités d’emploiAlutard SQ est une immunothérapie spécifique pour le traitement de la rhinite allergique et la conjonctivite allergique causées par le pollen de graminées, de céréales ou d’arbres. Le diagnostic est établi avec un prick-test positif et/ou un test IgE spécifique positif pour les allergènes pertinents du pollen correspondant.
Posologie/Mode d’emploiLe traitement est composé d’un traitement initial et d’un traitement d’entretien. L’évaluation et la pose de l’indication doivent être effectuées par un médecin formé en allergologie. Le médecin doit maîtriser les mesures usuelles de réanimation.
Après chaque injection, surveillez le patient pendant au moins 30 minutes, et les patients très sensibles pendant au moins 60 minutes durant le traitement initial.
Il faut toujours garder à portée de main des médicaments d’urgence pour le traitement d’un choc anaphylactique.
La dose d’Alutard SQ doit être adaptée individuellement. La posologie est à déterminer en fonction de l’état général, des antécédents allergiques et de la sensibilité du patient à l’allergène employé.
Le patient doit être pris en compte lors de l’augmentation posologique (voir également la section « Ajustement de la posologie du fait d’effets indésirables/d’interactions »). L’injection est administrée par voie sous-cutanée en profondeur dans le bras, une largeur de main au-dessus de l’olécrâne.
En raison du risque de choc anaphylactique, il faut absolument éviter les injections intracutanées, intramusculaires ou intravasales. Contrôler par aspiration !
Pour éviter une injection intravasale, il faut aspirer attentivement avant l’injection et de même pendant l’injection, chaque fois après l’administration de 0,2 ml de solution. L’injection doit être administrée lentement, injecter 1 ml pendant 1 minute par exemple.
Directives posologiques
La posologie doit être adaptée aux réactions individuelles du patient et ne peut être augmentée qu’en cas de parfaite tolérance à l’injection précédente. Autrement et en cas d’interruption du traitement (p. ex. pour cause d’infection, de vaccination, de vacances), la dose doit être réduite (voir rubriques « Ajustement de la posologie du fait d’effets indésirables/d’interactions » et « Prise retardée »).
Les injections sont généralement administrées à des intervalles de 7 à 14 jours durant la phase de titration avec augmentation posologique à 16 paliers et à 11 paliers. Pour éviter le risque de cumulation, un intervalle de moins de 7 jours ne doit pas être dépassé.
Chez les adultes et les adolescents, la sécurité d’un troisième schéma avec augmentation posologique à 7 paliers et intervalle posologique de 7 jours a également été étudiée (de plus amples informations sur le profil de sécurité de ce schéma posologique sont disponibles dans la section « Effets indésirables »).
Durant le traitement d’entretien, les injections sont pratiquées à intervalles de 4 à 8 semaines.
L’objectif est d’augmenter progressivement la dose jusqu’à ce que la dose maximale tolérée soit atteinte, sans toutefois dépasser 100 000 SQ-U (1 ml du flacon 4). Les recommandations posologiques suivantes sont à considérer comme des recommandations générales.
Instauration du traitement
Traitement initial
Instauration habituelle du traitement
Le traitement ne doit être instauré qu’après la saison des pollens responsables de l’allergie. Si possible, le traitement initial doit être terminé avant le vol pollinique, soit :
·Arbres : juin–septembre
·Graminées : octobre–décembre
Augmentation posologique à 16 paliers
|
Flacon n°
|
Concentration
|
Injection n°
|
SQ-U
|
ml
| |
1
|
100 SQ-U/ml
100 SQ-U/ml
100 SQ-U/ml
|
1
2
3
|
20
40
80
|
0,2
0,4
0,8
| |
2
|
1 000 SQ-U/ml
1 000 SQ-U/ml
1 000 SQ-U/ml
|
4
5
6
|
200
400
800
|
0,2
0,4
0,8
| |
3
|
10 000 SQ-U/ml
10 000 SQ-U/ml
10 000 SQ-U/ml
10 000 SQ-U/ml
10 000 SQ-U/ml
|
7
8
9
10
11
|
2 000
4 000
6 000
8 000
10 000
|
0,2
0,4
0,6
0,8
1,0
| |
4
|
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
|
12
13
14
15
16
|
20 000
40 000
60 000
80 000
100 000
|
0,2
0,4
0,6
0,8
1,0
|
Augmentation posologique à 11 paliers
|
Flacon n°
|
Concentration
|
Injection n°
|
SQ-U
|
ml
| |
2
|
1 000 SQ-U/ml
1 000 SQ-U/ml
|
1
2
|
100
300
|
0,1
0,3
| |
3
|
10 000 SQ-U/ml
10 000 SQ-U/ml
10 000 SQ-U/ml
|
3
4
5
|
1 000
3 000
6 000
|
0,1
0,3
0,6
| |
4
|
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
|
6
7
8
9
10
11
|
10 000
20 000
40 000
60 000
80 000
100 000
|
0,1
0,2
0,4
0,6
0,8
1,0
|
Traitement d’entretien
Afin d’obtenir un effet optimal, le traitement d’entretien est poursuivi avec la dose bien tolérée la plus forte, c’est-à-dire celle à laquelle aucun effet indésirable significatif n’est survenu, sans toutefois dépasser 100 000 SQ-U. La dose d’entretien optimale est individuelle et dépend de la sensibilité du patient à l’allergène employé.
Les injections sont administrées à intervalles de 4 à 8 semaines. Une fois la dose d’entretien atteinte, il est conseillé d’allonger progressivement l’intervalle d’injection de 2 semaines pour atteindre un intervalle de 4 à 8 semaines.
Si le patient présente des réactions allergiques graves pendant le traitement d’entretien, il faut ajuster la dose (voir paragraphe « Ajustement de la posologie du fait d’effets indésirables/d’interactions »).
Adaptations de la dose durant le traitement d’entretien
Selon le type d’allergène, différentes méthodes de traitement peuvent être utilisées :
1. Traitement perannuel avec réduction de la dose d’entretien durant la saison : Pour toutes les espèces de pollen. Après obtention de la dose d’entretien, celle-ci est réduite à 1/5 durant la saison puis, après celle-ci, la dose est reportée au niveau d’entretien selon le schéma posologique (voir traitement initial).
2. Traitement présaisonnier : Pour toutes les espèces de pollen, le traitement étant interrompu durant la saison. Après la saison, le traitement est recommencé depuis le début et augmenté selon le schéma posologique (voir traitement initial) à la dose d’entretien atteinte jusqu’à présent.
Changement de flacon à la suite d’un réapprovisionnement
Lors d’un changement de flacon à la suite d’un réapprovisionnement pour le traitement d’entretien, seulement 2/3 de la dose atteinte jusque-là doivent être injectés et si la tolérance est bonne, le reste est injecté 15 minutes plus tard, ceci afin de prévenir une éventuelle diminution de la puissance de l’extrait lors du stockage. En général, une réduction de la dose n’est pas requise avec les allergènes SQ.
Traitement concomitant par 2 solutions d’hyposensibilisation différentes
Le risque éventuel de réactions allergiques en cas d’instauration de plusieurs traitements concomitants par plusieurs allergènes doit être évalué individuellement.
En cas de traitement concomitant par plusieurs solutions d’allergènes spécifiques, il convient d’administrer chaque solution sur un site d’injection différent et de respecter un intervalle d’au moins 30 minutes entre 2 injections afin de pouvoir interpréter correctement les réactions locales.
Durée du traitement
Le traitement par des préparations Alutard SQ doit être suivi sur au moins 3 ans.
Ajustement de la posologie du fait d’effets indésirables / d’interactions
Pendant le traitement initial ou le traitement d’entretien, si une réaction au site d’injection persiste pendant plus de 6 heures après l’injection, la dose suivante doit être réduite en fonction de la taille du gonflement et conformément aux recommandations du tableau « Réduction posologique en cas de papule au site d’injection ».
Réduction posologique en cas de papule au site d’injection
|
Diamètre maximal de la papule
|
Dose suivante
| |
Enfants
|
Adultes
| |
<5 cm
|
<8 cm
|
Traitement initial :
Augmenter la dose selon le schéma posologique
Traitement d’entretien :
Répétition de la dernière dose administrée
| |
5-7 cm
|
8-12 cm
|
Répétition de la dernière dose administrée
| |
7-12 cm
|
12-20 cm
|
Réduction de la dose d’un palier dans le schéma posologique
| |
12-17 cm
|
>20 cm
|
Réduction de la dose de 2 paliers dans le schéma posologique
| |
>17 cm
|
|
Réduction de la dose de 3 paliers dans le schéma posologique
|
Si une réaction systémique grave survient après une injection pendant le traitement initial ou pendant le traitement d’entretien, il convient de poursuivre le traitement uniquement après une évaluation minutieuse. Si le traitement est poursuivi, la dose suivante doit être réduite à 10 % de la dose ayant provoqué la réaction. Cette dose réduite peut être divisée en 2 doses unitaires qui sont à administrer à 30 minutes d’intervalle. Il faut de placer le patient sous surveillance après l’injection. La dose doit être augmentée conformément aux recommandations posologiques pour le traitement initial jusqu’à ce que la dose maximale tolérée soit atteinte.
Prise retardée
Pendant le traitement initial
Si exceptionnellement un intervalle d’injection de 14 jours est dépassé, la dose ne doit pas être augmentée et doit être adaptée comme suit.
Réduction de la dose après interruption du traitement
|
Intervalle
|
Réduction de la dose recommandée
| |
<2 semaines
|
Augmenter la dose selon le schéma posologique
| |
2-3 semaines
|
Répétition de la dernière dose administrée
| |
3-4 semaines
|
Réduction à 50 % de la dernière dose administrée
| |
>4 semaines
|
Réinitiation du traitement
|
Pendant le traitement d’entretien
Réduction de la dose après dépassement de l’intervalle de temps entre deux injections pendant le traitement d’entretien
|
Intervalle
|
Réduction de la dose recommandée
| |
<8 semaines
|
Aucune modification
| |
8-10 semaines
|
Réduction à 75 % de la dernière dose administrée
| |
10-12 semaines
|
Réduction à 50 % de la dernière dose administrée
| |
12-14 semaines
|
Réduction à 25 % de la dernière dose administrée
| |
14-16 semaines
|
Réduction à 10 % de la dernière dose administrée
| |
>16 semaines
|
Réinitiation du traitement
|
En cas de réduction de la dose pendant le traitement d’entretien, il faut placer le patient sous surveillance étroite après l’injection. La dose est ensuite augmentée conformément aux recommandations posologiques pour le traitement initial jusqu’à ce que la dose d’entretien soit atteinte.
Enfants et adolescents
En principe, le traitement d’immunothérapie allergénique ne convient pas aux enfants de moins de 5 ans, car les problèmes d’acceptation et de coopération sont plus probables dans cette tranche d’âge que chez les adultes.
Les données cliniques sur l’efficacité du produit chez les enfants de plus de 5 ans ne sont disponibles qu’en nombre limité, l’efficacité n’est pas démontrée. Les données sur l’innocuité n’indiquent pas de risque plus important que chez l’adulte.
Contre-indications·Hypersensibilité à l’un des excipients selon la composition.
·Les patients atteints de maladies auto-immunes systémiques actives et les patients présentant des défauts ou des déficiences immunitaires.
·Affections inflammatoires chroniques sévères.
·Les patients atteints de tumeurs malignes ayant valeur de maladie actuelle.
·Altérations secondaires irréversibles au niveau de l’organe atteint (p. ex. emphysème, bronchectasies).
·Insuffisance rénale chronique sévère (exposition à l’aluminium).
·Patients dont l’asthme n’est pas contrôlé ou dont le VEMS est inférieur à 70 % de la valeur prédictive chez les adultes (après un traitement pharmacologique adéquat) et dont le VEMS est inférieur à 80 % de la valeur prédictive chez les enfants et les adolescents (après un traitement pharmacologique adéquat).
·Les patients qui ont eu une exacerbation sévère de l’asthme au cours des 3 derniers mois.
Mises en garde et précautions
|
Après chaque injection, surveiller le patient pendant au moins 30 minutes, puis le soumettre à une évaluation médicale.
Réactions allergiques systémiques sévères
En raison du risque de réactions anaphylactiques sévères, tous les équipements et médicaments destinés à la réanimation doivent être en permanence à disposition, notamment de l’adrénaline pour injection, et un personnel qualifié doit être prêt à intervenir.
Si des signes d’une réaction systémique tels que l’urticaire, l’angio-œdème ou l’asthme sévère surviennent, un traitement symptomatique doit être immédiatement mis en place.
|
Le traitement ne devrait être instauré que par des médecins sachant mettre en œuvre une immunothérapie spécifique.
Pendant le traitement par Alutard SQ, les patients sont exposés à des allergènes qui peuvent provoquer des réactions allergiques locales et/ou systémiques. L’adrénaline est le traitement de choix en cas de réactions allergiques systémiques sévères (en règle générale, à la dose minimale de 0,01 mg/kg en intramusculaire dans la cuisse).
Étant donné que l’adrénaline est recommandée pour le traitement des réactions secondaires allergiques, les mises en garde et précautions ainsi que les contre-indications de l’adrénaline doivent être respectées.
Traitement médicamenteux au long cours :
L’effet de l’adrénaline peut être renforcé chez les patients traités avec des antidépresseurs tricycliques, des inhibiteurs de la monoaminooxydase (MAO) et/ou des inhibiteurs de la catéchol-Ométhyletransferase (inhibiteurs de la COMT), ce qui peut avoir des conséquences potentiellement fatales. L’effet de l’adrénaline peut être réduit chez les patients traités par des bêta-bloquants. Pendant un traitement par des agents antihypertenseurs, l’effet vasodilatateur de l’histamine peut être renforcé, ce qui augmente les réactions anaphylactiques. Il convient d’examiner pour chaque patient si le traitement par inhibiteurs de l’ECA doit être interrompu avant l’injection, car il existe un risque théorique de vasodilatation due à l’inhibition du métabolisme de l’angiotensine, qui peut contrecarrer le traitement par l’adrénaline.
Traitement des effets indésirables (recommandations conformes à la directive de l’EAACI sur l’immunothérapie de 2006) :
|
Symptômes
|
Traitement de l’adulte
|
Traitement de l’enfant
| |
Réaction locale étendue (>12 cm au bout de 30 min.)
|
Antihistaminique oral ;
corticostéroïde topique ;
observation pendant au moins 60 min.
|
Antihistaminique oral ;
corticostéroïde topique ;
observation pendant au moins 60 min.
| |
Rhinite
|
Antihistaminique oral ;
observation pendant au moins 60 min. et répétition du débit expiratoire de pointe (DEP).
|
Antihistaminique oral ;
observation pendant au moins 60 min. et répétition du débit expiratoire de pointe (DEP).
| |
Urticaire légère
|
Antihistaminique oral ou parentéral ;
observation pendant au moins 60 min.
|
Antihistaminique oral ou parentéral ;
observation pendant au moins 60 min.
| |
Asthme
|
β-2-agoniste par inhalation ;
β-2-agoniste IV/SC ;
oxygène ;
corticostéroïde (prednisolone 50 mg ou méthylprednisolone 40 mg IV) ;
théophylline ;
envisager une hospitalisation.
|
β-2-agoniste par inhalation ;
β-2-agoniste IV/SC ;
oxygène ;
corticostéroïde (méthylprednisolone 2 mg/kg IV) ;
théophylline ;
envisager une hospitalisation.
| |
Réactions systémiques
|
Adrénaline (1 mg/ml) 0,3-0,5 mg en IM profonde.
|
Adrénaline (1 mg/ml) 0,005 mg/kg en IM profonde.
| |
Urticaire généralisée
Angio-œdème
|
Accès IV (0,9 % de solution saline) ;
contrôle de la tension artérielle et du pouls ;
antihistaminique IM ;
corticostéroïde (prednisolone 50 mg ou méthylprednisolone 40 mg IV) ;
envisager une hospitalisation.
|
Accès IV (0,9 % de solution saline) ;
contrôle de la tension artérielle et du pouls ;
antihistaminique IM ;
corticostéroïde (méthylprednisolone 2 mg/kg IV) ;
envisager une hospitalisation.
| |
Choc anaphylactique
|
Adrénaline (1 mg/ml) 0,5-0,8 mg en IM profonde ou (diluée à 0,1 mg/ml) 0,3-0,5 mg IV (lentement en doses fractionnées) peut être répétée après 10 à 20 min. ;
Accès IV (0,9 % de solution saline) ;
mettre le patient en décubitus dorsal ;
oxygène 5-10 l/min. ;
contrôle de la tension artérielle, du pouls et de la saturation en oxygène ;
antihistaminique IV ;
méthylprednisolone 80 mg IV ;
hospitalisation nécessaire en raison du risque de choc retardé.
|
Adrénaline (1 mg/ml) 0,01 mg/kg (équivaut à 0,01 ml/kg) en IM profonde ou si nécessaire (diluée à 0,1 mg/ml) IV (lentement en doses fractionnées) ;
Accès IV (0,9 % de solution saline) ;
mettre le patient en décubitus dorsal ;
oxygène ;
contrôle de la tension artérielle, du pouls et de la saturation en oxygène ;
antihistaminique IM ;
corticostéroïde (méthylprednisolone 2 mg/kg IV) ;
hospitalisation nécessaire en raison du risque de choc retardé.
|
Les patients présentant une cardiopathie peuvent éventuellement être exposés à un risque accru lors de réactions allergiques systémiques sévères. L’expérience clinique concernant l’utilisation d’Alutard SQ chez les patients atteints d’affections cardiaques est limitée. Cet élément doit être pris en compte avant de démarrer un traitement spécifique d’immunothérapie allergénique.
Asthme
L’on sait que l’asthme est un facteur de risque prédisposant à des réactions allergiques systémiques sévères.
L’expérience clinique concernant l’utilisation d’Alutard SQ chez les patients asthmatiques est limitée.
Chez les patients ayant des antécédents d’asthme, les symptômes d’asthme doivent avoir été adéquatement contrôlés dans les 3 mois précédant le début du traitement par Alutard SQ.
L’état du patient asthmatique doit être vérifié avant chaque injection. L’injection d’allergènes thérapeutiques doit être reportée si l’asthme du patient n’a pas été entièrement contrôlé au cours de la dernière semaine précédant l’injection prévue.
Les patients ayant des antécédents d’asthme doivent être informés de la nécessité de consulter immédiatement un médecin si leur asthme s’aggrave soudainement.
Les patients ayant des antécédents médicaux d’asthme et d’infection respiratoire aiguë doivent reporter le début du traitement par Alutard SQ jusqu’à la résolution de l’infection.
Maladies auto-immunes en rémission
Les données concernant le traitement d’immunothérapie allergénique chez les patients présentant une maladie auto-immune en rémission sont limitées. Alutard SQ doit donc être prescrit avec prudence chez ce type de patients.
Exposition à l’aluminium
Alutard SQ contient de l’aluminium. Il existe donc un risque théorique d’accumulation d’aluminium chez les patients à haut risque (p. ex. les patients dont la fonction rénale est altérée et les patients traités en concomitance avec des préparations à base d’aluminium, telles que des antiacides). Il faut en tenir compte avant de commencer le traitement par Alutard SQ.
Enfants et adolescents
Les enfants de moins de 5 ans ne sont généralement pas considérés comme de bons candidats au traitement d’immunothérapie allergénique et ne doivent recevoir ce traitement que dans des cas exceptionnels et non de façon systématique. Une attention particulière doit être accordée à l’évaluation de la balance bénéfice-risque dans le traitement des enfants de moins de 5 ans. Il existe peu de données cliniques concernant l’efficacité chez les enfants de plus de 5 ans. Cependant, les données sur la sécurité n’indiquent pas de risque plus important que chez l’adulte. Le schéma d’augmentation posologique à 7 paliers n’a pas été étudié chez les enfants de moins de 12 ans.
Utilisation concomitante avec d’autres traitements spécifiques d’immunothérapie allergénique
Il n’existe pas de données cliniques concernant l’utilisation concomitante avec d’autres traitements d’immunothérapie allergénique.
Pendant le traitement :
L’injection doit être reportée si :
·le patient a de la fièvre ou présente des signes d’infection aiguë ou chronique.
·le patient a une fonction pulmonaire significativement réduite (VEMS < 70 % de la valeur prédictive du patient chez les adultes et VEMS < 80 % de la valeur prédictive du patient chez les enfants et les adolescents) ou présente des symptômes évocateurs d’une exacerbation de l’asthme.
·le patient présente une aggravation de la dermatite atopique.
·une vaccination a été administrée au cours de la semaine précédente ou sera administrée au cours de la semaine suivant l’injection d’Alutard SQ.
Avant l’injection :
·Le jour de l’injection, le patient doit éviter tout effort physique, les douches chaudes, les séances de sauna et la consommation d’alcool, car ces facteurs concomitants peuvent augmenter l’anaphylaxie.
·Le statut asthmatique des patients ayant des antécédents d’asthme doit être évalué avant chaque injection en mesurant le débit de pointe et la fonction pulmonaire (voir la section « Contre-indications »).
·L’état de santé du patient et ses allergies doivent également être évalués, ainsi que tout changement dans la prise d’autres médicaments depuis la dernière injection.
·Les réactions allergiques (locales et/ou systémiques) survenant après l’injection précédente doivent être notées et la dose doit être ajustée en conséquence (voir la section « Posologie/Mode d’emploi »).
·Avant chaque injection, l’allergène spécifié, la concentration, le volume et la date de la dernière injection (intervalle de dose) doivent être vérifiés deux fois.
·Alutard SQ doit être administré par voie sous-cutanée. L’administration intravasculaire doit être évitée en raison du risque accru de réactions allergiques (aspiration).
Après chaque injection :
·Le patient doit être informé qu’en cas de réaction systémique sévère tardive, il doit immédiatement consulter un médecin ou se rendre aux urgences.
·Le patient doit être informé qu’il doit surveiller l’apparition de toute réaction locale ou systémique retardée et en avertir le médecin traitant lors de la prochaine visite.
·Toute réaction allergique (locale et/ou systémique) doit être documentée avant que le patient ne quitte l’établissement.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par injection, c.-à-d. qu’il est essentiellement « sans sodium ».
InteractionsAucune étude sur les interactions humaines n’a été menée. On ne sait pas si un traitement par Alutard SQ interagit avec les vaccinations.
Un traitement symptomatique concomitant efficace par des antiallergiques, des corticostéroïdes ou des stabilisateurs des mastocytes peut augmenter le niveau de tolérance du patient à un traitement spécifique d’immunothérapie allergénique. Cet aspect doit être pris en considération lors de l’arrêt de ces médicaments.
Pour des informations sur l’utilisation concomitante des IMAO, des inhibiteurs de la COMT, des bêta-bloquants et des antiacides, voir la rubrique « Mises en garde et précautions ».
Grossesse, AllaitementGrossesse
Il n’existe pas de données suffisantes concernant l’emploi chez la femme enceinte. Il n’existe pas de données expérimentales animales suffisantes. Le risque potentiel pour l’être humain n’est pas connu.
Le médicament ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
Allaitement
Il n’existe pas de données cliniques sur l’emploi pendant l’allaitement. Alutard SQ ne doit être utilisé pendant l’allaitement qu’après une évaluation individuelle scrupuleuse de la balance bénéfice-risque.
Fertilité
On ne dispose pas de données cliniques concernant l’influence d’Alutard SQ sur la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesOccasionnellement, une légère fatigue peut survenir chez certains patients ; elle peut altérer l’aptitude à la conduite et la capacité à utiliser des machines.
Effets indésirablesRésumé du profil de sécurité
Les réactions associées aux traitements par Alutard SQ sont généralement causées par des réactions immunologiques (locales et/ou systémiques) à l’allergène en cause. Les symptômes d’une réaction précoce surviennent dans les 30 premières minutes suivant l’injection. Les symptômes d’une réaction tardive se manifestent normalement au cours des 24 heures suivant l’injection.
Les effets indésirables très fréquemment rapportés chez les patients traités par Alutard SQ sont des réactions locales au site d’injection.
Liste des effets indésirables
Les effets indésirables sont classés par fréquence selon la convention MedDRA : très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1 000, <1/100), rares (≥1/10 000, <1/1 000), très rares (<1/10 000). Les fréquences sont basées sur une étude clinique avec Alutard SQ Phleum pratense et une étude clinique avec Alutard SQ 6 mélange de graminées et de seigle, d’acariens de la poussière de maison et de bouleau, car le profil de sécurité général des préparations Alutard SQ est similaire.
|
Affections du système immunitaire
| |
Fréquent :
|
Réaction anaphylactique
| |
Occasionnel :
|
Choc anaphylactique
| |
|
| |
Affections oculaires
| |
Fréquents :
|
Conjonctivite
| |
Occasionnel :
|
Œdème des paupières
| |
| |
Affections vasculaires
| |
Fréquents :
|
Bouffée congestive
| |
|
| |
Affections de l’oreille et du labyrinthe
| |
Fréquent :
|
Prurit auriculaire, vertiges
| |
|
| |
Affections respiratoires, thoraciques et médiastinales
| |
Fréquents :
|
Sibilances, toux, dyspnée, asthme, congestion nasale, rhinite allergique, éternuements, irritation de la gorge, rhinorrhée, prurit nasal
| |
|
| |
Affections gastro-intestinales
| |
Fréquents :
|
Douleurs abdominales, diarrhée, vomissements, nausées, dyspepsie
| |
|
| |
Affections de la peau et du tissu sous-cutané
| |
Fréquents :
|
Urticaire, prurit, éruptions cutanées, érythème, eczéma
| |
Occasionnel :
|
Gonflement du visage
| |
|
| |
Troubles généraux et anomalies au site d’administration
| |
Très fréquents :
|
Réactions au site d’injection*
| |
Fréquents :
|
Malaises, fatigue, frissons, sensation de chaleur, sensation de corps étranger
|
* Les réactions au site d’injection incluent des événements tels que : prurit/ gonflement/ urticaire/ érythème/ nodules/ douleur/ ecchymoses/ hématome/ induration/ inflammation/ œdème/ éruption cutanée/ chaleur/décoloration/ papule au site d’injection, œdème localisé, douleur au site d’administration.
Les données d’une étude d’augmentation posologique à 7 paliers ont montré un risque légèrement accru de symptômes oculaires tels que le gonflement et le prurit oculaires, et de réactions cutanées telles que l’érythème, les éruptions cutanées et l’urticaire en cas d’augmentation posologique rapide (7 paliers vs 11 paliers).
Effets indésirables après commercialisation
Les données issues de l’expérience acquise après l’autorisation de mise sur le marché sont énumérées ci-dessous avec la fréquence « inconnue » (ne peut être estimée à partir des données disponibles).
|
Affections du système nerveux
| |
Inconnus :
|
Sensations vertigineuses, paresthésie
| |
|
| |
Affections cardiaques
| |
Inconnus :
|
Palpitations, tachycardie, cyanose
| |
|
| |
Affections vasculaires
| |
Inconnus :
|
Hypotension, pâleur
| |
|
| |
Affections respiratoires, thoraciques et médiastinales
| |
Inconnus :
|
Bronchospasme, sensation de gorge serrée
| |
|
| |
Affections de la peau et du tissu sous-cutané
| |
Inconnus :
|
Angio-œdème
| |
|
| |
Affections musculo-squelettiques et systémiques
| |
Inconnus :
|
Gonflement articulaire, arthralgie
| |
|
| |
Troubles généraux et anomalies au site d’administration
| |
Inconnus :
|
Gêne thoracique, hypertrichose au site d’injection
|
Description de certains effets indésirables
Réactions locales
Les réactions locales surviennent au site d’injection et comprennent gonflement au site d’injection, rougeurs, douleurs, prurit, décoloration et hématome. Les réactions locales peuvent être traitées par des médicaments symptomatiques tels que des antihistaminiques. La teneur en aluminium peut contribuer à l’apparition d’effets secondaires locaux, notamment un patchtest cutané positif pour l’aluminium.
Réactions allergiques systémiques
Les réactions systémiques comprennent tout symptôme affectant des organes éloignés du site d’injection.
Les réactions allergiques systémiques sont en général légères à modérées et peuvent être traitées par des médicaments symptomatiques tels que des antihistaminiques. Les réactions allergiques systémiques peuvent aller de la rhinite allergique au choc anaphylactique. Le traitement d’une réaction systémique sévère doit être démarré immédiatement.
Les symptômes peuvent comprendre, mais ne sont pas limités à une urticaire, un angio-œdème, un bronchospasme, une fatigue, un essoufflement, une oppression thoracique et une bouffée congestive. Les autres réactions immédiates peuvent être : rhinite, rhinorrhée, toux, éternuements, conjonctivite et asthme. Ces réactions peuvent également survenir tardivement. Autres réactions tardives : céphalées, prurit, malaise général.
Si ces réactions sont plus importantes et générales, le patient doit immédiatement informer son médecin ou à défaut son remplaçant. Dans tous les cas, le patient doit informer le médecin traitant avant l’injection suivante des réactions ultérieures survenues.
Réactions allergiques systémiques sévères
Une réaction allergique systémique sévère est une réaction potentiellement fatale qui survient généralement dans les minutes qui suivent l’exposition à l’allergène. Les symptômes qui indiquent une réaction allergique systémique sévère peuvent inclure, mais ne sont pas limités à, une sensation de chaleur, un malaise général, une hypotension, une tachycardie, une dyspnée, une toux, une sibilance, une bouffée congestive, une gêne thoracique, une douleur abdominale, un vomissement, une diarrhée, une éruption cutanée, un prurit et une urticaire.
Une réaction allergique systémique sévère telle que le choc anaphylactique se développe généralement rapidement, dans les minutes qui suivent l’injection, et nécessite un traitement rapide avec, par exemple, de l’adrénaline et/ou un autre traitement anaphylactique. Un traitement en accord avec les directives actuelles en matière de traitement de choc doit être instauré.
En cas de réactions locales étendues et de réactions systémiques, il faut évaluer le traitement (voir « Posologie/Mode d’emploi »).
Une dermatite atopique préexistante peut s’aggraver pendant le traitement.
Enfants et adolescents
Il existe peu de données cliniques concernant l’efficacité chez les enfants de plus de 5 ans. Cependant, les données sur la sécurité n’indiquent pas de risque plus important que chez l’adulte. Les enfants de moins de 5 ans ne sont généralement pas considérés comme de bons candidats au traitement d’immunothérapie allergénique. Une attention particulière doit être accordée à l’évaluation de la balance bénéfice-risque dans le traitement des enfants de moins de 5 ans.
Groupes de patients particuliers
Il n’existe pas de données provenant d’études cliniques concernant les effets secondaires chez d’autres groupes de patients.
Sécurité en cas d’augmentation posologique à paliers réduits
Pour les adultes et les adolescents, la sécurité d’un schéma d’augmentation posologique à paliers réduits à 7 injections a été étudiée. Les 7 injections ont été administrées à des intervalles de 7 ± 2 jours.
|
Flacon n°
|
Concentration
|
Injection n°
|
SQ-U
|
ml
| |
2
|
1 000 SQ-U/ml
|
1
|
300
|
0,3
| |
3
|
10 000 SQ-U/ml
10 000 SQ-U/ml
|
2
3
|
2 000
5 000
|
0,2
0,5
| |
4
|
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
100 000 SQ-U/ml
|
4
5
6
7
|
10 000
30 000
60 000
100 000
|
0,1
0,3
0,6
1,0
|
Aucun nouveau signal de sécurité n’a été observé avec ce schéma d’augmentation posologique à 7 paliers.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSi une dose supérieure à la dose prévue a été injectée, le risque d’effets secondaires augmente, y compris le risque de réaction allergique systémique ou de réactions allergiques locales sévères. Le patient doit être surveillé et ces réactions doivent être traitées par des médicaments symptomatiques appropriés.
Propriétés/EffetsCode ATC :
V01AA
Mécanisme d’action
Administré en doses croissantes selon les prescriptions posologiques, Alutard SQ provoque une insensibilité ou une sensibilité diminuée durable contre les allergènes spécifiques en cause.
Lors d’injection sous-cutanée, l’adsorption de l’hydroxyde d’aluminium entraîne une libération lente de l’extrait allergénique et, par conséquent, une hyposensibilisation bien supportée.
Pharmacodynamique
Le produit entraîne une hyposensibilisation des patients allergiques. Le mécanisme d’action exact est encore inexpliqué. L’effet pharmacodynamique cible le système immunitaire, l’objectif étant de retarder la réaction à l’allergène considéré, mais pas aux autres allergènes. Alutard SQ est indiqué pour le traitement de patients souffrant d’une allergie médiée par IgE. L’effet pharmacodynamique cible le système immunitaire en réduisant la réaction spécifique aux allergènes utilisés pour traiter le patient. Alutard SQ affecte et altère la migration des lymphocytes T et des granulocytes éosinophiles vers les organes cibles. Le rapport entre les cytokines Th2 et Th1 est modifié en faveur des cytokines Th1. Par ailleurs, le taux de synthèse de l’IL-10 qui provoque entre autres une anergie de lymphocytes T augmente. En raison du nombre réduit de granulocytes basophiles recirculants dans le sang périphérique, la libération de l’histamine est en outre réduite.
Efficacité clinique
Une étude en double aveugle, randomisée et contrôlée par placebo a montré une réduction à la fois des symptômes co-saisonniers et de la consommation de médicaments co-saisonniers lorsqu’ils sont traités par une augmentation posologique préalable à 15 paliers du traitement avec Alutard SQ pollen de graminées 100 000 SQ-U par rapport au placebo. Une étude clinique ouverte avec Alutard SQ graminées et Alutard SQ Betula verrucosa indique que Alutard SQ peut avoir un effet à long terme et peut prévenir la progression de la rhinite allergique vers l’asthme allergique chez les enfants (preuve clinique non établie). Un suivi de 7 ans indique également un effet possible à long terme avec Alutard SQ graminées (preuve clinique non établie).
PharmacocinétiqueAbsorption
Les allergènes contenus principalement dans Alutard SQ sont les polypeptides et les protéines. On estime qu’elles se décomposent en polypeptides et acides aminés courts. On suppose que les allergènes d’Alutard SQ ne sont pas absorbés en quantité significative dans le système vasculaire. Ni des études pharmacocinétiques sur l’animal ni des études cliniques n’ont été menées pour déterminer le profil pharmacocinétique et le métabolisme de Alutard SQ.
L’adsorption de l’allergène avec l’hydroxyde d’aluminium peut entraîner une libération lente au site d’injection. En cas d’injection sous-cutanée, l’allergène est libéré lentement, ce qui réduit son allergénicité et peut prolonger la stimulation du système immunitaire.
Distribution
Aucune donnée disponible.
Métabolisme
Aucune donnée disponible.
Élimination
Aucune donnée disponible.
Données précliniquesLes données précliniques sont limitées. Les études conventionnelles sur la sécurité, la toxicité en administration répétée chez les rongeurs, la toxicité pour la reproduction (développement embryo-fœtal) n’ont pas révélé de risque particulier pour l’homme. Les études ont été menées avec le principe actif sans formulation, c’est-à-dire l’extrait d’allergène sans adjuvant ni excipients. Aucune interaction des excipients avec les principes actifs n’est attendue. Aucune étude de carcinogénicité n’a été réalisée.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention « EXP » sur le récipient.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C). Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Ne pas utiliser les solutions qui ont été congelées puis décongelées ni celles contenant des particules (précipités floconneux grossiers irréversibles) !
Remarques concernant la manipulation
Un précipité et un liquide clair peuvent être constatés pendant le stockage. Il ne s’agit pas d’un signe d’altération. Le précipité peut être blanc à brun pâle ou vert.
Avant l’utilisation, retourner lentement le flacon 10-20 fois pour obtenir une suspension homogène.
Inspecter visuellement la suspension avant l’utilisation pour s’assurer de l’absence de particules. Jeter le produit s’il contient des particules.
Ne pas injecter par voie intravasculaire ! Aspirer.
Voir les remarques concernant la manipulation des flacons et réalisation de l’injection à la fin de l’information professionnelle.
Numéro d’autorisation60702, 60708, 60711 (Swissmedic).
PrésentationAlutard SQ, traitement initial :
N° 1, n° 2, n° 3, n° 4 4 x 5 ml [A]
Alutard SQ, traitement d’entretien :
N° 4 1 x 5 ml [A]
Titulaire de l’autorisationALK-Abelló AG, 8304 Wallisellen.
Mise à jour de l’informationAoût 2024
Remarques concernant la manipulation des flacons et réalisation de l’injection
|
Avant l’injection, toujours observer les rubriques « Posologie/Mode d’emploi » et « Mises en garde et précautions ».
| |
1
|
|

|
Prendre le flacon de l’emballage. L’allergène spécifié, la concentration, le volume et la date de la dernière injection (intervalle de dose) doivent être vérifiés deux fois avant chaque injection.
Contrôler :
·Données du patient
·Composition d’allergènes
·Concentration (dosage)
·Date de péremption
| |
2
|
|

|
Le flacon doit être lentement retourné 10-20 fois avant l’utilisation pour obtenir une suspension homogène.
Vérifier visuellement l’absence de particules dans la suspension avant de l’utiliser. Ne pas utiliser de solutions qui ont été congelées puis décongelées ni celles contenant des particules (précipités floconneux grossiers irréversibles) ! Jeter le produit si des particules sont présentes.
| |
3
|
|
|
Désinfecter et percer le bouchon de caoutchouc avec une seringue stérile de 1 ml à usage unique.
Questions au patient/à la patiente :
·État général
·Prise de médicaments
·Symptomatologie allergique actuelle
·Tolérance de l’injection précédente
| |
4
|
|
|
Injection bien tolérée :
Augmentation ou poursuite de la dose conformément aux directives posologiques.
Injection mal tolérée ou autres limitations :
Réduction de la dose conformément aux directives posologiques.
| |
5
|
|
|
Prélever le volume requis.
Ajustage exact de la dose à injecter (éviter les bulles d’air).
| |
6
|
|
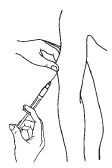
|
Purification et désinfection du site d’injection et après :
·Soulever un pli de peau à une largeur de main au-dessus de l’olécrâne.
·Éviter l’injection intravasculaire. Aspirer !
·Injecter lentement par voie sous-cutanée
| |
7
|
Surveillance du patient jusqu’à 30 minutes après l’injection !
Donner éventuellement des médicaments pour le traitement des réactions tardives (p.ex. antihistaminiques).
|
|






