Posologie/Mode d’emploiPosologie usuelle
La dose et le schéma posologique dépendent de l'indication.
Le traitement doit être initié et surveillé par un professionnel de santé expérimenté dans le traitement des déficits immunitaires ou de la PIDC par des IgG.
Pour assurer la traçabilité des médicaments biologiques, il est recommandé de documenter le nom commercial et le numéro de lot à chaque traitement.
Traitement de substitution chez l'adulte et l'enfant
La dose peut être adaptée individuellement à chaque patient en fonction de l'évolution clinique et des taux sériques résiduels d'IgG. Les posologies suivantes sont données à titre indicatif:
La thérapie de substitution par Hizentra administré par voie sous-cutanée a pour but de maintenir un taux constant d'IgG. La dose initiale est d'au moins 0,2-0,5 g/kg (1,0-2,5 ml/kg) de poids corporel. Elle peut être répartie sur plusieurs jours. La dose mensuelle pour le maintien d'un taux d'IgG stable, est de l'ordre de 0,4-0,8 g/kg (2,0-4,0 ml/kg) de poids corporel et elle est fractionnée en plus petites doses qui sont administrées à intervalles répétés (voir le chapitre «Pharmacocinétique»).
Pour les patients passant d'une administration intraveineuse à une administration sous-cutanée, la dose administrée auparavant de façon mensuelle est fractionnée en plus petites doses qui sont administrées à intervalles répétés (voir le chapitre «Pharmacocinétique»).
Les taux résiduels doivent être mesurés et évalués en tenant compte de l'évolution clinique de la maladie chez le patient. Selon l'évolution clinique (par ex. le taux d'infection), un ajustement des doses et/ou de l'intervalle entre les doses peut être envisagé pour atteindre des taux résiduels plus élevés.
Traitement immunomodulateur dans la PIDC
Le traitement par Hizentra est instauré 1 semaine après la dernière perfusion d'IgIV. La dose sous-cutanée initiale recommandée est de 0,4 g/kg de poids corporel par semaine.
Quand un patient est cliniquement stable, la dose hebdomadaire d'Hizentra peut être réduite à un minimum de 0,2 g/kg de poids corporel. En cas de rechute, après réduction de la dose à 0,2 g/kg de poids corporel par semaine, il convient de revenir à une dose sous-cutanée plus élevée de 0,4 g/kg de poids corporel par semaine. Si le patient ne répond pas ou si une rechute survient aux doses plus élevées, il convient de passer aux IgIV à une dose de saturation initiale. En cas de traitement de rattrapage avec des IgIV, un retour au traitement par IgSC ne peut pas être conseillé.
La dose hebdomadaire peut être fractionnée en doses plus petites et administrée à la fréquence souhaitée. Pour une perfusion toutes les deux semaines, doubler la dose d'Hizentra.
L'efficacité d'Hizentra par rapport au placebo a été démontrée dans des études cliniques après un changement d'immunoglobulines intraveineuses. On ne dispose pas de données comparatives directes sur Hizentra par rapport aux IgIV.
Patients âgés
La dose étant administrée en fonction du poids corporel et ajustée en fonction de la réponse clinique, on ne s'attend pas à ce que la dose pour les sujets âgés soit différente de celle chez les personnes âgées de 18 à 65 ans.
Hizentra a fait l'objet d'études cliniques chez 13 patients atteints de DIP âgés de plus de 65 ans. Aucun ajustement de dose spécifique n'a été nécessaire pour atteindre les taux sériques d'IgG souhaités.
Hizentra a été étudié dans le cadre d'essais cliniques chez 61 patients atteints de PIDC âgés de plus de 65 ans. Aucun ajustement de dose spécifique n'a été nécessaire pour obtenir les résultats cliniques souhaités.
Enfants et adolescents
La posologie est calculée, comme chez l'adulte, en fonction du poids corporel et est ajustée selon l'évolution clinique de la maladie lors du traitement de substitution. Hizentra a été évalué chez 68 enfants âgés de 2 à 12 ans et 57 adolescents âgés de 12 à <18 ans atteints de DIP. Aucun ajustement de la dose relatif à la population pédiatrique n'a été nécessaire pour atteindre les taux sériques d'IgG souhaités.
À ce jour, Hizentra n'a pas été évalué dans des études cliniques chez des patients pédiatriques atteints de PIDC.
Mode d'administration
Hizentra doit être administré uniquement par voie sous-cutanée.
Hizentra peut être perfusé dans des sites tels que la paroi abdominale, la cuisse, le bras, et la face latérale de la hanche (voir Figure 1). Si des quantités importantes (>50 ml) doivent être administrées, il est conseillé de répartir les injections sur plusieurs sites. Chez les nourrissons et les enfants, le site d'injection doit être changé tous les 5-15 ml. Il n'y a pas de nombre limité de sites d'injection. Les sites d'injection doivent être espacés au minimum de 5 cm. Plusieurs' dispositifs de perfusion peuvent être utilisés simultanément. La quantité de produit injecté dans un site particulier peut varier. Il faut changer de site de perfusion en cas d'administrations successives.
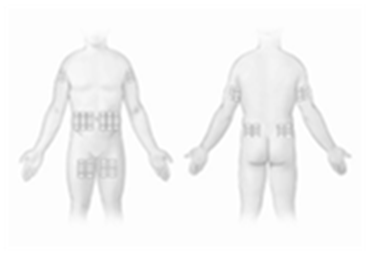
Figure 1: Sites de perfusion possibles pour Hizentra
L'autotraitement à domicile doit être initié et accompagné au début par un professionnel de la santé. Le professionnel de la santé doit avoir l'expérience de la prise en charge de patients autotraités à domicile. Le patient ou le soignant doivent être formés et entraînés à l'utilisation des appareils de perfusion, aux techniques de perfusion, à la tenue du carnet de traitement, à la reconnaissance des effets indésirables graves et aux mesures à prendre en cas de survenue de ces derniers.
Débit de perfusion
Hizentra peut être perfusé:
·avec un appareil de perfusion (par ex. une pompe de perfusion)
·en perfusion manuelle avec une seringue.
Le débit de perfusion recommandé varie en fonction des besoins individuels de chaque patient.
Perfusion avec un appareil de perfusion:
Traitement de substitution
Le débit de perfusion initial recommandé ne doit pas dépasser 20 ml/heure/site. S'il est bien toléré, le débit de perfusion peut ensuite être augmenté progressivement jusqu'à 100 ml/heure/site.
Polyradiculonévrite inflammatoire démyélinisante chronique (PIDC)
Le débit de perfusion initial recommandé ne doit pas dépasser 20 ml/heure par site de perfusion. S'il est bien toléré, le débit de perfusion peut être progressivement augmenté jusqu'à 50 ml/heure/site de perfusion.
Pour l'administration toutes les deux semaines, le volume nécessaire d'Hizentra peut être administré au besoin en 4 séances maximum, p.ex. une fois le matin et une fois le soir et répété le lendemain ou au cours de la deuxième semaine.
Perfusion manuelle
Le débit de perfusion initial recommandé ne doit pas dépasser 0,5 ml/min par site de perfusion (30 ml/heure par site de perfusion).
S'il est bien toléré, le débit de perfusion peut être progressivement augmenté jusqu'à 2,0 ml/min/site de perfusion (120 ml/heure par site de perfusion) en fonction de l'évaluation par le personnel médical et de la tolérance individuelle du patient.
Il est recommandé d'utiliser des aiguilles d'injection de calibre 24 ou plus (donc avec une gauge plus petite) afin que les patients puissent perfuser manuellement avec un débit plus élevé. L'utilisation d'aiguilles d'injection plus petites (donc avec une gauge plus importante) peut rendre difficile la perfusion d'Hizentra.
On ne peut perfuser manuellement avec une seringue qu'à un seul site de perfusion.
Lorsqu'il est nécessaire d'administrer manuellement un volume supérieur à 20 ml, il est recommandé, en fonction de la dose individuelle à administrer, de perfuser la dose à plusieurs sites. Dans ce cas, une seringue d'Hizentra supplémentaire est nécessaire pour chaque site de perfusion. Si le volume est perfusé à plusieurs sites, il faut utiliser à chaque fois une nouvelle aiguille d'injection stérile pour chaque seringue de perfusion.
Les kits d'administration avec plusieurs aiguilles de perfusion/cathéters ou les systèmes d'administration en Y ne doivent pas être utilisés.
| 