CompositionPrincipes actifs
Fentanyl sous forme de citrate de fentanyl.
Excipients
Mannitol, bicarbonate de sodium, acide citrique, carbonate de sodium, carboxyméthylamidon sodique (type A), stéarate de magnésium.
Un comprimé buccal à 100 µg contient 10,2 mg de sodium. Un comprimé buccal à 200 µg, 400 µg 600 µg, 800 µg contient 20,4 mg de sodium.
Indications/Possibilités d’emploiEffentora est indiqué pour le traitement des accès douloureux paroxystiques chez des patients adultes ayant un cancer et recevant déjà un traitement opioïde de fond contre leurs douleurs chroniques d'origine cancéreuse.
Un accès douloureux paroxystique est une exacerbation passagère d'une douleur chronique par ailleurs contrôlée par un traitement de fond.
Les patients sous traitement opioïde de fond sont ceux prenant au moins 60 mg de morphine par voie orale par jour, au moins 25 microgrammes de fentanyl transdermique par heure, au moins 30 mg d'oxycodone par jour, au moins 8 mg d'hydromorphone par voie orale par jour ou une dose équianalgésique d'un autre opioïde pendant une durée d'au moins une semaine
Posologie/Mode d’emploiLe traitement doit être instauré et suivi par un médecin expérimenté dans le traitement opioïde chez les patients atteints de cancer. Le médecin doit avoir conscience du risque potentiel d'utilisation abusive du fentanyl. Les patients traités pour des accès douloureux paroxystiques doivent être informés de ne pas utiliser simultanément deux formulations différentes de fentanyl et d'éliminer tout autre produit contenant du fentanyl prescrit auparavant pour les accès douloureux paroxystiques, lors du passage à Effentora. Le nombre de dosages différents, mis à disposition du patient au même moment, doit être réduit au minimum pour éviter les erreurs et un éventuel surdosage.
Objectifs et interruption du traitement
Avant de commencer le traitement par Effentora, il est souhaitable de convenir avec le patient, conformément aux directives relatives au traitement de la douleur, d'une stratégie de traitement qui tient compte de la durée et des objectifs du traitement.
Pendant le traitement, un contact régulier doit être maintenu entre le médecin et le patient afin d'évaluer la nécessité de poursuivre le traitement, d'envisager l'arrêt du médicament et d'adapter la posologie, si nécessaire. Effentora doit être arrêté immédiatement si le patient ne présente plus d'accès douloureux paroxystiques (voir «Arrêt du traitement»).
Titration des doses
Effentora doit être titré individuellement pour chaque patient afin d'obtenir la dose efficace, c'est-à-dire la dose produisant une analgésie suffisante avec le minimum d'effets indésirables. Lors des études cliniques, il n'a pas été possible de prédire la dose efficace d'Effentora pour le traitement des accès douloureux paroxystiques, à l'aide de la dose quotidienne du traitement opioïde de fond.
Les patients doivent être surveillés étroitement jusqu'à l'obtention d'une dose efficace.
Titration chez des patients ne prenant pas déjà d'autres médicaments contenant du fentanyl
La dose initiale d'Effentora doit être de 100 microgrammes. Celle-ci peut être augmentée, si nécessaire, conformément à la gamme de dosages disponibles (100, 200, 400, 600, et 800 microgrammes).
Titration chez des patients passant d'un autre médicament contenant du fentanyl à Effentora
Compte tenu du fait que ces produits possèdent des profils d'absorption différents, la substitution ne doit pas se faire selon un rapport de 1:1. Chez les patients passant d'une autre forme orale de citrate de fentanyl à Effentora, la titration de la dose d'Effentora doit être réalisée indépendamment de la dose utilisée précédemment, étant donné que la biodisponibilité entre les produits diffère significativement et que lors d'une substitution basée sur des milligrammes, un surdosage fatal peut en résulter.
Il n'existe pas d'instruction sûre pour convertir la posologie des produits contenant du fentanyl utilisés jusque-là. Néanmoins, chez ces patients, une dose initiale supérieure à 100 microgrammes peut être envisagée.
Méthode de titration
Durant la titration, si une analgésie satisfaisante n'est pas obtenue dans les 30 minutes suivant l'administration d'un seul comprimé, un deuxième comprimé d'Effentora du même dosage peut être utilisé. Il faut attendre au moins 4 heures avant la prise d'une nouvelle dose.
Si le traitement d'un accès douloureux paroxystique requiert plus d'un comprimé, il convient d'envisager de passer au dosage immédiatement supérieur pour le traitement de l'accès douloureux paroxystique suivant.
Plusieurs comprimés peuvent être utilisés lors de la phase de titration de la dose: jusqu'à quatre comprimés à 100 microgrammes ou jusqu'à quatre comprimés à 200 microgrammes peuvent être utilisés pour traiter un seul accès douloureux paroxystique selon le schéma suivant:
·Si la prise initiale d'un comprimé à 100 microgrammes n'est pas efficace, il faut informer le patient qu'il doit traiter le prochain accès douloureux paroxystique avec deux comprimés à 100 microgrammes. Il est recommandé de placer un comprimé de chaque côté de la bouche. Si cette dose est considérée comme suffisamment efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec un seul comprimé à 200 microgrammes d'Effentora.
·Si l'utilisation d'un seul comprimé à 200 microgrammes d'Effentora (ou de deux comprimés à 100 microgrammes) n'est pas considérée comme suffisamment efficace, il faut indiquer au patient d'utiliser deux comprimés à 200 microgrammes (ou quatre comprimés à 100 microgrammes) pour traiter l'accès douloureux paroxystique suivant. Il est recommandé de placer la moitié des comprimés du côté gauche de la bouche et l'autre moitié du côté droit. Si cette dose est considérée comme suffisamment efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec un seul comprimé à 400 microgrammes d'Effentora.
·Il convient d'utiliser des comprimés à 200 microgrammes pour une augmentation posologique à 600 microgrammes ou à 800 microgrammes.
Des doses supérieures à 800 microgrammes n'ont pas été évaluées lors des études cliniques.
Il ne faut pas utiliser plus de deux comprimés pour traiter un même accès douloureux paroxystique, sauf lors de l'adaptation posologique décrite ci-dessus, utilisant jusqu'à quatre comprimés.
Lors de la titration, les patients doivent attendre au moins 4 heures avant de traiter un nouvel accès douloureux paroxystique par Effentora.
Traitement d'entretien
Une fois que la dose efficace individuelle a été déterminée dans le cadre de la phase de titration, le patient poursuivra son traitement avec cette dose. On choisira pour cela un comprimé unique de la puissance correspondante. L'intensité des accès douloureux paroxystiques peut varier et la dose d'Effentora nécessaire peut augmenter au cours du temps en raison de la progression de la maladie cancéreuse sous-jacente. Si un accès douloureux paroxystique ne s'amende pas dans les 30 minutes qui suivent la prise d'une dose d'Effentora, on peut donner un second comprimé d'Effentora de la même puissance. Il faut attendre au moins 4 heures avant d'administrer une nouvelle dose.
Lorsque plusieurs accès douloureux paroxystiques successifs nécessitent un second comprimé d'Effentora, la dose du traitement d'entretien habituel doit être ajustée (cf. ci-dessous).
Adaptation des doses
La dose d'entretien d'Effentora doit être augmentée lorsque le patient requiert plus d'un comprimé par crise lors de plusieurs accès douloureux paroxystiques successifs. Pour la détermination de la nouvelle dose, on se référera à la marche à suivre décrite sous «Titration des doses» (voir ci-dessus).
Si les patients présentent régulièrement plus de quatre accès douloureux paroxystiques par 24 heures, il peut être nécessaire de réajuster la posologie du traitement opioïde de fond.
Si un contrôle adéquat des douleurs n'a pas pu être obtenu, la possibilité de la survenue d'une hyperalgésie, d'une tolérance et de la progression de la maladie sous-jacente doit être prise en considération (voir rubrique «Mises en garde et précautions»).
Arrêt du traitement
Le traitement par Effentora doit être immédiatement arrêté si le patient ne présente plus d'accès douloureux paroxystiques. Le traitement de fond des douleurs chroniques doit être poursuivi conformément à la prescription.
Si l'arrêt de tout traitement opioïde est nécessaire, le patient doit être surveillé de près par le médecin afin de gérer le risque d'effets liés à un sevrage brutal.
Patients âgés
Au cours des études cliniques, la dose efficace individuelle tendait à être plus faible chez les patients âgés de plus de 65 ans que chez les patients plus jeunes. La plus grande prudence est de rigueur lors de la titration de la dose d'Effentora chez les patients âgés.
Enfants et adolescents
Effentora n'est pas recommandé chez l'enfant et l'adolescent de moins de 18 ans compte tenu du manque de données concernant l'innocuité et l'efficacité.
Patients présentant des troubles de la fonction hépatique
Effentora doit être administré avec prudence chez les patients présentant une insuffisance hépatique modérée ou sévère (voir aussi «Mises en garde et précautions»).
Patients présentant des troubles de la fonction rénale
Effentora doit être administré avec prudence chez les patients présentant une insuffisance rénale modérée ou sévère (voir aussi «Mises en garde et précautions»).
Patients présentant une xérostomie
Il est conseillé aux patients présentant une xérostomie de boire de l'eau avant l'administration d'Effentora afin d'humidifier l'espace entre la gencive et la joue. Il est conseillé de changer de traitement dans le cas où cette recommandation ne suffirait pas à obtenir une réaction de dissolution du comprimé adéquate.
Mode d'administration
Lors du contact du comprimé d'Effentora avec de l'humidité, une réaction effervescente se produit pour délivrer le principe actif. Il est donc recommandé aux patients de ne pas ouvrir la plaquette blister avant d'être prêts à placer le comprimé entre la gencive et la joue.
Ouverture de la plaquette blister
Les patients doivent être informés de NE PAS essayer de pousser le comprimé à travers la plaquette blister car cela pourrait endommager le comprimé buccal. La méthode appropriée pour l'ouverture de la plaquette blister est la suivante:
Détacher une des alvéoles de la plaquette blister le long des perforations. Plier l'alvéole le long de la ligne imprimée au dos de la feuille de protection. Retirer ensuite la feuille de protection pour faire apparaître le comprimé.
Les patients doivent être prévenus qu'il ne faut pas écraser ni couper le comprimé.
Le comprimé ne doit pas être conservé une fois la feuille de protection retirée, car l'intégrité du comprimé ne peut être garantie dans ce cas et il existe un risque d'exposition accidentelle au produit.
Administration des comprimés
Les patients doivent retirer un comprimé d'Effentora de la plaquette blister et le placer immédiatement, en entier, entre la joue et la gencive d'un côté près d'une molaire.
Le comprimé d'Effentora ne doit pas être sucé, mâché ou avalé, car les concentrations plasmatiques seraient alors inférieures à celles obtenues lors de l'utilisation selon les directives.
Effentora doit être placé entre la gencive et la joue et y rester pendant une période de temps suffisante pour permettre la désintégration du comprimé, ce qui prend généralement 14 à 25 minutes.
Une alternative est de placer le comprimé en sublingual (voir «Pharmacocinétique»).
Après 30 minutes, s'il reste des morceaux de comprimé d'Effentora, il est possible de les avaler avec un verre d'eau.
Le temps de désintégration totale du comprimé après administration dans la cavité buccale ne semble pas avoir d'influence sur l'exposition systémique précoce au fentanyl.
Tant que le comprimé se trouve entre la gencive et la joue, les patients ne doivent ni boire ni manger.
En cas d'irritation de la muqueuse entre la gencive et la joue, il est recommandé de changer l'emplacement du comprimé.
Contre-indicationsHypersensibilité au fentanyl ou à l'un des excipients.
Patients sans traitement opioïde de fond (voir «Indications/Possibilités d'emploi»), en raison d'un risque accru de dépression respiratoire.
Dépression respiratoire sévère ou bronchopneumopathie obstructive sévère.
Traitement des douleurs aiguës autres que des accès douloureux paroxystiques (par exemple les douleurs postopératoires, les céphalées et les migraines).
Administration simultanée d'inhibiteurs de la monoamine-oxydase (MAO) ou administration d'Effentora dans les deux semaines qui suivent l'arrêt d'un traitement par inhibiteurs de la MAO.
Mises en garde et précautionsIl est impératif d'informer les patients et les soignants du fait qu'Effentora contient un principe actif à une dose potentiellement mortelle, particulièrement pour un enfant. De ce fait, ils doivent conserver tous les comprimés hors de la portée et de la vue des enfants.
Afin de réduire au minimum les risques d'effets indésirables liés aux opioïdes et de déterminer la dose efficace individuelle, il est indispensable que les patients soient étroitement surveillés par un médecin durant la phase de titration.
Il est important de s'assurer que le traitement de fond par des opioïdes à libération prolongée, utilisé pour traiter la douleur permanente du patient soit stabilisé avant d'instaurer Effentora et que le patient poursuive son traitement de fond par des opioïdes à libération prolongée lorsqu'il prend Effentora.
Dépendance médicamenteuse et potentiel d'abus
L'utilisation répétée d'opioïdes peut entraîner le développement d'une tolérance ainsi qu'une dépendance physique et/ou psychique. Une dépendance iatrogène peut apparaître après l'utilisation d'opioïdes. Effentora, comme d'autres opioïdes, peut faire l'objet d'un abus et tous les patients recevant des opioïdes doivent être surveillés afin de détecter tout signe d'abus ou de dépendance. Les patients présentant un risque accru d'abus d'opioïdes peuvent néanmoins être traités de manière appropriée par des opioïdes. Ces patients doivent cependant faire l'objet d'une surveillance supplémentaire afin de détecter tout signe d'utilisation incorrecte, d'abus ou de dépendance. L'utilisation répétée d'Effentora peut entraîner un trouble de l'utilisation des opioïdes. L'abus ou l'utilisation incorrecte intentionnelle d'Effentora peut entraîner un surdosage et/ou un décès. Le risque de développer un trouble de l'utilisation des opioïdes est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles de la consommation de substances (y compris troubles de la consommation d'alcool), chez les fumeurs ou chez les patients ayant des antécédents d'autres affections psychiques (p.ex. dépression majeure, troubles anxieux et troubles de la personnalité). Les patients doivent être surveillés afin de détecter tout signe de comportement addictif (drug-seeking behavior) (p.ex. demander trop tôt des ordonnances de suivi). Il s'agit également de vérifier l'absence de prise concomitante d'opioïdes et de médicaments psychoactifs (tels que les benzodiazépines). La consultation d'un addictologue doit être envisagée pour les patients présentant les signes et les symptômes d'un trouble de l'utilisation des opioïdes.
Dépression respiratoire
Comme avec tous les opioïdes, l'utilisation d'Effentora est associée à un risque de dépression respiratoire cliniquement significative. Si elle n'est pas identifiée et traitée immédiatement, une dépression respiratoire peut entraîner un arrêt respiratoire et un décès. Le traitement d'une dépression respiratoire comprend, selon l'état clinique du patient, une surveillance étroite, des mesures de soutien et l'administration d'antagonistes opioïdes. Une dépression respiratoire grave, potentiellement mortelle ou mortelle, peut survenir à tout moment du traitement, le risque étant maximal au début du traitement ou après une augmentation de la dose.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l'apnée centrale du sommeil (ACS) et l'hypoxémie liée au sommeil. L'utilisation d'opioïdes est accompagnée d'une augmentation dose-dépendante du risque d'apnée centrale du sommeil.
Chez les patients présentant une apnée centrale du sommeil, une diminution de la dose totale d'opioïdes doit être envisagée.
Pathologie pulmonaire chronique obstructive
La prudence est de rigueur lors de la titration d'Effentora chez des patients présentant une bronchopneumopathie chronique obstructive non sévère ou toute autre pathologie les prédisposant à une dépression respiratoire, car même administré aux doses thérapeutiques normales, Effentora peut altérer la commande respiratoire, voire provoquer une insuffisance respiratoire.
Utilisation concomitante avec des dépresseurs du système nerveux central
L'utilisation concomitante d'opioïdes et de benzodiazépines ou d'autres dépresseurs du système nerveux central, y compris les gabapentinoïdes (gabapentine ou prégabaline), peut entraîner une forte sédation, une dépression respiratoire, un coma et un décès. En raison de ces risques, les opioïdes et les benzodiazépines ou autres dépresseurs du système nerveux central doivent uniquement être administrés en concomitance chez les patients pour lesquels aucune autre option de traitement n'est envisageable. S'il est décidé de prescrire Effentora en association avec des benzodiazépines ou d'autres dépresseurs du système nerveux central, il convient de choisir la dose efficace la plus faible et une durée minimale d'utilisation concomitante. Les patients doivent être étroitement surveillés afin de détecter tout signe ou symptôme de dépression respiratoire et de sédation (voir rubrique «Interactions»).
Alcool
La prise concomitante de fentanyl et d'alcool peut entraîner une dépression respiratoire grave, qui peut s'avérer mortelle dans certains cas (voir «Interactions»).
Exposition accidentelle
Les patients et leurs soignants doivent être informés qu'Effentora contient un principe actif à une dose potentiellement mortelle, en particulier chez les enfants. Les patients et leurs soignants doivent être informés de la nécessité de conserver toutes les unités hors de la portée des enfants et d'éliminer de façon conforme les unités ouvertes ou non utilisées.
Augmentation de la pression intracrânienne, troubles de la conscience
Effentora ne doit être administré qu'avec une extrême prudence chez les patients qui pourraient être particulièrement sensibles aux effets cérébraux de l'hypercapnie (rétention de CO2), par exemple chez les patients présentant des signes d'hypertension intracrânienne ou des troubles de la conscience. Les opioïdes pouvant masquer l'évolution clinique en cas de traumatisme crânien, ils ne doivent être utilisés dans ce cadre qu'en cas de nécessité clinique.
Délire
Le risque de délire est important avec les médicaments contenant du fentanyl, y compris les médicaments utilisés par voie transmuqueuse et les préparations combinées.
Pathologie cardiaque
Administré par voie intraveineuse, le fentanyl peut provoquer une bradycardie. Au cours des études cliniques sur Effentora, aucun signe manifeste de bradycardie n'a été observé. Toutefois, la prudence est de rigueur en cas d'administration d'Effentora chez des patients présentant une bradyarythmie préexistante ou antérieure au traitement.
Insuffisance rénale ou hépatique
Effentora doit également être administré avec prudence chez les patients présentant une insuffisance hépatique ou rénale. L'influence d'une insuffisance hépatique ou rénale sur la pharmacocinétique du médicament n'a pas été étudiée. Cependant, lors de l'administration intraveineuse, la clairance du fentanyl est modifiée par l'insuffisance hépatique ou rénale en raison d'une altération de la clairance métabolique et de la liaison aux protéines plasmatiques. Après administration d'Effentora, l'insuffisance hépatique ou rénale peut d'une part augmenter la biodisponibilité du fentanyl absorbé par voie orale et d'autre part diminuer sa clairance systémique, ce qui pourrait entraîner des effets opioïdes accrus et prolongés. Une prudence particulière est donc de rigueur lors de la phase de titration chez des patients présentant une insuffisance hépatique ou rénale modérée ou sévère.
Hypovolémie, hypotension
Les patients atteints d'hypovolémie ou d'hypertension nécessitent également une attention particulière.
Syndrome sérotoninergique
La prudence est de rigueur lorsqu'Effentora est administré concomitamment avec des médicaments qui influencent les systèmes sérotoninergiques des neurotransmetteurs.
Un syndrome sérotoninergique potentiellement mortel peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques, comme les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSN), les myorelaxants (p.ex. cyclobenzaprine, métaxalone) et de médicaments qui perturbent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [inhibiteurs de la MAO]), même lors de l'utilisation de la dose recommandée.
Un syndrome sérotoninergique peut s'exprimer sous forme d'altérations de l'état mental (p.ex. excitation, hallucinations, coma), d'instabilité autonome (p.ex. tachycardie, variations de la tension artérielle, hyperthermie), d'anomalies neuromusculaires (p.ex. hyperréflexie, faiblesse de la coordination, rigidité) et/ou de symptômes gastro-intestinaux (p.ex. nausées, vomissements, constipation). En cas de suspicion d'un syndrome sérotoninergique, le traitement par Effentora doit être immédiatement arrêté.
Anaphylaxie et hypersensibilité
Des réactions anaphylactiques et d'hypersensibilité ont été observées en corrélation avec l'utilisation d'autres préparations orales de fentanyl administré par voie transmuqueuse. (voir «Effets indésirables»).
Insuffisance surrénale
Les opioïdes peuvent provoquer une insuffisance surrénale réversible, qui nécessite une surveillance et un traitement de substitution par glucocorticoïdes. Les symptômes d'une insuffisance surrénale peuvent inclure, entre autres, les symptômes suivants: nausées, vomissements, perte d'appétit, fatigue, faiblesse, vertiges ou hypotension.
Syndrome de sevrage aux opioïdes néonatal
La prise prolongée d'Effentora durant la grossesse peut entraîner un syndrome de sevrage aux opioïdes néonatal potentiellement mortel lorsqu'il n'est pas identifié et traité à temps. Le traitement doit avoir lieu conformément aux protocoles développés par des experts en néonatologie. Si l'utilisation d'opioïdes est nécessaire chez une femme enceinte durant une période prolongée, informez la patiente du risque de syndrome de sevrage aux opioïdes néonatal et assurez-vous que le traitement adéquat soit disponible, le cas échéant.
Hyperalgésie
Une hyperalgésie induite par les opioïdes (HIO) se produit lorsqu'un analgésique opioïde provoque paradoxalement une augmentation de la douleur ou de la sensibilité à la douleur. Elle diffère de la tolérance, pour laquelle des doses plus élevées d'opioïdes sont nécessaires pour maintenir un effet donné. Les symptômes de l'HIO comprennent notamment une augmentation de la douleur en cas d'augmentation de la dose d'opioïdes, une diminution de la douleur en cas de réduction de la dose d'opioïdes ou une douleur provoquée par des stimuli habituellement indolores (allodynie). Si une HIO est suspectée, il convient d'envisager une réduction de la dose d'opioïdes ou une rotation des opioïdes.
Diminution des taux d'hormones sexuelles et augmentation du taux de prolactine
L'utilisation prolongée d'opioïdes peut être associée à une baisse des taux d'hormones sexuelles et à une augmentation du taux de prolactine. Les symptômes incluent une perte de la libido, une dysérection ou une aménorrhée.
Spasme du sphincter d'Oddi/pancréatite
Les opioïdes peuvent provoquer un dysfonctionnement et un spasme du sphincter d'Oddi, ce qui augmente la pression intrabiliaire ainsi que le risque de symptômes des voies biliaires et de pancréatite.
Régime hyposodé
Ce médicament contient 10,2 mg de sodium (Effentora 100 microgrammes) par comprimé buccal et 20,4 mg de sodium (Effentora 200/400/600/800 microgrammes) par comprimé buccal ce qui équivaut respectivement à 0,5 % et 1 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Ceci doit être pris en compte en cas de régime hyposodé contrôlé (pauvre en sodium/pauvre en sel).
InteractionsAutres interactions
L'utilisation concomitante d'autres dépresseurs du SNC, tels qu'autres opioïdes, sédatifs comme les benzodiazépines ou les hypnotiques, anesthésiques généraux, phénothiazines, tranquillisants, myorelaxants, antihistaminiques sédatifs, gabapentinoïdes (gabapentine et prégabaline) et alcool, peut entraîner des effets dépresseurs additifs susceptibles d'entraîner une détresse respiratoire, une hypotension, une forte sédation, voire un coma, qui peuvent s'avérer mortels dans certains cas (voir rubrique «Mises en garde et précautions»).
Le cas échéant, un ajustement de la dose doit être envisagé.
Compte tenu qu'une potentialisation sévère et imprévisible des effets des analgésiques opioïdes a été rapportée lors de l'administration concomitante d'inhibiteurs de la monoamine-oxydase (IMAO), Effentora est contre-indiqué chez les patients ayant reçu des IMAO durant les 14 derniers jours.
Un syndrome sérotoninergique peut survenir en cas d'administration concomitante d'opioïdes avec des inhibiteurs de la monoamine oxydase (IMAO) et des agents sérotoninergiques, tels que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), et les antidépresseurs tricycliques (ATC). Les symptômes du syndrome sérotoninergique peuvent inclure une altération de l'état de conscience, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux.
Interactions pharmacocinétiques
Le fentanyl est principalement métabolisé par l'isoenzyme 3A4 du cytochrome P450 (CYP3A4). Par conséquent, des interactions peuvent survenir en cas d'administration concomitante d'Effentora et de substances ayant un effet sur l'activité du CYP3A4. L'efficacité d'Effentora peut être réduite en cas d'administration concomitante de substances ayant un effet inducteur sur l'activité du CYP3A4.
L'administration concomitante d'Effentora et d'inhibiteurs puissants du CYP3A4 (par ex. ritonavir, kétoconazole, itraconazole, troléandomycine, clarithromycine, et nelfinavir) ou modérés (par ex. amprénavir, aprépitant, diltiazem, érythromycine, fluconazole, fosamprénavir, jus de pamplemousse et vérapamil) est susceptible d'augmenter les concentrations plasmatiques de fentanyl, ce qui pourrait entraîner des effets indésirables graves, y compris une dépression respiratoire mortelle. Les patients recevant Effentora en même temps que des inhibiteurs modérés ou puissants du CYP3A4 doivent faire l'objet d'une surveillance étroite pendant une période prolongée. L'augmentation posologique doit être réalisée avec prudence.
Interactions pharmacodynamiques
L'utilisation concomitante d'antagonistes des opioïdes (comme la naloxone) ou d'agonistes/antagonistes opioïdes partiels (par exemple: buprénorphine) n'est pas recommandée. En effet, ils possèdent une forte affinité pour les récepteurs opioïdes avec une activité intrinsèque relativement faible et donc antagonisent partiellement l'effet analgésique du fentanyl, pouvant ainsi induire un syndrome de sevrage chez les patients dépendants aux opioïdes.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'emploi du fentanyl chez la femme enceinte.
Les expérimentations animales ont révélé une toxicité de reproduction (voir «Données précliniques»). Le risque potentiel pour l'être humain n'est pas connu. Effentora ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue.
La prise prolongée d'Effentora pendant la grossesse peut entraîner un syndrome de sevrage des opioïdes néonatal potentiellement mortel lorsqu'il n'est pas identifié et traité à temps. Le traitement doit avoir lieu conformément aux protocoles développés par des experts en néonatologie. Si l'utilisation d'opioïdes est nécessaire chez une femme enceinte durant une période prolongée, informez la patiente du risque de syndrome de sevrage des opioïdes néonatal et assurez-vous que le traitement adéquat soit disponible, le cas échéant (voir également rubrique «Mises en garde et précautions»).
Il est recommandé de ne pas utiliser le fentanyl pendant le travail et l'accouchement (ni durant une césarienne), car le fentanyl franchit la barrière placentaire et peut entraîner une dépression respiratoire chez le fœtus. On tiendra un antidote à portée de main immédiate si Effentora est malgré tout administré.
Allaitement
Le fentanyl passe dans le lait maternel et peut provoquer une sédation et une dépression respiratoire chez le nourrisson. Le fentanyl ne doit pas être utilisé par les mères qui allaitent. On ne reprendra pas l'allaitement moins de 5 jours après la dernière prise de fentanyl.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été réalisée sur les effets sur l'aptitude à la conduite de véhicules et à l'utilisation de machines. Toutefois, les analgésiques opioïdes affectent les facultés physiques et/ou mentales nécessaires à l'accomplissement de tâches potentiellement dangereuses (comme par ex. la conduite d'un véhicule ou l'utilisation de machines). Il est conseillé aux patients de ne pas conduire ni utiliser de machines s'ils présentent une somnolence, des vertiges ou des troubles de la vue pendant le traitement par Effentora. Ils devront également renoncer à la conduite d'un véhicule et à l'utilisation de machines tant qu'ils ne connaissent pas leurs réactions à un traitement par Effentora.
Effets indésirablesLes effets indésirables auxquels il faut s'attendre sous Effentora sont les effets indésirables typiques des opioïdes. Ils disparaissent souvent complètement au cours de la titration à la dose la plus appropriée ou diminuent d'intensité au fur et à mesure de la poursuite du traitement. Parmi les effets indésirables les plus graves, il faut relever la dépression respiratoire (susceptible de conduire à une apnée ou un arrêt respiratoire), la dépression circulatoire, l'hypotension et l'état de choc. Tous les patients requièrent une surveillance étroite à la recherche des premiers signes de ces effets indésirables.
Le but des essais cliniques sur Effentora était d'évaluer l'efficacité et la sécurité dans le traitement des accès douloureux paroxystiques. Tous les patients recevaient dans ce contexte un traitement de fond contre leurs douleurs chroniques, sous forme d'opioïdes, tels que morphine à libération prolongée ou fentanyl par voie transdermique. Il n'est par conséquent pas possible de délimiter avec certitude les effets seulement dus à Effentora.
Les effets indésirables suivants ont été observés lors du traitement par Effentora durant les essais cliniques et depuis son introduction sur le marché. Ces effets indésirables sont listés dans le tableau ci-dessous selon la classification recommandée par la convention MedDRA par systèmes d'organes et ordre de fréquence.
Les fréquences sont définies de la manière suivante:
très fréquents (≥1/10), fréquents (≥1/100 et <1/10), occasionnels (≥1/1000 et <1/100), rares (≥1/10'000 et <1/1000), inconnus (fréquence non appréciable sur la base des données disponibles). À l'intérieur des groupes de fréquence, les effets indésirables sont indiqués par ordre décroissant de sévérité:
Infections et infestations
Fréquents: Candidoses orales
Occasionnels: Pharyngite
Rares: Pustules buccales
Affections hématologiques et du système lymphatique
Fréquents: Anémie, neutropénie
Occasionnels: Thrombopénie
Affections du système immunitaire
Inconnus: Réactions d'hypersensibilité (y compris exanthème, érythème, œdème des lèvres et du visage, urticaire)
Affections endocriniennes
Rares: Hypogonadisme
Inconnus: insuffisance corticosurrénale, carence en androgènes
Troubles du métabolisme et de la nutrition
Fréquents: Anorexie
Affections psychiatriques
Fréquents: Dépression, anxiété, état confusionnel, insomnie
Occasionnels: Humeur euphorique, nervosité, hallucinations, hallucinations visuelles, altérations de l'état mental, dépendance (toxicomanie), désorientation
Inconnus: Délire
Affections du système nerveux
Très fréquents: Vertiges (13%), céphalées (11%)
Fréquents: Troubles du goût, somnolence, léthargie, tremblements, sédation, hypoesthésie, migraine
Occasionnels: Troubles de la conscience, troubles de l'attention, troubles de l'équilibre, dysarthrie
Rares: Troubles cognitifs, troubles moteurs
Inconnus: Perte de connaissance, crises tonico-cloniques
Affections oculaires
Occasionnels: Troubles de la vue, hyperémie oculaire, vision trouble, diminution de l'acuité visuelle
Rares: Sensations anormales dans l'œil, photopsie
Affections de l'oreille et du labyrinthe
Occasionnels: Vertiges, acouphènes, troubles de l'oreille
Affections cardiaques
Fréquents: Tachycardie
Occasionnels: Bradycardie
Affections vasculaires
Fréquents: Hypotension, hypertension
Occasionnels: Flush, bouffées de chaleur
Affections respiratoires, thoraciques et médiastinales
Fréquents: Dyspnée, douleurs pharyngolaryngées
Occasionnels: Dépression respiratoire, syndrome d'apnées du sommeil
Inconnus: Arrêt respiratoire
Affections gastro-intestinales
Très fréquents: Nausées (23%), vomissements (12%)
Fréquents: Constipation, stomatite, sécheresse buccale, diarrhées, douleurs abdominales, reflux gastro-œsophagien, troubles gastriques, dyspepsie, douleurs dentaires
Occasionnels: Iléus, ulcérations buccales, hypoesthésie buccale, troubles buccaux, coloration de la muqueuse buccale, maladie des tissus mous de la bouche, glossodynie, apparition de vésicules sur la langue, douleurs gingivales, ulcères de la langue, affection de la langue, œsophagite, lèvres gercées, affections dentaires
Rares: Apparition de vésicules sur la muqueuse buccale, sécheresse des lèvres
Inconnus: Pancréatite
Affections hépatobiliaires
Occasionnels: Dilatation de voies biliaires
Inconnus: Spasme du sphincter d'Oddi
Affections de la peau et du tissu sous-cutané
Fréquents: Prurit, hyperhidrose, rash
Occasionnels: Sueurs froides, œdème du visage, prurit généralisé, alopécie
Rares: Onychorrhexis
Affections musculo-squelettiques et du tissu conjonctif
Fréquents: Myalgies, lombalgies
Occasionnels: Secousses musculaires, faiblesse musculaire
Affections du rein et des voies urinaires
Occasionnels: Rétention urinaire
Troubles généraux et anomalies au site d'administration
Très fréquents: Troubles au site d'administration (11%), tels que saignements, douleurs, ulcérations, irritations, paresthésies, anesthésie, érythème, œdème, tuméfaction et formation de vésicules
Fréquents: Œdèmes périphériques, fatigue, asthénie, syndrome de sevrage, frissons
Occasionnels: Malaise, léthargie, troubles de la cage thoracique, impression de maladie, agitation nerveuse, soif, sensation de froid, sudations
Inconnus: Fièvre, syndrome de sevrage néonatal aux opioïdes (voir également les rubriques «Mises en garde et précautions» et «Grossesse/Allaitement»).
Abus de médicaments (voir également la rubrique «Mises en garde et précautions»).
Investigations
Fréquents: Perte de poids
Occasionnels: Thrombocytopénie, tachycardie, diminution de l'hématocrite, diminution de l'hémoglobine
Lésions, intoxications et complications liées aux procédures
Fréquents: Chute
L'administration répétée d'opioïdes tels que le fentanyl, peut entraîner une tolérance, une dépendance physique et/ou psychique.
Des symptômes de sevrage des opioïdes tels que nausées, vomissements, diarrhée, anxiété, frissons, tremblements et sudation ont été observés lors de l'utilisation de fentanyl par voie transmuqueuse.
En cas de surdosage, il a été observé une perte de connaissance et un arrêt respiratoire.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
L'on peut s'attendre à ce que les symptômes en cas de surdosage par fentanyl soient de même nature que ceux observés après l'administration intraveineuse de fentanyl ou d'autres opioïdes, et constituent une extension des effets pharmacologiques. Les effets indésirables les plus graves et pouvant entraîner la mort sont l'altération des facultés mentales, la perte de connaissance, le coma, l'hypotension, la dépression respiratoire, la détresse respiratoire et l'arrêt respiratoire.
Des cas de respiration de Cheyne-Stokes ont été observés en cas de surdosage de fentanyl, en particulier chez les patients ayant des antécédents d'insuffisance cardiaque.
Une leucoencéphalopathie toxique a été observée en cas de surdosage d'opioïdes.
Traitement
Les mesures à prendre immédiatement en cas de surdosage d'opioïdes consistent à retirer immédiatement le comprimé buccal d'Effentora de la bouche du patient s'il s'y trouve encore, à s'assurer de la perméabilité des voies respiratoires, à effectuer des stimulations physiques et verbales du patient et à déterminer son niveau de conscience ainsi que son état respiratoire et circulatoire et à instaurer si nécessaire une ventilation assistée (assistance respiratoire).
Le traitement du surdosage (ingestion accidentelle) chez une personne naïve d'opioïdes nécessite la mise en place d'une voie veineuse et l'administration de naloxone ou d'un autre antagoniste des opioïdes, selon l'état clinique. La durée de la dépression respiratoire due au surdosage peut être plus longue que les effets de l'antagoniste des opioïdes (exemple: la demi-vie de la naloxone est comprise entre 30 et 81 minutes) et il peut donc être nécessaire de répéter l'administration de l'antidote.
Pour plus de détails sur le mode d'emploi de l'antagoniste des opioïdes utilisé, se référer à l'information professionnelle du produit en question.
Pour traiter un surdosage chez les patients recevant un traitement opioïde de fond, mettre en place une voie veineuse. Dans certains cas, l'utilisation judicieuse de naloxone ou d'un autre antagoniste des opioïdes peut être justifiée, mais elle est associée à un risque de déclenchement d'un syndrome de sevrage aigu.
Bien qu'il n'ait jamais été décrit de rigidité musculaire compromettant la respiration après administration d'Effentora, un tel phénomène est possible avec le fentanyl ou d'autres opioïdes. Dans un tel cas, il faudra instaurer une ventilation assistée, administrer un antagoniste des opioïdes et, en dernier recours, un myorelaxant.
Propriétés/EffetsCode ATC N02AB03
Mécanisme d'action
Le fentanyl est un agoniste opioïde qui agit essentiellement sur le récepteur opioïde µ. Ses effets thérapeutiques principaux sont l'analgésie et la sédation. Les effets pharmacologiques secondaires sont la dépression respiratoire, la bradycardie, l'hypothermie, la constipation, le myosis, la dépendance physique et l'euphorie.
Pharmacodynamique
Les effets analgésiques du fentanyl sont liés à ses concentrations plasmatiques. En règle générale, les concentrations efficace et toxique augmentent parallèlement à l'augmentation de l'accoutumance aux opioïdes. Il existe une grande variation interindividuelle de la rapidité de développement d'une tolérance. Par conséquent, la titration de la dose d'Effentora permettant d'obtenir l'effet recherché doit être réalisée individuellement pour chaque patient (voir «Posologie/Mode d'emploi»).
Tous les agonistes des récepteurs opioïdes µ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients qui reçoivent un traitement opioïde de fond, car ces patients développent une tolérance à la dépression respiratoire.
Les opioïdes peuvent influer sur l'axe hypothalamo-hypophyso-surrénalien ou l'axe hypothalamo-hypophyso-gonadique. Les modifications qui peuvent survenir comprennent une augmentation de la prolactine sérique et une diminution du taux plasmatique de cortisol et de testostérone. Ces modifications hormonales peuvent se traduire par des signes et symptômes cliniques.
Efficacité clinique
La sécurité et l'efficacité d'Effentora ont été évaluées chez les patients ayant pris le médicament à l'apparition de l'accès douloureux paroxystique. L'utilisation préventive d'Effentora dans les épisodes douloureux prévisibles n'a pas été étudiée dans les études cliniques.
Deux études cliniques en crossover, randomisées, en double aveugle, contrôlées contre placebo, ont été menées sur un total de 248 patients cancéreux présentant en moyenne 1 à 4 accès douloureux paroxystiques quotidiens alors qu'ils recevaient un traitement opioïde de fond. La détermination de la dose efficace d'Effentora a été réalisée lors d'une phase initiale de titration en ouvert. Les patients pour lesquels une dose efficace pouvait être établie participaient à la phase en double insu de l'étude. Le critère principal d'efficacité était l'évaluation de l'intensité de la douleur par le patient. Les patients ont évalué l'intensité de la douleur selon une échelle de 11 points. A chaque accès douloureux paroxystique, l'intensité de la douleur était évaluée avant et à différents points dans le temps après le traitement.
La titration d'une dose efficace a été possible chez 67 % des patients.
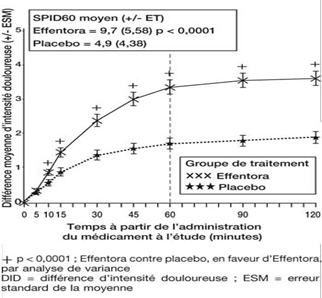
Dans l'étude clinique pivotale (Etude 1), le critère d'évaluation principal a été la somme moyenne des différences des scores d'intensité douloureuse, évaluée depuis la prise de la dose jusqu'à y compris 60 minutes après celle-ci (SPID60). Cette valeur a été statistiquement significative par rapport au placebo (p < 0,0001).
Dans la seconde étude pivotale (Etude 2), le critère d'évaluation principal était le SPID30. Cette valeur a également été statistiquement significative par rapport au placebo (p < 0,0001).
Voir figures ci-dessous:
Etude 1: Différence moyenne d'intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d'analyse)
Etude 2: Différence moyenne d'intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d'analyse)
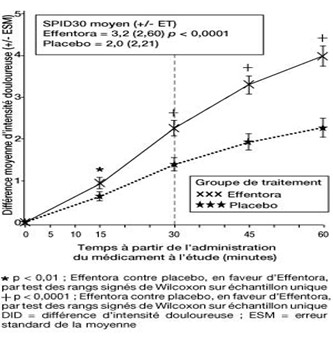
Une amélioration statistiquement significative de la différence d'intensité douloureuse a déjà été constatée sous Effentora versus placebo après 10 minutes dans l'étude 1 et après 15 minutes (mesure la plus précoce) dans l'étude 2, par rapport au placebo. Ces différences ont continué à être statistiquement significatives à chaque point dans le temps et dans chacune des deux études.
PharmacocinétiqueGénéralités
Le fentanyl est une substance très lipophile et peut être absorbé très rapidement par la muqueuse buccale et plus lentement par la voie gastro-intestinale conventionnelle. Il subit un métabolisme par effet de premier passage hépatique et intestinal, mais ses métabolites ne contribuent pas à ses effets thérapeutiques.
Effentora utilise une réaction effervescente pour délivrer la substance active, ce qui permet d'augmenter le taux et la proportion de fentanyl absorbé par la muqueuse buccale. La réaction effervescente est accompagnée de modifications transitoires du pH qui peuvent améliorer la dissolution (à un pH plus bas) ou la perméabilité membranaire (à un pH plus élevé).
Le temps de rétention (défini comme étant la période nécessaire à la désintégration totale du comprimé après administration buccale) n'influence pas la disponibilité systémique précoce du fentanyl. Une étude comparative réalisée avec un comprimé à 400 µg d'Effentora administré soit par voie buccale (c'est-à-dire, entre la joue et la gencive) soit par voie sublinguale, a montré la bioéquivalence des deux voies d'administration.
L'effet d'une insuffisance rénale ou hépatique sur la pharmacocinétique d'Effentora n'a pas été étudié.
Absorption
Après administration d'Effentora dans la cavité buccale, le fentanyl est légèrement absorbé avec une biodisponibilité absolue de 65 %. Le profil d'absorption d'Effentora résulte en majeure partie d'une absorption initiale rapide par la muqueuse buccale. Les prélèvements veineux montrent que les concentrations plasmatiques maximales sont obtenues en moyenne dans l'heure qui suit l'administration dans la cavité buccale. Environ 50 % de la dose totale administrée sont rapidement absorbés par la voie transmuqueuse et deviennent disponibles sur le plan systémique. Les 50 % restants de la dose totale sont ingérés et lentement absorbés à partir du tractus gastro-intestinal. Environ 30 % de la fraction ingérée (50 % de la dose totale) échappent à l'élimination lors du premier passage hépatique et intestinal et deviennent disponibles sur le plan systémique.
Le tableau ci-dessous récapitule les principaux paramètres pharmacocinétiques.
Paramètres pharmacocinétiques* chez les sujets adultes recevant Effentora
|
Paramètre pharmacocinétique
(moyenne)
|
Effentora 400 microgrammes
| |
Biodisponibilité absolue
|
65 % (± 20 %)
| |
Proportion résorbée par voie transmuqueuse
|
48 % (± 31,8 %)
| |
Tmax (minutes) **
|
46,8 (20-240)
| |
Cmax (ng/ml)
|
1,02 (± 0,42)
| |
AUC0-tmax (ng x h/ml)
|
0,40 (± 0,18)
| |
AUC0-inf (ng x h/ml)
|
6,48 (± 2,98)
|
* Sur la base des échantillons sanguins veineux (plasma). Les concentrations sériques de citrate de fentanyl étaient supérieures à celles du plasma. L'AUC et la Cmax sériques ont été respectivement d'environ 20 % à 30 % supérieures à l'AUC et à la Cmax plasmatiques. La raison de cette différence n'est pas connue.
** Les données pour de Tmax sont indiquées sous forme de médiane (valeurs extrêmes).
Dans les études de pharmacocinétique ayant comparé la biodisponibilité absolue et relative d'Effentora à celle du citrate de fentanyl administré par voie buccale transmuqueuse (OTFC), le taux et la fraction d'absorption du fentanyl d'Effentora ont montré une exposition 30 % à 50 % supérieure à celle du citrate de fentanyl administré par voie buccale transmuqueuse. Chez les patients passant d'une autre forme orale de citrate de fentanyl à Effentora, la titration de la dose d'Effentora doit être réalisée indépendamment de la dose utilisée précédemment, étant donné que la biodisponibilité entre les produits diffère significativement. Néanmoins, chez ces patients, une dose initiale supérieure à 100 µg peut être envisagée.
Voir figure ci-dessous:
Concentrations plasmatiques moyennes en fonction du temps
Profils après dose unique d'Effentora et OTFC chez les sujets sains
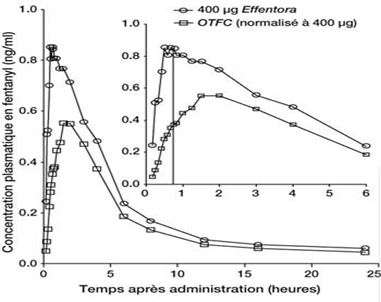
Les données OTFC utilisées ont été ajustées (800 µg à 400 µg).
Des différences de disponibilité d'Effentora ont été observées au cours d'une étude clinique chez des patients atteints de mucite de grade 1. La Cmax et l'AUC0-8 ont été respectivement 1 % et 25 % plus élevées chez les patients atteints de mucite par rapport à ceux qui n'en étaient pas atteints. Les différences observées n'étaient pas cliniquement significatives.
Distribution
Le fentanyl est une substance fortement lipophile qui présente une bonne distribution extravasculaire et un volume apparent de distribution élevé. Après administration buccale d'Effentora, le fentanyl subit une distribution initiale rapide qui représente une équilibration du fentanyl entre le plasma et les tissus fortement vascularisés (cerveau, cœur et poumons). Par la suite, le fentanyl est redistribué entre le compartiment tissulaire profond (muscles et graisses) et le plasma.
Le taux de liaison du fentanyl aux protéines plasmatiques est de 80 à 85%. La principale protéine de liaison est l'alpha-1 glycoprotéine acide, mais l'albumine et les lipoprotéines sont également impliquées dans une certaine mesure. L'acidose augmente la fraction libre de fentanyl.
Métabolisme
Les voies métaboliques empruntées par Effentora après administration buccale n'ont pas été déterminées lors d'études cliniques. Le fentanyl est métabolisé en norfentanyl dans le foie et la muqueuse intestinale sous l'effet de l'isoenzyme 3A4 du cytochrome P450. Lors des expérimentations animales, le norfentanyl n'a pas montré d'effet pharmacologique. Plus de 90% de la dose de fentanyl administrée sont éliminés par biotransformation en métabolites N-désalkylés et hydroxylés inactifs.
Élimination
Après administration intraveineuse de fentanyl, moins de 7% de la dose administrée sont éliminés sous forme inchangée dans les urines et seul 1% environ est éliminé sous forme inchangée dans les selles. Les métabolites sont essentiellement éliminés par voie urinaire, l'excrétion fécale étant moins importante.
Après administration d'Effentora, la phase terminale d'élimination du fentanyl résulte de la redistribution entre le plasma et un compartiment profond. Cette phase d'élimination est lente et est à l'origine d'une demi-vie d'élimination terminale médiane t1/2 d'environ 22 heures après administration buccale de la forme effervescente et d'environ 18 heures après administration intraveineuse. La clairance plasmatique totale de fentanyl après administration intraveineuse est d'environ 42 l/h.
Linéarité/Non-linéarité
Une proportionnalité à la dose a été constatée dans l'éventail des doses allant de 100 à 1000 microgrammes.
Données précliniquesLes données précliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicité après administration répétée, de génotoxicité et de carcinogénicité n'ont pas mis en évidence de risque particulier pour l'être humain.
Les études sur le développement embryonnaire/fœtal conduites chez le rat et le lapin n'ont révélé aucune malformation ou modification du développement liée à la substance lors de l'administration pendant l'organogenèse.
Dans une étude de fertilité et de développement embryonnaire précoce chez le rat, un effet transmis par les mâles a été observé à forte dose (300 µg/kg/jour, voie sous-cutanée).
Cet effet concordait probablement avec les effets sédatifs du fentanyl dans les expérimentations animales.
Dans les études de développement pré- et postnatal chez le rat, le taux de survie de la descendance était significativement réduit à des doses entraînant une toxicité maternelle sévère. Les autres effets des doses toxiques maternelles sur la première génération étaient: un retard du développement physique, des fonctions sensorielles, des réflexes et du comportement. Ces effets pourraient être des effets indirects dus à une modification du comportement maternel et/ou une diminution de la production de lait ou un effet direct du fentanyl sur les jeunes animaux.
Les études de carcinogénicité (test alternatif par voie cutanée chez la souris transgénique Tg. AC durant 26 semaines, étude par voie sous-cutanée chez le rat durant 2 ans) n'ont pas révélé de potentiel oncogène.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Conserver dans l'emballage d'origine et ne pas conserver au-dessus de 30°C. Conserver hors de la portée des enfants.
Remarques concernant la manipulation
Il est impératif d'informer les patients et le personnel soignant d'éliminer, dès qu'ils ne sont plus nécessaires, tous les comprimés restants encore dans l'emballage.
Tout médicament entamé ou non utilisé ou tout déchet doit être rapporté à l'endroit où il a été remis pour qu'il soit éliminé conformément à la réglementation en vigueur.
Numéro d’autorisation61669 (Swissmedic).
PrésentationEffentora, 100 µg Emballages de 4 et 28 comprimés buccaux [A+]
Effentora, 200 µg Emballages de 4 et 28 comprimés buccaux [A+]
Effentora, 400 µg Emballages de 4 et 28 comprimés buccaux [A+]
Effentora, 600 µg Emballages de 4 et 28 comprimés buccaux [A+]
Effentora, 800 µg Emballages de 4 et 28 comprimés buccaux [A+]
Titulaire de l’autorisationCuratis AG, 4410 Liestal
Mise à jour de l’informationMars 2024.
|



