Propriétés/EffetsCode ATC N02AB03
Mécanisme d'action
Le fentanyl est un agoniste opioïde qui agit essentiellement sur le récepteur opioïde µ. Ses effets thérapeutiques principaux sont l'analgésie et la sédation. Les effets pharmacologiques secondaires sont la dépression respiratoire, la bradycardie, l'hypothermie, la constipation, le myosis, la dépendance physique et l'euphorie.
Pharmacodynamique
Les effets analgésiques du fentanyl sont liés à ses concentrations plasmatiques. En règle générale, les concentrations efficace et toxique augmentent parallèlement à l'augmentation de l'accoutumance aux opioïdes. Il existe une grande variation interindividuelle de la rapidité de développement d'une tolérance. Par conséquent, la titration de la dose d'Effentora permettant d'obtenir l'effet recherché doit être réalisée individuellement pour chaque patient (voir «Posologie/Mode d'emploi»).
Tous les agonistes des récepteurs opioïdes µ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients qui reçoivent un traitement opioïde de fond, car ces patients développent une tolérance à la dépression respiratoire.
Les opioïdes peuvent influer sur l'axe hypothalamo-hypophyso-surrénalien ou l'axe hypothalamo-hypophyso-gonadique. Les modifications qui peuvent survenir comprennent une augmentation de la prolactine sérique et une diminution du taux plasmatique de cortisol et de testostérone. Ces modifications hormonales peuvent se traduire par des signes et symptômes cliniques.
Efficacité clinique
La sécurité et l'efficacité d'Effentora ont été évaluées chez les patients ayant pris le médicament à l'apparition de l'accès douloureux paroxystique. L'utilisation préventive d'Effentora dans les épisodes douloureux prévisibles n'a pas été étudiée dans les études cliniques.
Deux études cliniques en crossover, randomisées, en double aveugle, contrôlées contre placebo, ont été menées sur un total de 248 patients cancéreux présentant en moyenne 1 à 4 accès douloureux paroxystiques quotidiens alors qu'ils recevaient un traitement opioïde de fond. La détermination de la dose efficace d'Effentora a été réalisée lors d'une phase initiale de titration en ouvert. Les patients pour lesquels une dose efficace pouvait être établie participaient à la phase en double insu de l'étude. Le critère principal d'efficacité était l'évaluation de l'intensité de la douleur par le patient. Les patients ont évalué l'intensité de la douleur selon une échelle de 11 points. A chaque accès douloureux paroxystique, l'intensité de la douleur était évaluée avant et à différents points dans le temps après le traitement.
La titration d'une dose efficace a été possible chez 67 % des patients.
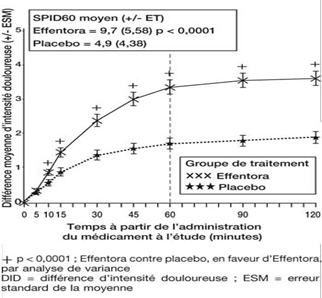
Dans l'étude clinique pivotale (Etude 1), le critère d'évaluation principal a été la somme moyenne des différences des scores d'intensité douloureuse, évaluée depuis la prise de la dose jusqu'à y compris 60 minutes après celle-ci (SPID60). Cette valeur a été statistiquement significative par rapport au placebo (p < 0,0001).
Dans la seconde étude pivotale (Etude 2), le critère d'évaluation principal était le SPID30. Cette valeur a également été statistiquement significative par rapport au placebo (p < 0,0001).
Voir figures ci-dessous:
Etude 1: Différence moyenne d'intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d'analyse)
Etude 2: Différence moyenne d'intensité douloureuse (± ESM) à chaque point dans le temps (échantillon complet d'analyse)
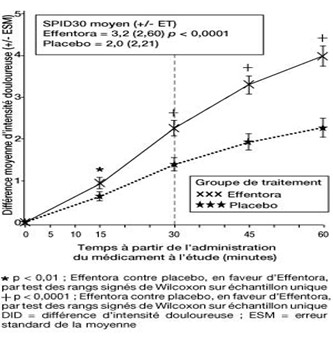
Une amélioration statistiquement significative de la différence d'intensité douloureuse a déjà été constatée sous Effentora versus placebo après 10 minutes dans l'étude 1 et après 15 minutes (mesure la plus précoce) dans l'étude 2, par rapport au placebo. Ces différences ont continué à être statistiquement significatives à chaque point dans le temps et dans chacune des deux études.
| 

