Posologie/Mode d’emploiLa dose de Fycompa doit être augmentée progressivement en fonction de la réponse de chaque patient, afin d'optimiser le rapport efficacité-tolérance. Le médecin doit prescrire la formulation et le dosage les mieux appropriés en fonction du poids et de la dose. D'autres formulations de pérampanel sont disponibles, notamment une suspension buvable. Il convient de respecter un délai au moins d'une ou deux semaines entre chaque augmentation posologique en fonction du traitement initial et/ou des traitements concomitants (voir ci-dessous et rubrique «Interactions»), et du rapport bénéfice-risque individuel.
Crises d'épilepsie focales
Adultes, adolescents et enfants de 4 ans et plus
Le Tableau 1 suivant présente une synthèse des posologies recommandées pour les adultes, les adolescents et les enfants de 4 ans et plus, pour le traitement des crises d'épilepsie focales. Le traitement par Fycompa doit être instauré à la dose la plus faible en fonction de l'âge et du poids du patient, comme il est décrit dans le Tableau 1. La dose peut ensuite être augmentée par paliers en fonction de la réponse clinique et de la tolérance (paliers de titration selon le Tableau 1 en fonction de l'âge et du poids).
Tableau 1: Posologie de Fycompa pour les crises d'épilepsie focales
|
|
Adultes/adolescents
(12 ans et plus)
[dose journalière]
|
Enfants (4 à 11 ans); poids:
[dose journalière]
| |
≥30 kg
|
20 à < 30 kg
|
< 20 kg
| |
Dose initiale/jour
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
1 mg (2 ml)
| |
Schéma de titration (augmentation par paliers)a
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
1 mg (2 ml)
| |
Dose d'entretien recommandée/jour
|
4–8 mg (8 – 16 ml)
|
4–8 mg (8-16 ml)
|
4–6 mg (8-12 ml)
|
2–4 mg (4-8 ml)
| |
Schéma de titration
(augmentation par paliers)a
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
0,5 mg (1 ml)
| |
Dose maximale recommandée/jour
|
12 mg (24 ml)
|
12 mg (24 ml)
|
8 mg (16 ml)
|
6 mg (12 ml)
| |
a
en respectant un délai minimal d'une semaine, détails voir rubrique «Intervalle entre chaque augmentation posologique» ci-dessous
|
Crises généralisées tonico-cloniques primaires
Adultes, adolescents et enfants de 7 ans et plus
Le Tableau 2 suivant présente une synthèse des posologies recommandées pour les adultes, les adolescents et les enfants de 7 ans et plus, pour le traitement des crises généralisées tonico-cloniques primaires. Le traitement par Fycompa doit être instauré à la dose la plus faible en fonction de l'âge et du poids du patient, comme il est décrit dans le Tableau 2. La dose peut ensuite être augmentée par paliers en fonction de la réponse clinique et de la tolérance (paliers de titration selon le Tableau 2 en fonction de l'âge et du poids).
Tableau 2: Posologie pour les crises généralisées tonico-cloniques primaires
|
|
Adultes/adolescents
(12 ans et plus)
[dose journalière]
|
Enfants (7 à 11 ans); poids:
[dose journalière]
| |
≥30 kg
|
20 à < 30 kg
|
< 20 kg
| |
Dose initiale/jour
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
1 mg (2 ml)
| |
Schéma de titration (augmentation par paliers)a
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
1 mg (2 ml)
| |
Dose d'entretien recommandée/jour
|
Jusqu'à 8 mg (16 ml)
|
4–8 mg (8-16 ml)
|
4–6 mg (8-12 ml)
|
2–4 mg (4-8 ml)
| |
Schéma de titration (augmentation par paliers)a
|
2 mg (4 ml)
|
2 mg (4 ml)
|
1 mg (2 ml)
|
0,5 mg (1 ml)
| |
Dose journalière recommandée/jour
|
12 mg (24 ml)
|
12 mg (24 ml)
|
8 mg (16 ml)
|
6 mg (12 ml)
| |
a
en respectant un délai minimal d'une semaine, détails voir rubrique «Intervalle entre chaque augmentation posologique» ci-dessous
|
Intervalle entre chaque augmentation posologique
Chez les patients dont les traitements concomitants n'entraînent pas une réduction de la demi-vie du pérampanel (voir rubrique «Interactions»), il convient de respecter un délai d'au moins deux semaines entre chaque augmentation posologique.
Chez les patients dont les traitements concomitants diminuent la demi-vie du pérampanel (voir rubrique «Interactions»), un délai d'au moins une semaine devra être observé.
Recommandation posologique en cas de comédication avec un inducteur du CYP3A
Après administration complémentaire de pérampanel en doses fixes, les taux de réponse étaient plus faibles si les patients recevaient concomitamment des antiépileptiques inducteurs du CYP3A (carbamazépine, phénytoïne, oxcarbazépine) que chez des patients traités concomitamment avec des antiépileptiques ne présentant pas cet effet inducteur. Il convient de surveiller le taux de réponse des patients si ceux-ci passent d'un antiépileptique non inducteur enzymatique administré concomitamment à une substance inductrice enzymatique ou inversement. En fonction de la réponse clinique individuelle et de la tolérance, la dose peut être augmentée ou réduite par paliers de 2 mg.
Mode d'administration
Fycompa doit être pris une fois par jour au coucher. Fycompa peut être pris au moment des repas ou en dehors des repas (voir «Pharmacocinétique»). Le relais entre les formulations en comprimé et en suspension doit être effectué avec précaution (voir «Pharmacocinétique»).
Comprimé pelliculé:
Le comprimé doit être avalé entier à l'aide d'un verre d'eau. Il ne doit pas être croqué, écrasé ou divisé. En l'absence de barre de cassure, les comprimés ne peuvent pas être coupés en deux.
Suspension:
Pour l'administration, veuillez utiliser la seringue pour administration orale. Les instructions d'utilisation de l'adaptateur et de la seringue sont présentées ci-dessous:
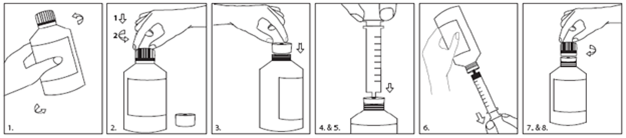
1.Agitez pendant au moins 5 secondes avant utilisation.
2.Appuyez (1) sur le bouchon en tournant (2) pour ouvrir le flacon.
3.Insérez l'adaptateur dans le goulot du flacon jusqu'à obtention d'un joint étanche.
4.Enfoncez complètement le piston de la seringue.
5.Insérez la seringue pour administration orale aussi loin que possible dans l'orifice de l'adaptateur.
6.Retournez l'ensemble et prélevez la quantité prescrite de Fycompa à partir du flacon.
7.Retournez le flacon et retirez la seringue pour administration orale.
8.Laissez l'adaptateur en place et refermez le flacon avec le bouchon.
Après administration de la dose, retirez le piston de la seringue et immergez-les dans de l'eau savonneuse chaude. Ensuite, placez le piston et le corps de la seringue dans de l'eau propre, rincez-les et laissez-les sécher à l'air libre. Ne les essuyez pas avec un linge.
Arrêt du traitement de Fycompa
Il est recommandé d'arrêter progressivement le traitement afin de réduire le risque de crises d'épilepsie par effet rebond (voir rubrique Posologie/Mode d'emploi). Cependant, compte tenu de sa longue demi-vie et de la lente diminution des concentrations plasmatiques qui en résulte, le pérampanel peut être arrêté brutalement en cas d'absolue nécessité.
Arrêt de la co-médication
En cas d'arrêt d'inducteurs enzymatiques pris concomitamment, la concentration plasmatique de pérampanel peut augmenter et un ajustement de la posologie être nécessaire.
Prise oubliée:
En cas d'oubli d'une seule dose et compte tenu de la demi-vie longue du pérampanel, le patient doit attendre et prendre la dose suivante au moment habituel.
En cas d'oubli de plus d'une dose pendant une période continue de moins de cinq demi-vies (3 semaines pour les patients ne recevant pas de médicaments antiépileptiques induisant le métabolisme du pérampanel, 1 semaine pour les patients prenant des médicaments antiépileptiques induisant le métabolisme du pérampanel (voir «Interactions»), il convient d'envisager la reprise du traitement à la dernière dose administrée.
Si un patient a arrêté l'administration de pérampanel pendant une période continue de plus de 5 demi-vies, il est conseillé de suivre les recommandations d'instauration du traitement initial indiquées ci-dessus.
Adolescents
Chez les adolescents il faut surveiller les signes indiquant des modifications du comportement (voir rubrique «Mises en garde et précautions» concernant la suicidalité et l'agressivité)
Population pédiatrique
La sécurité et l'efficacité de Fycompa pour les enfants âgés de moins de 4 ans présentant des crises d'épilepsie focales et pour les enfants âgés de moins de 7 ans présentant des crises généralisées tonico-cloniques primaires n'ont pas encore été établies. Aucune donnée n'est disponible. L'utilisation de ce médicament dans ce groupe d'âge n'est pas recommandée (voir «Mises en garde et précautions» concernant la suicidalité et l'agressivité)
Patients âgés (65 ans et plus)
Les études cliniques de Fycompa portant sur le traitement de l'épilepsie n'ont pas inclus suffisamment de patients âgés de 65 ans et plus pour déterminer si leur réponse au traitement est différente de celle des patients plus jeunes. Le rapport bénéfice-risque et/ou la nécessité de l'utilisation du pérampanel chez les patients âgés doivent être soigneusement évalués en particulier chez les patients âgés polymédiqués en raison des interactions médicamenteuses éventuelles. En outre, se référer également à la rubrique «Mises en garde et précautions», en particulier concernant les troubles de l'équilibre et de la coordination et le risque de chutes.
Patients présentant des troubles de la fonction rénale
Aucune adaptation posologique n'est requise chez les patients présentant une insuffisance rénale légère. L'utilisation de Fycompa n'est pas recommandée chez les patients présentant une insuffisance rénale modérée ou sévère ou chez les patients sous hémodialyse (voir également rubrique «Contre-indications» et «Données précliniques»).
Patients présentant des troubles de la fonction hépatique
Les augmentations posologiques chez les patients présentant une insuffisance hépatique légère ou modérée doivent reposer sur la réponse clinique et la tolérance et être effectuées en respectant un délai d'au moins deux semaines. Le traitement peut être instauré à la dose de 2 mg et la dose doit être augmentée par paliers de 2 mg à intervalles d'au moins 2 semaines jusqu'à une dose maximale de 8 mg, en fonction de l'efficacité et de la tolérance. Chez les patients présentant une insuffisance hépatique légère à modérée, la dose de pérampanel ne doit donc pas dépasser 8 mg. L'utilisation de Fycompa n'est pas recommandée chez les patients présentant une insuffisance hépatique sévère (voir également rubrique «Contre-indications» et «Données précliniques»).
| 
