CompositionPrincipes actifs
Nucléides mère et fille:
Radionucléide parent: 99Mo (fission)
Radionucléide de filiation: 99mTc
Activités:
|
Activités en Tc-99m (J 12h CET)
(Activité maximale éluable au jour de calibration, 12H00)
|
2
|
4
|
6
|
8
|
10
|
12
|
16
|
20
|
25
|
50
|
GBq
| |
Activités en Mo-99 (J 12h CET)
|
2,5
|
5
|
7
|
9,5
|
12
|
14,5
|
19
|
24
|
30
|
60
|
GBq
|
Sans entraîneur
Excipients
Matériaux de la colonne de chromatographie:
Colonne de chromatographie en verre contenant de l’alumine
Poche de solution pour élution:
Natrii chloridum, Natrii nitras, Aqua ad iniectabilia.
Flacons d’élution:
Nitrogenium sous pression réduite.
Chaque mL de solution de pertechnétate (99mTc) de sodium contient 3,6 mg de sodium.
Spécifications
Spécifications de la solution éluée
La solution éluée est une solution claire et incolore de pertechnétate (99mTc) de sodium dont
le pH est compris entre 4,5 et 7,5 et et qui a une pureté radiochimique d'au moins 95 %.
Pureté radionucléidique (Monographie 0124 " Solution injectable de pertechnétate (99mTc) de sodium (fission)" de la Pharmacopée Européenne, édition en vigueur<9:
•iode-131: au maximum 5 × 10-3 pour cent de la radioactivité totale.
•molybdène-99: au maximum 0,1 pour cent de la radioactivité totale.
•ruthénium-103: au maximum 5 × 10-3 pour cent de la radioactivité totale.
•strontium-89: au maximum 6 × 10-5 pour cent de la radioactivité totale.
•strontium-90: au maximum 6 × 10-6 pour cent de la radioactivité totale.
•Autres émetteurs de rayonnements gamma: au maximum 0,01 pour cent de la radioactivité totale.
•Emetteurs de rayonnements alpha: au maximum 1 × 10-7 pour cent de la radioactivité totale.
Pureté radiochimique (Monographie 0124 " Solution injectable de pertechnétate (99mTc) de sodium (fission)" de la Pharmacopée Européenne, édition en vigueur)
ion (99mTc)pertechnétate: au minimum 95 pour cent de la radioactivité totale due au technétium-99m.
Indications/Possibilités d’emploiCe médicament est à usage diagnostique uniquement.
La solution injectable de pertechnétate (99mTc) de sodium obtenue peut être utilisée comme précurseur pour le marquage de différents composés fournis sous forme de trousses, ou être administrée directement dans les indications suivantes:
a. Administration par voie intraveineuse:
•Scintigraphie thyroïdienne: imagerie et mesure de la fixation thyroïdienne permettant d’obtenir des informations fonctionnelles de la thyroïde (nodules, position).
•Scintigraphie des glandes salivaires: examen fonctionnel.
•Recherche de muqueuse gastrique ectopique (diverticule de Meckel, duplication intestinale avec hétérotopie de muqueuse gastrique).
b. Marquage in vivo des globules rouges par le technétium (99mTc) après l’administration d’un agent réducteur
•angioscintigraphie pourévaluation de la fraction d’éjection ventriculaireévaluation globale ou régionale de la motilité de la paroi cardiaqueimagerie des phases ventriculairesimagerie de perfusion d’organe ou d’anomalies vasculaires
c. Instillation dans l’œil:
•Scintigraphie des canaux lacrymaux
La solution injectable de pertechnétate (99mTc) de sodium est iutilisable chez l’adulte et les enfants, du nouveau-né à l’adolescent.
Posologie/Mode d’emploiCe médicament est destiné à être utilisé uniquement au sein d’installations de médecine nucléaire et ne doit être manipulé que par du personnel autorisé.
Pour la préparation du patient, voir rubrique « Mises en garde et précautions ».
Posologie habituelle
La solution injectable de pertechnétate (99mTc) de sodium est habituellement administrée par voie intraveineuse ou par instillation dans les yeux. Les activités utilisées varient largement selon l’information clinique recherchée et l’appareillage utilisé. Les activités recommandées sont les suivantes:
Adultes (70 kg) et personnes âgées :
Scintigraphie thyroïdienne: 20 - 80 MBq
L’acquisition des images est débutée 20 minutes après l’injection intraveineuse.
Scintigraphie des glandes salivaires: 50 à 150 MBq
L’acquisition des images est débutée immédiatement après l’injection intraveineuse et à intervalles réguliers jusqu’à 15 minutes.
Recherche de muqueuse gastrique ectopique: 400 MBq
L’acquisition des images est débutée immédiatement après l’injection intraveineuse et à intervalles réguliers jusqu’à 30-60 minutes.
Angioscintigraphie: 750 – 1’000 MBq
Les globules rouges sont marqués in vivo, après administration préalable d’un agent réducteur. Les images du premier passage cardiaque sont acquises immédiatement après l’injection; pour l’étude en mode «gated» (=synchronisation cardiaque), et sont suivies par des images acquises à l’équilibre jusqu’à 30 minutes après injection.
Scintigraphie des canaux lacrymaux: 2 - 4 MBq dans chaque œil.
Des gouttes sont instillées dans chaque œil et une série d’images est acquise dans les 2 minutes, pendant les 20 minutes suivantes des images statiques sont acquises à intervalles réguliers.
Population pédiatrique :
L’utilisation dans la population pédiatrique doit être soigneusement considérée, après évaluation des besoins cliniques et du rapport bénéfices / risques dans cette population. Les activités à administrer chez l’enfant et l’adolescent doivent être adaptées et peuvent être
calculées conformément aux recommandations de la carte de posologie pédiatrique de
l’European Association of Nuclear Medicine (EANM). L’activité administrée au jeune patient
peut être calculée en multipliant une activité de base (à des fins de calcul) par un facteur de
correction correspondant à sa masse corporelle (Tableau 1).
A[MBq] Administrée = Activité de base x facteur de correction
Scintigraphie thyroïdienne:
Activité administrée [MBq] = 5,6 MBq x Facteur de correction (Tableau 1)
Avec une activité minimale à administrer de 10 MBq, nécessaire à l’obtention d’images de qualité satisfaisante.
Recherche de muqueuse gastrique ectopique:
Activité administrée [MBq] = 10,5 MBq x Facteur de correction (Tableau 1)
Avec une activité minimale à administrer de 20 MBq, nécessaire à l’obtention d’images de qualité satisfaisante.
Scintigraphie cardiaque (1er passage):
Activité administrée [MBq] = 35,0 MBq x Facteur de correction (Tableau 1)
Avec une activité minimale à administrer de 80 MBq, nécessaire à l’obtention d’images de qualité satisfaisante.
Angioscintigraphie (à l’équilibre) / marquage des globules rouges in vivo:
Activité administrée [MBq] = 56,0 MBq x Facteur de correction (Tableau 1)
Avec une activité minimale à administrer de 80 MBq, nécessaire à l’obtention d’images de qualité satisfaisante.
Tableau 1 : Facteurs de correction selon la masse corporelle dans la population pédiatrique
(pour la scintigraphie thyroïdienne et l'identification/localisation de la muqueuse gastrique
ectopique) conformément aux recommandations de l’EANM (Mai 2008).
|
Masse
|
|
facteur
|
Masse
|
|
facteur
|
Masse
|
|
facteur
| |
3 kg
|
=
|
1
|
22 kg
|
=
|
5,29
|
42 kg
|
=
|
9,14
| |
4 kg
|
=
|
1,14
|
24 kg
|
=
|
5,71
|
44 kg
|
=
|
9,57
| |
6 kg
|
=
|
1,71
|
26 kg
|
=
|
6,14
|
46 kg
|
=
|
10,00
| |
8 kg
|
=
|
2,14
|
28 kg
|
=
|
6,43
|
48 kg
|
=
|
10,29
| |
10 kg
|
=
|
2,71
|
30 kg
|
=
|
6,86
|
50 kg
|
=
|
10,71
| |
12 kg
|
=
|
3,14
|
32 kg
|
=
|
7,29
|
52-54 kg
|
=
|
11,29
| |
14 kg
|
=
|
3,57
|
34 kg
|
=
|
7,72
|
56-58 kg
|
=
|
12,00
| |
16 kg
|
=
|
4,00
|
36 kg
|
=
|
8,00
|
60-62 kg
|
=
|
12,71
| |
18 kg
|
=
|
4,43
|
38 kg
|
=
|
8,43
|
64-66 kg
|
=
|
13,43
| |
20 kg
|
=
|
4,86
|
40 kg
|
=
|
8,86
|
68 kg
|
=
|
14,00
|
Scintigraphie des glandes salivaires :
Le Groupe de Travail "Pédiatrie" de l'EANM (1990) recommande que l’activité administrée à
l’enfant soit calculée en fonction de sa masse corporelle indiquée dans le tableau 2. Une
activité minimale de 10 MBq est nécessaire pour l’obtention d’images de qualité
satisfaisante.
Tableau 2 : Facteurs de correction pour la population pédiatrique (pour la scintigraphie des
glandes salivaires) selon les recommandations de l’EANM 1990
|
Masse
|
|
facteur
|
Masse
|
|
facteur
|
Masse
|
|
facteur
| |
3 kg
|
=
|
0,1
|
22 kg
|
=
|
0,50
|
42 kg
|
=
|
0,78
| |
4 kg
|
=
|
0,14
|
24 kg
|
=
|
0,53
|
44 kg
|
=
|
0,80
| |
6 kg
|
=
|
0,19
|
26 kg
|
=
|
0,56
|
46 kg
|
=
|
0,82
| |
8 kg
|
=
|
0,23
|
28 kg
|
=
|
0,58
|
48 kg
|
=
|
0,85
| |
10 kg
|
=
|
0,27
|
30 kg
|
=
|
0,62
|
50 kg
|
=
|
0,88
| |
12 kg
|
=
|
0,32
|
32 kg
|
=
|
0,65
|
52-54 kg
|
=
|
0,90
| |
14 kg
|
=
|
0,36
|
34 kg
|
=
|
0,68
|
56-58 kg
|
=
|
0,92
| |
16 kg
|
=
|
0,40
|
36 kg
|
=
|
0,71
|
60-62 kg
|
=
|
0,96
| |
18 kg
|
=
|
0,44
|
38 kg
|
=
|
0,73
|
64-66 kg
|
=
|
0,98
| |
20 kg
|
=
|
0,46
|
40 kg
|
=
|
0,76
|
68 kg
|
=
|
0,99
|
Scintigraphie des canaux lacrymaux :
Les activités recommandées sont identiques chez l’adulte et l’enfant.
Pour les instructions pour la préparation des radiopharmaceutiques, et pour les précautions particulières de manipulation voir rubrique « Remarques particulières ». / « Remarques concernant la manipulation ». Pour les précautions particulières d’élimination, voir rubrique « Dispositions légales ».
Recommandations posologiques spéciales
Patients présentant une insuffisance rénale:
Aucune étude d’escalade et d’ajustement de dose n’a été réalisée avec ce produit dans les populations normales et spécifiques. La pharmacocinétique du pertechnétate (99mTc) de sodium chez les patients présentant une insuffisance rénale n’a pas été caractérisée.
Insuffisants rénaux :
Le rapport bénéfice/risque doit être déterminé avec soins, car une exposition accrue au
rayonnement est possible chez ces patients.
Mode d’administration
Par voie intraveineuse ou oculaire.
Pour usage multidose
Pour les instructions concernant la préparation extemporanée du médicament avant
administration, voir la rubrique « Instructions pour la preparation ».
Pour la préparation du patient, voir la rubrique « Mises en garde spéciales et précautions d'emploi ».
Pour la scintigraphie thyroïdienne, la scintigraphie des glandes salivaires,
l’identification/localisation de la muqueuse gastrique ectopique, la solution de pertechnétate
(99mTc) de sodium est administrée par voie intraveineuse.
Pour la scintigraphie des canaux lacrymaux, des gouttes sont instillées dans chaque œil
(usage oculaire).
Acquisition des images
Scintigraphie thyroïdienne : 20 minutes après injection intraveineuse.
Scintigraphie des glandes salivaires : immédiatement après l’injection et à intervalles
réguliers pendant 15 minutes.
Identification/localisation de la muqueuse gastrique ectopique (diverticule de Meckel) :
immédiatement après l’injection et à intervalles réguliers pendant 30 minutes.
Scintigraphie des canaux lacrymaux : acquisition dynamique dans les deux minutes suivant
l’instillation, suivi d’images statiques acquises à intervalles réguliers sur 20 minutes.
Exposition aux rayonnements
Les données dans le tableau ci-dessous sont issues de l’ICRP n°128 et sont calculées selon les hypothèses suivantes:
Selon l’ICRP128, toutes les études publiées ont démontré une fixation active rapide dans la thyroïde, les glandes salivaires et l’estomac, et une fixation retardée dans le côlon. La fraction restante de l’activité administrée est supposée être uniformément répartie dans les tissus de tous les autres organes (à l’exception du cerveau). L’élimination se fait par voie rénale et intestinale.
(1) Doses de rayonnement reçues par le patient après injection intraveineuse de pertechnétate de sodium (99mTc) sans traitement préalable par un agent bloquant
|
Organe
|
Dose absorbée par unité d’activité administrée (µGy/MBq)
| |
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Glandes surrénales
|
3,7
|
4,6
|
7,1
|
11,0
|
19,0
| |
Paroi vésicale
|
18,0
|
23,0
|
34,0
|
45,0
|
66,0
| |
Surfaces osseuses
|
5,4
|
6,5
|
9,6
|
14,0
|
25,0
| |
Cerveau
|
2,0
|
2,5
|
4,1
|
6,5
|
11,0
| |
Seins
|
1,8
|
2,3
|
3,4
|
5,6
|
11,0
| |
Vésicule biliaire
|
7,4
|
9,8
|
16,0
|
23,0
|
35,0
| |
Voies gastrointestinales
|
|
|
|
|
| |
Paroi gastrique
|
26,0
|
34,0
|
48,0
|
78,0
|
160,0
| |
Intestin grêle
|
16,0
|
20,0
|
31,0
|
47,0
|
82,0
| |
Côlon
|
41,0
|
53,0
|
89,0
|
140,0
|
270,0
| |
Paroi du côlon ascendant
|
56,0
|
73,0
|
120,0
|
200,0
|
370,0
| |
Paroi du côlon descendant
|
21,0
|
27,0
|
45,0
|
71,0
|
130,0
| |
Cœur
|
3,1
|
4,0
|
6,0
|
9,1
|
16,0
| |
Reins
|
5,0
|
6,0
|
8,6
|
13,0
|
21,0
| |
Foie
|
3,8
|
4,8
|
8,0
|
12,0
|
22,0
| |
Poumons
|
2,6
|
3,4
|
5,1
|
7,9
|
14,0
| |
Muscles
|
3,2
|
4,0
|
6,0
|
9,1
|
16,0
| |
Œsophage
|
2,5
|
3,2
|
4,8
|
7,5
|
14,0
| |
Ovaires
|
9,9
|
13,0
|
18,0
|
27,0
|
44,0
| |
Pancréas
|
5,6
|
7,2
|
11,0
|
16,0
|
27,0
| |
Moelle osseuse rouge
|
3,7
|
4,4
|
6,5
|
9,0
|
15,0
| |
Glandes salivaires
|
8,5
|
10,0
|
14,0
|
18,0
|
26,0
| |
Peau
|
1,8
|
2,2
|
3,5
|
5,6
|
10,0
| |
Rate
|
4,3
|
5,3
|
8,0
|
12,0
|
20,0
| |
Testicules
|
2,8
|
3,7
|
5,9
|
9,1
|
16,0
| |
Thymus
|
2,5
|
3,2
|
4,8
|
7,5
|
14,0
| |
Thyroïde
|
22,0
|
36,0
|
54,0
|
120,0
|
220,0
| |
Utérus
|
8,1
|
10,0
|
16,0
|
23,0
|
37,0
| |
Autres tissus
|
3,7
|
4,7
|
7,1
|
11,0
|
19,0
| |
Dose efficace (mSv/MBq)
|
13,0
|
17,0
|
26,0
|
42,0
|
79,0
|
(2) Doses de rayonnement reçues par le patient après injection intraveineuse de pertechnétate de sodium (99mTc) avec traitement préalable par un agent bloquant
|
Organe
|
Dose absorbée par unité d’activité administrée (µGy/MBq)
| |
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Glandes surrénales
|
3,3
|
4,1
|
6,2
|
9,3
|
17,0
| |
Paroi vésicale
|
30,0
|
38,0
|
55,0
|
71,0
|
91,0
| |
Surfaces osseuses
|
5,1
|
6,1
|
9,0
|
13,0
|
23,0
| |
Cerveau
|
2,3
|
2,9
|
4,7
|
7,6
|
13,0
| |
Seins
|
1,9
|
2,5
|
3,5
|
5,6
|
11,0
| |
Vésicule biliaire
|
3,5
|
4,7
|
7,8
|
11,0
|
14,0
| |
Voies gastro-intestinales
|
|
|
|
|
| |
Paroi gastrique
|
3,1
|
4,1
|
6,6
|
9,3
|
16,0
| |
Intestin grêle
|
3,9
|
4,9
|
7,5
|
11,0
|
19,0
| |
Côlon
|
4,1
|
5,3
|
8,0
|
12,0
|
19,0
| |
Paroi du côlon ascendant
|
3,7
|
4,8
|
7,1
|
11,0
|
18,0
| |
Paroi du côlon descendant
|
4,7
|
5,9
|
9,1
|
12,0
|
21,0
| |
Cœur
|
3,1
|
3,9
|
5,8
|
8,6
|
15,0
| |
Reins
|
4,6
|
5,6
|
8,3
|
13,0
|
22,0
| |
Foie
|
3,0
|
3,8
|
5,9
|
8,8
|
16,0
| |
Poumons
|
2,7
|
3,5
|
5,2
|
7,9
|
14,0
| |
Muscles
|
2,8
|
3,5
|
5,3
|
7,9
|
14,0
| |
Œsophage
|
2,7
|
3,5
|
5,2
|
8,0
|
15,0
| |
Ovaires
|
4,8
|
5,9
|
8,7
|
13,0
|
20,0
| |
Pancréas
|
3,5
|
4,4
|
6,6
|
10,0
|
18,0
| |
Moelle osseuse rouge
|
2,9
|
3,6
|
5,4
|
7,9
|
14,0
| |
Peau
|
1,9
|
2,2
|
3,6
|
5,6
|
10,0
| |
Rate
|
3,1
|
3,9
|
6,0
|
8,9
|
16,0
| |
Testicules
|
3,4
|
4,3
|
6,8
|
10,0
|
16,0
| |
Thymus
|
2,7
|
3,5
|
5,2
|
8,0
|
15,0
| |
Thyroïde
|
2,8
|
3,5
|
5,6
|
9,0
|
16,0
| |
Utérus
|
6,4
|
7,8
|
12,0
|
16,0
|
24,0
| |
Autres tissus
|
2,9
|
3,6
|
5,4
|
8,2
|
14,0
| |
Dose efficace
(mSv/MBq)
|
4,6
|
5,8
|
8,7
|
12,0
|
20,0
|
La dose efficace résultant de l’administration intraveineuse de 400 MBq de pertechnétate (99mTc) de sodium à un adulte pesant 70 kg est d’environ 5’200 mSv.
Pour cette activité injectée, les doses de radiations suivantes sont délivrées aux organes cibles: paroi gastrique: 10’400 µGy; thyroïde: 8’800 µGy; glandes salivaires: 3’400 µGy; et les doses de radiations suivantes sont délivrées aux organes critiques: paroi du côlon ascendant 22’400 µGy.
Après prétraitement par un agent bloquant et administration de 400 MBq de pertechnétate (99mTc) de sodium à un adulte pesant 70 kg, la dose efficace est de 1,7 mSv.
La dose de radiations absorbée par le cristallin de l’œil à la suite de l’administration de pertechnétate (99mTc) de sodium pour une scintigraphie des canaux lacrymaux, est estimée à 0,038 mGy/MBq. Il en résulte une dose efficace équivalente de moins de 0,01 mSv pour une activité administrée de 4 MBq.
L’exposition aux radiations présentée est uniquement applicable si la fonction de tous les organes accumulant le pertechnétate (99mTc) de sodium est normale. Un hyperfonctionnement ou un hypofonctionnement (par exemple de la thyroïde, de la muqueuse gastrique ou des reins) et des processus étendus avec altération de la barrière hématoencéphalique ou troubles de l’élimination rénale peuvent entraîner des modifications de l’exposition aux radiations et même de fortes augmentations locales de celleci.
(3) Doses de rayonnement reçues par le patient après marquage in vivo des érythrocytes avec technétium (99mTc)
|
Organe
|
Dose absorbée par unité d’activité administrée (µGy/MBq)
| |
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Glandes surrénales
|
9,9
|
12,0
|
20,0
|
30,0
|
56,0
| |
Paroi vésicale
|
8,5
|
11,0
|
14,0
|
17,0
|
31,0
| |
Surfaces osseuses
|
7,4
|
12,0
|
19,0
|
36,0
|
74,0
| |
Cerveau
|
3,6
|
4,6
|
7,5
|
12,0
|
22,0
| |
Seins
|
3,5
|
4,1
|
7,0
|
11,0
|
19,0
| |
Vésicule biliaire
|
6,5
|
8,1
|
13,0
|
20,0
|
30,0
| |
Voies gastro-intestinales
|
|
|
|
|
| |
Paroi gastrique
|
4,6
|
5,9
|
9,7
|
14,0
|
25,0
| |
Intestin grêle
|
3,9
|
4,9
|
7,8
|
12,0
|
21,0
| |
Côlon
|
3,7
|
4,8
|
7,5
|
12,0
|
20,0
| |
Paroi du côlon ascendant
|
4,0
|
5,1
|
8,0
|
13,0
|
22,0
| |
Paroi du côlon descendant
|
3,4
|
4,4
|
6,9
|
10,0
|
18,0
| |
Cœur
|
23,0
|
29,0
|
43,0
|
66,0
|
110,0
| |
Reins
|
18,0
|
22,0
|
36,0
|
57,0
|
110,0
| |
Foie
|
13,0
|
17,0
|
26,0
|
40,0
|
72,0
| |
Poumons
|
18,0
|
22,0
|
35,0
|
56,0
|
110,0
| |
Muscles
|
3,3
|
4,0
|
6,1
|
9,4
|
17,0
| |
Œsophage
|
6,1
|
7,0
|
9,8
|
15,0
|
23,0
| |
Ovaires
|
3,7
|
4,8
|
7,0
|
11,0
|
19,0
| |
Pancréas
|
6,6
|
8,1
|
13,0
|
19,0
|
33,0
| |
Moelle osseuse rouge
|
6,1
|
7,6
|
12,0
|
20,0
|
37,0
| |
Peau
|
2,0
|
2,4
|
3,8
|
6,2
|
12,0
| |
Rate
|
14,0
|
17,0
|
27,0
|
43,0
|
81,0
| |
Testicules
|
2,3
|
3,0
|
4,4
|
6,9
|
13,0
| |
Thymus
|
6,1
|
7,0
|
9,8
|
15,0
|
23,0
| |
Thyroïde
|
5,7
|
7,1
|
12,0
|
19,0
|
36,0
| |
Utérus
|
3,9
|
4,9
|
7,4
|
11,0
|
19,0
| |
Autres tissues
|
3,5
|
4,5
|
7,3
|
13,0
|
23,0
| |
Dose efficace (mSv/MBq)
|
7,0
|
8,9
|
14,0
|
21,0
|
39,0
|
La dose efficace résultant de l’administration de 1000 MBq de pertechnétate (99mTc) de sodium après marquage in vivo des globules rouges, (activité maximale recommandée pour un individu de 70 kg), est de 7’000 µSv.
Pour une activité injectée de 1000 MBq, la dose de radiation suivante est délivrée aux organes cibles: cœur: 23’000 µGy, et les doses de radiations suivantes sont délivrées aux organes critiques: poumons: 18’000 µGy; reins: 18’000 µGy; rate: 14’000 µGy; foie: 13’000 µGy.
La dose de radiations absorbée par le cristallin suivant l’administration de pertechnétate (99mTc) de sodium afin de procéder à une scintigraphie des canaux lacrymaux, est estimée à 38 µGy/MBq. Il en résulte une dose efficace de moins de 10 µSv pour une activité administrée de 4 MBq.
Contre-indicationsHypersensibilité à la substance active ou à l’un des excipients.
Mises en garde et précautionsLes produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans les services compétents. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis aux réglementations et aux autorisations appropriées des autorités compétentes.
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection. Les précautions appropriées d’asepsie doivent être prises.
Potentiel de réactions d'hypersensibilité ou de réactions anaphylactiques
En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit doit être immédiatement interrompue et un traitement par voie intraveineuse doit être débuté, si nécessaire.
Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à disposition immédiate les médicaments et le matériel nécessaires, notamment une sonde d’intubation trachéale et du matériel de ventilation.
Justification du bénéfice / risque individuel
Chez chaque patient, l’exposition aux rayonnements ionisants doit se justifier sur la base du bénéfice attendu. L’activité administrée doit, dans tous les cas, être déterminée en limitant autant que possible la dose de radiation résultante tout en permettant d’obtenir l’information diagnostique requise.
Insuffisants rénaux
Le rapport bénéfice/risque doit être déterminé avec soins, car une exposition accrue au rayonnement est possible chez ces patients.
Population pédiatrique
L’utilisation chez l’enfant et l’adolescent doit être envisagée avec prudence, sur la base des besoins cliniques et après une évaluation du rapport bénéfice risque.
L'indication doit être considérée avec prudence, car la dose efficace par MBq est plus élevée
que chez l’adulte (voir la rubrique «Exposition aux rayonnements»).
Le blocage de la thyroïde revêt une importance particulière chez les patients pédiatriques, excepté lors de la scintigraphie thyroïdienne.
Préparation du patient
Le patient doit être bien hydraté avant le début de l’examen et uriner aussi souvent que possible au cours des premières heures après l’examen afin de réduire l’exposition aux radiations.
Un pré-traitement des patients par des médicaments bloquant la thyroïde peut être nécessaire pour certaines indications.
Un agent bloquant de la thyroïde doit être administré avant une scintigraphie des canaux lacrymaux ou une recherche du diverticulum de Meckel, afin d’éviter des faux positifs et pour minimiser l’accumulation de pertechnétate dans la thyroïde et les glandes salivaires.
En revanche, AUCUN agent bloquant la thyroïde ne doit être administré avant une scintigraphie de la thyroïde, de la parathyroïde, ou des glandes salivaires.
Avant l'injection de la solution de pertechnétate (99mTc) de sodium pour la scintigraphie du diverticule de Meckel, le patient doit avoir l’estomac vide depuis 3 ou 4 heures afin de maintenir un faible péristaltisme intestinal.
Après marquage in vivo des hématies en utilisant les ions stanneux pour sa réduction, le pertechnétate (99mTc) de sodium se fixe principalement au sein des hématies. C’est pourquoi la scintigraphie à la recherche d’un diverticule de Meckel doit être réalisée avant ou plusieurs jours après le marquage in vivo des hématies.
Après l’examen
Tout contact étroit avec un nourrisson ou une femme enceinte doit être évité au cours des 12 heures suivant l’examen.
Mises en garde specifiques
La solution injectable de pertechnétate (99mTc) de sodium contient 3,6 mg/ml de sodium. En fonction du moment de préparation de l’injection et selon le volume injecté, la teneur en sodium peut être dans certains cas supérieure à 1 mmol (23 mg). Ceci doit être pris en compte chez les patients suivant un régime hyposodé. En cas de marquage d’une trousse, la teneur en sodium de la dose administrée doit tenir compte du sodium provenant de l’éluat et de la trousse. Se référer à l’information professionelle de la trousse considérée.
Dans la scintigraphie des glandes salivaires, une spécificité moindre de la méthode doit être attendue comparativement à la sialographie par IRM (Imagerie par Résonance Magnétique).
Pour les précautions liées au risque environnemental, voir la rubrique «Précautions de manipulation».
InteractionsL’atropine, l’isoprénaline et les analgésiques peuvent retarder la vidange gastrique et induire ainsi une redistribution du pertechnétate (99mTc) en imagerie abdominale.
L’administration de laxatifs doit être interrompue car ceux-ci irritent le tractus gastro-intestinal. Les examens avec produits de contraste (produit de contraste baryté par exemple) ou les examens des voies digestives hautes doivent être évités durant les 48 heures précédant l’administration du pertechnétate (99mTc) pour une scintigraphie de diverticules de Meckel.
De nombreux agents pharmacologiques modifient la fixation thyroïdienne.
·les agents antithyroïdiens (par exemple carbimazole ou autres dérivés imidazolés tels que le propylthio-uracile), salicylés, corticoïdes, nitroprussiate de sodium, sulfobromophtaléine de sodium et perchlorate: leur administration doit être interrompue une semaine avant la scintigraphie thyroïdienne;
·la phénylbutazone et les expectorants: le traitement doit être interrompu deux semaines auparavant;
·les préparations thyroïdiennes naturelles ou de synthèse (par exemple thyroxine sodique, liothyronine sodique, extrait thyroïdien): le traitement doit être interrompu deux ou trois semaines auparavant;
·l’amiodarone, les benzodiazépines et le lithium doivent être interrompus quatre semaines auparavant
·aucun produit de contraste iodé ne doit avoir été administré au cours des 30 à 60 jours précédents.
·Les ions étain (II) et les sulfamides peuvent conduire à une concentration accrue de pertechnétate de sodium (99mTc) dans les globules rouges, et donc à une accumulation réduite dans le plasma. Les médicaments correspondants doivent être arrêtés au moins 8 jours avant l'utilisation.
Pour des informations concernant les interactions possibles lors d'une utilisation pour le marquage d'une trousse pour médicament radioactif, voir les informations correspondantes du fabricant de la trousse en question.
Grossesse, AllaitementFemmes en âge de procréer
Il a été démontré que le technétium (99mTc) sous forme de pertechnétate, passe au travers de la barrière placentaire. Lorsqu'il est nécessaire d'administrer ce produit à une femme en âge de procréer, toute suspicion de grossesse doit être écartée.
Grossesse
Les examens utilisant des radionucléides chez la femme enceinte entraînent également l’irradiation du fœtus. Il ne faut réaliser au cours de la grossesse que les seuls examens absolument nécessaires lorsque le bénéfice probable dépasse les risques encourus par la mère et le fœtus. D’autres techniques n’impliquant pas l’emploi de radiations ionisantes doivent être considérées. Il a été démontré que le 99mTc (sous forme de pertechnétate libre) traverse la barrière placentaire.
L’administration directe de 400 MBq de pertechnétate (99mTc) de sodium à une patiente entraîne une dose d’irradiation de l’utérus de 3,2 mGy. L’administration de 1’000 MBq de globules rouges marqués au technétium (99mTc) entraîne une dose d’irradiation de l’utérus de 3,9 mGy. La dose d’irradiation délivrée au fœtus est inconnue.
Allaitement
Avant l’administration de radiopharmaceutiques à une mère qui allaite, il est nécessaire d’envisager la possibilité de retarder l’examen après la fin de l’allaitement ou de se demander si le radiopharmaceutique choisi est le plus approprié en termes de passage de radioactivité dans le lait maternel.
Si l'administration est considérée comme nécessaire, l’allaitement doit être interrompu pendant 12 heures après administration et le lait tiré doit être éliminé.
Les contacts étroits entre la mère et l'enfant doivent être limités pendant les 12 premières heures après l'injection.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont encore fait l’objet d’aucune étude.
Effets indésirablesRésumé du profil de sécurité
Des informations sur des effets indésirables issues de notifications spontanées sont disponibles. Les types d’effets indésirables rapportés sont des réactions anaphylactoïdes,
des réactions neurovégétatives et divers types de réactions au site d’injection. Le
pertechnétate (99mTc) de sodium issu du générateur radiopharmaceutique TEKCIS est utilisé pour le marquage radioactif de divers composés. Le potentiel d’effets indésirables de ces médicaments est généralement plus élevé que celui du 99mTc, et de ce fait, les effets
indésirables rapportés sont plutôt liés aux composés marqués qu'au 99mTc.
Les types éventuels des effets indésirables à la suite de l’administration intraveineuse d’une préparation pharmaceutique marquée par le 99mTc dépendent du composé spécifique utilisé. Ces informations peuvent être consultées dans le RCP de la trousse utilisée pour la préparation radiopharmaceutique.
Liste des effets indésirables
Les effets indésirables sont listés en fonction de leur fréquence et de la classification des systèmes d’organes MedDRA : Les fréquences sont définies comme suit: «Très fréquent» (≥1/10), «Fréquent» (<1/10, ≥1/100), «Peu fréquent » (<1/100, ≥1/1000), « Rare» (<1/1000, ≥1/10 000), «Très rare» (<1/10 000).
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes MedDRA
|
Symptôme
|
Fréquence
| |
Affections du système immunitaire
|
Réactions anaphylactoïdes (par exemple dyspnée, coma, urticaire, érythème, éruption, prurit, œdème à diverses localisations, par exemple du visage)
|
indéterminée *
| |
Affections du système nerveux
|
Réactions vasovagales (par exemple syncope, tachycardie, bradycardie, sensations vertigineuses, céphalées, vision floue, bouffées vasomotrices)
|
indéterminée *
| |
Affections gastro-intestinales
|
Vomissements, nausées, diarrhée
|
indéterminée *
| |
Troubles généraux et anomalies au site d’administration
|
Réactions au site de l’injection, en raison de l'extravasation (par exemple cellulite, douleur, érythème, tuméfaction)
|
indéterminée *
|
* Effets indésirables décrits dans des notifications spontanées.Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
L’exposition aux radiations ionisantes peut potentiellement induire des cancers ou développer des déficiences héréditaires. La dose efficace étant de 7 mSv pour une activité recommandée de 1000 MBq la probabilité de survenue de tels effets est faible.
Description des effets indésirables sélectionnés
Réactions anaphylactiques (par exemple dyspnée, coma, urticaire, érythème, éruption, prurit, œdème à diverses localisations, (par exemple au visage).
Des réactions anaphylactiques ont été rapportées à la suite de l’injection intraveineuse de solution de pertechnétate (99mTc) de sodium et concernent divers symptômes cutanés ou respiratoires tels que des irritations cutanées, œdèmes ou dyspnées.
Réactions neurovégétatives (système nerveux et troubles digestifs)
Des cas isolés de réactions neurovégétatives sévères ont été rapportés, mais la plupart des effets neurovégétatifs décrits ont été des troubles digestifs tels que des nausées ou des vomissements. D’autres rapports ont décrit des réactions vasovagales telles que des céphalées ou des sensations vertigineuses. Les effets neurovégétatifs sont plutôt considérés comme liés au contexte de l’examen qu’au technétium (99mTc), particulièrement chez les patients anxieux.
Troubles généraux et anomalies au site d’administration
D’autres rapports ont décrit des réactions locales au site de l’injection. Ces réactions sont liées à l’extravasation de la substance radioactive durant l’injection, et sont allées d’une tuméfaction locale jusqu’à une cellulite. Selon la radioactivité administrée et le composé radiomarqué, une extravasation étendue peut nécessiter un traitement chirurgical.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas d'administration d'une activité excessive de pertechnétate (99mTc) de sodium au patient, un blocage de la thyroïde par ingestion de perchlorate de potassium ou par surcharge iodée doit être effectué le plus rapidement possible. La dose absorbée par le patient peut être réduite en augmentant autant que possible la diurèse et l'excrétion fécale du radioélément non décru.
En cas de surdosage de globules rouges marqués au technétium (99mTc), très peu de mesures efficaces peuvent être envisagées étant donné que l'élimination dépend du processus hémolytique normal.
Propriétés/EffetsCode ATC
V09FX01
Mécanisme d’action
TEKCIS est un générateur de technétium-99m prêt à l’emploi, qui permet d’obtenir une solution stérile et apyrogène de pertechnétate de sodium Tc-99m. Cette solution est obtenue par élution d’une colonne de chromatographie remplie d’alumine sur laquelle est fixé du molybdène fissile (99Mo, période=66 h) en tant que nucléide père du technétium (99mTc, période=6,0 h). Le système est automatisé et muni d’un blindage optimal.
Propriétés physiques
Le technétium (99mTc) est produit par décroissance radioactive du molybdène (99Mo). Il décroît en émettant un rayonnement gamma d'énergie moyenne de 140 keV avec une période de 6,02 heures pour donner du technétium (99Tc) qui, de par sa très longue période (2,13 x 105 années), peut être considéré comme stable.
Pharmacodynamique
Aucune activité pharmacologique n’a été observée aux activités administrées à des fins diagnostiques.
Efficacité clinique
pas applicable
PharmacocinétiqueAbsorption
voir la rubrique « Distribution »
Distribution
L’ion pertechnétate présente une distribution biologique similaire à celle des ions iodure et perchlorate, se concentrant transitoirement dans les glandes salivaires, le plexus choroïde, l’estomac (muqueuse gastrique) et la glande thyroïde, d’où il est éliminé sous forme inchangée. L’ion pertechnétate tend également à se concentrer dans des régions présentant une hypervascularisation ou des anomalies de la perméabilité vasculaire, particulièrement quand un prétraitement par un agent bloquant a inhibé la fixation dans des structures glandulaires. Si la barrière hémato-encéphalique est intacte, le pertechnétate (99mTc) de sodium ne pénètre pas dans les tissus cérébraux.
Fixation aux organes
Dans la circulation sanguine, 70 à 80 % du pertechnétate (99mTc) de sodium injecté par voie intraveineuse sont liés aux protéines, principalement à l’albumine de façon non spécifique. La fraction non liée (20 à 30 %) s’accumule transitoirement dans la thyroïde et les glandes salivaires, les muqueuses gastrique et nasale et le plexus choroïdien.
Néanmoins, contrairement à l’iode, le pertechnétate (99mTc) de sodium n’est ni utilisé dans la synthèse des hormones thyroïdiennes (organification), ni absorbé dans l'intestin grêle. Dans la thyroïde, selon son état fonctionnel et sa saturation en iode (environ 0,3 à 3 % en euthyroïdie et jusqu’à 25 % en hyperthyroïdie et en déplétion iodée), l’accumulation maximale est atteinte environ 20 minutes après l’injection puis diminue rapidement. Il en est de même pour les cellules pariétales de la muqueuse gastrique et les acini des glandes salivaires.
Contrairement à la thyroïde qui libère du pertechnetate de sodium (99mTc) dans la circulation sanguine, les glandes salivaires et l'estomac sécrètent le pertechnetate de sodium (99mTc) respectivement dans la salive et le suc gastrique.
L’accumulation dans les glandes salivaires est de l’ordre de 0,5 % de l’activité administrée et atteint sa valeur maximale au bout d’environ 20 minutes. Une heure après injection, la concentration salivaire est environ 10 à 30 fois supérieure à la concentration plasmatique.
L’excrétion peut être accélérée par la prise de jus de citron ou par une stimulation du système nerveux parasympathique ; le perchlorate réduit l’absorption.
Métabolisme
pas applicable
Élimination
Le technétium (99mTc) est rapidement éliminé du liquide céphalo-rachidien.
Après administration intraveineuse, le pertechnétate (99mTc) de sodium se répartit dans le système vasculaire d’où il est éliminé par trois principaux mécanismes:
•Diffusion dans le liquide interstitiel donnant une élimination rapide.
•Concentration du pertechnétate dans les tissus glandulaires, principalement la thyroïde, les glandes salivaires et le fundus gastrique.
•Filtration glomérulaire rénale donnant une élimination lente.
Demi-vie
La demi-vie plasmatique est d’environ trois heures.
Durant les 24 heures suivant l’administration, l’excrétion est principalement urinaire (environ 25 %); l’excrétion fécale apparaît dans les 48 heures suivantes. Environ 50 % de l’activité administrée est éliminée dans les 50 premières heures.
Lorsque le pertechnétate (99mTc) de sodium est administré après un pré-traitement par des agents réducteurs tels qu’étain stanneux / médronate ou étain stanneux / pyrophosphate qui conduit à l’incorporation d’étain stanneux dans les globules rouges, jusqu’à 95 % de l’activité administrée est fixée par les globules rouges. Le pertechnétate (99mTc) de sodium non lié est éliminé par voie rénale; l’activité plasmatique représente normalement moins de 5 % de l’activité intravasculaire.
Le sort du technétium (99mTc) est lié à celui des érythrocytes eux-mêmes et la radioactivité disparaît très lentement. On estime qu’il y a un faible relargage de la radioactivité par les globules rouges circulants.
Données précliniquesLes études de toxicité à doses uniques et à doses répétées, les études à long terme de cancérogénèse et de la fonction de reproduction n’ont pas été effectuées.
Toxicité pour la reproduction : Le passage transplacentaire du technétium (99mTc) après administration intraveineuse de pertechnétate (99mTc) de sodium a été étudié chez la souris. L’utérus pendant la gestation contenait plus de 60 % de l’activité injectée. Des études menées sur des souris pendant la gestation, pendant la gestation et la lactation, et pendant la lactation seule, ont montré des changements dans la descendance tels que réduction de poids, pilosité réduite et stérilité.
Remarques particulièresIncompatibilités
Ce médicament ne doit pas être mélangé avec d’autres médicaments à l’exception de ceux mentionnés dans la rubrique «Indications».
Stabilité
La date de calibration et la date de péremption («EXP») sont mentionnées sur l’étiquette.
Générateur du radionucléide : 21 jours à partir de la date de fabrication.
Éluat pertechnétate (99mTc) de sodium : à utiliser dans les 10 heures après élution, avec un maximum de 10 prélèvements.
Ce produit ne nécessite pas de précautions particulières de conservation.
Flacons d’élution : 24 mois.
Remarques particulières concernant le stockage
Générateur du radionucléide: Pas de précautions particulières de conservation concernant la température.
Éluat pertechnétate (99mTc) de sodium : Ce produit ne nécessite pas de précautions particulières de conservation.
Flacons sous vide : Ne pas conserver au-dessus de 25° C.
Le stockage doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs.
Remarques concernant la manipulation
Le générateur TEKCIS comprend:
·une pochette souple en polypropylène de 250 ml contenant la solution d’élution (1). Elle est connectée par une aiguille en acier inoxydable (2) à la partie supérieure de la colonne chromatographique.
·une colonne chromatographique en verre (3) fermée à ses deux extrémités par des bouchons en silicone munis de frittés en acier inoxydable (4). Cette colonne contient de l’alumine sur laquelle est adsorbée le molybdène-99.
·une aiguille de sortie (5) dont l’une des extrémités est connectée à la partie inférieure de la colonne. L’autre extrémité (6) peut recevoir un flacon d’élution pour éluer la colonne ou un flacon protecteur (STE-ELU) afin de préserver la stérilité entre deux élutions.
La colonne d'alumine et les aiguilles sont intégrées dans un blindage cylindro-conique (7) en plomb ou en tungstène. Jusqu'à 25 GBq, les générateurs sont équipés d'un blindage en plomb et celui de 50 GBq d'un blindage en tungstène.L’ensemble est placé dans une coque parallélépipédique (23 x 21 x 14 cm) en plastique moulé (8-9).
La coque plastique présente à sa partie supérieure l’aiguille pour élution protégée par un capuchon de transport ou un flacon protecteur (STE-ELU).
A côté de l’aiguille pour élution, se trouve un robinet (10) fermé au cours du transport.
Accessoires fournis avec le générateur:
·une pochette de 7 flacons d’élution (TC-ELU-5) (11), stériles et apyrogènes, avec un vide partiel permettant d'éluer 5 ml à 6 ml.
·un flacon stérile protecteur de l’aiguille pour élution (STE-ELU).
Chaque flacon d’élution ou flacon protecteur est un flacon de 15 ml en verre, incolore, type I de la Pharmacopée Européenne, fermé par un bouchon de caoutchouc et scellé par une capsule en aluminium.
·un conteneur d’élution (12) est fourni avec le premier envoi.
Le générateur TEKCIS est livré en conteneur de transport type A.
Schéma du générateur TEKCIS en mode élution

|
1
|
poche de solution pour élution
|
blindage cylindro-conique en plomb ou en tungstène
|
7
| |
2
|
aiguille de connexion
|
coque plastique inférieure
|
8
| |
3
|
colonne de chromatographie en verre
|
coque plastique supérieure
|
9
| |
4
|
bouchon en silicone + frittés en acier inoxydable
|
robinet
|
10
| |
5
|
aiguille de sortie en acier inoxydable
|
flacon d’élution
|
11
| |
6
|
aiguille pour élution
|
conteneur d’élution
|
12
|
Instructions pour la préparation des radiopharmaceutiques
L’élution du générateur doit être réalisée dans des locaux conformes à la réglementation nationale relative à la sécurité d'utilisation des produits radioactifs.
Il est recommandé de rester derrière un blindage supplémentaire adéquat (p.ex. paroi de plomb de 50 mm) pour effectuer l'élution du générateur ainsi que toutes les autres manipulations de la solution sodique. Le débit de dose à la surface et à 1 m de la surface ne doit pas dépasser 1mSv/h et 10 µSv/h respectivement. Les seringues utilisées pour la fabrication du produit radiopharmaceutique doivent également être munies d'un blindage en plomb (codes OS-2, OS-5, OS-10 et OS-P-10).
Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire à la fois aux normes de radioprotection et de qualité pharmaceutique. Les précautions appropriées d’asepsie doivent être prises afin de satisfaire aux exigences de Bonnes Pratiques de Fabrication pharmaceutique.
Comme avec tout produit radiopharmaceutique, si l’intégrité du flacon est compromise lors de la préparation de ce produit, celui-ci doit être rejeté.
Méthode de préparation:
Désinfecter le bouchon et l’aiguille d’élution avant chaque élution.
Important:
Ne pas projeter d'éthanol ou d'éther éthylique sur l'aiguille ni sur le bouchon du flacon récepteur, ce qui risquerait de perturber le processus d'élution. Durant le transport, la stérilité de l'aiguille pour élution est assurée par un capuchon.
Pour protéger l’aiguille pour élution d'une éventuelle contamination bactérienne, il est nécessaire, entre deux élutions, de mettre le flacon protecteur sur cette aiguille.
Respecter l’ordre de réalisation des séquences suivantes pour obtenir des résultats satisfaisants:
Première élution:
Lors de la mise en service, OUVRIR le robinet (10 ) en position ON, AVANT de mettre en place le flacon d'élution. Ne jamais refermer le robinet entre deux élutions. Le refermer seulement après la mise hors service définitive du générateur.
Pour éluer le générateur, il suffit de remplacer le capuchon ou le flacon protecteur par un conteneur d'élution (A) dans lequel a été placé un flacon d’élution sous vide correspondant au volume d'élution choisi (13).
On peut observer l'élution à travers la fenêtre de verre au plomb (14) du conteneur (A).
Attendre deux minutes pour que l'élution soit totale.
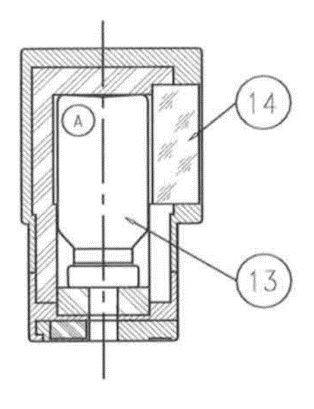
Vérifier la limpidité de l'éluat avant l'utilisation. Si l’éluat n’est pas clair, il devra être rejeté.
Après l'élution, remettre immédiatement le flacon protecteur en place pour préserver la stérilité de l'aiguille.
Volumes d'élution
Le générateur TEKCIS a été étudié pour éluer toute l'activité en technétium-99m disponible en 5 ml. Il n'est donc pas utile de procéder à des élutions fractionnées. En revanche, une élution avec des volumes plus importants peut être effectuée: 10 ml ou 15 ml.
Possibilités d'utilisation
L’activité inscrite sur l’étiquette du générateur est exprimée en technétium-99m disponible à la date de calibration (12 h CET).
L’activité en technétium-99m disponible est fonction:
·de l’activité en molybdène-99 au moment de l’élution;
·du temps écoulé depuis la dernière élution.
Contrôles de qualité
La limpidité de la solution, et la radioactivité doivent être vérifiés avant toute administration.
Chaque éluat doit être contrôlé visuellement à travers la fenêtre de verre plombé du récipient d'élution. Si l'éluat est trouble ou présente une coloration, il ne doit pas être utilisé. Le titulaire de l'autorisation doit immédiatement être informé.
La fuite de Molybdène-99 doit être testée par I'utilisateur conformément à I'ordonnance sur I'utilisation des sources radioactives non scellées, Il est fait référence à la méthode décrite dans la monographie 0124 de la Ph. Eur. (essai préliminaire).
Se référer aux rubriques « Propriétés physiques » et « Propriétés chimiques » dans « Propriétés / Effets ».
Masse de technétium (99mTc + 99Tc) présent dans l'éluat:
Le molybdène-99 se transforme en technétium-99m (87,6 % des désintégrations du molybdène-99) et en technétium-99 (12,4 % des désintégrations du molybdène-99). Le calcul de la masse totale en technétium ((99mTc) + (99Tc)) exprimée en μg de technétium présent dans l'éluat, se fait en utilisant la formule simplifiée suivante:
|
M (µg)
|
=
|
Technetium-99m-Aktivität des Eluats x k
| |
F
|
k = 5,161.10-3 (activité exprimée en GBq)
F représente le rapport du nombre d'atomes de technétium-99m (N99m) sur le nombre total d'atomes de technétium (Nt):
Les valeurs de ce rapport (F) en fonction du temps écoulé entre deux élutions sont données dans le tableau suivant:
|
Heures
|
Jours
| |
|
0
|
1
|
2
|
3
|
4
|
5
|
6
| |
0
|
-
|
0,277
|
0,131
|
0,076
|
0,0498
|
0,0344
|
0,0246
| |
3
|
0,727
|
0,248
|
0,121
|
0,072
|
0,0474
|
0,0329
|
0,0236
| |
6
|
0,619
|
0,223
|
0,113
|
0,068
|
0,0452
|
0,0315
|
0,0227
| |
9
|
0,531
|
0,202
|
0,105
|
0,064
|
0,0431
|
0,0302
|
0,0218
| |
12
|
0,459
|
0,184
|
0,098
|
0,061
|
0,0411
|
0,0290
|
0,0210
| |
15
|
0,400
|
0,168
|
0,092
|
0,058
|
0,0393
|
0,0278
|
0,0202
| |
18
|
0,352
|
0,154
|
0,086
|
0,055
|
0,0375
|
0,0266
|
0,0194
| |
21
|
0,311
|
0,141
|
0,081
|
0,052
|
0,0359
|
0,0256
|
0,0187
|
Exemples:
On élue le technétium-99m d'un générateur dans 5 ml; l’activité mesurée est de 10 GBq; la précédente élution remonte à 27 heures.
La masse de technétium sera de:
|
M (µg)
|
=
|
10 x 5,161 x 10-3
|
=
|
0,208 µg
| |
0,248
|
soit: 0,042 µg/ml.
On élue le technétium-99m d'un générateur 4 jours après sa préparation (il s'agit alors pour l'utilisateur d'une première élution). Pour une activité éluée de 10 GBq dans 5 ml, la masse de technétium est:
|
M (µg)
|
=
|
10 x 5,161 x 10-3
|
=
|
1,036 µg
| |
0,0498
|
soit: 0,207 μg/ml, c'est-à-dire cinq fois plus de technétium que dans l'exemple précédent.
Bien que faible, cette quantité de technétium peut perturber le rendement de marquage de certains composés.
Précautions de manipulation
Sans blindage supplémentaire, le débit de dose mesuré au contact du générateur est au maximum de:
|
Activité nominale du générateur, exprimée en technétium-99m éluable à la date de référence (GBq)
|
2
|
4
|
6
|
8
|
10
|
12
|
16
|
20
|
25
|
50 **
| |
Débit de dose maximum *
(mSv/heure)
|
0,2
|
0,5
|
0,75
|
1,0
|
1,2
|
1,4
|
1,9
|
2,4
|
3
|
2,8
|
*mesuré à date de fabrication pour un générateur calibré à 8 jours
**jusqu'à 25 GBq, les générateurs sont équipés d'un blindage en plomb et celui de 50 GBq d'un blindage en tungstène.
Dispositions légales
Précautions et données d’activité
L’administration de produits radioactifs chez l’homme est réglementée par «L’Ordonnance sur la radioprotection» resp. I'ordonnance sur I'utilisation des sources radioactives non scellées (voir la version la plus actuelle).Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans les services agréés. Leur réception, leur stockage, leur utilisation, leur transfert et leur élimination sont soumis à une autorisation préalable de l’Office fédéral de la santé publique.
Élimination des déchets
Lors de l’emploi de produits radioactifs et de l’élimination de déchets radioactifs provenant de leur utilisation, toutes les précautions décrites dans ladite ordonnance doivent être respectées afin de maintenir l’exposition aux radiations du patient et du personnel soignant au strict minimum. Les solutions non utilisées ainsi que le matériel contaminé lors de leur utilisation doivent être stockés dans un local prévu à cet effet, jusqu’à décroissance de la radioactivité au seuil de la radioactivité tolérée pour l’isotope concerné.
L'administration de produits radiopharmaceutiques présente des risques pour l'entourage du patient en raison de l'irradiation externe ou de la contamination par les urines, les vomissements, les expectorations. Par conséquent, il faut prendre des mesures de protection contre les radiations conformément aux réglementations nationales.
Numéro d’autorisation62442
PrésentationGénérateur de Technétium (99mTc)
|
Activités en Tc-99m (J 12h CET)
(Activité maximale éluable au jour de calibration, 12H00 CET)
|
2
|
4
|
6
|
8
|
10
|
12
|
16
|
20
|
25
|
50
|
GBq
|
Le générateur TEKCIS est livré en conteneur de transport type A.
Accessoires fournis avec le générateur:
·une pochette de 7 flacons d’élution (TC-ELU-5), stériles et apyrogènes, avec un vide partiel permettant d'éluer 5 ml à 6 ml.
·un flacon stérile protecteur de l’aiguille pour élution (STE-ELU).
·Chaque flacon d’élution ou flacon protecteur est un flacon de 15 ml en verre, incolore, type I de la Pharmacopée Européenne, fermé par un bouchon de caoutchouc et scellé par une capsule en aluminium.
·un conteneur d’élution (12) est fourni avec le premier envoi.
Autres accessoires disponibles:
·flacons d’élution de 15 ml:- soit sous vide partiel permettant d'éluer 5 à 6 ml (Réf. TC-ELU-5) ;- soit sous vide partiel permettant d'éluer 9 à 11 ml (Réf. TC-ELU-10);- soit sous vide permettant d'éluer 14 à 16 ml (Réf. TC-ELU-15).
·blindage supplémentaire en plomb s’adaptant au générateur TEKCIS: PROTECT ELU.
Catégorie de remise A
Titulaire de l’autorisationb.e.imaging AG
6430 Schwyz
Mise à jour de l’informationAoût 2023
|


