Propriétés/EffetsCode ATC
A10AE06
Mécanisme d'action
L'insuline dégludec se lie spécifiquement au récepteur de l'insuline humaine et a donc les mêmes effets pharmacologiques que l'insuline humaine.
L'effet hypoglycémiant de l'insuline dégludec est dû à la liaison de l'insuline aux récepteurs de l'insuline des cellules musculaires et adipeuses, facilitant ainsi l'assimilation du glucose, et à l'inhibition simultanée de la production hépatique de glucose.
Pharmacodynamique
Tresiba est une insuline basale qui forme des multi-hexamères solubles après injection sous-cutanée, ce qui entraîne un dépôt à partir duquel l'insuline dégludec est lentement absorbée en continu dans la circulation, avec pour résultat un effet hypoglycémiant stable et plat de l'insuline dégludec (voir Figure 1). Sur une période de 24 heures, avec un traitement une fois par jour, l'effet hypoglycémiant de Tresiba était réparti de manière égale entre les 12 premières heures et les 12 heures suivantes (AUCGIR,0-12h,SS/AUCGIR,total,SS = 0.5).
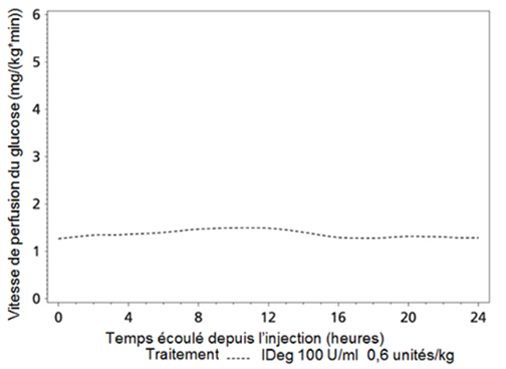
Figure 1: Taux moyen de perfusion de glucose (GIR) – Insuline dégludec à l'état d'équilibre (steady-state SS) lors de diabète de type 2
La durée d'action de Tresiba dans l'intervalle de doses thérapeutiques est supérieure à 42 heures (étude de clamp de glucose).
L'état d'équilibre est atteint 2 à 3 jours après la première dose administrée.
L'effet hypoglycémiant de l'insuline dégludec à l'état d'équilibre montre une variabilité d'un jour à l'autre plus faible en termes de coefficients de variation (CV) de l'effet hypoglycémiant durant l'intervalle entre les doses avec un CV% pour l'AUCGIR,τ,SS de 20% pour l'insuline dégludec et de 82% pour l'insuline glargine.
L'effet hypoglycémiant de Tresiba augmente linéairement avec la dose.
L'effet hypoglycémiant est comparable pour Tresiba 100 unités/ml et 200 unités/ml après l'administration d'une même dose des deux produits.
Il n'existe aucune différence cliniquement significative au niveau de la pharmacodynamique de Tresiba entre les sujets adultes âgés et plus jeunes.
Efficacité clinique
Neuf études cliniques multinationales, randomisées, contrôlées, en ouvert, en parallèle, «treat-to-target» d'une durée de 26 ou 52 semaines ont été menées, avec Tresiba une fois par jour chez un total de 3'815 patients (1'102 ayant un diabète de type 1 et 2'713 un diabète de type 2).
Tresiba a été testé chez des patients atteints de diabète de type 1 (Tableau 3), chez des patients n'ayant jamais reçu d'insuline (initiation de l'insuline lors de diabète de type 2, Tableau 4) et chez des patients sous insuline (intensification de l'insuline lors de diabète de type 2, Tableau 5). La non-infériorité concernant la baisse du taux de l'HbA1c entre le début de l'étude et la fin de l'étude a été confirmée dans toutes les études par rapport aux insulines de comparaison. Dans une méta-analyse prospective avec des patients avec un diabète de type 1 et un diabète de type 2, Tresiba était supérieur en termes de diminution du nombre d'épisodes d'hypoglycémie confirmée apparaissant sous traitement (s'expliquant par un bénéfice dans le diabète de type 2, voir Tableau 2) et d'épisodes d'hypoglycémie nocturne confirmée.
Tableau 2: Résultats de la méta-analyse sur l'hypoglycémie
|
Rapport du risque estimé
(insuline dégludec/insuline glargine (100 U/ml))
|
Hypoglycémies confirméesa
| |
Total
|
Nocturnes
| |
Diabète de type 1 + diabète de type 2 (poolés)
|
0.91*
|
0.74*
| |
Phase d'entretienb
|
0.84*
|
0.68*
| |
Sujets âgés ≥65 ans
|
0.82
|
0.65*
| |
Diabète de type 1
|
1.10
|
0.83
| |
Phase d'entretienb
|
1.02
|
0.75*
| |
Diabète de type 2
|
0.83*
|
0.68*
| |
Phase d'entretienb
|
0.75*
|
0.62*
| |
Insuline basale seule chez des patients n'ayant jamais reçu d'insuline
|
0.83*
|
0.64*
|
* Statistiquement significatif.
a L'hypoglycémie confirmée était définie comme un épisode confirmé par une glycémie plasmatique <3.1 mmol/l ou par la nécessité d'aide au patient par une tierce personne. L'hypoglycémie nocturne confirmée était définie comme un épisode survenant entre minuit et 6 heures du matin.
b Episodes à partir de la 16e semaine.
Tableau 3: Résultats d'études ouvertes sur le diabète de type 1
|
|
52 semaines de traitement
|
26 semaines de traitement
| |
Tresiba1
|
Insuline glargine
(100 U/ml)1
|
Tresiba1
|
Insuline détémir1
| |
N
|
472
|
157
|
302
|
153
| |
HbA1c (%)
| |
Fin de l'étude
|
7.3
|
7.3
|
7.3
|
7.3
| |
Variation moyenne
|
-0.40
|
-0.39
|
-0.73
|
-0.65
| |
|
Différence: -0.01
[-0.14; 0.11]
|
Différence: -0.09
[-0.23; 0.05]
| |
Glucose plasmatique à jeun (mmol/l)
| |
Fin de l'étude
|
7.8
|
8.3
|
7.3
|
8.9
| |
Variation moyenne
|
-1.27
|
-1.39
|
-2.60
|
-0.62
| |
|
Différence: -0.33
[-1.03; 0.36]
|
Différence: -1.66
[-2.37; -0.95]
| |
Taux d'hypoglycémie (par patient-année d'exposition)
| |
Sévère
|
0.21
|
0.16
|
0.31
|
0.39
| |
Confirmée2
|
42.54
|
40.18
|
45.83
|
45.69
| |
|
Rapport: 1.07
[0.89; 1.28]
|
Rapport: 0.98
[0.80; 1.20]
| |
Nocturne confirmée2
|
4.41
|
5.86
|
4.14
|
5.93
| |
|
Rapport: 0.75
[0.59; 0.96]
|
Rapport: 0.66
[0.49; 0.88]
| |
Dose moyenne quotidienne d'insuline à la fin de l'étude
(unités: unités/kg)
|
61.4:0.7
|
66.2:0.8
|
60.6:0.9
|
68.9:1.0
|
1 Administration une fois par jour + insuline aspart pour couvrir les besoins en insuline nécessaires pour les repas.
2 L'hypoglycémie confirmée était définie comme un épisode confirmé par une glycémie plasmatique <3.1 mmol/l ou par la nécessité d'aide au patient par une tierce personne. L'hypoglycémie nocturne confirmée était définie comme un épisode survenant entre minuit et 6 heures du matin.
Tableau 4: Résultats d'études sur le diabète de type 2 avec des patients insulino-naïfs (premier traitement à l'insuline)
|
|
52 semaines de traitement
|
26 semaines de traitement
| |
Tresiba1
|
Insuline glargine
(100 U/ml)1
|
Tresiba1
|
Insuline glargine
(100 U/ml)1
| |
N
|
773
|
257
|
228
|
229
| |
HbA1c (%)
| |
Fin de l'étude
|
7.1
|
7.0
|
7.0
|
6.9
| |
Variation moyenne
|
-1.06
|
-1.19
|
-1.30
|
-1.32
| |
|
Différence: 0.09
[-0.04; 0.22]
|
Différence: 0.04
[-0.11; 0.19]
| |
Glucose plasmatique à jeun (mmol/l)
| |
Fin de l'étude
|
5.9
|
6.4
|
5.9
|
6.3
| |
Variation moyenne
|
-3.76
|
-3.30
|
-3.70
|
-3.38
| |
|
Différence: -0.43
[-0.74; -0.13]
|
Différence: -0.42
[-0.78; -0.06]
| |
Taux d'hypoglycémie (par patient-année d'exposition)
| |
Sévère
|
0
|
0,02
|
0
|
0
| |
Confirmée2
|
1.52
|
1.85
|
1.22
|
1.42
| |
|
Rapport: 0.82 [0.64; 1.04]
|
Rapport: 0.86 [0.58; 1.28]
| |
Nocturne confirmée2
|
0.25
|
0.39
|
0.18
|
0.28
| |
|
Rapport: 0.64
[0.42; 0.98]
|
Rapport: 0.64
[0.30; 1.37]
| |
Dose moyenne quotidienne d'insuline à la fin de l'étude
(unités: unités/kg)
|
56.0:0.6
|
57.8:0.6
|
59.5:0.6
|
62.7:0.7
|
1 Administration une fois par jour + metformine ± inhibiteur de la DPP-4.
2 L'hypoglycémie confirmée était définie comme un épisode confirmé par un taux plasmatique de glucose <3.1 mmol/l ou par la nécessité d'aide au patient par une tierce personne. L'hypoglycémie nocturne confirmée était définie comme un épisode survenant entre minuit et 6 heures du matin.
Tableau 5: Résultats d'études sur le diabète de type 2 - patients préalablement sous insuline basale
|
|
52 semaines de traitement
| |
Tresiba1
|
Insuline glargine
(100 U/ml)1
| |
N
|
744
|
248
| |
HbA1c (%)
|
| |
Fin de l'étude
|
7.1
|
7.1
| |
Variation moyenne
|
-1.17
|
-1.29
| |
|
Différence: 0.08 [-0.05; 0.21]
| |
Glucose plasmatique à jeun (mmol/l)
| |
Fin de l'étude
|
6.8
|
7.1
| |
Variation moyenne
|
-2.44
|
-2.14
| |
|
Différence: -0.29 [-0.65; 0.06]
| |
Taux d'hypoglycémie (par patient–année d'exposition)
| |
Hypoglycémie sévère
|
0.06
|
0.05
| |
Confirmée2
|
11.09
|
13.63
| |
|
Rapport: 0.82 [0.69; 0.99]
| |
Confirmée nocturne2
|
1.39
|
1.84
| |
|
Rapport: 0.75 [0.58; 0.99]
| |
Dose moyenne quotidienne d'insuline à la fin de l'étude
(unités: unités/kg)
|
143.1: 1.5
|
139.0: 1.4
|
1 Administration une fois par jour + insuline aspart pour couvrir les besoins en insuline nécessaires pour les repas ± metformine ± pioglitazone.
2 L'hypoglycémie confirmée était définie comme un épisode confirmé par un taux plasmatique de glucose <3.1 mmol/l ou par la nécessité d'aide au patient par une tierce personne. L'hypoglycémie nocturne confirmée était définie comme un épisode survenant entre minuit et 6 heures du matin.
Par ailleurs, deux essais randomisés en double-aveugle, contrôlés en cross over, treat-to-target de 64 semaines, ont été menés chez des patients présentant au moins un facteur de risque d'hypoglycémie et présentant un diabète de type 1 (501 patients) ou un diabète de type 2 (721 patients).
Les patients ont été randomisés pour recevoir soit du Tresiba soit de l'insuline glargine (100 unités/ml), suivis d'un cross over. Les études ont évalué le taux d'hypoglycémie après traitement par Tresiba par rapport à l'insuline glargine (100 unités/ml) (voir Tableau 6).
Tableau 6: Résultats des études cliniques cross-over en double-aveugle dans le diabète de type 1 et le diabète de type 2
|
|
Diabète de type 1
|
Diabète de type 2
| |
Tresiba1
|
Insuline glargine
(100 U/ml)1
|
Tresiba2
|
Insuline glargine
(100 U/ml)2
| |
N
|
501
|
721
| |
HbA1c (%)
| |
Début du traitement
|
7.6
|
7.6
| |
Fin du traitement
|
6.9
|
6.9
|
7.1
|
7.0
| |
Glycémie à jeun (mmol/l)
| |
Début du traitement
|
9.4
|
7.6
| |
Fin du traitement
|
7.5
|
8.4
|
6.0
|
6.1
| |
Taux d'hypoglycémies sévères3
| |
Phase d'entretien4
|
0.69
|
0.92
|
0.05
|
0.09
| |
Ratio: 0.65 [0.48; 0.89]
|
Ratio: 0.54 [0.21; 1.42]
| |
Taux d'hypoglycémies sévères ou d'hypoglycémies symptomatiques confirmées 3,5
| |
Phase d'entretien4
|
22.01
|
24.63
|
1.86
|
2.65
| |
Ratio: 0.89 [0.85; 0.94]
|
Ratio: 0.70 [0.61; 0.80]
| |
Taux d'hypoglycémies sévères ou d'hypoglycémies nocturnes symptomatiques confirmées 3,5
| |
Phase d'entretien4
|
2.77
|
4.29
|
0.55
|
0.94
| |
|
Ratio: 0.64 [0.56; 0.73]
|
Ratio: 0.58 [0.46; 0.74]
|
1 Dans un schéma posologique en une fois par jour + insuline asparte pour couvrir les besoins en insuline au moment des repas
2 Dans un schéma posologique en une fois par jour ± ADO (toute association de metformine, inhibiteur de la dipeptidyl-peptidase-4, inhibiteur de l'alpha-glucosidase, thiazolidinediones et d'inhibiteur de sodium/glucose-cotransporter-2)
3 Par patient-année d'exposition
4 Épisodes à partir de la semaine 16 dans chaque période de traitement
5 L'hypoglycémie symptomatique confirmée était définie comme un épisode confirmé par une glycémie plasmatique <3.1 mmol/l. L'hypoglycémie nocturne confirmée était définie comme un épisode survenant entre minuit et 6 heures du matin.
Évaluation cardiovasculaire
DEVOTE est un essai clinique randomisé, mené en double-aveugle, comparant la sécurité cardiovasculaire de l'insuline dégludec à celle de l'insuline glargine (100 unités/ml) chez 7'637 patients présentant un diabète de type 2 avec un risque élevé d'évènements cardiovasculaires. La durée de l'étude a été déterminée en fonction des évènements, c'est-à-dire que l'étude a été menée jusqu'à ce que 633 événements soient survenus. La durée du traitement était de 1.83 année (médiane) et le temps d'observation était de 1.99 année (médiane).
L'analyse primaire était le délai de survenue, depuis la randomisation, du premier évènement cardiovasculaire majeur (MACE, major adverse cardiovascular event). Le MACE comprenait trois composants: la «mortalité cardiovasculaire», l'«infarctus du myocarde non fatal» ou l'«accident vasculaire cérébral non fatal».
Afin d'exclure une augmentation du risque cardiovasculaire relatif de plus de 30%, l'essai a été conçu comme un essai de non-infériorité. La limite supérieure de l'intervalle de confiance (IC) à 95% du RR d'un MACE était inférieure au seuil prédéfini de 1.3, démontrant ainsi la sécurité cardiovasculaire de l'insuline dégludec par rapport à l'insuline glargine (Figure 2).
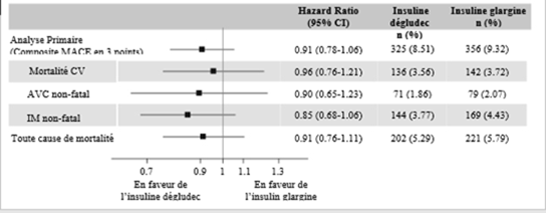
n: nombre de sujets avec un premier événement confirmé pendant l'essai par le EAC.
%: pourcentage de sujets avec un premier événement confirmé par le EAC relatif au nombre de sujets randomisés.
EAC: comité d'arbitrage d'événements.
IC: intervalle de confiance.
Figure 2: Graphique en forêt de l'analyse du critère composite MACE en 3 points et des critères d'évaluation cardiovasculaires individuels dans DEVOTE
Les améliorations de l'HbA1c obtenues avec l'insuline dégludec et l'insuline glargine étaient également comparables (Tableau 7).
Le traitement par Tresiba a entraîné une réduction du taux d'événements hypoglycémiques sévères et de la proportion de patients ayant au moins une hypoglycémie sévère par rapport au traitement par l'insuline glargine (Tableau 7).
Tableau 7: Résultats de DEVOTE
|
|
Insuline dégludec1
|
Insuline glargine
(100 unités/ml)1
| |
N
|
3'818
|
3'819
| |
HbA1c moyenne (%)
| |
Valeur initiale
|
8.44
|
8.41
| |
Après 2 années de traitement
|
7.50
|
7.47
| |
|
Différence: 0.008 [-0.05; 0.07] IC à 95%
| |
Taux d'hypoglycémie (par 100 patients-année d'observation)
| |
Sévère
|
3.70
|
6.25
| |
|
Rapport des risques 0.60 [0.48; 0.76] IC à 95%
| |
Proportions de patients avec une hypoglycémie (pourcentage de patients)
| |
Sévère
|
4.9
|
6.6
| |
|
Taux de ratio: 0.73 [0.60; 0.89] IC à 95%
|
1 En ajout à une prise en charge standard du diabète et de la maladie cardiovasculaire.
Population pédiatrique
L'efficacité et la sécurité de Tresiba ont été étudiées au cours d'une étude clinique randomisée 1:1 et contrôlée, menée chez des enfants et des adolescents présentant un diabète de type 1, d'une durée de 26 semaines (n = 350) suivie d'une prolongation de 26 semaines (n = 280). Le bras Tresiba comprenait 43 enfants âgés de 1 à 5 ans, 70 enfants entre 6 et 11 ans et 61 adolescents entre 12 et 17 ans. Par rapport au médicament de comparaison, l'insuline détémir, administrée une ou deux fois par jour, l'administration de Tresiba une fois par jour a montré une diminution similaire de la valeur de l'HbA1c à la semaine 52 et une diminution plus importante de la valeur de glycémie à jeun (par rapport à la situation de base). Ceci a été atteint avec une dose quotidienne de Tresiba de 30% inférieure à la dose d'insuline détémir. Les taux (évènements par patient-année d'exposition) d'hypoglycémies sévères (définition de l'ISPAD; 0.51 versus 0.33), d'hypoglycémies confirmées (57.71 versus 54.05) et d'hypoglycémies confirmées nocturnes (6.03 versus 7.60) étaient comparables sous Tresiba et sous insuline détémir. Dans les deux groupes de traitement, les enfants de 6 à 11 ans ont montré un taux d'hypoglycémies confirmées plus élevé en nombre que les autres groupes d'âge. Un taux d'hypoglycémies sévères plus élevé en nombre a été observé chez les enfants âgés de 6 à 11 ans dans le bras d'étude Tresiba.
Le taux d'épisodes hyperglycémiques avec cétose était plus bas sous Tresiba que sous insuline détémir, de 0.68 versus 1.09. Sous Tresiba, aucun problème de sécurité sur le plan des effets indésirables et des paramètres standards de sécurité n'a été constaté. Le développement d'anticorps était minime et n'avait aucun retentissement clinique.
Les essais chez l'animal sur la reproduction sous l'insuline dégludec n'ont pas révélé d'effets négatifs sur la capacité de reproduction.
Grossesse
Une étude clinique randomisée en ouvert (EXPECT) a comparé l'efficacité et la sécurité de deux insulines basales (insuline dégludec [92 femmes] et insuline détémir [96 femmes]) chez des patientes diabétiques de type 1 qui planifiaient une grossesse ou étaient déjà enceintes. Toutes les participantes, traitées dans le cadre d'un schéma thérapeutique de type basal-bolus, ont reçu en complément de l'insuline asparte.
Concernant l'effet hypoglycémiant, l'insuline dégludec était non inférieure à l'insuline détémir (voir Tableau 8).
Tableau 8: Résultats de l'étude clinique randomisée en ouvert, avec comparateur actif, chez des femmes enceintes diabétiques de type 1
|
|
Tresiba®
|
Insuline détémir
| |
Population d'analyse FAS (Full Analysis Set) de femmes enceintes (N)
|
92
|
96
| |
HbA1c (%) initiale au début du traitement
| |
N
|
87
|
90
| |
Moyenne (ET)
|
6.73 (0.65)
|
6.56 (0.77)
| |
HbA1c (%) à la dernière visite prévue avant l'accouchement
| |
N
|
84
|
84
| |
Moyenne (ET)
|
6.30 (0.70)
|
6.26 (0.73)
| |
Écart estimé entre les traitements
|
-0.11 point de pourcentage [-0.31; 0.08] IC à 95%;
p <0.0001
| |
HbA1c ≤6.0% – au cours de la période de grossesse pendant la participation à l'étude – valeur initiale au début du traitement
| |
N
|
87
|
90
| |
Pourcentage de participantes
|
12.6
|
28.9
| |
HbA1c ≤6.0% – au cours de la période de grossesse pendant la participation à l'étude – à la dernière visite prévue avant l'accouchement
| |
N
|
84
|
84
| |
Pourcentage de participantes
|
42.9
|
36.9
| |
Odds Ratio estimé
|
1.95 [0.92; 4.17] IC à 95%; p = 0.0832
| |
HbA1c ≤6.5% – au cours de la période de grossesse pendant la participation à l'étude – valeur initiale au début du traitement
| |
N
|
87
|
90
| |
Pourcentage de participantes
|
39.1
|
45.6
| |
HbA1c ≤6.5% – au cours de la période de grossesse pendant la participation à l'étude – à la dernière visite prévue avant l'accouchement
| |
N
|
84
|
84
| |
Pourcentage de participantes
|
69.0
|
63.1
| |
Odds Ratio estimé
|
2.05 [0.97; 4.33] IC à 95%; p = 0.0617
|
Aucune différence majeure n'a été observée entre l'insuline dégludec et l'insuline détémir dans l'étude EXPECT concernant les critères d'évaluation de la sécurité maternelle (hypoglycémie, accouchement avant le terme, pré-éclampsie, césarienne non planifiée et événements indésirables au cours de la grossesse). Une pré-éclampsie est survenue chez 12 sujets traités par l'insuline dégludec (13.2%) et chez 7 sujets traités par l'insuline détémir (7.4%). Une césarienne non planifiée a dû être pratiquée chez 23 patientes sous insuline dégludec (25.3%) et chez 15 patientes sous insuline détémir (16.0%). Une appréciation définitive de ces écarts est difficile considérant la petite population de l'étude. La plupart des événements indésirables signalés dans les deux groupes étaient sans gravité et peu susceptibles d'être liés au médicament étudié.
Aucun décès périnatal ou néonatal n'a été rapporté. Aucune différence cliniquement significative n'a été constatée entre l'insuline dégludec et l'insuline détémir pour ce qui est des critères d'évaluation de la grossesse (mort fœtale précoce, présence d'anomalies majeures, hypoglycémie néonatale, mortalité périnatale, mortalité néonatale, macrosomie fœtale, grandeur pour l'âge gestationnel et événements indésirables chez le nourrisson au cours des 30 jours suivant la naissance).
L'emploi de Tresiba a été évalué lors d'une étude de sécurité prospective, non interventionnelle, post-commercialisation (EVOLVE), dans un petit sous-groupe de femmes enceintes (n = 41). Les résultats plaident en faveur de l'utilisation de Tresiba chez les femmes diabétiques enceintes puisque aucun risque en termes de sécurité n'a été relevé au cours de l'étude.
| 

