Propriétés/EffetsCode ATC
R03BB06
Mécanisme d'action
Seebri Breezhaler est un antagoniste des récepteurs muscariniques (anticholinergique) de longue durée d'action, administré par voie inhalée, indiqué dans le traitement bronchodilatateur d'entretien par voie inhalée de la BPCO. Les nerfs parasympathiques forment les voies nerveuses bronchoconstrictrices les plus importantes des voies aériennes et le tonus cholinergique est la principale composante réversible de l'obstruction des voies aériennes dans la BPCO. Seebri Breezhaler inhibe l'action bronchoconstrictrice de l'acétylcholine sur les cellules des muscles lisses des voies aériennes et produit ainsi une dilatation de ces dernières.
Des cinq sous-types de récepteurs muscariniques connus (M1-5), seuls les sous-types M1-3 ont une fonction physiologique bien définie dans le poumon humain. Le bromure de glycopyrronium est un antagoniste des récepteurs muscariniques ayant une forte affinité pour ces trois sous-types de récepteurs. Dans les essais de liaison compétitive, la substance a présenté une sélectivité 4 à 5 plus élevée pour les récepteurs M3 et M1 humains que pour le récepteur M2 humain. Comme cela a été démontré au cours des essais cliniques par l'observation des paramètres cinétiques de l'association/dissociation aux récepteurs et du délai d'action après l'inhalation, elle présente un délai d'action rapide.
On peut supposer, à partir de la demi-vie d'élimination terminale prolongée du glycopyrronium à la suite de l'inhalation de Seebri Breezhaler par rapport à la demi-vie après une injection i.v., que la longue durée d'action est partiellement due à la persistance des concentrations de principe actif dans les poumons (voir «Pharmacocinétique»).
Pharmacodynamique
Effets pharmacodynamiques primaires
Dans une série d'essais cliniques sur la pharmacocinétique et l'efficacité, Seebri Breezhaler a entraîné des améliorations tout à fait significatives de la fonction pulmonaire (mesurée par le volume expiratoire maximal par seconde, VEMS) durant 24 heures.
Les études pivot ont révélé un délai d'action rapide de l'ordre de 5 minutes après inhalation de Seebri Breezhaler avec une augmentation du VEMS de 0,091 l à 0,094 l versus valeur initiale. Dans l'étude sur 52 semaines, Seebri Breezhaler a induit une valeur de VEMS significativement plus élevée au jour 1 et à la semaine 26 que le tiotropium. Le VEMS était d'autre part numériquement supérieur durant les 4 premières heures après la prise de Seebri Breezhaler aux semaines 12 et 52 versus tiotropium.
L'action bronchodilatatrice de Seebri Breezhaler s'est maintenue durant 24 heures. Aucun indice suggérant une tachyphylaxie pour l'effet bronchodilatateur n'a été relevé après des doses répétées sur une période allant jusqu'à 52 semaines.
Effets pharmacodynamiques secondaires
Aucune modification de la fréquence cardiaque moyenne ou de l'intervalle QTc n'a été observée après l'inhalation de Seebri Breezhaler à des doses allant jusqu'à 176 microgrammes chez des patients avec BPCO. Dans une grande étude sur le QT chez 73 sujets sains, une dose inhalée unique de 352 microgrammes de glycopyrronium (8 fois la dose thérapeutique) n'a pas entraîné d'allongement de l'intervalle QTc et n'a induit qu'une discrète diminution de la fréquence cardiaque (effet maximal: -5,9 pulsations/min; effet moyen sur 24 heures: -2,8 pulsations/min) par rapport au placebo. L'effet de 150 microgrammes de bromure de glycopyrronium (soit 120 microgrammes de glycopyrronium) sur la fréquence cardiaque et l'intervalle QTc après injection intraveineuse a été évalué chez des sujets jeunes en bonne santé. Les concentrations maximales (Cmax) atteintes correspondaient à environ 50 fois l'exposition après l'inhalation de 44 microgrammes de glycopyrronium à l'état d'équilibre et n'étaient associées ni à une tachycardie, ni à des allongements de l'intervalle QTc. Une légère réduction de la fréquence cardiaque (différence moyenne sur 24 h: -2 pulsations/min versus placebo) a été observée; il s'agit d'un effet connu des anticholinergiques à faibles concentrations chez les sujets jeunes en bonne santé.
Au cours d'une étude «approfondie du QT/QTc» incluant 73 personnes en bonne santé, la dose inhalée de 352 microgrammes de Seebri Breezhaler (soit 8 fois la dose thérapeutique) n'a entraîné, par rapport au placebo, aucun allongement de l'intervalle QTc, mais a légèrement diminué la fréquence cardiaque (effet maximal 5,9 bpm; effet moyen sur 24 heures 2,8 bpm).
Efficacité clinique
Le programme de développement clinique de phase III de Seebri Breezhaler a compris deux études clés (une étude contrôlée par placebo sur 6 mois et une étude contrôlée par placebo et par substance active sur 12 mois), ayant inclus au total 1888 patients porteurs d'un diagnostic clinique de BPCO. Les patients étaient âgés de 40 ans ou plus et présentaient une anamnèse de tabagisme d'au moins 10 paquets-années, un VEMS post-bronchodilatateur < 80% et ≥30% de la valeur normale prédite, ainsi qu'un rapport VEMS/CVF inférieur à 70%. Les patients porteurs de cardiopathies et/ou avec des contre-indications aux anticholinergiques étaient exclus.
Fonction pulmonaire
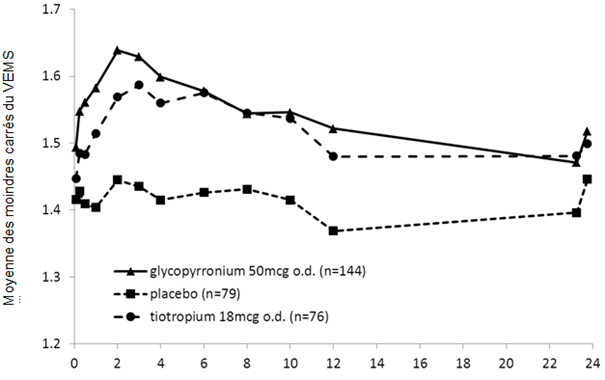
Dans le cadre de ces essais cliniques, Seebri Breezhaler a entraîné, à la dose de 50 microgrammes une fois par jour, des améliorations cliniquement significatives de la fonction pulmonaire (mesurée par le volume expiratoire maximal par seconde, VEMS) durant 24 heures. Concernant le principal critère d'évaluation à 12 semaines (VEMS résiduel après 24 heures), Seebri Breezhaler a induit une amélioration de la bronchodilatation de 0,108 l et de 0,097 l versus placebo dans les études respectivement sur 6 mois et sur 12 mois (p < 0,001). Dans la seconde étude, l'amélioration versus placebo dans le groupe non aveugle sous 18 microgrammes de tiotropium une fois par jour était de 0,083 l (p < 0,001).
Dans les études pivot, l'effet de Seebri Breezhaler est apparu rapidement, dans les 5 minutes après l'inhalation, avec une augmentation du VEMS par rapport à la valeur initiale de l'ordre de 0,091 l à 0,094 l.
Les améliorations du VEMS résiduel moyen observées pour le principal critère d'évaluation (12 semaines) se sont maintenues pendant toute la durée de l'étude, aussi bien dans l'étude sur 6 mois que dans l'étude sur 12 mois. Le VEMS résiduel moyen a augmenté de 0,1008 l versus placebo à la semaine 12 de l'étude sur 6 mois et de 0,113 l à la semaine 26 de l'étude sur 6 mois; dans l'étude sur 12 mois, celui-ci a augmenté de 0,097 l à la semaine 12 et de 0,108 l à la semaine 52.
Ces données suggèrent que l'effet bronchodilatateur de Seebri Breezhaler sur 24 heures s'est maintenu tout au long d'une période d'un an à partir de la première dose.
Des mesures spirométriques ont été réalisées en série durant l'étude sur 6 mois au jour 1 (fig. 1-1), à la semaine 12 (fig. 1-2) et à la semaine 26. Dans l'étude sur 12 mois, des mesures spirométriques ont été réalisées en série au jour 1 (fig. 1-3), à la semaine 12 (fig. 1-4) et à la semaine 52.
Les données des mesures spirométriques en série ont été utilisées pour calculer l'aire sous la courbe (AUC) standardisée du VEMS (en fonction du temps). Dans l'étude sur 6 mois, Seebri Breezhaler a induit une amélioration versus placebo de l'AUC du VEMS 0−24h de 0,133 l et de 0,199 l respectivement aux semaines 12 et 26 (p < 0,001). À la semaine 12 de l'étude sur 12 mois, Seebri Breezhaler a induit une amélioration versus placebo de l'AUC du VEMS 0−24h de 0,106 l (p < 0,001); pour le tiotropium, la différence du traitement par rapport au placebo était de 0,079 l (p = 0,014). À la semaine 52 de l'étude sur 12 mois, Seebri Breezhaler a entraîné une amélioration versus placebo de l'AUC du VEMS 0−24h de 0,106 l (p < 0,001); pour le tiotropium, la différence du traitement par rapport au placebo était de 0,040 l (p = 0,279).
L'importance de l'effet bronchodilatateur de Seebri Breezhaler dépend probablement du degré de réversibilité de la limitation du flux respiratoire au début de l'étude (celle-ci avait été évaluée par l'administration d'un antagoniste muscarinique bronchodilatateur à courte durée d'action): les analyses de sous-groupes secondaires correspondantes ont montré que les patients ayant le degré de réversibilité le plus faible au début de l'étude (< 5%) présentaient généralement aussi une réaction bronchodilatatrice plus faible que ceux dont le degré de réversibilité au même moment était plus élevé (≥5%). Chez les patients ayant le degré de réversibilité le plus faible au début de l'étude (< 5%), Seebri Breezhaler a entraîné, par rapport au placebo, une augmentation du VEMS résiduel de 0,072 l après 12 semaines (critère d'évaluation principal), et chez ceux ayant un degré de réversibilité plus élevé au même moment (≥5%), une augmentation du VEMS résiduel de 0,113 l (p < 0,05 dans chaque cas). Des résultats comparables ont été observés chez les patients sous tiotropium. Après 12 semaines de traitement par tiotropium, les patients ayant le degré de réversibilité le plus faible au début de l'étude (< 5%) ont présenté, par rapport au placebo, une augmentation du VEMS résiduel de 0,059 l, alors que ceux dont le degré de réversibilité était plus élevé au même moment (≥5%) ont présenté, par rapport au placebo, une augmentation du VEMS résiduel de 0,097 l.
Figure 1-1 Étude pivot sur six mois: données des spirométries en série (moyenne des moindres carrés du VEMS (l)) après la première dose
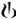
Figure 1-2 Étude pivot sur six mois: données des spirométries en série (moyenne des moindres carrés du VEMS (l)) à la semaine 12
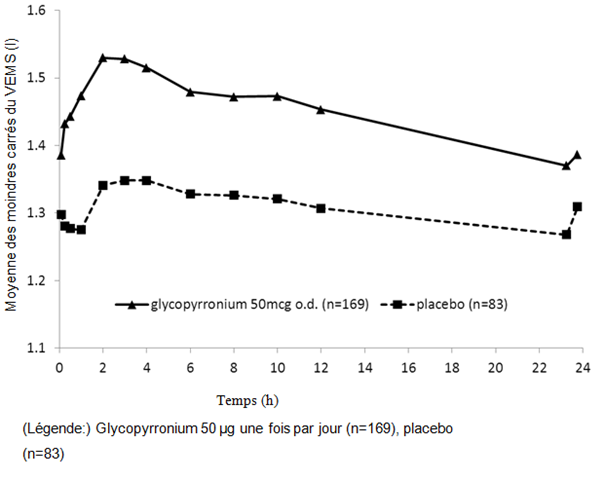
Figure 1-3 Étude pivot sur douze mois: données des spirométries en série (moyenne des moindres carrés du VEMS (l)) après la première dose
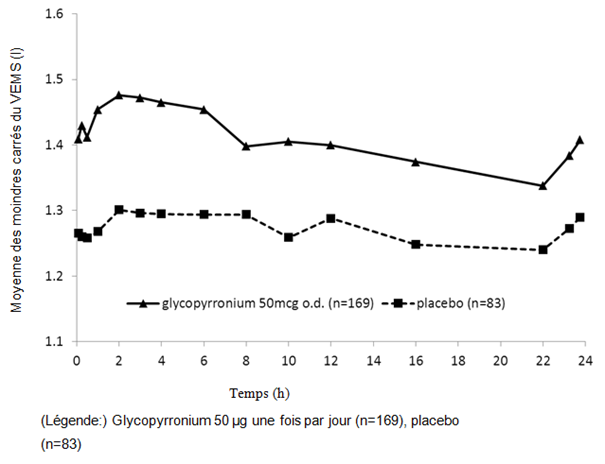
Figure 1-4 Étude pivot sur douze mois: données des spirométries en série (moyenne des moindres carrés du VEMS (l)) à la semaine 12
En plus de l'amélioration démontrée du VEMS, Seebri Breezhaler a aussi amélioré de manière consistante dans les deux essais pivot la capacité vitale forcée (CVF) et la capacité inspiratoire (CI). À la semaine 12, Seebri Breezhaler a induit dans les études sur 6 mois et sur 12 mois une augmentation respective de la CVF résiduelle moyenne versus placebo de 0,194 l et 0,183 l (p < 0,001). Seebri Breezhaler a amélioré la CI résiduelle à la semaine 12 des études sur 6 et 12 mois de 0,097 l et 0,129 l versus placebo (p < 0,001).
Efficacité sur les symptômes
La dose journalière unique de 50 µg de Seebri Breezhaler a diminué de manière significative la dyspnée estimée par le Transitional Dyspnea Index (TDI). Dans une analyse des données cumulées des deux études pivot sur 6 et 12 mois, le pourcentage de patients ayant répondu par une amélioration cliniquement significative du score TDI focal de ≥1 point à la semaine 26;était de 58,4% sous Seebri Breezhaler contre 46,4% chez les patients sous placebo et 53,4% chez les patients sous tiotropium. Les différences de taux de réponse étaient statistiquement significatives pour la comparaison Seebri Breezhaler versus placebo (< 0,001) et pour la comparaison tiotropium versus placebo (p = 0,009).
L'administration de Seebri Breezhaler 50 µg une fois par jour a également un effet significatif sur l'état de santé mesuré à l'aide du St. George's Respiratory Questionnaire (SGRQ). Une analyse des données cumulées des études pivot sur 6 et 12 mois a montré que le pourcentage des patients ayant répondu à Seebri Breezhaler par une amélioration cliniquement significative du score SGRQ global (≤ -4) à la semaine 26 était de 57,8% contre 47,6% chez les patients sous placebo et 61,0% chez ceux sous tiotropium. Les différences de taux de réponse étaient statistiquement significatives pour la comparaison Seebri Breezhaler versus placebo (< 0,001) et tiotropium versus placebo (p = 0,004).
Dans une analyse des données cumulées des études sur 6 et 12 mois, l'administration de Seebri Breezhaler 50 µg une fois par jour a significativement allongé le délai jusqu'à la première exacerbation modérée à sévère de la BPCO et diminué le nombre d'épisodes d'exacerbation modérée à sévère (les exacerbations étaient considérées comme modérées lorsqu'elles nécessitaient une corticothérapie systémique et/ou une antibiothérapie et comme sévères lorsqu'elles nécessitaient une hospitalisation). Le pourcentage de patients avec exacerbation de BPCO modérée à sévère de l'analyse cumulée d'une durée de 26 semaines était de 19,8% sous Seebri Breezhaler vs 27,2% sous placebo et le risque relatif estimé pour le délai jusqu'à des exacerbations modérées ou sévères était de 0,64 [IC à 95%: 0,520, 0,799; p < 0,001], ce qui correspond à une réduction du risque vs placebo de 36%. De la même façon, le risque relatif estimé pour le délai jusqu'à la première exacerbation sévère nécessitant une hospitalisation était de 0,39 [IC à 95%: 0,205, 0,728; p = 0,003]. Dans l'analyse cumulée d'une durée de 26 semaines, le taux d'exacerbations était significativement plus faible chez les patients sous Seebri Breezhaler que chez ceux sous placebo, le rapport des taux se situant vers 0,66 ([IC à 95%: 0,525, 0,841; p < 0,001]).
Par rapport au placebo, Seebri Breezhaler 50 µg une fois par jour a significativement réduit de 0,46 bouffées par jour (p = 0,005) le recours à la médication de secours pendant 26 semaines et de 0,37 bouffées par jour (p = 0,039) pendant 52 semaines durant les études sur 6 et 12 mois.
L'effet de Seebri Breezhaler en termes de réduction de l'hyperinflation dynamique et les améliorations de la tolérance de l'effort qui lui sont associées ont fait l'objet d'une étude randomisée, en double aveugle, contrôlée par placebo, chez 108 patients avec BPCO modérée à sévère. Seebri Breezhaler a atteint son effet maximal d'amélioration de la capacité inspiratoire à l'effort (0,23 l) et a entraîné une augmentation statistiquement significative de 43 secondes (une augmentation de 10%) de la durée d'effort après la première dose. Après 3 semaines de traitement, Seebri Breezhaler a amélioré la durée de l'effort de 89 secondes (une augmentation de 21%) et la capacité inspiratoire à l'effort a augmenté de 0,20 l.
Des mesures menées à l'aide de l'échelle de Borg ont montré que Seebri Breezhaler réduit la dyspnée et les douleurs des jambes. La diminution de la dyspnée de repos a également été mise en évidence à l'aide du Transitional Dyspnea Index (TDI).
|