Propriétés/EffetsCode ATC
A10BD10
Mécanisme d'action
Saxagliptine
La saxagliptine est un inhibiteur compétitif de la DPP-4. Chez les patients diabétiques de type 2, l'administration de saxagliptine a entraîné une inhibition de l'activité de l'enzyme DPP-4 pendant 24 heures. Après une charge orale de glucose, cette inhibition de la DPP-4 a provoqué une augmentation d'un facteur 2 à 3 des taux circulants d'hormones incrétines actives telles que le glucagon like peptid 1, GLP-1 et le polypeptide insulinotropique dépendant du glucose, GIP, une réduction des concentrations de glucagon et une augmentation de la sécrétion glucose-dépendante d'insuline. L'augmentation de la libération d'insuline par les cellules bêta pancréatiques et la diminution de la libération de glucagon par les cellules alpha pancréatiques ont été associées à une réduction de la glycémie à jeun et à une moindre augmentation de la glycémie après une charge orale de glucose ou un repas.
Metformine
La metformine est un biguanide aux effets hypoglycémiants qui agissent à la fois sur la glycémie de base et la glycémie postprandiale. La metformine ne stimule pas la libération d'insuline et ne provoque donc pas d'hypoglycémie en monothérapie.
La metformine peut déployer ses effets par trois mécanismes:
·Réduction de la production hépatique de glucose par une inhibition de la néoglucogenèse et de la glycogénolyse;
·Augmentation modérée de la sensibilité du tissu musculaire à l'insuline, entraînant une amélioration de l'absorption et de l'utilisation du glucose en périphérie;
·Ralentissement de l'absorption intestinale du glucose.
La metformine stimule la synthèse intracellulaire de glycogène par ses effets sur le glycogène synthétase. La metformine a augmenté la capacité de transport de certains types de transporteurs membranaires du glucose (GLUT-1 et GLUT-4).
Chez l'homme, la metformine a des effets bénéfiques sur le métabolisme des lipides indépendamment de ses effets hypoglycémiants. Cet effet a été démontré dans des études cliniques contrôlées de moyenne et de longue durée avec des doses thérapeutiques. La metformine réduit les taux de cholestérol total, de LDL-C et de triglycérides.
Pharmacodynamique
Voir aussi sous «Mécanisme d'action».
Efficacité clinique
Il n'a pas été effectué d'études sur l'efficacité et la sécurité clinique de Kombiglyze XR dans lesquelles l'effet sur la baisse de l'hémoglobine A1c (HbA1C) ait été caractérisé. La bioéquivalence de Kombiglyze XR avec l'administration concomitante de saxagliptine et de chlorhydrate de metformine sous forme de comprimés à libération retardée est démontrée; des études sur la comparaison de la biodisponibilité relative entre Kombiglyze XR et la co-administration de saxagliptine et de comprimés de chlorhydrate de metformine à libération non retardée n'ont toutefois pas été réalisées. L'absorption de chlorhydrate de metformine à partir de comprimés à libération retardée et de comprimés à libération non retardée est comparable (AUC), tandis que les concentrations plasmatiques maximales après la prise de comprimés à libération retardée sont environ 20% plus basses qu'après la prise de la même dose sous forme de comprimés à libération non retardée du principe actif.
L'administration concomitante de saxagliptine et de comprimés de metformine à libération non retardée du principe actif a été étudiée chez des patients adultes atteints de diabète de type 2 dont le contrôle glycémique était insuffisant sous monothérapie de metformine, ainsi que chez des patients naïfs de traitement dont la glycémie était insuffisamment contrôlée par un régime et l'exercice physique seuls. Dans ces deux études, l'administration matinale de comprimés de saxagliptine plus metformine à libération non retardée a entraîné des améliorations cliniquement importantes et statistiquement significatives de la valeur de HbA1C, du glucose plasmatique à jeun (FPG, fasting plasma glucose) et de la valeur du glucose postprandial (PPG) 2 heures après un test standard de tolérance au glucose (OGTT). La baisse de la valeur de HbA1C a pu être classée en sous-groupes (notamment en fonction du sexe, de l'âge, de l'origine ethnique et de la valeur initiale du BMI).
Dans ces deux études, la réduction du poids corporel dans les groupes de traitement qui ont reçu la saxagliptine et la metformine à libération non retardée, a été comparable à celle observée dans les groupes sous monothérapie de metformine à libération non retardée. Par rapport à la monothérapie de metformine, le traitement de saxagliptine plus metformine à libération non retardée a été associée à des variations non significatives des lipides sériques à jeun.
L'administration concomitante de saxagliptine et de comprimés de metformine à libération non retardée a été en outre comparée, dans une étude avec contrôle actif, à la saxagliptine comme traitement adjuvant et au glipizide chez 858 patients dont le contrôle glycémique était insuffisant sous monothérapie de metformine, ainsi que dans une étude avec contrôle de placebo, dans laquelle un sous-groupe de 314 patients dont le contrôle glycémique était insuffisant sous insuline plus metformine a reçu un traitement adjuvant de saxagliptine ou de placebo.
Dans une étude randomisée, en double aveugle, de 24 semaines, des patients qui avaient reçu 500 mg deux fois par jour de metformine à libération non retardée pendant une période d'au moins 8 semaines, ont été traités avec soit 500 mg deux fois par jour de metformine à libération non retardée soit de la metformine à libération retardée (1000 mg une fois par jour ou 1500 mg une fois par jour). La variation moyenne de la valeur de HbA1C entre le début de l'étude et la semaine 24 a été de 0,1% (intervalle de confiance à 95%: 0%; 0,3%) sous metformine à libération non retardée, de 0,3% (intervalle de confiance à 95%: 0,1%; 0,4%) sous 1000 mg de metformine à libération retardée et de 0,1% (intervalle de confiance à 95%: 0%; 0,3%) sous 1500 mg de metformine à libération retardée. Les résultats de cette étude suggèrent que, chez les patients qui reçoivent la metformine à libération non retardée, il est possible de passer en toute sécurité à la metformine à libération retardée une fois par jour, à la même dose journalière (jusqu'à 2000 mg une fois par jour). Après un passage de la metformine à libération non retardée à la metformine à libération retardée, on surveillera étroitement le contrôle glycémique et on procèdera éventuellement à des ajustements appropriés de la dose.
Administration de la saxagliptine le matin et le soir
Une étude de monothérapie sur 24 semaines a été réalisée pour évaluer divers schémas posologiques de la saxagliptine. Des patients naïfs de traitement dont le diabète était insuffisamment contrôlé (HbA1C ≥7% à 10%) ont été inclus dans une phase de lead-in sous placebo de 2 semaines en simple aveugle, avec régime et exercice physique. Au total, 365 patients ont été ensuite randomisés pour recevoir soit la saxagliptine 2,5 mg une fois par jour le matin, avec augmentation possible à 5 mg une fois par jour le matin ou 5 mg une fois par jour le soir, soit un placebo. Les patients qui n'atteignaient pas certaines valeurs déterminées de glycémie pendant l'étude ont reçu, outre le placebo ou la saxagliptine, un traitement de secours de metformine; le nombre de patients dans les divers groupes de traitement se situait entre 71 et 74.
Le traitement avec la saxagliptine 5 mg une fois par jour le matin ou 5 mg une fois par jour le soir a entraîné des améliorations significatives de la valeur de HbA1C par rapport au placebo (baisse moyenne, corrigée pour le placebo, respectivement de -0,4 et -0,3%).
Administration additionnelle de saxagliptine à la metformine à libération non retardée
Un total de 743 patients atteints de diabète de type 2 ont participé à une étude de 24 semaines, randomisée, contrôlée par placebo, en double aveugle, qui a évalué l'efficacité et la sécurité de la saxagliptine associée à la metformine chez des patients dont le contrôle glycémique était insuffisant (HbA1C ≥7% à ≤10%) sous monothérapie de metformine. Pour pouvoir participer à l'étude, les patients devaient avoir reçu de la metformine à un dosage stable (1500 - 2550 mg par jour) pendant au moins 8 semaines.
Les patients qui remplissaient les critères d'inclusion ont été inclus dans une phase de lead-in sous placebo, en simple aveugle, de 2 semaines, avec régime et exercice physique, au cours de laquelle ils ont pris de la metformine au même dosage qu'avant l'étude (jusqu'à 2500 mg par jour); ce traitement de metformine a été poursuivi sur toute la durée de l'étude. À la suite de la phase de lead-in, les patients qui remplissaient les critères d'inclusion ont été randomisés pour recevoir 2,5 mg, 5 mg ou 10 mg de saxagliptine ou un placebo en plus du traitement de metformine à un dosage inchangé (la dose maximale autorisée recommandée de saxagliptine est de 5 mg par jour; la dose de 10 mg par jour ne manifeste pas une efficacité supérieure à celle de la dose de 5 mg). Les patients qui n'atteignaient pas certaines valeurs cibles de glycémie pendant l'étude ont reçu, outre leur traitement de l'étude, de la pioglitazone comme traitement de secours. Les augmentations progressives de la dose de saxagliptine et de metformine n'étaient pas autorisées.
La saxagliptine 2,5 mg ou 5 mg ajoutée à la metformine a entraîné des améliorations significatives de HbA1C, FPG et PPG par rapport au placebo ajouté à la metformine (Tableau 1). Les variations moyennes de la valeur de HbA1C en fonction du temps, par rapport aux valeurs du début de l'étude, sont illustrées dans la Figure 1. Le pourcentage de patients qui ont arrêté le traitement ou reçu un traitement de secours en raison d'un contrôle glycémique insuffisant s'est élevé à 15% dans le groupe recevant 2,5 mg de saxagliptine en complément de la metformine, à 13% dans le groupe recevant 5 mg de saxagliptine en complément de la metformine et à 27% dans le groupe recevant le placebo en complément de la metformine.
Tableau 1: Paramètres du contrôle glycémique (semaine 24) dans une étude contrôlée par placebo avec la saxagliptine comme traitement adjuvant de la metformine à libération non retardée*
|
Paramètre d'efficacité
|
Saxagliptine 2,5 mg + metformine
N = 192
|
Saxagliptine 5 mg + metformine
N = 191
|
Placebo + metformine
N = 179
| |
Hémoglobine HbA1C (%)
|
N = 186
|
N = 186
|
N = 175
| |
Début de l'étude (moyenne)
|
8,1
|
8,1
|
8,1
| |
Variation par rapport au début de l'étude (moyenne ajustée†)
|
−0,6
|
−0,7
|
+0,1
| |
Différence par rapport au placebo (moyenne ajustée†)
|
−0,7‡
|
−0,8‡
|
| |
Intervalle de confiance à 95%
|
(−0,9, −0,5)
|
(−1,0, −0,6)
|
| |
Pourcentage de patients qui ont atteint une HbA1C <7%
|
37%§ (69/186)
|
44%§ (81/186)
|
17% (29/175)
| |
Glucose plasmatique à jeun
(mg/dl/mmol/l)
|
N = 188
|
N = 187
|
N = 176
| |
Début de l'étude (moyenne)
|
174 / 9,66
|
179 / 9,93
|
175 / 9,71
| |
Variation par rapport au début de l'étude (moyenne ajustée†)
|
-14 / -0,78
|
-22 / -1,22
|
+1 / +0,06
| |
Différence par rapport au placebo (moyenne ajustée†)
|
−16 / -0,89§
|
−23 / 1,28§
|
| |
Intervalle de confiance à 95%
|
(−23, −9) /
(-1,28, -0,50)
|
(−30, −16) /
(-1,67, -0,89)
|
| |
Glucose postprandial à 2h
(mg/dl/mmol/l)
|
N = 155
|
N = 155
|
N = 135
| |
Début de l'étude (moyenne)
|
294 / 16,32
|
296 / 16,43
|
295 / 16,37
| |
Variation par rapport au début de l'étude (moyenne ajustée†)
|
−62 / -3,44
|
−58 / -3,22
|
−18 / -1,00
| |
Différence par rapport au placebo (moyenne ajustée†)
|
−44 / - 2,44§
|
−40 / - 2,22§
|
| |
Intervalle de confiance à 95%
|
(−60, −27) /
(-3,33, -1.50)
|
(−56, −24) /
(-3,11, -1,33)
|
|
* Population Intent-to-treat (avec utilisation de la dernière valeur obtenue pendant l'étude ou de la dernière valeur obtenue avant un traitement de secours à la pioglitazone).
† Moyenne des moindres carrés, ajustée pour la valeur initiale au début de l'étude.
‡ p <0,0001 par rapport au placebo + metformine
§ p <0,05 par rapport au placebo + metformine
Figure 1: Variation moyenne de la valeur de HbA1C dans une étude contrôlée par placebo avec la saxagliptine comme traitement adjuvant de la metformine à libération non retardée*
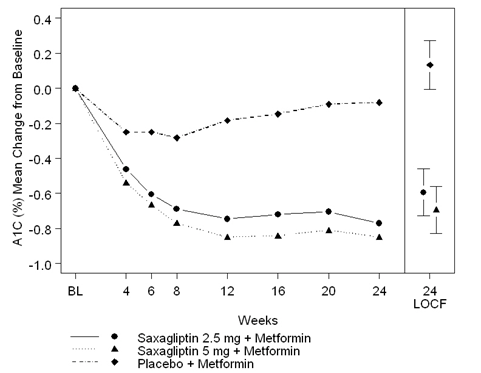
* Patients avec des valeurs aussi bien au début de l'étude qu'à la semaine 24.
Semaine 24 (LOCF) englobe la population Intent-to-treat avec utilisation de la dernière valeur obtenue avant un traitement de secours avec la pioglitazone. La variation moyenne par rapport au de l'étude est ajustée pour la valeur initiale.
La saxagliptine en traitement adjuvant de la metformine à libération non retardée versus le glipizide en traitement adjuvant de la metformine à libération non retardée
Dans cette étude de 52 semaines, contrôlée, randomisée, en double aveugle, 858 patients au total atteints de diabète de type 2 dont le contrôle glycémique était insuffisant (HbA1C >6,5% et ≤10%) ont été traités avec la saxagliptine ou le glipizide. Les patients devaient avoir reçu la metformine à une dose stable (au minimum 1500 mg par jour) depuis au moins 8 semaines avant leur inclusion dans l'étude.
Les patients qui remplissaient les critères d'inclusion ont été inclus dans une phase de lead-in sous placebo, en simple aveugle, de 2 semaines, avec régime et exercice physique, au cours de laquelle ils ont reçu de la metformine (1500 – 3000 mg, selon la dose utilisée avant l'étude). À la suite de la phase de lead-in, les patients ont été randomisés pour recevoir 5 mg de saxagliptine ou 5 mg de glipizide en complément de leur dose de metformine administrée de façon ouverte. Chez les patients du groupe sous glipizide plus metformine, un titrage en aveugle de la dose de glipizide a été effectué pendant les 18 premières semaines de l'étude, jusqu'à une dose maximale de 20 mg de glipizide par jour. Le titrage de la dose s'est fait jusqu'à l'obtention d'une valeur cible de FPG de ≤110 mg/dl / 6,11 mmol/l ou jusqu'à la plus haute dose tolérée de glipizide. Chez 50% des patients traités avec le glipizide, la dose a été augmentée à 20 mg par jour; à la fin du titrage de la dose, 21% des patients traités avec le glipizide recevaient une dose de glipizide de 5 mg ou moins par jour. En moyenne, la dose de glipizide après le titrage était de 15 mg.
Administrés en complément de la metformine, la saxagliptine et le glipizide ont induit au bout de 52 semaines de traitement une baisse moyenne comparable de HbA1C par rapport au début de l'étude (Tableau 2). Cette conclusion se limite probablement aux patients dont la valeur initiale de HbA1C se situe dans la zone des valeurs initiales décrites dans cette étude (91% des patients avaient une valeur de HbA1C <9% au début de l'étude).
Chez les patients traités avec la saxagliptine, on a constaté une perte pondérale moyenne significative de 1,1 kg par rapport au poids initial moyen de 89 kg mesuré au début de l'étude; en revanche, chez les patients traités au glipizide, une prise pondérale moyenne de 1,1 kg (p<0,0001) a été relevée.
Tableau 2: Paramètres du contrôle glycémique (semaine 52) dans une étude avec contrôle actif comparant la saxagliptine au glipizide associés à la metformine à libération non retardée *
|
Paramètre d'efficacité
|
Saxagliptine 5 mg + metformine
N = 428
|
Glipizide (titré) + metformine
N = 430
| |
Hémoglobine HbA1C (%)
|
N = 423
|
N = 423
| |
Début de l'étude (moyenne)
|
7,7
|
7,6
| |
Variation par rapport au début de l'étude (moyenne ajustée†)
|
−0,6
|
−0,7
| |
Différence par rapport au glipizide + metformine (moyenne ajustée†)
|
0,1
|
| |
Intervalle de confiance à 95%
|
(−0,02, 0,2)‡
|
| |
Glucose plasmatique à jeun
(mg/dl / mmol/l)
|
N = 420
|
N = 420
| |
Début de l'étude (moyenne)
|
162 / 8,99
|
161 / 8,94
| |
Variation par rapport au début de l'étude (moyenne ajustée†)
|
−9 / -0,50
|
−16 / -0,89
| |
Différence par rapport au glipizide + metformine (moyenne ajustée†)
|
6 / 0,33
|
| |
Intervalle de confiance à 95%
|
(2, 11) / (0,11, 0,61)§
|
|
* Population Intent-to-treat (avec utilisation de la dernière valeur obtenue pendant l'étude ou de la dernière valeur obtenue avant un traitement de secours à la pioglitazone).
† Moyenne des moindres carrés, ajustée pour la valeur initiale au début de l'étude.
‡ Saxagliptine + metformine est considéré comme non inférieur à glipizide + metformine car la limite supérieure de cet intervalle de confiance se situe au-dessous de la limite préétablie de non infériorité de 0,35%.
§ Signification statistique non vérifiée.
Saxagliptine dans le traitement adjuvant associé avec de l'insuline
Un total de 455 patients atteints de diabète de type 2 et avec un contrôle insuffisant de la glycémie (HbA1C ≥7,5% et ≤11%) a participé à une étude randomisée de 24 semaines, en double aveugle, contrôlée versus placebo pour évaluer l'efficacité et la sécurité d'emploi de la saxagliptine 5 mg en association à une dose stable d'insuline (valeur de base moyenne: 54,2 unités/jour). Les patients étaient soit sous insuline seule (n=141) ou sous insuline associée à une dose stable de metformine (variation ≤20%) (libération rapide ou retardée) (n=314). La saxagliptine 5 mg était prise 1 fois par jour le matin. Comparativement au placebo, une amélioration significative des valeurs de l'HbA1C et de la glycémie postprandiale a été notée après 24 semaines. Par rapport au placebo, la réduction de l'HbA1C a été plus importante (env. 0,4%) chez les patients recevant de la saxagliptine en ajout à l'insuline, qu'ils utilisent de la metformine ou non. Cet effet s'est maintenu durant la phase d'extension de 28 semaines de cette étude. Durant les 24 premières semaines de l'étude, l'augmentation de la dose d'insuline requise a été plus faible chez les patients sous saxagliptine que chez ceux du groupe placebo (2 unités/jour versus 5 unités/jour). Une prise de poids minime a été enregistrée sur 24 semaines dans les deux bras de l'étude.
Saxagliptine dans le traitement adjuvant associé avec une sulfonylurée
Un total de 257 patients atteints de diabète de type 2 a participé à une étude randomisée de 24 semaines, en double aveugle, contrôlée versus placebo pour évaluer l'efficacité et la sécurité d'emploi de la saxagliptine en association à la metformine et à une sulfonylurée chez des patients avec un contrôle insuffisant de la glycémie (HbA1C ≥7% et ≤10%).
Associée à la metformine et à une sulfonylurée, la saxagliptine a entraîné une amélioration significative de l'HbA1C et du PPG comparativement au placebo associé à de la metformine et à une sulfonylurée. La modification de l'HbA1C pour la saxagliptine (n=127) comparée au placebo (n=128) était de -0,7% à la semaine 24.
Tableau 3: Principaux résultats des études d'efficacité contrôlées versus placebo d'associations avec la saxagliptine et la metformine
|
|
Début de l'étude (moyenne) HbA1C (%)
|
Variation par rapport au début de l'étude HbA1C (%)
|
Moyenne ajustée par rapport au placebo HbA1C (%) (IC 95%)
| |
Etude de 24 semaines portant sur le traitement adjuvant associé avec de l'insuline
| |
Saxagliptine 5 mg par jour
Etude CV181057 (n=300)
|
8,7
|
-0,7
|
-0,4 (-0,6, -0,2)1
| |
Etude de 24 semaines portant sur le traitement adjuvant associé avec une sulfonylurée
| |
Saxagliptine 5 mg par jour
Etude D180006 (n=257)
|
8,4
|
-0,7
|
-0,7‡ (−0,9, −0,5)
|
n=patients randomisés
1 p<0,0001 par rapport au placebo
‡ valeur de p <0,0001 par rapport au placebo + sulfonylurée
Etude SAVOR (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus-Thrombolysis in Myocardial Infarction)
L'étude SAVOR était une étude clinique contrôlée avec critères d'évaluation cardiovasculaires. 16 492 patients présentant une HbA1C ≥6,5% et <12% ont été traités. 12 959 d'entre eux présentaient un antécédent de maladie cardiovasculaire, 3533 avaient des facteurs de risque multiples pour une maladie cardiovasculaire. Les patients ont été randomisés pour recevoir la saxagliptine (n=8280) ou un placebo (n=8212), en complément des traitements antidiabétiques déjà en cours. 8561 patients étaient âgés de ≥65 ans, 2330 avaient ≥75 ans. 13 916 patients avaient une fonction rénale normale ou une altération légère de la fonction rénale, 2240 patients avaient une altération de la fonction rénale modérée et 336 une altération sévère.
Le critère d'évaluation principal (sécurité d'emploi et efficacité) était un paramètre composite regroupant les événements indésirables cardiovasculaires majeurs suivants (MACE: major adverse cardiovascular events): mortalité cardiovasculaire, infarctus du myocarde non fatal ou accident vasculaire cérébral ischémique non fatal. Le délai avant la survenue de l'un de ces événements a été analysé statistiquement (fonction de survie selon la méthode de Kaplan-Meier; modèle des risques proportionnels de Cox).
Après une durée moyenne de deux ans, l'étude a atteint son critère de sécurité d'emploi principal, démontrant ainsi que la saxagliptine en complément d'un traitement de fond en cours n'augmente pas le risque cardiovasculaire (MACE) chez des patients atteints de diabète de type 2 par rapport au placebo (HR 1,00; IC à 95%: [0,89; 1,12]; p=0,99 pour la supériorité; p<0,001 pour la non-infériorité).
Le critère d'efficacité principal n'a pas été atteint. La saxagliptine n'a conduit ni à une réduction ni à une augmentation du critère d'évaluation composite comprenant la mortalité pour causes cardiovasculaires, l'infarctus du myocarde et l'accident vasculaire cérébral.
Tableau 4: Critères d'évaluation clinique principaux et secondaires par groupe de traitement dans l'étude SAVOR**
(taux d'événements et pourcentages correspondent aux estimations selon Kaplan-Meier après 2 ans).
|
Critère d'évaluation
|
Saxagliptine
(N=8280)
|
Placebo
(N=8212)
|
Hazard
Ratio
(IC 95%)†
| |
Patients avec événements
n (%)
|
Patients avec événements
n (%)
|
| |
Critère principal composite: MACE
|
613
(7,4)
|
609
(7,4)
|
1,00
(0,89;
1,12)‡,§
| |
Critère secondaire composite: MACE plus&
|
1059
(12,8)
|
1034
(12,6)
|
1,02
(0,94; 1,11)¶
| |
Mortalité globale
|
420
(5,1)
|
378
(4,6)
|
1,11
(0,96; 1,27)¶
|
* Population en intention de traiter (intent-to-treat-Population)
& MACE plus: mortalité cardiovasculaire, infarctus du myocarde non fatal, accident vasculaire cérébral ischémique non fatal, hospitalisation pour angine de poitrine instable, insuffisance cardiaque ou revascularisation coronaire.
† Hazard Ratio, ajusté selon la catégorie de fonction rénale initiale et la catégorie de risque de maladie cardiovasculaire.
‡ Valeur de p <0,001 pour la non-infériorité (basée sur un HR <1,3) par rapport au placebo.
§ Valeur de p = 0,99 pour la supériorité (basée sur un HR <1,0) par rapport au placebo.
¶ Signification statistique non testée.
Les hospitalisations pour insuffisance cardiaque sont survenues plus fréquemment dans le groupe saxagliptine (3,5%) par rapport au groupe placebo (2,8%) (HR = 1,27; [IC à 95%: 1,07, 1,51]). Aucun facteur clinique pertinent relié à l'augmentation du risque relatif d'insuffisance cardiaque sous saxagliptine n'a pu être identifié de manière certaine. Il n'y a pas eu d'augmentation du risque concernant les critères d'évaluation principaux et secondaires chez les patients avec antécédents d'insuffisance cardiaque par rapport au placebo.
** Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. Scirica B.M.et al. NEJM 2013;369:1317-26.
** The design and rationale of the Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus- Thrombolysis in Myocardial Infarction (SAVOR-TIMI) 53 study. Scirica B.M.et al. Am Heart J 2011;162:818.e6-825.e6.
Sécurité et efficacité chez les patients âgés
Dans l'étude SAVOR, l'efficacité et la sécurité d'emploi dans les sous-groupes des tranches d'âge supérieures à 65 et à 75 ans ont été comparables à celles observées dans la population globale de l'étude.
|

