CompositionPrincipes actifs
Insuline dégludec*/insuline asparte* (70% d'insuline dégludec soluble et 30% d'insuline asparte soluble), équivalent à 2,56 mg d'insuline dégludec exempte de sel et anhydre et 1,05 mg d'insuline asparte exempte de sel et anhydre.
* fabriqués par génie génétique à l'aide d'ADN recombinant dans Saccharomyces cerevisiae.
Excipients
Glycérol, chlorure de sodium, acétate de zinc, eau pour préparations injectables. Agents conservateurs: métacresol 1,72 mg/ml, phénol 1,50 mg/ml.
Indications/Possibilités d’emploiDiabète sucré de type 1 chez les adultes, les adolescents et les enfants à partir de 2 ans.
Diabète sucré de type 2 chez l'adulte à condition qu'un traitement à l'insuline soit nécessaire.
Posologie/Mode d’emploiRyzodeg est une insuline soluble constituée de l'insuline basale dégludec à longue durée d'action et d'insuline prandiale d'action rapide, l'insuline asparte.
Ryzodeg est administré une ou deux fois par jour par voie sous-cutanée au moment des repas principaux.
La teneur en insuline des analogues de l'insuline, y compris de Ryzodeg, est exprimée en unités (U). Une (1) unité (U) d'IDegAsp correspond à 1 unité internationale (UI) d'insuline humaine et à 1 unité de tous les autres analogues de l'insuline.
Chez les patients ayant un diabète de type 2, Ryzodeg peut être administré seul, en association avec des antidiabétiques oraux (AO) autorisés pour l'administration avec de l'insuline, ou en association avec une insuline en bolus (voir sous «Propriétés/Effets»).
Chez les patients ayant un diabète de type 1, Ryzodeg est associé à une insuline d'action courte/rapide lors des autres repas.
Ajustement de la posologie
La posologie de Ryzodeg doit être adaptée individuellement, en fonction des besoins du patient. Il est recommandé d'ajuster la dose d'insuline principalement en fonction de la glycémie à jeun.
Comme pour toutes les insulines, un ajustement de la dose peut être nécessaire si le patient augmente son activité physique, modifie son régime alimentaire habituel ou en cas de maladie concomitante.
Si Ryzodeg est utilisé une fois par jour, il faut envisager de passer à deux fois par jour dès que des doses plus élevées sont nécessaires, par exemple pour éviter une hypoglycémie. La dose doit être divisée en fonction des besoins individuels du patient et utilisée avec les repas principaux.
Instauration du traitement
Chez les patients ayant un diabète de type 2, la dose initiale journalière recommandée est de 10 unités de Ryzodeg au moment du ou des repas, suivie d'un ajustement individuel de la posologie.
Chez les patients ayant un diabète de type 1, Ryzodeg est administré une fois par jour au moment d'un repas et associé à une insuline d'action courte/rapide lors des autres repas. La dose initiale de Ryzodeg recommandée est de 60 à 70% des besoins quotidiens totaux en insuline. Une adaptation individuelle de la dose est nécessaire.
Patients atteints de diabète de type 2
Chez les patients sous insuline basale ou prémélangée administrée une fois par jour, le passage à Ryzodeg une fois par jour ou deux fois par jour peut se faire dans un rapport 1:1, à raison d'une dose totale d'insuline égale à la dose totale d'insuline du traitement précédent.
Les patients qui passent de l'insulinothérapie basale ou prémélangée administrée plus d'une fois par jour, le passage à Ryzodeg une ou deux fois par jour peut se faire dans un rapport 1:1, à raison d'une dose totale d'insuline égale à la dose totale d'insuline du traitement précédent.
Les patients sous insulinothérapie de type basal/bolus qui passent à un traitement par Ryzodeg devront adapter leur dose en fonction de leurs besoins individuels. En général, les patients commencent avec le même nombre d'unités basales.
La dose et les moments de prise de la médication antidiabétique concomitante doivent également être adaptés.
Patients atteints de diabète de type 1
Chez les patients atteints de diabète de type 1, la dose initiale de Ryzodeg recommandée est de 60 à 70% des besoins quotidiens totaux en insuline en association avec une insuline d'action courte/rapide administrée lors des autres repas, suivie d'un ajustement individuel de la posologie.
La dose et les moments de prise d'insulines à action courte/rapide concomitantes doivent également être adaptés.
Moment de l'administration
Ryzodeg est administré une ou deux fois par jour par voie sous-cutanée au moment du ou des repas principaux. L'insuline dégludec a un rythme lent et uniforme d'absorption, ce qui conduit à une faible variabilité de l'effet hypoglycémiant. C'est pourquoi, dans les cas où une dose a été oubliée ou s'il arrive que le moment habituel de l'injection ne puisse pas être respecté, la dose peut être prise avec un repas principal à un autre moment le même jour.
Ensuite, il faut revenir à l'horaire normal d'administration, une ou deux fois par jour.
Passage d'une autre préparation d'insuline à Ryzodeg
Comme pour toutes les préparations d'insuline, il est recommandé de surveiller attentivement la glycémie pendant la transition et dans les semaines qui suivent.
Instructions posologiques particulières
Patients présentant des troubles de la fonction rénale et hépatique
Ryzodeg peut être utilisé chez les sujets atteints de troubles rénaux ou hépatiques. Comme pour toutes les préparations d'insuline, le contrôle de la glycémie doit être intensifié. La dose d'insuline doit être adaptée individuellement (voir sous «Pharmacocinétique»).
Patients âgés
Ryzodeg peut être utilisé chez les sujets âgés. Comme pour toutes les préparations d'insuline, le contrôle de la glycémie doit être intensifié. La dose d'insuline doit être adaptée individuellement (voir sous «Pharmacocinétique»).
Enfants et adolescents
L'insuline prémélangée Ryzodeg (70% d'insuline dégludec et 30% d'insuline asparte) peut être utilisée au moment du repas principal chez les adolescents et les enfants à partir de 2 ans ayant un diabète de type 1 (voir sous «Pharmacodynamique»), si une insulinothérapie intensifiée selon le schéma classique basal/bolus n'est pas possible ou n'est pas souhaité. Lors du passage d'une autre insulinothérapie à Ryzodeg, une réduction de la dose d'insuline totale doit être envisagée sur une base individuelle pour minimiser le risque d'hypoglycémie (voir sous «Mises en garde et précautions»).
Ryzodeg doit être utilisé avec une prudence particulière chez les enfants et les adolescents, car le taux d'hypoglycémie sévère était numériquement plus élevé lors d'un essai clinique dans cette population que dans le groupe témoin (voir «Efficacité clinique», «Pharmacodynamique», «Effets indésirables» et «Mises en garde et précautions»).
Mode d'administration
Ryzodeg s'administre uniquement par voie sous-cutanée.
Ryzodeg ne doit pas être administré par voie intraveineuse en raison d'un risque d'hypoglycémie sévère.
Ryzodeg ne doit pas être administré par voie intramusculaire car l'absorption pourrait être modifiée.
Ryzodeg ne doit pas être utilisé dans une pompe à perfusion d'insuline.
Ryzodeg est administré par voie sous-cutanée par injection dans la paroi abdominale, le bras ou la cuisse. Une rotation des sites d'injection devra toujours être effectuée au sein d'une même région afin de diminuer le risque de développer une lipodystrophie et une amyloïdose cutanée.
Ryzodeg FlexTouch® est un stylo prérempli conçu pour être utilisé avec les aiguilles NovoFine® ou NovoTwist®. Ryzodeg FlexTouch® fournit de 1 à 80 unités par paliers de 1 unité.
Ryzodeg Penfill® est destiné à l'emploi avec les appareils d'injection de Novo Nordisk et les aiguilles NovoFine® ou NovoTwist®.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients selon la composition.
Mises en garde et précautionsHypoglycémie
Pour le diabétique traité à l'insuline, il existe en principe un risque d'hypoglycémie légère ou sévère. Celle-ci peut atténuer la capacité de concentration et est notamment susceptible de compromettre la sécurité du patient lors de la conduite d'un véhicule ou de l'utilisation de machines. Ces phénomènes surviennent en particulier au début du traitement, lors d'un changement de préparation, en cas de repas irréguliers ainsi que, d'une manière générale, lorsque le métabolisme est mal ou non équilibré, ce qui peut s'accompagner de fortes fluctuations de la glycémie, y compris d'hypoglycémie. Il faut rappeler au patient que la consommation d'alcool accroît encore ce risque (par inhibition de la gluconéogenèse hépatique). En outre, les patients ayant déjà été atteints d'hypoglycémie sévère présentent un risque accru de récidive. Afin que le patient soit en mesure de prévenir suffisamment tôt une hypoglycémie, il y a lieu de lui recommander de se munir constamment de sucre de raisin, de sucre en morceaux ou d'un autre aliment équivalent. Il doit aussi porter sur lui sa carte de diabétique.
Comme avec les autres insulines basales, l'effet prolongé peut retarder la récupération après une hypoglycémie.
Les maladies concomitantes, en particulier les infections et les états fébriles augmentent généralement les besoins en insuline du patient. Les maladies concomitantes affectant les reins ou le foie, tout comme les maladies affectant les glandes surrénales, l'hypophyse ou la thyroïde peuvent nécessiter un ajustement de la dose d'insuline.
Chez les patients présentant un état métabolique nettement amélioré (p.ex. en raison d'une insulinothérapie intensifiée) ou après le passage d'insuline animale à de l'insuline humaine, ainsi que parfois lors d'un autre changement de préparation, certains ou tous les symptômes annonciateurs de l'hypoglycémie peuvent, dans certaines circonstances, rester silencieux. Ces patients doivent être prévenus de ce problème (voir également sous «Effets indésirables»).
Chez des patients présentant un diabète depuis longtemps, les symptômes d'alerte habituels pourraient disparaître.
Les bêta-bloquants peuvent affaiblir ou masquer les symptômes d'alerte habituels de l'hypoglycémie. La consommation de marijuana peut éventuellement altérer la tolérance au glucose (d'autres substances illégales n'ont pas été testées). (Autres interactions, voir sous «Interactions»).
Chez les enfants, l'utilisation de l'insuline prémélangée Ryzodeg ne devrait être envisagée qu'après un examen attentif des autres options thérapeutiques. Il convient de veiller tout particulièrement à ce que la dose d'insuline soit bien équilibrée avec la prise alimentaire et l'activité physique afin de minimiser le risque d'hypoglycémie. Dans une étude, Ryzodeg a été associé à une augmentation de cas d'hypoglycémie sévères chez les enfants et les adolescents par rapport au schéma basal/bolus (voir sous «Pharmacodynamique»).
Coma hyperglycémique/acidocétose diabétique
L'administration d'une insuline d'action rapide est recommandée dans les situations d'hyperglycémie sévère. Une posologie insuffisante ou un arrêt du traitement chez les patients qui doivent recevoir de l'insuline peuvent entraîner une hyperglycémie et potentiellement une acidocétose diabétique. De plus, les maladies concomitantes, en particulier les infections, peuvent entraîner une hyperglycémie et, de ce fait, augmenter les besoins en insuline.
Les premiers symptômes d'une hyperglycémie se développent habituellement lentement, sur plusieurs heures ou plusieurs jours. Ils prennent notamment les formes suivantes: sensation de soif, grandes quantités d'urine, perte d'appétit, fatigue, obnubilation, nausées, vomissements, sécheresse buccale, peau rouge et sèche et odeur acétonique de l'haleine. Les autres causes possibles sont les suivantes: erreurs diététiques, omission ou réduction des injections d'insuline. Il faut instruire le patient qu'il doit consulter le médecin immédiatement, dès les premiers signes d'une hyperglycémie. Les réactions hyperglycémiques non traitées peuvent entraîner une perte de connaissance, un coma ou la mort.
Affections de la peau et du tissu sous-cutané
Les patients doivent avoir pour instruction d'effectuer une rotation continue des sites d'injection afin de réduire le risque de développer une lipodystrophie et une amyloïdose cutanée. Il existe un risque potentiel d'absorption retardée de l'insuline et d'aggravation du contrôle de la glycémie suite à des injections d'insuline au niveau de sites présentant ces réactions. Il a été rapporté qu'un changement soudain du site d'injection vers une zone non affectée entraîne une hypoglycémie. La surveillance de la glycémie est recommandée après changement du site d'injection d'une zone affectée vers une zone non affectée, et un ajustement de la dose des médicaments antidiabétiques peut être envisagé.
Information des patients au sujet du diabète sucré
L'insulinothérapie exige en principe que le patient soit en mesure de gérer son diabète de façon autonome, notamment de surveiller sa glycémie, d'apprendre la technique d'injection et de prendre les mesures appropriées dans les situations métaboliques d'hypoglycémie et d'hyperglycémie. Les patients doivent être formés de manière à pouvoir effectuer ces gestes seuls. Ils doivent également être informés de la façon de se comporter dans les situations d'urgence liées par exemple à une insuffisance des doses d'insuline ou à une omission, ou encore à une prise accidentelle de doses élevées d'insuline, à un apport alimentaire insuffisant ou à un repas manqué (voir également sous «Moment de l'administration»).
Le traitement à l'insuline nécessite une surveillance constante quant à une éventuelle hypoglycémie ou hyperglycémie. Les patients et leurs familles doivent connaître les mesures correctives indiquées lors d'un cas ou d'un soupçon d'hyperglycémie ou d'hypoglycémie, et savoir quand il faut informer un médecin.
En cas de contrôle insuffisant de la glycémie ou d'une tendance à des épisodes hyperglycémiques ou hypoglycémiques, il faut vérifier si le patient respecte le traitement prescrit, les sites d'injection choisis et la technique d'injection appropriée, le maniement du FlexTouch et du Penfill et tous les autres facteurs pertinents avant d'ajuster la dose.
En remplacement d'autres insulines
En cas de changement de type, de marque ou de fabricant d'insuline, le patient devra faire l'objet d'un suivi médical et un changement de posologie pourra être nécessaire (voir également sous «Posologie/Mode d'emploi»).
Association de la pioglitazone et des insulines
Dans le cadre de l'association de pioglitazone et d'insuline, des cas d'insuffisance cardiaque ont été signalés, en particulier chez les patients présentant des facteurs de risque de développement d'une telle insuffisance. Il convient de garder cela à l'esprit lorsqu'un traitement combiné avec la pioglitazone et des préparations d'insuline est envisagé. Lorsque l'association est utilisée, les patients doivent faire l'objet d'une surveillance quant à des signes et des symptômes d'insuffisance cardiaque, d'une prise de poids et d'œdèmes. La pioglitazone doit être interrompue en cas d'apparition de signes de détérioration de la fonction cardiaque.
Prévention des erreurs médicamenteuses
Les patients doivent contrôler visuellement le nombre d'unités sélectionnées sur l'affichage de la dose du stylo. Pour pouvoir réaliser eux-mêmes leurs injections, les patients doivent donc être en mesure de lire l'affichage de la dose du stylo. Les patients aveugles ou malvoyants doivent avoir pour consigne de toujours demander l'aide d'une autre personne ayant une bonne vue et formée à l'utilisation du dispositif injecteur d'insuline.
L'administration d'insuline peut induire la formation d'anticorps. Dans de rares cas, la présence d'anticorps anti-insuline peut nécessiter un ajustement de la dose d'insuline.
InteractionsCertains médicaments influencent le métabolisme du glucose.
1. Le besoin en insuline peut être réduit en présence de substances qui améliorent l'efficacité de l'insuline (en augmentant la sensibilité à cette substance), stimulent la sécrétion insulinique, inhibent la gluconéogenèse hépatique ou modifient l'absorption intestinale du glucose. En présence d'une quantité inchangée d'insuline, il existe de ce fait un risque accru d'hypoglycémie en cas de prise simultanée de:
antidiabétiques oraux; agonistes du récepteur du GLP-1; inhibiteurs de l'ECA (p.ex. le captopril et énalapril); substances anti-arythmiques comme le disopyramide; β-bloquants et clonidine, ISRS; fenfluramine; inhibiteurs de la MAO; antidépresseurs tricycliques; salicylés et (rarement) d'autres AINS; fibrates; tétracyclines; pentamidine (hypoglycémie, occasionnellement suivie d'une hyperglycémie); antipaludiques (quinine, chloroquine, méfloquine); sulfamides (p.ex. cotrimoxazole); cimétidine et ranitidine.
2. Le besoin d'insuline peut augmenter lors de la prise/utilisation simultanée des substances ou des groupes de substances suivants:
les contraceptifs oraux et autres préparations estrogéniques ou progestatives; les corticostéroïdes et l'ACTH; la GH (somatotropine); le danazol; les hormones thyroïdiennes, les sympathicomimétiques (surtout les β2-sympathicomimétiques comme la ritodrine, le salbutamol, la terbutaline, mais également des sympathicomimétiques α-sélectifs ainsi que non sélectifs comme l'épinéphrine); le diazoxide; l'acide nicotinique et ses dérivés; la chlorpromazine (surtout à des doses élevées) et d'autres dérivés de la phénothiazine; les diurétiques (p.ex. les diurétiques thiazidiques, l'indapamide et le furosémide); les substances anti-rétrovirales; les substances immunosuppressives (ciclosporine, tacrolimus, sirolimus), les antipsychotiques atypiques.
3. L'effet de l'insuline peut être accru ou affaibli, en fonction de la dose, lors de l'utilisation des substances suivantes:
·dérivés du lanréotide, dérivés de l'octréotide, dérivés salicylés, sels de lithium (rarement).
·Les bêta-bloquants peuvent aggraver l'insulinorésistance, mais aussi, dans certains cas, entraîner une hypoglycémie. Il existe en outre un risque de diminution ou de masquage des symptômes d'alerte de l'hypoglycémie.
·L'alcool peut renforcer ou affaiblir l'effet hypoglycémiant de l'insuline.
Grossesse, allaitementGrossesse
Il n'existe pas de données cliniques concernant l'emploi de Ryzodeg chez la femme enceinte. C'est pourquoi Ryzodeg ne doit pas être utilisé durant la grossesse.
Les études sur la reproduction animale n'ont mis en évidence aucune différence entre l'insuline dégludec et l'insuline humaine en termes d'embryotoxicité ou d'effets tératogènes.
Chez la femme enceinte diabétique, il est généralement recommandé d'intensifier le contrôle glycémique et d'assurer une surveillance attentive tout au long de la grossesse ainsi qu'en cas de projet de grossesse. Les besoins en insuline diminuent habituellement au cours du premier trimestre puis augmentent au cours des deuxième et troisième trimestres. Après l'accouchement, les besoins en insuline reviennent généralement rapidement au niveau antérieur à la grossesse.
Allaitement
Il n'existe pas de données cliniques concernant l'emploi de Ryzodeg chez les femmes en période d'allaitement. Chez le rat, l'IDegAsp a été détecté dans le lait maternel, toutefois à des concentrations inférieures à celles du plasma.
On ignore si l'IDegAsp passe dans le lait maternel humain. C'est pourquoi Ryzodeg ne doit pas être utilisé en période d'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes capacités de concentration et de réaction du patient peuvent être altérées suite à une hypoglycémie. Ceci peut constituer un risque dans les situations où ces facultés revêtent une signification particulière (par exemple pour la conduite automobile ou l'utilisation de machines).
Les patients doivent en être informés afin de pouvoir prendre des mesures pour éviter l'hypoglycémie pendant la conduite. Ceci est particulièrement important chez ceux qui ont une conscience réduite des signes avant-coureurs de l'hypoglycémie ou ne les perçoivent pas, ou encore de fréquents épisodes d'hypoglycémie.
Effets indésirablesPlus de 2000 patients ont été inclus dans l'élaboration du programme clinique de Ryzodeg. L'effet indésirable le plus fréquemment rapporté lors du traitement est l'hypoglycémie.
Les effets indésirables répertoriés ci-dessous sont issus des données des études cliniques et présentés selon la classe de systèmes d'organes MedDRA. Les fréquences des effets indésirables ont été définies de la manière suivante: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10'000 à 1/1000) et très rares (<1/10'000).
|
Affections du système immunitaire
|
Rares – hypersensibilité
| |
Rares – urticaire
| |
Troubles du métabolisme et de la nutrition
|
Très fréquents – hypoglycémie
| |
Affections de la peau et du tissu sous-cutané
|
Inconnue - Lipodystrophie acquise
Inconnue – Amyloïdose cutanée
| |
Troubles généraux et anomalies au site d'administration
|
Fréquents – réactions au site d'injection
| |
Occasionnels – œdèmes périphériques
|
Description de certains effets indésirables
Affections du système immunitaire
Rares – réactions allergiques, urticaire
Sous les préparations d'insuline, des réactions allergiques peuvent survenir. Les réactions allergiques de type immédiat, dues soit à l'insuline elle-même, soit à l'un des excipients, sont potentiellement mortelles.
De rares cas d'hypersensibilité (qui se traduisent par un gonflement de la langue et des lèvres, une diarrhée, des nausées, une fatigue et des démangeaisons) et d'urticaire ont été rapportés en association avec Ryzodeg.
Troubles du métabolisme et de la nutrition
Très fréquents – hypoglycémie (sous Ryzodeg administré une fois par jour: 95% chez les patients atteints de diabète de type 1, 44.2-57.7% chez les patients atteints de diabète de type 2; sous Ryzodeg administré deux fois par jour: 61.2-73.5% chez les patients atteints de diabète de type 2)
Une hypoglycémie peut survenir lorsque la dose d'insuline est trop importante par rapport aux besoins insuliniques. Les hypoglycémies sévères peuvent provoquer une perte de connaissance et/ou des crampes, avec des troubles passagers ou durables des fonctions cérébrales ou même le décès. Les symptômes de l'hypoglycémie surviennent habituellement de manière soudaine. Ces symptômes sont: sueurs froides, pâleur et froideur cutanées, fatigue, nervosité ou tremblements, anxiété, asthénie ou faiblesse inhabituelles, confusion mentale, difficultés de concentration, obnubilation, sensation de faim excessive, troubles visuels, maux de tête, nausées et palpitations.
Troubles généraux et anomalies au site d'administration
Fréquents – réactions au site d'injection
Des réactions au site d'injection (y compris hématomes au site d'injection, douleurs, hémorragies, érythèmes, nodules, gonflements, décoloration, prurit et chaleur) sont apparues chez des patients traités avec Ryzodeg. Ces réactions sont habituellement légères et transitoires et disparaissent généralement lors de la poursuite du traitement.
Affections de la peau et du tissu sous-cutané
La lipodystrophie (notamment la lipohypertrophie, la lipoatrophie) et l'amyloïdose cutanée peuvent survenir au niveau du site d'injection et retarder l'absorption locale de l'insuline. Une rotation continue des sites d'injection dans une zone donnée peut aider à diminuer ou éviter ces réactions (voir rubrique «Mises en garde et précautions»).
Groupes particuliers de patients
Les résultats d'études cliniques ne montrent aucune différence en termes de fréquence, de type et de sévérité des effets secondaires entre les personnes âgées, les patients présentant une insuffisance rénale ou hépatique et l'ensemble de la population.
Ryzodeg a été utilisé chez les enfants et les adolescents n'ayant pas plus de 18 ans pour étudier les propriétés pharmacocinétiques (voir section «Pharmacocinétique»). La sécurité et l'efficacité ont été démontrées dans une étude menée chez des enfants âgés de 2 à moins de 18 ans. Dans cette étude, une incidence plus élevée de cas d'hypoglycémie sévères a été observée lorsque Ryzodeg était administré au moment du repas principal par rapport au bolus basal standard (voir sous «Posologie/Mode d'emploi», «Mises en garde et précautions» et «Propriétés/Effets»). Sinon, la fréquence, le type et la sévérité des effets secondaires chez les enfants et les adolescents étaient comparables à ceux observés chez les adultes.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage spécifique de l'insuline n'est pas défini. Lorsque la dose dépasse les besoins du patient (et que le patient reçoit plus d'insuline que ce dont il a besoin), une hypoglycémie peut se mettre en place progressivement (voir sous «Mises en garde et précautions»).
Les épisodes hypoglycémiques modérés peuvent être traités par l'administration par voie orale de glucose ou d'autres aliments contenant du sucre. Il est recommandé aux diabétiques d'avoir toujours sur eux des produits contenant du glucose.
Les épisodes d'hypoglycémie sévère, au cours desquels le patient n'est pas capable de se traiter lui-même, peuvent être traités par administration intramusculaire ou sous-cutanée de glucagon (0,5 à 1 mg) par une personne formée à cet effet, ou par administration intraveineuse de glucose par un personnel médical. Si le patient ne répond pas au glucagon dans un délai de 10 à 15 minutes, du glucose devra être administré par voie intraveineuse. Dès que le patient a repris connaissance, il faut lui administrer des hydrates de carbone par voie orale afin de prévenir une rechute.
Propriétés/EffetsCode ATC
A10AD06
Mécanisme d'action
L'insuline dégludec et l'insuline asparte se lient spécifiquement au récepteur de l'insuline humaine et ont donc les mêmes effets pharmacologiques que l'insuline humaine.
L'effet hypoglycémiant de l'insuline est dû à la liaison de l'insuline aux récepteurs de l'insuline des cellules musculaires et adipeuses, facilitant ainsi l'absorption du glucose, et à l'inhibition simultanée de la production hépatique de glucose.
Pharmacodynamique
L'effet pharmacodynamique de Ryzodeg est spécifique pour chaque composant (figure 1) et le profil d'action qui en résulte reflète les deux composants, l'insuline asparte d'action rapide et l'insuline basale dégludec.
Le composant basal à longue durée d'action de Ryzodeg (insuline dégludec) forme des multihexamères solubles après injection sous-cutanée, ce qui entraîne un dépôt à partir duquel l'insuline dégludec est lentement absorbée en continu dans la circulation, avec pour résultat un effet hypoglycémiant stable et plat. Cet effet est maintenu dans l'association avec l'insuline asparte et n'interfère pas avec les monomères d'insuline asparte d'action rapide.
Après l'administration de Ryzodeg, l'entrée en action est très rapide et couvre les repas. La composante basale présente un profil plat, stable et de longue durée d'action, ce qui permet une couverture continue du besoin basal d'insuline. La durée d'action d'une dose unique de Ryzodeg est supérieure à 24 heures.
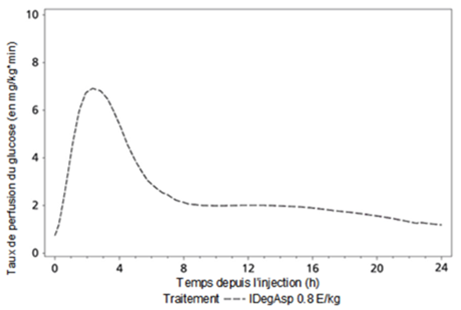
Figure 1: Taux de perfusion moyen de Ryzodeg après l'administration d'une dose unique de 0,8 U/kg chez des diabétiques de type 1.
L'effet hypoglycémiant général et l'effet hypoglycémiant maximum de Ryzodeg augmentent linéairement avec la dose. L'état équilibre est atteint 2 à 3 jours après la première dose administrée.
Il n'y a pas de différence au niveau de l'effet pharmacodynamique de Ryzodeg entre les sujets âgés et les sujets plus jeunes.
Efficacité clinique
Sept études cliniques «treat-to-target» multinationales, randomisées, contrôlées, en mode ouvert d'une durée comprise entre 26 semaines et 52 semaines ont été menées. Dans le cadre de celles-ci, un total de 1761 sujets atteints de diabète (1 étude avec 362 sujets avec un diabète de type 1 et 6 études avec 1399 sujets avec un diabète de type 2) ont été traités par Ryzodeg.
Ryzodeg, administré une fois par jour a été comparé à l'insuline glargine (IGlar) (une fois par jour) dans le cadre de deux études portant sur le diabète de type 2 (tableau 1).
Ryzodeg, administré deux fois par jour a été comparé à l'insuline asparte biphasique 30 (IAspB 30) administrée deux fois par jour dans le cadre de deux études portant sur le diabète de type 2 et dans le cadre d'une étude portant également sur le diabète de type 2, Ryzodeg a été comparé à l'insuline dégludec (IDeg) administrée une fois par jour et à l'insuline asparte (IAsp) administrée 2 à 4 fois par jour (tableau 2).
Dans une étude sur le diabète sucré de type 2, Ryzodeg, administré une fois par jour, a été comparé à l'insuline glargine (IGlar) administrée une fois par jour avec l'IAsp administrée une fois par jour. Après 26 semaines de traitement, la dose de Ryzodeg a été divisée en deux doses quotidiennes (tableau 3). Les antidiabétiques oraux (OAD) ont été autorisés dans toutes les études sur le diabète sucré de type 2.
Ryzodeg administré une fois par jour en association avec de l'insuline asparte (IAsp) a également été comparé à l'insuline détémir (IDet) administrée une ou deux fois par jour en association avec de l'IAsp dans le diabète de type 1 (tableau 4).
La non-infériorité de la variation de l'HbA1c de référence jusqu'à la fin de l'étude a été confirmée dans 6 des 7 études par rapport à tous les comparateurs utilisant le principe du traitement par rapport à la cible, tandis que la non-infériorité dans une étude (comparaison de Ryzodeg administré deux fois par jour avec IDeg une fois par jour avec l'insuline IAsp administrée 2 à 4 fois par jour) chez des diabétiques du type 2 n'était pas confirmée (tableau 2).
En association avec un ADO, Ryzodeg une fois par jour permet, aussi bien chez les diabétiques de type 2 n'ayant jamais été traités à l'insuline que chez ceux l'ayant déjà été, un contrôle glycémique similaire à celui de l'insuline glargine. Ryzodeg a conduit à un meilleur contrôle glycémique prandial, avec un plus faible taux d'hypoglycémies nocturnes (définies comme les épisodes survenant entre minuit et 6 h du matin avec un taux de glucose plasmatique confirmé <3,1 mmol/l ou les situations où le patient avait besoin de l'aide d'une tierce personne) (tableau 1) par comparaison avec l'insuline glargine.
Il a été démontré que le contrôle de la glycémie (HbA1c) avec Ryzodeg administré 2 fois par jour est similaire à celui obtenu avec BIAsp 30 administré 2 fois par jour. Ryzodeg a permis d'obtenir une meilleure glycémie à jeun et les patients ont atteint la valeur-cible d'un taux plasmatique de 5 mmol/l plus rapidement qu'avec le BIAsp 30. Ryzodeg a conduit à un plus faible taux total d'hypolycémies et d'hypoglycémies nocturnes (tableau 2).
Ryzodeg, administré deux fois par jour, a été comparé à l'insuline IDeg administrée une fois par jour avec l'insuline IAsp (2 à 4 injections par jour) chez des patients atteints de diabète sucré de type 2 traités avec de l'insuline basale et nécessitant une intensification thérapeutique avec de l'insuline prandiale. Les deux traitements ont amélioré le contrôle de la glycémie, mais le traitement par Ryzodeg n'a pas atteint la limite de non-infériorité prédéfinie de 0,4% par rapport à l'IDeg plus IAsp en ce qui concerne le paramètre principal de modification de l'HbA1c à la semaine 26 (Tableau 2). Il n'y avait aucune différence statistiquement significative entre les deux groupes de traitement.
Dans une étude menée auprès de patients atteints de diabète sucré de type 2 traités avec l'insuline basale et nécessitant une intensification du traitement avec l'insuline prandiale, Ryzodeg a été comparé à l'insuline IGlar administrée une fois par jour avec l'insuline IAsp administrée une fois par jour pendant 26 semaines. Après 26 semaines, la dose de Ryzodeg dans le groupe Ryzodeg a été divisée en deux doses quotidiennes. Dans le groupe IGlar, des doses supplémentaires d'IAsp auraient pu être administrées pendant d'autres repas (jusqu'à trois fois par jour). Ryzodeg, administré une fois par jour, a obtenu un contrôle glycémique similaire (HbA1c) comparé à l'insuline IGlar administrée une fois par jour avec l'insuline IAsp administrée une fois par jour après 26 semaines. Ryzodeg, administré une ou deux fois par jour, a obtenu un contrôle glycémique similaire (HbA1c) une fois par jour avec l'insuline IAsp administrée une à trois fois par jour après 38 semaines par rapport à l'IGlar administrée une fois par jour avec l'IAsp. Ryzodeg a montré un taux plus faible d'hypoglycémie nocturne pendant les 26 et 38 semaines (tableau 3).
Chez les patients ayant un diabète de type 1, il a été démontré que le traitement par Ryzodeg une fois par jour en association avec l'insuline asparte pour les autres repas procure un contrôle de la glycémie (HbA1c et glycémie à jeun) similaire, avec un taux d'hypoglycémies nocturnes plus faible comparativement à un schéma basal/bolus avec l'insuline détémir en association à l'insuline asparte à tous les repas (tableau 4).
Tableau 1: Résultat de deux études de 26 semaines portant sur le diabète de type 2
|
|
Ryzodeg
(une fois par jour)1
Patients n'ayant jamais été traités à l'insuline
|
IGlar
(une fois par jour)1
Patients n'ayant jamais été traités à l'insuline
|
Ryzodeg
(une fois par jour)2 Patients prenant de l'insuline
|
IGlar
(une fois par jour)2
Patients prenant de l'insuline
| |
N
|
266
|
263
|
230
|
233
| |
Valeur HbA1c moyenne (%)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
7,2
-1,65
|
7,2
-1,72
|
7,3
-0,98
|
7,4
-1,00
| |
|
Différence:
0,03 [-0,14; 0,20]
|
Différence:
-0,03 [-0,20; 0,14]
| |
Glycémie à jeun (GAJ) (mmol/l)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
6,8
-3,32
|
6,3
-4,02
|
6,3
-1,68
|
6,0
-1,88
| |
|
Différence:
0,51 [0,09; 0,93]
|
Différence:
0,33 [-0,11; 0,77]
| |
Glycémie (plasma) 90 minutes après les repas, à la fin de l'étude (en mmol/l)
| |
Après le petit-déjeuner
Modification moyenne par rapport à la valeur initiale
|
1,9
-1,5
|
3,4
-0,3
|
|
| |
Après le repas du soir
Modification moyenne par rapport à la valeur initiale
|
|
|
1,2
-1,5
|
2,6
-0,6
| |
Taux d'hypoglycémies (par patient-année d'exposition)
| |
Sévères
|
0,01
|
0,01
|
0,00
|
0,04
| |
Confirmées3
|
4,23
|
1,85
|
4,31
|
3,20
| |
|
Ratio:
2,17 [1,59; 2,94]
|
Ratio:
1,43 [1,07; 1,92]
| |
Nocturnes confirmées3
|
0,19
|
0,46
|
0,82
|
1,01
| |
|
Ratio:
0,29 [0,13;0,65]
|
Ratio:
0,80 [0,49;1,30]
|
1 Administration une fois par jour + metformine
2 Administration une fois par jour + metformine ± pioglitazone ± inhibiteur de la DPP-4
3 L'hypoglycémie confirmée a été définie comme des épisodes confirmés par un taux de glucose plasmatique <3,1 mmol / l ou par le patient nécessitant une aide extérieure. L'hypoglycémie nocturne confirmée était définie comme des épisodes survenus entre minuit et 6h00.
IGlar = insuline glargine
Tableau 2: Résultat de trois études de 26 semaines portant sur le diabète de type 2
|
|
Ryzodeg
(deux fois par jour)1
Patients prenant de l'insuline
|
BIAsp 30
(deux fois par jour)1
Patients prenant de l'insuline
|
Ryzodeg
(deux fois par jour)2
Patients prenant de l'insuline
|
BIAsp 30
(deux fois par jour)2
Patients prenant de l'insuline
|
Ryzodeg (deux fois par jour)3 Patients prenant de l'insuline
|
IDeg (une fois fois par jour) + IAsp4
Patients prenant de l'insuline
| |
N
|
224
|
222
|
280
|
142
|
138
|
136
| |
Valeur HbA1c moyenne (%)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
7,1
-1,28
|
7,1
-1,30
|
7,1
-1,38
|
7,0
-1,42
|
7,0
-1,31
|
6,8
-1,50
| |
|
Différence:
-0,03 [-0,18; 0,13]
|
Différence:
0,05 [-0,10; 0,20]
|
Différence:
0,18 [-0,04; 0,41]
| |
Glycémie à jeun (GAJ) (mmol/l)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
5,8
-3,09
|
6,8
-1,76
|
5,4
-2,55
|
6,5
-1,47
|
6,8
-2,25
|
7,1
-1,78
| |
|
Différence:
-1,14 [-1,53; -0,76]
|
Différence:
-1,06 [-1,43; -0,70]
|
Différence:
-0,31 [-0,97; 0,34]
| |
Taux d'hypoglycémies (par patient-année d'exposition)
| |
Sévères
|
0,09
|
0,25
|
0,05
|
0,03
|
0,47
|
0,24
| |
Confirmées5
|
9,72
|
13,96
|
9,56
|
9,52
|
11,55
|
13,62
| |
|
Ratio:
0,68 [0,52; 0,89]
|
Ratio:
1,00 [0,76; 1,32]
|
Ratio:
0,81 [0,61; 1,07]
| |
Nocturnes confirmées5
|
0,74
|
2,53
|
1,11
|
1,55
|
1,23
|
1,55
| |
|
Ratio:
0,27 [0,18; 0,41]
|
Ratio:
0,67 [0,43; 1,06]
|
Ratio:
0,80 [0,50; 1,29]
| |
Dose totale d'insuline (unités)
| |
Fin de l'étude
|
|
106,7
|
130,6
| |
Ratio:
0,81 [0,69; 0,95]
|
1 Administration deux fois par jour ± metformine ± pioglitazone ± inhibiteur de la DPP-4
2 Administration deux fois par jour ± metformine
3 Administration deux fois par jour ± metformine ± sécrétagogue d'insuline ± inhibiteur DPP-4 ± inhibiteur α-glucosidase
4 Administration une fois par jour + insuline asparte 2 à 4 fois par jour sous forme d'insuline prandiale ± metformine ± sécrétagogue d'insuline ± inhibiteur de DPP-4 ± inhibiteur de α-glucosidase
5 L'hypoglycémie confirmée a été définie comme des épisodes confirmés par un taux de glucose plasmatique <3,1 mmol / l ou par le patient nécessitant une aide extérieure. L'hypoglycémie nocturne confirmée était définie comme des épisodes survenus entre minuit et 6h00.
Tableau 3: Résultat d'une étude de 38 semaines portant sur le diabète de type 2
|
|
Ryzodeg
(une fois par jour)1
Après 26 semaines
|
IGlar (une fois par jour) +
IAsp (une fois par jour)1
Après 26 semaines
|
Ryzodeg
(une fois par jour/deux fois par jour)2
Après 38 semaines
|
IGlar (une fois par jour) +
IAsp (une à trois fois par jour)3
Après 38 semaines
| |
N
|
267
|
265
|
267
|
265
| |
Valeur HbA1c moyenne (%)
|
|
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
7,1
-1,1
|
7,1
-1,1
|
7,0
-1,2
|
6,9
-1,2
| |
|
Différence:
0,07 [-0,06; 0,21]
|
Différence:
0,09 [-0,04; 0,22]
| |
Glycémie à jeun (GAJ) (mmol/l)
|
|
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
6,7
-2.3
|
6.5
-2,3
|
6,3
-2,7
|
6,5
-2,3
| |
|
Différence:
0,04 [-0,34; 0,42]
|
Différence:
-0,24 [-0,60; 0,13]
| |
Taux d'hypoglycémies (par patient-année d'exposition)
| |
Sévères ou confirmées4
|
2,58
|
2,96
|
2,87
|
3,43
| |
|
Ratio:
0,90 [0,67; 1,22]
|
Ratio:
0,86 [0,65; 1,14]
| |
Nocturnes sévères ou confirmées4
|
0,48
|
0,93
|
0,60
|
1,01
| |
|
Ratio:
0,55 [0,34; 0,90]
|
Ratio:
0,61 [0,40; 0,93]
| |
Dose totale d'insuline (unités)
| |
Fin de l'étude
|
70,9
|
79,4
|
83,4
|
89,3
| |
|
Ratio:
0,88 [0,81; 0,95]
|
Ratio:
0,91 [0,83; 0,99]
|
1 Administration une fois par jour ± ADOs
2 Administration une fois ou deux fois par jour ± ADOs
3 Une fois par jour insuline glargine + insuline asparte 1 à 3 fois par jour ± ADOs
4 L'hypoglycémie confirmée a été définie comme des épisodes confirmés par un taux de glucose plasmatique <3,1 mmol / l ou par le patient nécessitant une aide extérieure. L'hypoglycémie nocturne confirmée était définie comme des épisodes survenus entre minuit et 6h00.
Remarque: Les ADOs peuvent contenir toute combinaison de metformine, d'inhibiteurs de la DPP-4, d'inhibiteurs de la glucosidase α ou d'inhibiteurs de la SGLT2.
Tableau 4: Résultat d'une étude de 26 semaines portant sur le diabète de type 1
|
|
Ryzodeg
(une fois par jour)1
|
IDet
(une/deux fois par jour)2
| |
N
|
366
|
182
| |
Valeur HbA1c moyenne (%)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
7,6
-0,73
|
7,6
-0,68
| |
|
Différence:
-0,05 [-0,18; 0,08]
| |
Glycémie à jeun (GAJ) (mmol/l)
| |
Fin de l'étude
Modification moyenne par rapport à la valeur initiale
|
8,7
-1,61
|
8,6
-2,41
| |
|
Différence:
0,23 [-0,46; 0,91]
| |
Taux d'hypoglycémies (par patient-année d'exposition)
| |
Sévères
|
0,33
|
0,42
| |
Confirmées3
|
39,2
|
44,3
| |
|
Ratio:
0,91 [0,76; 1,09]
| |
Nocturnes confirmées3
|
3,71
|
5,72
| |
|
Ratio:
0,63 [0,49; 0,81]
|
1 Administration une fois par jour + insuline asparte pour couvrir les besoins en insuline liés aux repas
2 Administration une ou deux fois par jour + insuline asparte pour couvrir les besoins en insuline liés aux repas
3 L'hypoglycémie confirmée a été définie comme des épisodes confirmés par un taux de glucose plasmatique <3,1 mmol/l ou par le patient nécessitant une aide extérieure. L'hypoglycémie nocturne confirmée était définie comme des épisodes survenus entre minuit et 6h00.
Évaluation cardiovasculaire
DEVOTE est un essai clinique randomisé en double aveugle comparant la sécurité cardiovasculaire de l'insuline dégludec à celle de l'insuline glargine (100 unités/ml) chez 7637 patients atteints de diabète sucré de type 2 et présentant un risque élevé de manifestations cardiovasculaires. La durée de l'étude était «événementielle», c'est-à-dire jusqu'à ce que les événements ≥633 soient atteints. La durée médiane du traitement était de 1,83 an, la durée d'observation médiane étant de 1,99 an.
L'analyse primaire couvrait la période allant de la randomisation à la première occurrence d'un événement cardiovasculaire indésirable grave (MACE). MACE comportait trois volets: «décès d'origine cardiovasculaire», «crise cardiaque non mortelle» ou «accident vasculaire cérébral non mortel».
Afin d'écarter une augmentation de plus de 30% du risque cardiovasculaire relatif, l'étude a été conçue comme une étude de non-infériorité. La limite supérieure de l'intervalle de confiance (IC) à 95% pour MACE-HR était inférieure à ce seuil prédéfini de 1,3, ce qui démontre l'innocuité cardiovasculaire de l'insuline dégludec par rapport à l'insuline glargine (figure 2).
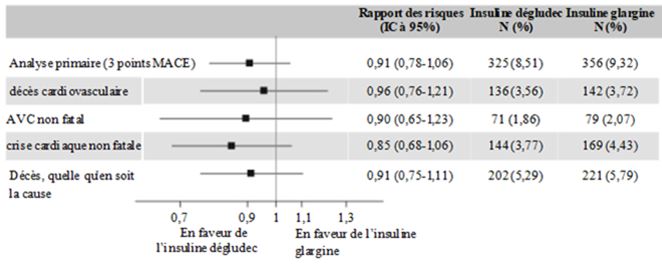
N: nombre de patients ayant eu un premier événement confirmé par l'EAC au cours de l'étude.
%: pourcentage de patients ayant présenté le premier événement confirmé par l'EAC par rapport au nombre de patients randomisés.
EAC: Event Adjudication Commitee.
IC: intervalle de confiance
Figure 2: Diagramme de l'analyse des paramètres combinés MACE à 3 composants et des paramètres cardiovasculaires individuels dans DEVOTE.
L'amélioration de l'HbA1c obtenue avec l'insuline dégludec et l'insuline glargine était également comparable (tableau 5).
Le traitement à l'insuline dégludec a entraîné une réduction du taux d'événements hypoglycémiques sévères et de la proportion de patients présentant au moins une hypoglycémie grave par rapport au traitement avec l'insuline glargine (tableau 4).
Tableau 5: Résultats de DEVOTE
|
|
Insuline dégludec1
|
Insuline glargine1
| |
N
|
3818
|
3819
| |
Valeur HbA1c moyenne (%)
| |
Valeur initiale
|
8.44
|
8.41
| |
Après 2 années de traitement
|
7.50
|
7.47
| |
|
Différence:
0.008 [-0.05; 0.07]IC à 95%
| |
Hypoglycémies (par 100 années-patients d'observation)
| |
Sévères
|
3.70
|
6.25
| |
|
Hazard-Ratio:
0.60 [0.48; 0.76]IC à 95%
| |
Proportion de patients ayant eu une hypoglycémie (pourcentage de patients)
| |
Sévère
|
4.9
|
6.6
| |
|
Rapport des risques:
0.73 [0.60; 0.89]IC à 95%
|
Sécurité et efficacité en pédiatrie
La sécurité et l'efficacité de Ryzodeg ont été étudiées chez des enfants et des adolescents ayant un diabète sucré de type 1 au cours d'une étude clinique randomisée et contrôlée sur une période de 16 semaines (n=362). Les patients du groupe de traitement traité par Ryzodeg étaient 40 enfants âgés de 2 à 5 ans, 61 enfants âgés de 6 à 11 ans et 80 adolescents âgés de 12 à 17 ans. L'administration de Ryzodeg une fois par jour au moment du repas principal en association avec de l'insuline asparte administrée au moment des autres repas a montré une réduction similaire du taux d'HbA1c à la semaine 16 et aucune différence entre la glycémie à jeun et la glycémie mesurée par rapport à l'insuline détémir, administrée une ou deux fois par jour, en association avec de l'insuline asparte administrée au moment des repas. À la semaine 16, la dose quotidienne moyenne d'insuline totale était de 0,88 unité/kg dans le groupe traité avec Ryzodeg contre 1,01 unité/kg dans le groupe traité avec l'insuline détémir. Les taux (d'événements par année-patient d'exposition) d'hypoglycémie confirmée (définition ISPAD [International Society for Child and Adolescent Diabetology] 2009: 46,23 vs 49,55) et d'hypoglycémie confirmée nocturne (5,77 vs 5,40) étaient comparables pour Ryzodeg et l'insuline détémir. Cependant, le taux d'hypoglycémie sévère (0,26 contre 0,07) était numériquement plus élevé chez les patients traités avec Ryzodeg (RC 3,2 [0.88; 11.66]IC à 95%).
Données à long terme
Il n'y a pas de développement cliniquement significatif d'anticorps dirigés contre l'insuline après un traitement à long terme avec Ryzodeg.
Informations complémentaires
Fertilité
Les essais chez l'animal sur la reproduction sous insuline dégludec n'ont pas révélé d'effets négatifs sur la capacité de reproduction.
PharmacocinétiqueAbsorption
Ryzodeg est un mélange de l'insuline basale dégludec et de l'insuline asparte à action rapide, qui garde la capacité de l'insuline dégludec à former des multihexamères au site d'injection après l'administration sous-cutanée. L'insuline dégludec crée, dans le tissu sous-cutané, un dépôt de multihexamères qui libère progressivement des monomères d'insuline dégludec, ce qui permet une libération lente et continue de cette dernière dans la circulation. La concentration sérique du composant basal (insuline dégludec) à l'état d'équilibre est atteinte au bout de 2 à 3 jours après l'administration de Ryzodeg.
L'absorption rapide bien connue de l'insuline asparte est maintenue pour Ryzodeg. L'insuline asparte apparaît dans la circulation sanguine 14 minutes après l'injection et la concentration maximale est atteinte au bout de 72 minutes.
Distribution
L'affinité de l'insuline dégludec pour l'albumine sérique correspond à une liaison aux protéines plasmatiques >99% dans le plasma humain. La liaison de l'insuline asparte aux protéines plasmatiques est faible (<10%), ce qui est similaire à ce que l'on observe avec l'insuline humaine soluble.
Métabolisme
La dégradation de l'insuline dégludec et de l'insuline asparte est semblable à celle de l'insuline humaine; tous les métabolites formés sont inactifs.
Élimination
La demi-vie après une administration sous-cutanée de Ryzodeg est déterminée par la vitesse d'absorption à partir du tissu sous-cutané. La demi-vie du composant basal (insuline dégludec) à l'état d'équilibre est de 25 heures indépendamment de la dose.
Linéarité
L'exposition totale à Ryzodeg augmente proportionnellement avec la dose du composant basal (insuline dégludec) et du composant lié aux repas (insuline asparte) dans le diabète de type 1 et dans le diabète de type 2.
Cinétique pour certains groupes de patients
Sexe
Il n'existe aucune différence cliniquement significative au niveau des propriétés pharmacocinétiques de Ryzodeg entre les sexes.
Patients âgés et patients atteints d'insuffisance rénale ou hépatique
Aucune différence cliniquement significative n'a été observée au niveau des propriétés pharmacocinétiques d'IDegAsp entre les sujets âgés et les sujets adultes plus jeunes ou entre les sujets sains et les sujets atteints d'insuffisance rénale ou hépatique.
Enfants et adolescents
Les propriétés pharmacocinétiques de Ryzodeg dans le diabète de type 1 ont été étudiées chez des enfants (de 6 à 11 ans) et des adolescents (de 12 à 18 ans), puis comparées à celles d'adultes après administration d'une dose unique.
Les propriétés pharmacocinétiques de la composante insuline dégludec de Ryzodeg à l'état stable ont été étudiées dans une analyse pharmacocinétique de la population chez des enfants à partir de 1 an.
L'exposition totale et la concentration maximale d'insuline asparte étaient plus élevées chez les enfants que chez les adultes et semblables à celles des adultes chez les adolescents.
Les propriétés pharmacocinétiques de l'insuline dégludec à l'état stationnaire chez les enfants (de 1 à 11 ans) et les adolescents (de 12 à 18 ans) étaient comparables à celles observées chez les adultes ayant un diabète sucré de type 1. Toutefois, l'exposition totale à l'insuline dégludec après une seule dose était plus élevée chez les enfants et les adolescents que chez les adultes ayant un diabète sucré de type 1.
Données précliniquesLes données précliniques issues d'études de pharmacologie de sécurité, de toxicité en administration répétée, de cancérogénicité et de toxicité de reproduction n'ont pas révélé d'éléments préoccupants pour la sécurité humaine.
Le rapport entre l'effet mitogène et l'effet métabolique de l'insuline dégludec correspond à celui de l'insuline humaine.
Remarques particulièresIncompatibilités
L'adjonction d'autres substances à Ryzodeg peut causer une dégradation de l'insuline dégludec et/ou de l'insuline asparte.
Ryzodeg ne doit pas être mélangée avec des solutions de perfusion.
Ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne peut être utilisé que jusqu'à la date indiquée sur l'emballage après la mention «EXP».
Stabilité après ouverture ou gardé sur soi en réserve
Ryzodeg Penfill: Ne pas conserver au-dessus de 30 °C. Ne pas mettre au réfrigérateur. Utiliser en l'espace de 4 semaines. Conserver les cartouches Ryzodeg Penfill dans la boîte en carton afin de les protéger contre la lumière.
Ryzodeg FlexTouch: Ne pas conserver au-dessus de 30 °C. Peut être conservé au réfrigérateur (2-8 °C). Utiliser en l'espace de 4 semaines. Conserver le capuchon sur le stylo lorsque Ryzodeg FlexTouch n'est pas en cours d'utilisation afin d'en protéger le contenu de la lumière.
Tous les restes doivent être jetés.
Remarques particulières concernant le stockage
Stockage:
Conserver au réfrigérateur (2-8 °C), mais pas à proximité de l'élément du congélateur.
Ne pas congeler.
Conserver dans l'emballage d'origine.
Entreposer le contenant dans l'emballage extérieur pour protéger le contenu de la lumière.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
Le stylo prérempli Ryzodeg FlexTouch est conçu pour être utilisé avec les aiguilles à usage unique NovoFine/NovoTwist.
Ryzodeg FlexTouch fournit de 1 à 80 unités par paliers de 1 unité. Les instructions jointes au stylo prérempli doivent être respectées.
La cartouche Ryzodeg Penfill est destinée à l'emploi avec les appareils d'injection de Novo Nordisk (appareils destinés à des administrations répétées) et les aiguilles à usage unique NovoFine/NovoTwist.
Ryzodeg FlexTouch et Ryzodeg Penfill ne doivent être utilisés que par une seule personne. La cartouche ne doit pas être de nouveau remplie.
Ryzodeg ne doit pas être utilisé si la solution n'est pas limpide et incolore.
Ryzodeg ne doit pas être utilisé s'il a été congelé.
Eliminer l'aiguille après chaque injection.
Numéro d’autorisation62627, 62648 (Swissmedic)
PrésentationRyzodeg Penfill
Cartouches de 100 U/ml de 3 ml (300 U par cartouche): 5 (B)
Ryzodeg FlexTouch
Stylo prérempli de 100 U/ml de 3 ml (300 U par stylo prérempli): 5 (B)
Titulaire de l’autorisationNovo Nordisk Pharma AG, Kloten
Domicile: Zürich
Mise à jour de l’informationNovembre 2020
|


