CompositionPrincipes actifs
Complexus toxini botulinici A et haemagglutinini
Excipients
Albuminum humanum, Lactosum monohydricum
Indications/Possibilités d’emploiAzzalure est utilisé pour améliorer temporairement l'aspect des
rides glabellaires modérées à sévères (rides verticales intersourcilières) observées lors du froncement des sourcils,
rides canthales latérales modérées à sévères (pattes d'oie) observées lors d'un sourire maximum
chez l'adulte de moins de 65 ans, lorsque l'importance de ces rides entraîne une souffrance psychique importante chez le patient.
Posologie/Mode d’emploiLes unités de toxine botulinique sont différentes selon les médicaments. Les unités Speywood d'Azzalure sont spécifiques à ce médicament et ne sont pas transposables à d'autres préparations à base de toxine botulinique.
Azzalure doit être administré uniquement par des médecins ayant les qualifications adéquates, une bonne expérience du traitement, et disposant de l'équipement approprié.
Le produit doit être reconstitué avant l'injection; les instructions correspondantes figurent dans la rubrique «Remarques particulières».
La peau doit être nettoyée de tout maquillage et désinfectée avec un antiseptique local.
Les injections intramusculaires doivent être effectuées à l'aide d'une aiguille stérile de 29 ou 30 gauges.
L'intervalle entre deux traitements dépend de la réponse individuelle observée chez le patient.
L'intervalle entre deux traitements par Azzalure ne doit pas être inférieur à 3 mois.
Les points d'injection recommandés pour les rides glabellaires et les rides canthales latérales sont illustrés ci-dessous.
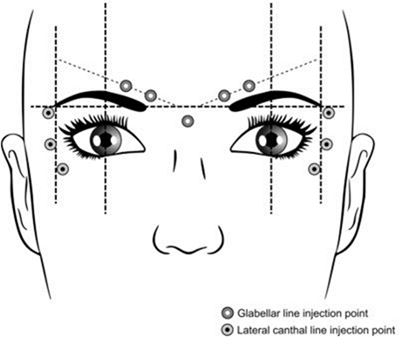
Posologie usuelle
Rides glabellaires
La dose recommandée est de 50 unités Speywood (0,25 ml de solution reconstituée) d'Azzalure, répartie sur 5 sites d'injection, c.-à-d. que 10 unités Speywood (0,05 ml de la solution reconstituée) sont injectées par voie intramusculaire perpendiculairement à la peau dans chacun des 5 sites suivants: deux injections dans chacun des muscles corrugateurs du sourcil et une injection dans le muscle procerus près de l'angle nasofrontal, comme illustré dans la figure ci-dessus.
Les repères anatomiques peuvent être identifiés plus rapidement s'ils sont observés et palpés lors du froncement maximum des sourcils. Avant l'injection, il faut appuyer fermement le pouce ou l'index sous le rebord orbitaire afin d'éviter une extravasation sous le rebord orbitaire. L'aiguille doit être orientée vers le haut et vers la ligne médiane lors de l'injection. Pour diminuer le risque de ptosis, il faut éviter les injections à proximité du muscle releveur de la paupière supérieure, en particulier chez les patients dotés d'importants complexes abaisseurs des sourcils (depressor supercilii). Les injections dans le muscle corrugateur du sourcil ne doivent être effectuées que dans la partie centrale du muscle, à au moins 1 cm au-dessus du rebord orbitaire.
Dans les études cliniques, un effet optimal sur les rides glabellaires a été démontré pendant une durée allant jusqu'à 4 mois après l'injection. Certains patients étaient encore répondeurs au traitement 5 mois après l'injection (voir rubrique «Propriétés/Effets»).
Rides canthales latérales
La dose recommandée de chaque côté est de 30 unités Speywood d'Azzalure (60 unités Speywood pour les 2 côtés, 0,30 ml de solution reconstituée), à répartir sur 3 sites d'injection; c.-à-d. qu'une injection intramusculaire de 10 unités Speywood (0,05 ml de solution reconstituée) est administrée au niveau de chacun des points d'injection. L'injection doit être réalisée latéralement (avec un angle de 20 à 30°) par rapport à la surface de la peau et très superficiellement. Tous les points d'injection doivent se situer au niveau de la partie externe du muscle orbiculaire de l'œil (orbicularis oculi) et suffisamment loin du rebord orbitaire (environ 1 à 2 cm), comme illustré dans la figure ci-dessus.
Les repères anatomiques peuvent être identifiés plus rapidement s'ils sont observés et palpés lors d'un sourire maximum. Des précautions doivent être prises pour éviter les injections dans les muscles grand et petit zygomatiques (zygomaticus major/minor) afin d'éviter une déformation latérale de la bouche et un sourire asymétrique.
Informations générales
En cas d'échec thérapeutique ou de diminution de l'effet après des injections répétées, il convient d'utiliser d'autres méthodes thérapeutiques. En cas d'échec du traitement après la première utilisation, les mesures suivantes peuvent être envisagées:
−Analyse des causes de l'échec du traitement, p.ex. muscles inappropriés (dans lesquels l'injection a été effectuée) ou technique d'injection inappropriée, formation d'anticorps neutralisant la toxine
−Réévaluation de la pertinence du traitement par le complexe toxine botulique A-hémagglutinine.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Durée du traitement
La sécurité et l'efficacité d'injections répétées d'Azzalure ont été évaluées pendant jusqu'à 24 mois et 8 cycles de traitement répétés pour les rides glabellaires et pendant jusqu'à 12 mois et 5 cycles de traitement répétés pour les rides canthales latérales.
Patients âgés
La sécurité et l'efficacité d'Azzalure chez les personnes de plus de 65 ans n'ont pas été établies. L'utilisation d'Azzalure chez les personnes de plus de 65 ans n'est pas recommandée.
Enfants et adolescents
La sécurité et l'efficacité d'Azzalure chez les personnes de moins de 18 ans n'ont pas été établies. L'utilisation d'Azzalure chez les personnes de moins de 18 ans n'est pas recommandée.
Contre-indicationsAzzalure ne doit pas être utilisé en cas de:
−Hypersensibilité au principe actif ou à l'un des excipients conformément à la composition.
−Infections au niveau des sites d'injection prévus.
−Myasthénie grave, syndrome de Lambert-Eaton ou sclérose latérale amyotrophique.
Mises en garde et précautionsIl faut veiller à ne pas injecter Azzalure dans un vaisseau sanguin.
Troubles neuromusculaires préexistants
Azzalure doit être utilisé avec prudence chez les patients présentant un risque ou des signes cliniques avérés d'anomalies de la transmission neuromusculaire. De tels patients ont éventuellement une sensibilité accrue aux médicaments tels qu'Azzalure, ce qui peut entraîner une faiblesse musculaire excessive.
Diffusion locale et à distance de l'effet de la toxine
Des effets indésirables, pouvant être liés à la diffusion de la toxine à distance du site d'injection, ont très rarement été rapportés avec la toxine botulique. Les patients traités à doses thérapeutiques peuvent présenter une faiblesse musculaire excessive. Les troubles de la déglutition et de la respiration sont graves et peuvent provoquer le décès.
Une sécheresse oculaire a été rapportée lors de l'utilisation d'Azzalure dans le traitement des rides glabellaires et des rides latérales (voir « Effets indésirables »). Une réduction de la production de larmes, une réduction des clignements et des troubles cornéens peuvent survenir avec l'utilisation de toxines botuliques.
L'injection d'Azzalure n'est pas recommandée chez les patients ayant des antécédents de dysphagie ou de pneumopathie d'inhalation.
Les patients ou le personnel soignant doivent être informés de la nécessité de consulter immédiatement un médecin en cas d'apparition de troubles de la déglutition ou de l'élocution ou de troubles respiratoires.
Les posologies recommandées et la fréquence d'administration d'Azzalure ne doivent pas être dépassées.
Avant l'utilisation d'Azzalure, il est impératif que le médecin étudie l'anatomie faciale du patient. Des asymétries faciales, un ptosis, une dermatochalasie excessive, des cicatrices et toutes les modifications anatomiques résultant d'interventions chirurgicales antérieures doivent être prises en considération.
La prudence s'impose lorsque Azzalure est utilisé en présence d'une inflammation au(x) site(s) d'injection prévu(s) ou en cas de faiblesse marquée ou d'atrophie du muscle dans lequel l'injection doit être pratiquée.
Comme pour toute injection intramusculaire, le traitement par Azzalure est déconseillé chez les patients présentant un allongement du temps de coagulation.
Formation d'anticorps
Les injections à des intervalles plus rapprochés ou à des doses trop élevées peuvent augmenter le risque de formation d'anticorps dirigés contre la toxine botulique. Sur le plan clinique, la formation d'anticorps neutralisants est susceptible de diminuer l'efficacité des traitements ultérieurs.
Les unités de toxine botulique ne sont pas interchangeables d'un produit à l'autre. Les doses recommandées dans les unités Speywood sont différentes des autres préparations de toxine botulique.
Azzalure ne doit être utilisé que pour le traitement d'un seul patient au cours d'une séance. Tout médicament résiduel non utilisé doit être éliminé comme décrit plus en détail dans la rubrique «Remarques particulières». Une prudence particulière s'impose lors de la préparation et de l'utilisation du produit ainsi que lors de l'inactivation et de l'élimination de la solution résiduelle non utilisée (voir rubrique «Remarques particulières»).
InteractionsLe traitement simultané par Azzalure et des aminoglycosides ou d'autres médicaments agissant sur la transmission neuromusculaire (p.ex. principes actifs de type curare) impose la prudence, car l'action du complexe toxine botulique A-hémagglutinine peut être potentialisée.
Aucune étude d'interactions n'a été réalisée. Aucune autre interaction cliniquement significative n'a été rapportée.
Grossesse, allaitementGrossesse
Azzalure ne doit pas être administré pendant la grossesse. Il n'existe pas de données suffisantes concernant l'emploi du complexe toxine botulique A-hémagglutinine chez la femme enceinte. Les expérimentations animales ont révélé une toxicité de reproduction à fortes doses (voir rubrique «Données précliniques»). Le risque potentiel pour l'être humain n'est pas connu.
Allaitement
On ignore si Azzalure passe dans le lait maternel. L'utilisation d'Azzalure n'est pas recommandée pendant l'allaitement.
Fertilité
Il n'y a pas de données cliniques sur les effets d'Azzalure sur la fertilité. Il n'y a aucune preuve d'un effet direct d'Azzalure sur la fertilité dans les études animales (voir « Données précliniques »).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAzzalure exerce une influence légère ou modérée sur l'aptitude à la conduite et l'utilisation de machines.
Il existe un risque potentiel de faiblesse musculaire localisée, de troubles visuels, de vertiges, d'une asthénie généralisée ou de fatigue liés à l'utilisation de ce médicament, susceptible d'affecter temporairement la conduite de véhicules ou l'utilisation de machines (voir «Effets indésirables»). Les patients doivent être informés de ce risque.
Effets indésirablesPlus de 3800 patients ont reçu Azzalure au cours des différentes études cliniques.
Sur la base d'études cliniques contrôlées contre placebo, les taux observés d'effets indésirables après la première injection d'Azzalure ont été de 22,3% lors du traitement des rides glabellaires (16,6% pour le placebo) et de 6,2% lors du traitement des rides canthales latérales (2,9% pour le placebo). La plupart de ces événements étaient de sévérité légère à modérée et réversibles.
Les effets indésirables les plus fréquents étaient les céphalées et les réactions au site d'injection pour les rides glabellaires, et les céphalées, les réactions au site d'injection et l'œdème palpébral pour les rides canthales latérales.
Les effets indésirables liés au traitement ou à la technique d'injection sont généralement survenus durant la première semaine suivant l'injection et ils étaient transitoires.
L'incidence des réactions liées au traitement et/ou à la technique d'injection a diminué avec la répétition des cycles d'injection. Les effets indésirables peuvent être liés au principe actif, à la procédure d'injection ou à la combinaison des deux.
« très fréquents » (≥1/10),
« fréquents » (≥1/100 à <1/10),
« occasionnels » (≥1/1000 à <1/100),
« rares » (≥1/10 000 à <1/1000),
« très rares » (<1/10 000)
« Fréquence inconnue » (ne peut être estimée sur la base des données disponibles)
Affections du système immunitaire
Occasionnels: hypersensibilité*
Affections du système nerveux
Très fréquents: céphalées (12,5%)**
Fréquents: parésie faciale temporaire (parésie temporaire des muscles du visage proches des sites d'injection, une parésie du releveur de la paupière est le plus souvent décrite)
Occasionnels: vertiges*
Affections oculaires
Fréquents: asthénopie*, ptosis, œdèmes des paupières, larmoiement accru*, sécheresse oculaire***, secousses musculaires* (secousses des muscles autour des yeux)
Occasionnels: troubles visuels*, vision floue*, diplopie*,
Rares: troubles de la motricité oculaire*
Affections de la peau et du tissu sous-cutané
Occasionnels: prurit*, éruption cutanée*
Rares: urticaire*
Troubles généraux et anomalies au site d'administration
Très fréquents: réactions au site d'injection** (p.ex. rougeur cutanée, œdème, irritation, éruption cutanée (rash), prurit, paresthésies, douleurs, gêne, picotements et ecchymose)
Des effets indésirables, attribués à la diffusion de l'effet de la toxine à distance du site d'injection (faiblesse musculaire excessive, dysphagie, pneumopathie d'inhalation, d'issue fatale dans certains cas), ont très rarement été rapportés après l'administration de la toxine botulique (voir rubrique «Mises en garde et précautions»).
*effets indésirables seulement observés dans l'indication «rides glabellaires»
**«fréquents» dans l'indication «rides canthales latérales»
***«occasionnels» dans l'indication rides canthales latérales
Effets indésirables identifiés après la mise sur le marché
Affections du système nerveux
Fréquence inconnue: Hypoesthésie
Affections du système immunitaire
Fréquence inconnue: Hypersensibilité
Affections musculosquelettiques et du tissu conjonctif
Fréquence inconnue: Atrophie musculaire
Troubles généraux et anomalies au site d'administration
Fréquence inconnue: Asthénie, fatigue, symptômes pseudo-grippaux
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageIl y a tout lieu de penser que des doses excessives de toxine botulique provoquent une faiblesse neuromusculaire associée à de nombreux symptômes. Une ventilation peut s'avérer nécessaire chez les patients présentant une paralysie des muscles respiratoires provoquée par des doses excessives. En cas de surdosage, une surveillance médicale du patient doit être assurée pour déceler d'éventuels symptômes de faiblesse musculaire excessive ou de paralysie musculaire. Un traitement symptomatique doit être instauré si nécessaire.
Il se peut que les symptômes d'un surdosage ne surviennent pas immédiatement après l'injection.
Une hospitalisation doit être envisagée chez les patients présentant des symptômes d'intoxication par le complexe toxine botulique A-hémagglutinine (p.ex. l'association d'une faiblesse musculaire, d'un ptosis, d'une diplopie, de troubles de la déglutition et de l'élocution ou d'une paralysie des muscles respiratoires).
Propriétés/EffetsCode ATC
M03AX01
Mécanisme d'action
La toxine botulique A bloque sélectivement la conduction aux terminaisons nerveuses cholinergiques par inhibition de la libération d'acétylcholine. La dénervation chimique provoque une paralysie flasque des muscles squelettiques et une atonie des muscles lisses innervés par le système parasympathique.
La formation de nouvelles terminaisons nerveuses et plaques motrices terminales rétablit la conduction de l'influx. Ce processus de régénération commence env. 8 semaines après l'administration de la toxine.
Pharmacodynamique
Le principal effet pharmacodynamique du complexe toxine botulique A-hémagglutinine est lié à la dénervation chimique du muscle traité, qui conduit à une diminution mesurable du potentiel d'action musculaire global provoquant une diminution localisée de l'activité musculaire, voire une paralysie.
Efficacité clinique
Au cours du développement clinique d'Azzalure, plus de 4500 patients ont été inclus dans les différentes études cliniques et environ 3800 patients ont reçu Azzalure.
Rides glabellaires
Dans ces études cliniques, 2032 patients présentant des rides glabellaires modérées à sévères ont été traités par la dose recommandée de 50 unités Speywood. Parmi ceux-ci, 305 patients ont été traités par 50 unités au cours de deux études d'homologation de phase III en double aveugle, contrôlées contre placebo, et 1200 patients par 50 unités au cours d'une étude ouverte de phase III à long terme, à doses répétées. Les autres patients ont été traités dans des études supportives ou des études de recherche de dose.
Le délai médian d'apparition de la réponse a été de 2 à 3 jours après le traitement, l'effet maximum ayant été observé au 30e jour. Dans les deux études d'homologation de phase III contrôlées contre placebo, les injections d'Azzalure ont significativement diminué la sévérité des rides glabellaires pendant une durée allant jusqu'à 4 mois. L'effet était encore significatif au bout de 5 mois dans l'une de ces deux études d'homologation.
Trente jours après l'injection, 90% des patients (273/305) étaient répondeurs au traitement (c.-à-d. rides glabellaires absentes ou peu marquées lors du froncement maximum des sourcils) selon l'évaluation des investigateurs, contre seulement 3% des patients (4/153) ayant reçu le placebo. Cinq mois après l'injection, 17% (32/190) des patients traités par Azzalure étaient toujours répondeurs au traitement, contre seulement 1% (1/92) des patients ayant reçu le placebo, dans l'étude concernée. L'auto-évaluation des patients lors du froncement maximum des sourcils, 30 jours après le traitement, a montré un taux de réponse de 82% (251/305) chez les patients traités par Azzalure et de 6% (9/153) chez les patients ayant reçu le placebo. La proportion de patients présentant, selon l'évaluation des investigateurs, une amélioration de deux grades lors du froncement maximum des sourcils a été de 77% (79/103) dans l'étude d'homologation de phase III ayant évalué ce critère.
Un sous-groupe de 177 patients présentait des rides glabellaires modérées ou sévères au repos avant le traitement. Trente jours après le traitement, 71% (125/177) des patients traités par Azzalure dans ce groupe étaient répondeurs au traitement, selon l'évaluation des investigateurs, contre 10% (8/78) des patients ayant reçu le placebo.
L'étude ouverte de phase III à long terme, à doses répétées, a montré que le délai médian d'apparition de la réponse de 3 jours s'est maintenu lors de la répétition des cycles de traitement. Le taux de réponse lors du froncement maximum des sourcils, évalué par les investigateurs 30 jours après le traitement, s'est maintenu lors de la répétition des cycles de traitement et était compris entre 80% et 91% pendant les 5 cycles. Le taux de réponse au repos pendant la répétition des cycles de traitement concordait également avec celui observé dans les études à dose unique et était compris entre 56% et 74% 30 jours après le traitement chez les patients traités par Azzalure, selon l'évaluation des investigateurs.
Aucun des critères d'évaluation clinique ne comportait une évaluation objective du retentissement psychique.
Rides canthales latérales
Dans des études cliniques menées en double aveugle, 308 patients présentant des rides canthales latérales modérées à sévères lors d'un sourire maximum ont été traités par la dose recommandée de 30 unités Speywood par côté. Parmi ces patients, 252 ont été traités dans le cadre d'une étude de phase III contrôlée contre placebo, en double aveugle et 56 patients ont été traités dans le cadre d'une étude de phase II en double aveugle destinée à déterminer la posologie.
Le critère d'efficacité principal de l'étude de phase III, évalué par les investigateurs à 4 semaines après l'injection, a montré que 47,2% (119/252) des patients avaient répondu au traitement (rides canthales latérales absentes ou minimes lors d'un sourire maximum), contre 7,2% (6/83) des patients traités par le placebo.
Les injections d'Azzalure ont réduit de façon significative la sévérité des rides canthales latérales par rapport au placebo (p ≤0,001) à 4, 8 et 12 semaines (évaluées lors d'un sourire maximum par les investigateurs). L'évaluation de la satisfaction des patients concernant l'aspect de leurs rides canthales latérales a montré une différence statistiquement significative entre Azzalure et le placebo (p ≤0,010) en faveur d'Azzalure à 4, 8 et 12 semaines.
Au total, 315 patients ont intégré la phase d'extension en ouvert de l'étude de phase III. Les patients traités par Azzalure dans les phases en double aveugle et ouverte de l'étude de phase III ont reçu en moyenne 3 traitements pour les rides canthales latérales. L'intervalle médian entre les injections pour les rides canthales latérales, qui était en grande partie déterminé par le protocole de l'étude, était compris entre 85 et 108 jours. Les résultats ont montré que l'efficacité s'est maintenue avec des traitements répétés sur une période d'un an.
Le niveau de satisfaction des patients aux semaines 4, 16 et 52 après le premier traitement par Azzalure montre que 165/252 (65,5%) des patients étaient très satisfaits ou satisfaits de l'aspect de leurs rides canthales latérales.
Après 16 semaines, c.-à-d. 4 semaines après le deuxième traitement par Azzalure pour les patients randomisés dans le groupe sous Azzalure au cours de la première partie de l'étude ou 4 semaines après le premier traitement pour les patients randomisés dans le groupe sous placebo, la proportion de patients qui étaient très satisfaits ou satisfaits était de 233/262 (89,0%). Après 52 semaines, lorsque les patients ont pu bénéficier de jusqu'à cinq cycles de traitement par Azzalure, dont le dernier était effectué après 48 semaines, la proportion de patients très satisfaits ou satisfaits était de 255/288 (84,7%).
Données à long terme
Aucun patient n'a été testé positif pour les anticorps neutralisant la toxine, même après avoir reçu des traitements répétés par Azzalure pendant plus d'un an.
PharmacocinétiqueAbsorption
Il est improbable qu'Azzalure soit présent dans le sang périphérique à des concentrations mesurables après injection IM à la dose recommandée. Aucune étude pharmacocinétique n'a donc été réalisée avec Azzalure.
Distribution
Aucune indication.
Métabolisme
Aucune indication.
Élimination
Aucune indication.
Données précliniquesToxicité en cas d'administration répétée
Une étude de toxicité à long terme réalisée chez le rat n'a révélé aucun indice de toxicité systémique à des doses correspondant à 75 fois la dose recommandée chez l'être humain (50 unités), réparties de façon égale entre les muscles fessiers droit et gauche.
Les études de toxicité aiguë, de toxicité à long terme et de tolérance locale au site d'injection n'ont montré aucun effet indésirable local ou systémique inhabituel après administration de doses cliniquement significatives.
Mutagénicité/Carcinogénicité
Aucune étude sur le potentiel génotoxique ou cancérigène Azzalure n'a été réalisée.
Toxicité sur la reproduction
Les études de reproduction chez le rat et le lapin ont montré une sévère toxicité maternelle associée à des pertes d'implantation (de nidation) après administration de fortes doses. Aucune toxicité embryofœtale n'a été observée chez le lapin et le rat à des doses correspondant respectivement à 60 et 100 fois la dose recommandée chez l'être humain (50 unités). Aucun effet tératogène n'a été mis en évidence chez ces espèces. Chez le rat, une diminution de la fertilité a été observée chez le mâle et la femelle en raison de la réduction des accouplements due à la paralysie musculaire survenant à fortes doses.
Remarques particulièresIncompatibilités
Ce médicament ne peut être mélangé qu'aux médicaments mentionnés sous Remarques concernant la manipulation.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité de la poudre dans le récipient intact: 24 mois.
Stabilité de la solution reconstituée
La solution prête à l'emploi ne contient pas de conservateur. La stabilité physicochimique de la solution reconstituée a été démontrée pendant 24 heures à une température comprise entre 2 °C et 8 °C.
Pour des raisons microbiologiques, la solution pour injection prête à l'emploi devrait être administrée directement, c'est-à-dire immédiatement après reconstitution. Si la solution pour injection prête à l'emploi n'est pas administrée directement, l'utilisateur est responsable de la durée et des conditions de conservation qui ne doit pas dépasser 24 heures à une température comprise entre 2 et 8 °C. Ne pas congeler pour une utilisation ultérieure.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C).
Conserver dans l'emballage d'origine.
Conserver hors de la portée des enfants.
Remarques concernant la manipulation
Les instructions de manipulation, d'utilisation et d'élimination doivent être strictement respectées.
Préparation de la solution injectable
La reconstitution doit être réalisée conformément aux règles de bonnes pratiques de fabrication, notamment en ce qui concerne l'asepsie.
Azzalure doit être reconstitué avec 0,63 ml d'une solution injectable de chlorure de sodium à 9 mg/ml (0,9%). Cela permet d'obtenir une solution limpide et incolore contenant 125 unités Speywood de principe actif, à une concentration de 10 unités pour 0,05 ml de solution reconstituée.
Pour mesurer précisément le volume de 0,63 ml, il est possible d'utiliser des seringues de 1 ml, de type seringue à insuline: celles-ci comportent des graduations de 0,1 ml et 0,01 ml jusqu'à 1 ml.
Recommandations pour l'élimination du matériel contaminé
Immédiatement après l'utilisation et avant l'élimination, la solution reconstituée et non utilisée d'Azzalure (dans le flacon ou la seringue) doit être inactivée avec 2 ml d'une solution diluée d'hypochlorite de sodium (à 0,55 ou 1%) (eau de Javel).
Les flacons, seringues et matériels utilisés ne doivent pas être vidés, mais doivent être jetés dans des récipients adaptés et éliminés conformément à la réglementation locale en vigueur.
Recommandations en cas d'accidents pendant la manipulation de la toxine botulique
−Tout médicament renversé doit être essuyé: soit avec un matériel absorbant imbibé d'une solution d'hypochlorite de sodium (eau de Javel) dans le cas de la poudre, soit avec un matériel absorbant sec dans le cas de la solution reconstituée.
−Les surfaces contaminées doivent être nettoyées avec un matériel absorbant, imbibé d'hypochlorite de sodium (eau de Javel), puis séchées.
−En cas de bris d'un flacon, procéder comme indiqué ci-dessus: ramasser précautionneusement les éclats de verre et essuyer le médicament, en évitant les coupures cutanées.
−En cas de contact du médicament avec la peau, laver la zone concernée avec une solution d'hypochlorite de sodium (eau de Javel), puis rincer soigneusement et abondamment à l'eau.
−En cas de contact du médicament avec les yeux, rincer soigneusement et abondamment à l'eau ou avec une solution pour lavage oculaire.
−En cas de contact du produit avec une plaie, une coupure ou une peau lésée, rincer soigneusement et abondamment à l'eau et prendre les mesures médicales appropriées en fonction de la dose injectée.
Numéro d’autorisation62780 (Swissmedic).
PrésentationEmballage d'un ou de deux flacon(s) (A)
Titulaire de l’autorisationIPSEN Pharma Schweiz GmbH, Zug
Mise à jour de l’informationMars 2022
|

