Propriétés/EffetsCode ATC
L01EC02
Mécanisme d'action
Tafinlar en monothérapie
Le dabrafénib est un puissant inhibiteur sélectif, compétitif de l'ATP, des kinases RAF, avec des valeurs de CI50 de 0,65, 0,5 et 1,84 nM pour les enzymes BRAF V600E, BRAF V600K et BRAF V600D. Des mutations oncogènes de BRAF entraînent une activation constitutive de la cascade de transduction du signal RAS/RAF/MEK/ERK, stimulant la croissance de cellules tumorales. Des mutations BRAF sont observées très fréquemment dans certaines sortes de cancers, notamment dans environ 50% de tous les mélanomes. La mutation BRAF V600E, la plus fréquemment observée, représente environ 90% des mutations BRAF observées chez des patients atteints de mélanome. On trouve en outre une série de substitutions rares, par exemple les mutations V600K, V600D, V600G, V600M et V600R.
De surcroît, le dabrafénib inhibe les enzymes BRAF et CRAF de type sauvage avec des valeurs de CI50 de 3,2 et 5,0 nM. Le dabrafénib inhibe in vitro et in vivo la croissance des cellules de mélanome porteur d'une mutation BRAF V600.
Dans des lignées cellulaires de mélanome présentant une mutation BRAF V600, la suppression par le dabrafénib d'un biomarqueur pharmacodynamique en aval (ERK phosphorylée) a été démontrée in vitro et dans des modèles animaux.
Chez des participants atteints d'un mélanome porteur d'une mutation BRAF V600, l'administration de dabrafénib a entraîné l'inhibition de la phosphorylation d'ERK dans les cellules tumorales par rapport à la valeur mesurée avant le traitement.
Tafinlar en association avec le tramétinib - mélanome métastatique et CPNPC
Le tramétinib est un inhibiteur allostérique, réversible et hautement sélectif de l'activation et de l'activité des kinases MEK 1 et MEK 2 (MEK = kinases régulées par des signaux extracellulaires, activées par un mitogène). Les protéines MEK sont des composants critiques de la voie des kinases régulées par des signaux extracellulaires (extracellular signal-regulated kinase, ERK).
Le tramétinib et le dabrafénib inhibent les deux kinases MEK et BRAF au sein de cette chaîne de transduction de signal; la combinaison des deux principes actifs conduit à une double inhibition efficace de la chaîne de transduction de signal. L'association de tramétinib et de dabrafénib s'est révélée synergique pour les lignées cellulaires de mélanome et de CPNPC porteurs d'une mutation BRAF V600 in vitro et retarde l'apparition de résistance in vivo des xénogreffes de mélanome porteur d'une mutation BRAF V600.
Étude MEK111054
Allongement de l'intervalle QT
Un allongement de l'intervalle QTc > 60 ms dans les cas les plus défavorables a été observé chez 3% des patients traités par Tafinlar (dont un cas > 500 ms dans la population totale pour l'analyse des données de sécurité).
Le potentiel du dabrafénib d'allongement de l'intervalle QT a été évalué dans le cadre d'une étude portant spécifiquement sur l'intervalle QT sous administration répétée. Une dose suprathérapeutique de 300 mg de dabrafénib a été administrée deux fois par jour aux 32 participants atteints de tumeurs porteuses d'une mutation BRAF V600. Aucun effet cliniquement significatif du dabrafénib ou des métabolites du dabrafénib sur l'intervalle QTc n'a été observé.
Dans l'étude de phase III MEK115306, le cas défavorable d'un allongement de l'intervalle QTcB > 500 ms ne s'est présenté chez aucun des patients traités par le tramétinib en association avec le dabrafénib; l'intervalle QTcB a été allongé de plus de 60 ms par rapport à la valeur initiale chez 1% (3/209) des patients. Dans l'étude de phase III MEK116513, quatre patients (1%) traités par le tramétinib en association avec le dabrafénib ont présenté un allongement du QTcB de grade 3 (> 500 ms). Deux de ces patients ont présenté un allongement du QTcB de grade 3 (> 500 ms) qui représentait simultanément une augmentation > 60 ms par rapport à la valeur initiale.
Pharmacodynamique
Efficacité clinique
Tafinlar en monothérapie
L'efficacité de Tafinlar dans le traitement de patients adultes atteints de mélanome non résécable ou métastatique porteur d'une mutation BRAF V600 a été examinée dans 3 études (BRF113683 [BREAK-3], BRF113929 [BREAK-MB] et BRF113710 [BREAK-2]) chez des patients porteurs de la mutation BRAF V600E et/ou BRAF V600K. L'étude pivot BREAK-3 a été exclusivement réalisée chez des patients porteurs de la mutation V600E. Dans ces études, un total de 402 patients porteurs de la mutation BRAF V600E et 49 patients porteurs de la mutation BRAF V600K ont été inclus. Selon les résultats des études de phase II, en présence d'une mutation V600K, l'efficacité est plus faible que sur les tumeurs porteuses de la mutation V600E.
L'efficacité de Tafinlar chez des patients prétraités avec un inhibiteur de la protéine kinase n'a pas été étudiée.
Patients non traités préalablement (résultats de l'étude de phase III BREAK-3)
L'efficacité et la sécurité de Tafinlar ont été évaluées dans une étude de phase III randomisée, ouverte (BREAK-3) comparant Tafinlar à la dacarbazine (DTIC) chez des patients atteints de mélanome avancé (non résécable, stade III) ou métastatique (stade IV) porteur d'une mutation BRAF V600E et non traités préalablement.
L'objectif principal de l'étude consistait à évaluer l'efficacité de Tafinlar par rapport à celle du DTIC en termes de survie sans progression (SSP). Après la première confirmation radiographique indépendante d'une progression, les patients du bras DTIC ont pu recevoir Tafinlar. Les caractéristiques à l'inclusion ont été réparties de manière homogène entre les groupes de traitement. 60% des patients étaient de sexe masculin, 99,6% de type caucasien; l'âge médian était de 52 ans, 21% des patients étant âgés de ≥65 ans; 98,4% des patients avaient un indice ECOG de 0 ou 1 et 97% avaient un cancer métastatique.
L'analyse prédéfinie incluant les données recueillies jusqu'au 19 décembre 2011 a montré une amélioration significative du critère d'évaluation principal de SSP (HR = 0,30; IC à 95% 0,18, 0,51; p < 0,0001). Les résultats d'efficacité d'une analyse post hoc avec 6 mois supplémentaires de suivi sont résumés dans le tableau 8. La survie globale (SG) d'une autre analyse post-hoc reposant sur les données recueillies le 18 décembre 2012 est présentée dans le tableau 9 et dans la figure 1.
Tableau 8: Efficacité chez des patients non traités préalablement selon les médecins investigateurs (étude BREAK-3, 25 juin 2012)
|
|
Population en intention de traiter
| |
|
Tafinlar
N = 187
|
DTIC
N = 63
| |
Survie sans progression (selon les médecins investigateurs)
| |
Médiane (mois) (IC à 95%)
|
6,9 (5,2; 9,0)
|
2,7 (1,5; 3,2)
| |
HR (IC à 95%)
|
0,37 (0,24; 0,58)
P < 0,0001
| |
Taux de réponse globalea
| |
% (IC à 95%)b
|
59 (51,4; 66,0)
|
24 (21,4; 36,2)
| |
P < 0,0001
| |
Durée de la réponse
| |
|
N = 110
|
N = 15
| |
Médiane (mois) (IC à 95%)
|
8,0 (6,6; 11,5)
|
7,6 (5,0; 9,7)
| |
Abréviations: IC: intervalle de confiance; DTIC: dacarbazine; HR: hazard ratio
a Défini comme réponse complète + partielle.
b Réponse confirmée.
|
Au 25 juin 2012, date de collecte des données, 35 participants sur 63 (55,6%), randomisés pour recevoir le DTIC, sont passés dans le groupe sous Tafinlar. La SSP médiane après le changement de groupe de traitement a été de 4,4 mois.
Tableau 9: Données de survie de l'analyse post hoc (18 décembre 2012).
|
Traitement
|
Nombre de cas de décès (%)
|
Taux de survie globale à 12 mois
|
Hazard ratio
(IC à 95%)
| |
DTIC
|
28 (44%)
|
63%
|
0,76 (0,48; 1,21) (a)
| |
Tafinlar
|
78 (42%)
|
70%
|
(a)Les patients n'étaient pas censurés au moment du changement de groupe de traitement
Figure 1: Courbe de Kaplan-Meier de la survie globale (BREAK-3) (18 décembre 2012)
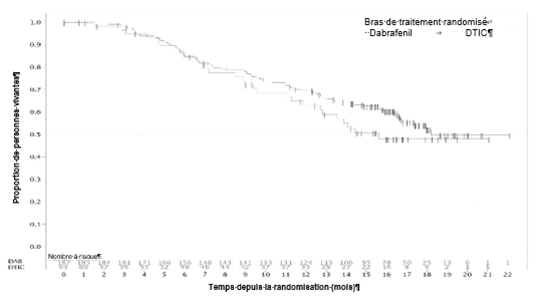
Patients avec métastases cérébrales (résultats de l'étude de phase II BREAK-MB)
BREAK-MB était une étude de phase II multicentrique, ouverte, composée de deux cohortes, conçue pour évaluer la réponse intracrânienne à Tafinlar chez les participants à l'étude atteints de mélanome confirmé histologiquement (stade IV) avec métastases cérébrales et une mutation de BRAF (V600E ou V600K). Les participants à l'étude ont été inclus dans la cohorte A (sujets n'ayant pas reçu de traitement local préalable pour les métastases cérébrales) ou dans la cohorte B (sujets ayant reçu un traitement local préalable pour les métastases cérébrales).
Le critère d'évaluation principal de cette étude était le taux de réponse intracrânienne globale (Overall Intracranial Response Rate, OIRR), évalué par les médecins investigateurs, dans la population présentant la mutation V600E. L'OIRR confirmé ainsi que d'autres résultats relatifs à l'efficacité sont présentés dans le tableau 10.
Tableau 10: Données sur l'efficacité chez des patients présentant des métastases cérébrales (étude BREAK-MB)
|
Population totale incluant tous les participants à l'étude traités
| |
|
BRAF V600E (principal)
|
BRAF V600K
| |
|
Cohorte A
N = 74
|
Cohorte B
N = 65
|
Cohorte A
N = 15
|
Cohorte B
N = 18
| |
Taux de réponse intracrânienne globale, % (IC à 95%)a
| |
|
39%
(28,0; 51,2)
P < 0,001b
|
31%
(19,9; 43,4)
P < 0,001b
|
7% (0,2; 31,9)
|
22% (6,4; 47,6)
| |
Durée de la réponse intracrânienne, médiane, mois (IC à 95%)
| |
|
N = 29
4,6 (2,8; NA)
|
N = 20
6,5 (4,6; 6,5)
|
N = 1
2,9 (NA; NA)
|
N = 4
3,8 (NA; NA)
| |
Taux de réponse globale, % (IC à 95%)a
| |
|
38%
(26,8; 49,9)
|
31%
(19,9; 43,4)
|
0 (0; 21,8)
|
28% (9,7; 53,5)
| |
Durée de la réponse, médiane, mois (IC à 95%)
| |
|
N = 28
5,1 (3,7; NA)
|
N = 20
4,6 (4,6; 6,5)
|
s/o
|
N = 5
3,1 (2,8; NA)
| |
Survie sans progression, médiane, mois (IC à 95%)
| |
|
3,7 (3,6; 5,0)
|
3,8 (3,6; 5,5)
|
1,9 (0,7; 3,7)
|
3,6 (1,8; 5,2)
| |
Survie globale, médiane, mois (IC à 95%)
| |
Médiane, mois
|
7,6 (5,9; NA)
|
7,2 (5,9; NA)
|
3,7 (1,6; 5,2)
|
5,0 (3,5; NA)
|
Abréviations: IC: Intervalle de confiance; NA: non atteint; s/o: sans objet
a – Réponse confirmée.
b – Cette étude a été conçue pour confirmer l'hypothèse nulle d'un OIRR ≤10% (sur la base de résultats antérieurs) ou la rejeter en faveur de l'hypothèse alternative d'un OIRR ≥30% chez des sujets porteurs d'une mutation BRAF V600E
Patients non traités préalablement ou ayant connu un échec avec au moins un traitement systémique antérieur (résultats de la phase II [BREAK-2])
L'étude BRF113710 (BREAK-2) était une étude multicentrique à un seul bras, portant sur 92 sujets atteints d'un mélanome métastatique (stade IV) avec une mutation BRAF V600E ou V600K confirmée.
Le taux de réponse confirmé évalué par les médecins investigateurs chez des patients présentant un mélanome métastatique et porteurs de la mutation BRAF V600E (n = 76) a été de 59% (IC à 95%: 48,2; 70,3) et la durée médiane de la réponse a été de 5,2 mois (IC à 95%: 3,9; non évaluable), sur la base d'un temps de suivi médian de 6,5 mois depuis le début du traitement. Chez les patients présentant un mélanome métastatique et porteurs de la mutation BRAF V600K (n = 16), le taux de réponse a été de 13% (2 patients sur 16) (IC à 95%: 0,0; 28,7), avec une durée médiane de réponse de 5,3 mois (IC à 95%: 3,7; 6,8).
Tafinlar en association avec le tramétinib
L'efficacité et la sécurité de la dose de Tafinlar recommandée (150 mg deux fois par jour) en association avec le tramétinib (2 mg une fois par jour) pour le traitement des patients adultes atteints d'un mélanome non résécable ou métastatique porteur d'une mutation BRAF V600 ont été évaluées dans deux études pivots de phase III.
Dans une étude précoce, l'association de Tafinlar 150 mg deux fois par jour et de tramétinib 2 mg une fois par jour a montré une activité clinique limitée chez un petit nombre de patients (26) qui avaient présenté une progression de la maladie après un traitement par un inhibiteur de BRAF. Le taux de réponse confirmé, évalué par l'investigateur, a été de 15% (IC à 95%: 4,4; 34,9) et la SSP moyenne de 3,6 mois (IC à 95%: 1,9; 5,2). Les résultats ont été similaires chez les 45 patients qui étaient passés de Tafinlar en monothérapie à l'association de tramétinib 2 mg une fois par jour et de Tafinlar 150 mg deux fois par jour dans la partie C de l'étude. Chez ces patients, un taux de réponse confirmé de 13% (IC à 95%: 5,0; 27,0) a été observé, avec une SSP moyenne de 3,6 mois (IC à 95%: 2; 4). Ce taux de réponse est nettement plus faible que chez les patients qui n'avaient présenté aucune progression de la maladie sous traitement préalable par un inhibiteur de BRAF, de sorte que l'administration du tramétinib en association avec Tafinlar ne doit être envisagée chez ces patients qu'après avoir considéré d'autres options thérapeutiques.
MEK115306 (COMBI-d)
MEK115306 (COMBI-d) était une étude de phase III randomisée et en double aveugle destinée à comparer l'association de Tafinlar et de tramétinib avec Tafinlar et un placebo en traitement de première ligne chez des patients atteints d'un mélanome cutané non résécable (stade IIIC) ou métastatique (stade IV) porteur de la mutation BRAF V600E/K. Le critère d'évaluation principal de l'étude était la survie sans progression (SSP) évaluée par l'investigateur. Les critères d'évaluation secondaires étaient la survie globale (SG) médiane, le taux de réponse globale (TRG) et la durée de la réponse (DdR). Les participants à l'étude ont été stratifiés en fonction de l'activité de la lactate déshydrogénase (LDH) (> limite supérieure de la normale (LSN) versus ≤ LSN) et de la mutation BRAF (V600E versus V600K).
Au total, 423 participants à l'étude ont été randomisés selon un rapport 1:1 et placés soit dans le bras traité par l'association (Tafinlar 150 mg deux fois par jour et tramétinib 2 mg une fois par jour) (N = 211) soit dans le bras traité par Tafinlar en monothérapie (150 mg deux fois par jour) (N = 212). Les caractéristiques à l'inclusion dans l'étude étaient équilibrées entre les deux groupes de traitement. Chez la plupart des patients, une mutation BRAF V600E était présente (85%); une mutation BRAF V600K était présente chez les 15% restants des patients.
Au moment de l'analyse principale de la SSP, la SSP médiane était de 9,3 mois avec l'association de Tafinlar et de tramétinib et de 8,8 mois avec Tafinlar en monothérapie (HR = 0,75, IC à 95%: 0,57; 0,99, p = 0,035). Le TRG était de 67% vs 51% (p = 0,0014) et la DdR s'élevait à 9,2 vs 10,2 mois avec l'association par rapport à Tafinlar en monothérapie. Dans une analyse ultérieure qui a coïncidé avec l'analyse principale de la SG (voir ci-dessous), la différence de SSP en faveur de l'association de tramétinib et de Tafinlar a été plus nette que lors de la première analyse principale, avec une SSP de 11,0 mois avec l'association (IC à 95%: 8,0; 13,9) et encore de 8,8 mois (IC à 95%: 5,9; 9,3) avec Tafinlar en monothérapie (HR = 0,67, IC à 95%: 0,53; 0,84, p < 0,001). Dans cette analyse, le TRG était de 69% vs 53% (p = 0,0014) et la DdR de 12,9 vs 10,6 mois avec l'association par rapport au traitement par Tafinlar en monothérapie.
Au moment de l'analyse principale de la SG, 222 décès (52,5%) ont été rapportés dans la population randomisée (ou ITT) [association: 99 décès (47%) et Tafinlar: 123 décès (58%)]. La durée médiane de suivi pour le traitement de l'étude était de 20 mois dans le bras traité par l'association et de 16 mois dans le bras traité par Tafinlar en monothérapie. L'étude MEK115306 a montré une diminution statistiquement significative du risque de décès de 29% dans le bras traité par l'association par rapport au bras traité par Tafinlar en monothérapie (HR = 0,71, IC à 95%: 0,55; 0,92; p = 0,011). La SG médiane a été de 25,1 mois dans le bras traité par l'association et de 18,7 mois dans le bras traité par Tafinlar en monothérapie. Les valeurs de la SG déterminées à 12 mois (74%) et à 24 mois (51,4%) ont été en outre plus élevées dans le bras traité par l'association que dans le bras traité par Tafinlar en monothérapie (respectivement 67,6 et 42,1%).
Une analyse de la survie globale (SG) après 5 ans a révélé que la survie globale (SG) médiane avec le traitement combiné était environ 7 mois plus longue que la survie globale (SG) médiane avec le traitement par Tafinlar en monothérapie (25,8 mois (IC à 95%: 19,2; 38,2) contre 18,7 mois (IC à 95%: 15,2; 23,1)) avec un hazard ratio de 0,80 (IC à 95%: 0,63; 1,01). Le taux de survie globale à 5 ans était de 32% (IC à 95%: 25,1; 38,3) avec le traitement combiné contre 27% (IC à 95%: 20,7; 33,0) avec le traitement par Tafinlar en monothérapie. Après 5 ans, la survie sans progression (SSP) médiane pour le traitement combiné était de 10,2 mois (IC à 95%: 8,1; 12,8) contre 8,8 mois (IC à 95%: 5,9; 9,3) pour le traitement par Tafinlar en monothérapie avec un hazard ratio de 0,73 (IC à 95%: 0,59; 0,91).
MEK116513 (COMBI-v)
L'étude MEK116513 était une étude de phase III randomisée, ouverte et à 2 bras destinée à comparer l'association de Tafinlar et de tramétinib avec le vémurafénib en monothérapie dans le mélanome métastatique porteur d'une mutation BRAF V600. Le critère d'évaluation principal de l'étude était la survie globale (SG). Les participants à l'étude ont été stratifiés en fonction de l'activité de la lactate déshydrogénase (LDH) (> limite supérieure de la normale (LSN) versus ≤ LSN) et de la mutation BRAF (V600E versus V600K).
Au total, 704 participants à l'étude ont été randomisés selon un rapport 1:1 et placés soit dans le bras traité par l'association (Tafinlar 150 mg deux fois par jour et tramétinib 2 mg une fois par jour) soit dans le bras traité par le vémurafénib en monothérapie (960 mg deux fois par jour). La majorité des participants à l'étude présentaient une mutation BRAF V600E (89%). 10% des patients avaient une mutation BRAF V600K et 1 patient (< 1%) présentait les deux mutations (BRAF V600E/K).
L'analyse de la SG a été réalisée lorsque 222 décès au total ont été constatés (77% des résultats nécessaires pour l'analyse finale). Le comité d'examen indépendant (Independent Data Monitoring Committee, IDMC) a recommandé d'arrêter l'étude, car les résultats de la SG avaient dépassé la limite d'efficacité statistique préalablement établie. Par la suite, l'analyse intermédiaire de la SG a été considérée comme l'analyse comparative finale de la SG.
L'analyse de l'OS pour l'étude MEK116513 était basée sur 222 décès (32%) [association: 100 décès (28%) et vémurafénib: 122 décès (35%)]. La durée médiane de suivi pour le traitement de l'étude a été de 11 mois dans le bras traité par l'association et de 9 mois dans le bras traité par le vémurafénib. L'étude MEK116513 a montré une diminution statistiquement significative du risque de décès de 31% dans le bras traité par l'association par rapport au bras traité par le vémurafénib (HR = 0,69, IC à 95%: 0,53; 0,89; p = 0,005). La SG médiane n'était pas encore atteinte pour le bras traité par l'association et a été de 17,2 mois pour le bras traité par le vémurafénib en monothérapie.
La SSP médiane observée a été de 11,4 mois pour l'association de Tafinlar et de tramétinib et de 7,3 mois pour le vémurafénib en monothérapie (HR = 0,56, IC à 95%: 0,46; 0,69, p < 0,001). Le TRG a été de 64% vs 51% (p = 0,0005) et la DdR de 13,8 vs 7,5 mois pour l'association par rapport au vémurafénib en monothérapie.
Une analyse de la survie globale (SG) après 5 ans a révélé que la survie globale (SG) médiane avec le traitement combiné a été environ 8 mois plus longue que la survie globale (SG) médiane avec le traitement par le vémurafénib en monothérapie (26,0 mois (IC à 95%: 22,1; 33,8) contre 17,8 mois (IC à 95%: 15,6; 20,7)) avec un hazard ratio de 0,70 (IC à 95%: 0,58; 0,84). Le taux de survie globale à 5 ans a été de 36% (IC à 95%: 30,5; 40,9) avec le traitement combiné contre 23% (IC à 95%: 18,1; 27,4) avec le traitement par le vémurafénib en monothérapie.
BRF117277/DRB436B2204 (COMBI-MB) – patients présentant des métastases cérébrales d'un mélanome métastatique
L'efficacité et la sécurité de Tafinlar en association avec le tramétinib chez les patients présentant un mélanome porteur d'une mutation de BRAF et des métastases cérébrales ont été étudiées lors d'une étude de phase II non randomisée, ouverte et multicentrique (étude COMBI-MB). Au total, 125 patients ont été admis dans 4 cohortes:
·Cohorte A: patients présentant un mélanome porteur d'une mutation BRAF V600E et des métastases cérébrales asymptomatiques sans traitement antérieur local et ciblé des métastases cérébrales et ayant un indice de performance ECOG de 0 ou 1.
·Cohorte B: patients présentant un mélanome porteur d'une mutation BRAF V600E et des métastases cérébrales asymptomatiques ayant reçu un traitement antérieur local et ciblé des métastases cérébrales et ayant un indice de performance ECOG de 0 ou 1.
·Cohorte C: patients présentant un mélanome porteur d'une mutation BRAF V600D/K/R et des métastases cérébrales asymptomatiques ayant ou n'ayant pas reçu de traitement antérieur local et ciblé des métastases cérébrales et ayant un indice de performance ECOG de 0 ou 1.
·Cohorte D: patients présentant un mélanome porteur d'une mutation BRAF V600D/E/K/R et des métastases cérébrales symptomatiques ayant ou n'ayant pas reçu de traitement antérieur local et ciblé des métastases cérébrales et ayant un indice de performance ECOG de 0, 1 ou 2.
Au total, 104 des 125 patients avaient une mutation V600E, 18 patients une mutation V600K et 3 patients seulement une mutation V600R. Aucun patient n'avait une mutation V600D.
Le critère d'évaluation principal de l'étude était la réponse intracrânienne dans la cohorte A, définie comme étant le pourcentage de patients présentant une réponse intracrânienne confirmée, évaluée par l'investigateur au moyen des critères RECIST (Response Evaluation Criteria in Solid Tumors, critères d'évaluation de la réponse au traitement dans les tumeurs solides), version 1.1. Les résultats d'efficacité sont résumés dans le tableau 11. Les critères d'évaluation secondaires étaient la durée de la réponse intracrânienne, le taux de réponse globale des manifestations tumorales intracrâniennes comme extracrâniennes, la SSP et la SG. Les résultats d'efficacité sont regroupés dans le tableau 11.
Tableau 11: COMBI-MB – Résultats d'efficacité selon l'estimation du médecin investigateur
|
|
Tous les patients traités
| |
Critères/Évaluation
|
Cohorte A
N = 76
|
Cohorte B
N = 16
|
Cohorte C
N = 16
|
Cohorte D
N = 17
| |
Taux de réponse intracrânienne, % (IC à 95%)
|
| |
|
59%
(47,3; 70,4)
|
56%
(29,9; 80,2)
|
44%
(19,8; 70,1)
|
59%
(32,9; 81,6)
| |
Durée de la réponse intracrânienne, valeur médiane, mois (IC à 95%)
| |
|
6,5
(4,9; 8,6)
|
7,3
(3,6; 12,6)
|
8,3
(1,3; 15,0)
|
4,5
(2,8; 5,9)
| |
Taux de réponse globale (intra et extracrânienne) TRG, % (IC à 95%)
| |
|
59%
(47,3; 70,4)
|
56%
(29,9; 80,2)
|
44%
(19,8; 70,1)
|
65%
(38,3; 85,8)
| |
Valeur médiane de la SSP, mois (IC à 95%)
| |
|
5,7
(5,3; 7,3)
|
7,2
(4,7; 14,6)
|
3,7
(1,7; 6,5)
|
5,5
(3,7; 11,6)
| |
Valeur médiane de la SG, mois (IC à 95%)
| |
Valeur médiane, mois
|
10,8
(8,7; 17,9)
|
24,3
(7,9; NR)
|
10,1
(4,6; 17,6)
|
11,5
(6,8; 22,4)
| |
IC = intervalle de confiance
NR = sans indication
|
Traitement adjuvant du mélanome
Étude BRF115532/CDRB436F2301 (COMBI-AD)
L'efficacité et la sécurité de Tafinlar en association avec le tramétinib ont été étudiées dans une étude de phase III multicentrique, randomisée, en double aveugle, contrôlée contre placebo, menée auprès de patients présentant un mélanome de stade III porteur d'une mutation BRAF V600 après résection complète.
Les patients ont été randomisés selon un rapport 1:1 et ont reçu soit un traitement combiné avec 150 mg de Tafinlar deux fois par jour et 2 mg de tramétinib une fois par jour, soit deux placebos, sur une période de 12 mois. Seuls des patients ayant subi une résection complète du mélanome et une lymphadénectomie complète au cours des 12 semaines précédant la randomisation ont été admis dans l'étude. Un traitement systémique préalable du cancer, y compris une radiothérapie, n'était pas autorisé. Les patients ayant des antécédents de malignité antérieure ont été autorisés à participer s'ils étaient sans maladie depuis au moins 5 ans. Les patients atteints de tumeurs malignes avec des mutations RAS activatrices confirmées n'ont pas été autorisés à participer. Les patients ont été stratifiés en fonction du statut de la mutation BRAF (V600E ou V600K) et du stade de la maladie avant l'opération (en sous-stades du stade III, c'est-à-dire différentes atteintes des ganglions lymphatiques, taille de la tumeur primitive et ulcération). Le critère d'évaluation principal était la survie sans récidive (SSR) évaluée par l'investigateur, définie comme étant la période allant de la randomisation à la réapparition de la tumeur ou à la mort, quelle qu'en soit la cause. Une évaluation radiologique de la tumeur a été réalisée tous les 3 mois au cours des deux premières années, puis tous les 6 mois, jusqu'à ce que la première récidive soit observée. Les critères d'évaluation secondaires étaient la survie globale (SG; critère secondaire important) et la survie sans métastases à distance (SSMD).
En tout, 870 patients ont été randomisés pour recevoir le traitement combiné (n = 438) ou le placebo (n = 432). L'étude a inclus des patients ayant une maladie à tous les sous-stades du stade III avant la résection; 18% de ces patients ont présenté des atteintes des ganglions lymphatiques seulement détectables au microscope et pas d'ulcération de la tumeur primitive. La majorité des patients étaient porteurs d'une mutation BRAF V600E (91%). Au moment de l'analyse principale, la durée médiane du suivi du traitement (temps écoulé de la randomisation jusqu'au dernier contact ou à la mort) a été de 2,83 ans dans le groupe de traitement et 2,75 ans dans le groupe placebo.
Les résultats de l'analyse principale sont représentés dans le tableau 12. L'étude a montré une différence statistiquement significative entre les bras de traitements pour le critère d'évaluation principal concernant la SSR. Dans le groupe de traitement ayant reçu Tafinlar et le tramétinib comme traitement combiné, la réduction du risque a été de 53% comparée au groupe placebo.
Tableau 12: Analyse principale de COMBI-AD - résultats de la survie sans récidive
|
|
Tafinlar + tramétinib
|
Placebo
| |
Paramètres de SSR
|
N = 438
|
N = 432
| |
Nombre d'évènements-n (%)
|
166 (38%)
|
248 (57%)
| |
Récidive
|
163 (37%)
|
247 (57%)
| |
Récidive avec métastases à distance
|
103 (24%)
|
133 (31%)
| |
Décès
|
3 (< 1%)
|
1 (< 1%)
| |
Valeur médiane (mois)
|
NE
|
16,6
| |
(IC à 95%)
|
(44,5; non estimable (NE))
|
(12,7; 22,1)
| |
Hazard ratio[1]
|
0,47
| |
(IC à 95%)
|
(0,39; 0,58)
| |
Valeur de p[2]
|
1,53 × 10-14
| |
Taux à 1 an (IC à 95%)
|
0,88 (0,85; 0,91)
|
0,56 (0,51; 0,61)
| |
Taux à 2 ans (IC à 95%)
|
0,67 (0,63; 0,72)
|
0,44 (0,40; 0,49)
| |
Taux à 3 ans (IC à 95%)
|
0,58 (0,54; 0,64)
|
0,39 (0,35; 0,44)
| |
[1]
Le hazard ratio résulte du modèle de Pike stratifié.
[2] La valeur de p est calculée à partir du test du Logrank stratifié bilatéral (les facteurs de stratification étaient le stade de la maladie, IIIA vs IIIB vs IIIC, et le type de mutation V600 sur le gène BRAF - V600E vs V600K).
NE = non estimable
|
Sur la base de 153 évènements (60 (14%) dans le bras de traitement combiné et 93 (22%) dans le bras placebo), ce qui correspond à une proportion d'information de 26% de l'objectif global de 597 évènements de SG, le hazard ratio estimé pour la SG était de 0,57 (IC à 95%: 0,42; 0,79; p = 0,0006). Ces résultats n'ont pas correspondu à la limite pré-spécifiée pour obtenir une significativité statistique dans cette première analyse intermédiaire de la SG (HR = 0,50; p = 0,000019). Les estimations de la survie 1 et 2 ans après la randomisation ont été de 97% et 91% dans le bras de traitement combiné et de 94% et 83% dans le bras placebo.
Sur la base des données actualisées issues d'une période de suivi supplémentaire de 29 mois en comparaison avec l'analyse principale (suivi minimal de 59 mois), le bénéfice de la survie sans récidive a été conservé avec un hazard ratio estimé de 0,51 (IC à 95%: 0,42; 0,61). Le taux de survie sans récidive à 5 ans s'est élevé à 52% (IC à 95%: 48; 58) dans le bras de traitement combiné contre 36% (IC à 95%: 32; 41) dans le bras placebo.
CPNPC avancé
Étude BRF113928
L'efficacité et la sécurité de Tafinlar en association avec le tramétinib ont été évaluées dans une étude de phase II multicentrique, ouverte et non randomisée menée auprès de 57 patients atteints d'un CPNPC métastatique porteur de la mutation BRAF V600E et antérieurement traités par chimiothérapie. Le critère d'évaluation principal était le taux de réponse globale (TRG) évalué par le médecin investigateur à l'aide des critères RECIST (Response Evaluation Criteria in Solid Tumors, critères d'évaluation de la réponse au traitement dans les tumeurs solides). Les critères d'évaluation secondaires incluaient la durée de la réponse (DdR), la survie sans progression (SSP) et la survie globale (SG). Le TRG, la DdR et la SSP ont été évalués par un comité d'évaluation indépendant (Independent Review Committee, IRC) sous la forme d'une analyse de sensibilité.
Au moment de l'analyse principale, pour le critère d'évaluation principal, à savoir le taux de réponse globale (TRG) évalué par le médecin investigateur, le TRG dans la population antérieurement traitée a atteint 66,7% (IC à 95%, 52,9%, 78,6%). Ainsi, la significativité statistique a été atteinte, permettant de rejeter l'hypothèse nulle selon laquelle le TRG pour le traitement par Tafinlar en association avec le tramétinib serait de 30% maximum pour cette population de patients atteints d'un CPNPC. Les résultats de l'évaluation du taux de réponse globale (TRG) par un comité d'évaluation indépendant (Independent Review Committee, IRC) concordaient avec l'évaluation faite par l'investigateur (tableau 13).
Tableau 13: TRG selon l'évaluation du médecin investigateur et l'évaluation radiologique indépendante d'après l'analyse finale après 5 ans
|
Groupe pour lequel l'évaluation radiologique a été réalisée
|
Investigateur:
|
Évaluation indépendante
| |
Catégorie
|
N = 57*
|
N = 57*
| |
Réponse globale – n (%)
| |
TRG (RC + RP)
|
39 (68,4)
|
36 (63,2)
| |
(IC à 95%)
|
(54,8; 80,1)
|
(49,3; 75,6)
| |
Durée de la réponse
| |
Nombre de répondeurs
|
39
|
36
| |
Nombre de patients présentant une progression de la maladie ou décédés - n (%)
|
27 (71)
|
20 (56)
| |
DdR médiane, en mois
(IC à 95%)
|
9,8
(6,9; 18,3)
|
12,6
(5,8; 26,2)
| |
Survie sans progression
| |
Progression de la maladie ou décès - n (%)
|
41 (72)
|
38 (67)
| |
SSP médiane, en mois
(IC à 95%)
|
10,2
(6,9; 16,7)
|
8,6
(5,2; 16,8)
| |
Survie globale
| |
Nombre de décès - n (%)
|
33 (58)
| |
Médiane, en mois
(IC à 95%)
|
18,2
(14,3; 28,6)
| |
Intervalle de confiance (IC) calculé avec la méthode exacte (appelé intervalle de Clopper-Pearson).
RC = rémission complète; RP = rémission partielle; MS = maladie stable; PM = progression de la maladie
|
Dans l'étude BRF113928, 36 patients atteints d'un CPNPC porteur d'une mutation BRAF V600E ayant reçu le dabrafénib en association avec le tramétinib comme traitement de première ligne contre une atteinte métastatique ont aussi été inclus. Lors de l'analyse finale après 5 ans pour tous les participants à l'étude traités avec le traitement de première ligne, le critère d'évaluation principal du taux de réponse globale (TRG) évalué par l'investigateur a été de 63,9% (IC à 95%, 46,2%, 79,2%). Ainsi, la significativité statistique a été atteinte, permettant de rejeter l'hypothèse nulle selon laquelle le TRG pour le traitement par le dabrafénib en association avec le tramétinib serait de 30% maximum pour cette population de patients atteints de CPNPC. La durée de rémission (DdR) médiane évaluée par l'investigateur a été de 10,2 mois (IC à 95%: 8,3; 15,2), la survie sans progression médiane évaluée par l'investigateur de 10,8 mois (IC à 95%: 7,0; 14,5), la survie globale médiane évaluée par l'investigateur de 17,3 mois (IC à 95%: 12,3; 40,2), avec 61% des cas de décès survenus au moment de l'analyse.
Gliome de bas grade (GBG)
Étude DRB436G2201
L'efficacité clinique et la sécurité du traitement par l'association de Tafinlar et du tramétinib chez les patients pédiatriques âgés de 1 à < 18 ans présentant un gliome porteur de la mutation BRAF V600E ont été évaluées dans l'étude clinique de phase II multicentrique et ouverte CDRB436G2201. Les patients présentant un gliome de bas grade (de grades 1 et 2 selon la classification de l'OMS de 2016), qui avaient besoin d'un premier traitement systémique et qui n'avaient pas reçu de radiothérapie auparavant ont été randomisés selon un rapport 2:1 pour recevoir dabrafénib plus tramétinib (D + T) ou carboplatine plus vincristine (C + V). Environ 83% de tous les patients avaient subi une intervention chirurgicale antérieure; deux patients seulement (tous deux dans le bras D + T) n'avaient pas de maladie résiduelle après l'intervention. Les patients présentant un score de performance de Karnofsky/Lansky < 50%, les patients dont les fonctions médullaire, rénale, hépatique et cardiaque étaient insuffisantes ainsi que les patients souffrant d'affections incontrôlées ou significatives, y compris les affections cardiaques, le diabète sucré, l'hypertension, les maladies hépatiques ou les infections, étaient exclus de l'étude (voir «Mises en garde et précautions»).
Le statut de la mutation du gène BRAF a été déterminé de manière prospective par un test local ou, lorsqu'un test local n'était pas disponible, par un test de PCR en temps réel du laboratoire central. Par ailleurs, des tests rétrospectifs sur des échantillons de tumeurs disponibles ont été effectués par le laboratoire central afin de confirmer la mutation BRAF V600E.
La posologie de Tafinlar et du tramétinib dépendait de l'âge et du poids, Tafinlar ayant été administré par voie orale à la posologie de 2,625 mg/kg deux fois par jour pour le groupe d'âge < 12 ans et de 2,25 mg/kg deux fois par jour pour le groupe d'âge 12 ans et plus; le tramétinib a été administré par voie orale à la posologie de 0,032 mg/kg une fois par jour pour le groupe d'âge < 6 ans et de 0,025 mg/kg une fois par jour pour le groupe d'âge 6 ans et plus. La dose maximale de Tafinlar a été limitée à 150 mg deux fois par jour et celle du tramétinib à 2 mg une fois par jour. Le carboplatine et la vincristine ont été administrés en fonction de l'âge et de la surface corporelle à une posologie de 175 mg/m2 et 1,5 mg/m2, respectivement, en tant que traitement d'induction de 10 semaines, suivi de huit cycles de 6 semaines d'un traitement d'entretien.
Le critère d'évaluation principal de l'efficacité dans les deux cohortes était le taux de réponse globale (TRG, somme des patients présentant une rémission complète/RC et une rémission partielle/RP confirmées) par un examen indépendant sur la base des critères RANO (2017). L'analyse principale a été effectuée lorsque tous les patients des deux cohortes ont eu terminé au moins 32 semaines de traitement.
Dans la cohorte des gliomes de bas grade (GBG) de l'étude G2201, 110 patients ont été choisis de manière aléatoire pour D + T (n = 73) ou C + V (n = 37). L'âge moyen était de 9,5 ans, 34 patients (30,9%) ayant entre 12 mois et < 6 ans, 36 patients (32,7%) entre 6 ans et < 12 ans et 40 patients (36,4%) entre 12 ans et < 18 ans; 60% étaient de sexe féminin. Au moment de l'analyse principale, la durée médiane de traitement était de 76 semaines dans le bras D + T, la durée médiane de suivi dans la cohorte GBG de 18,9 mois. Le TRG dans le bras D + T (46,6%) a montré une amélioration statistiquement significative par rapport au bras C + V (10,8%), avec un odds ratio (IC à 95%) de 7,19 (2,3; 22,4) et une valeur de p unilatérale < 0,001 (tableau 14). L'examen hiérarchique ultérieur a également révélé une amélioration de la survie sans progression (SSP) par rapport à la chimiothérapie, avec un hazard ratio (IC à 95%) de 0,31 (0,17; 0,55) (valeur de p log-rank unilatérale du test du log-rank < 0,001). Des différences dans l'évaluation de l'efficacité, qui comprenaient également la constatation de rémissions complètes et partielles ainsi que des progressions de la maladie, ont été observées entre l'examen indépendant et les centres investigateurs. Le taux de concordance dans le bras D + T était de 52% en tout.
Les modifications de la fréquence des convulsions («seizure activity») et de l'acuité visuelle («visual acuity») ont été étudiées en tant que paramètres fonctionnels avant et après le traitement. Pour ces deux paramètres, aucune amélioration n'a été démontrée sous traitement par D + T par rapport au bras témoin.
Tableau 14: Réponse et survie sans progression sur la base d'un examen indépendant dans l'étude G2201 (cohorte GBG, analyse principale)
|
|
Dabrafénib + tramétinib
N = 73
|
Carboplatine plus vincristine
N = 37
| |
Meilleure réponse globale
|
|
| |
Rémission complète (RC), n (%)
|
2 (2,7)
|
1 (2,7)
| |
Rémission partielle (RP), n (%)
|
32 (43,8)
|
3 (8,1)
| |
Maladie stable (MS), n (%)
|
30 (41,1)
|
15 (40,5)
| |
Progression de la maladie (PM), n (%)
|
8 (11,0)
|
12 (32,4)
| |
Inconnu, n (%)
|
1 (1,4)
|
6 (16,2)1
| |
Taux de réponse globale (TRG)
|
|
| |
TRG (RC + RP), (IC à 95%)2, valeur de p
|
46,6% (34,8–58,6%), p < 0,001
|
10,8% (3,0–25,4%)
| |
Odds ratio3 (IC à 95%)
|
7,19 (2,3–22,4)
| |
Survie sans progression
|
|
| |
Valeur médiane (mois) (IC à 95%)4
|
20,1 (12,8; s/o)
|
7,4 (3,6; 11,8)
| |
Hazard ratio (IC à 95%)5, valeur de p
|
0,31 (0,17–0,55), p < 0,001
| |
IC = intervalle de confiance, RC = rémission complète, NE = non estimable, TRG = taux de réponse globale, PM = progression de la maladie, RP = rémission partielle, MS = maladie stable.
1 4 patients randomisés dans le bras C + V ont arrêté le traitement prématurément.
2 Sur la base de l'intervalle de confiance exact de Clopper-Pearson.
3 Odds ratio (D + T vs C + V) et IC à 95% proviennent d'une régression logistique avec le traitement comme covariable unique, c'est-à-dire qu'il s'agit de la probabilité d'observer une réponse dans le bras D + T, comparée à la probabilité d'observer une réponse dans le bras C + V. Un odds ratio > 1 favorise D + T.
4 Sur la base de la méthode de Kaplan-Meier.
5 Sur la base de la méthode à risque proportionnel.
|
Au moment de l'analyse finale (durée médiane du suivi: 39,0 mois), le TRG se situait à 54,8% dans le bras D + T et à 16,2% dans le bras C + V avec un odds ratio de 6,26. La SSP médiane se situait à 24,9 mois dans le bras D + T et à 7,2 mois dans le bras C + V.
Tumeurs solides non résécables ou métastatiques
La sécurité et l'efficacité de Tafinlar en association avec le tramétinib pour le traitement de tumeurs solides non résécables ou métastatiques porteuses d'une mutation BRAF V600E ont été évaluées chez des patients adultes dans les études BRF117019 et NCI-MATCH.
Les patients des deux études ont reçu 150 mg de Tafinlar deux fois par jour et 2 mg de tramétinib une fois par jour. Les résultats les plus importants de la mesure de l'efficacité ont été le TRG (rémission complète [RC] ou partielle [RP]) selon les critères RECIST v1.1, RANO 2010-[GHG] ou RANO 2017-[GBG] modifiés et la durée de la réponse (DdR). Les réponses mineures ont été exclues du TRG.
Étude BRF117019 et étude NCI-MATCH
L'étude BRF117019 est une étude multicentrique, non randomisée et ouverte comportant plusieurs cohortes de patients adultes présentant des tumeurs rares sélectionnées porteuses d'une mutation BRAF V600E. L'étude comportait 7 cohortes de tumeurs solides: gliome de haut grade (GHG) (n = 45), carcinome des voies biliaires (CVB) (n = 43), cancer anaplasique de la thyroïde (CAT) (n = 36), gliome de bas grade (GBG) (n = 13), adénocarcinome de l'intestin grêle (AIG) (n = 3) et tumeurs stromales gastro-intestinales (TSGI) (n = 1) ainsi que tumeurs des cellules germinales non-séminomateuses (aucun patient inclus). Les tumeurs devaient être confirmées à l'histologie, avoir progressé après un traitement antérieur (tumeurs métastatiques ou locales non résécables) sans autre possibilité de traitement. Les patients ont été inclus à l'étude sur la base de l'évaluation locale du statut de mutation BRAF V600E; un laboratoire central a confirmé la mutation de BRAF pour 126 des 141 patients précités. 34 des 141 patients (24%) ont été recrutés par un seul centre d'étude (limité aux tumeurs de type GHG, CVB et CAT), ce qui a pu influencer le potentiel de généralisation des résultats de l'étude.
Les critères d'exclusion spécifiques de l'étude les plus importants étaient la présence connue d'une mutation activatrice de RAS, le traitement antérieur par inhibiteurs de BRAF et/ou de MEK, la présence de métastases cérébrales (sauf dans les cohortes de gliome), la pneumopathie interstitielle ou la pneumonie, les antécédents d'occlusion veineuse rétinienne et les troubles gastro-intestinaux cliniquement significatifs.
Le bras H (EAY131-H) de l'étude NCI-MATCH est une étude ouverte et à un bras dans laquelle des patients adultes présentant une tumeur maligne porteuse de la mutation BRAF V600E ont été inclus. Des patients présentant un mélanome, un cancer de la glande thyroïde ou un carcinome colorectal (CCR) ont été exclus. Le statut de la mutation BRAF V600E pour l'inclusion à l'étude a été déterminé par un laboratoire central ou local. Le tableau 15 présente la population d'efficacité principale de l'étude, incluant des tumeurs gastro-intestinales (n = 14), des tumeurs du poumon à l'exception du CPNPC (n = 1), des tumeurs gynécologiques ou péritonéales (n = 6), des tumeurs du SNC (n = 4) et un améloblastome du maxillaire inférieur (n = 1).
Les caractéristiques initiales des 167 patients présentant les types de tumeurs présentés dans le tableau 15, inclus dans les études BRF117019 et NCI-MATCH, étaient les suivantes: âge moyen de 56 ans, 32% des patients ayant 65 ans ou plus; 56% de femmes; 77% de blancs, 17% d'asiatiques, 2% de noirs, 4% d'autres appartenances ethniques et 31% des patients ayant un indice ECOG de 0, 63% un indice ECOG de 1 et 6% un indice ECOG de 2. 85% des 167 patients avaient reçu un traitement systémique antérieur. La durée d'exposition moyenne au traitement combiné a été de 8,0 mois dans les deux études.
Tableau 15: Résultats d'efficacité basés sur l'évaluation indépendante dans les études BRF117019 et NCI-MATCH bras H
|
Type de tumeur
|
N
|
Taux de réponse objective
(TRO)
|
Durée de la réponse
(DdR)
| |
%
|
IC à 95%
|
Plage (mois)
| |
Carcinome des voies biliairesb
|
48
|
46
|
(31; 61)
|
1,8d, 40d
| |
Gliome de haut gradec
|
48
|
33
|
(20; 48)
|
3,9, 44
| |
Glioblastome
|
32
|
25
|
(12; 43)
|
3,9, 27
| |
Xanthoastrocytome pléomorphe anaplasique
|
6
|
67
|
(22; 96)
|
6, 43
| |
Astrocytome anaplasique
|
5
|
20
|
(0,5; 72)
|
15
| |
Astroblastome
|
2
|
100
|
(16; 100)
|
15, 23d
| |
Indifférenciée
|
1
|
RP
|
(2,5; 100)
|
6
| |
Gangliogliome anaplasique
|
1
|
0
|
s/o
|
s/o
| |
Oligodendrogliome anaplasique
|
1
|
0
|
s/o
|
s/o
| |
CAT
|
36
|
53
|
(35,5; 69,6)
|
(0,9d, 43,0d)
| |
Gliome de bas grade
|
14
|
50
|
(23; 77)
|
6, 29d
| |
Astrocytome
|
4
|
50
|
(7; 93)
|
7, 23
| |
Gangliogliome
|
4
|
50
|
(7; 93)
|
6, 13
| |
Xanthoastrocytome pléomorphe
|
2
|
50
|
(1,3; 99)
|
6
| |
Astrocytome pilocytique
|
2
|
0
|
s/o
|
s/o
| |
Papillome du plexus choroïde
|
1
|
RP
|
(2,5; 100)
|
29d
| |
Gangliocytome/gangliogliome
|
1
|
RP
|
(2,5; 100)
|
18d
| |
Carcinome séreux de bas grade de l'ovaire
|
5
|
80
|
(28; 100)
|
12, 42d
| |
Adénocarcinome de l'intestin grêle
|
4
|
50
|
(7; 93)
|
7, 8
| |
Adénocarcinome du pancréas
|
3
|
0
|
s/o
|
s/o
| |
Carcinome ductal/adéno-neuroendocrine mixte
|
2
|
0
|
s/o
|
s/o
| |
Carcinome neuroendocrine du côlon
|
2
|
0
|
s/o
|
s/o
| |
Améloblastome du maxillaire inférieur
|
1
|
RP
|
(2,5; 100)
|
30
| |
Carcinome pulmonaire combiné à petites cellulesépidermoïde
|
1
|
RP
|
(2,5; 100)
|
5
| |
Adénocarcinome mucineux séropapillaire péritonéal
|
1
|
RP
|
(2,5; 100)
|
8
| |
Adénocarcinome de l'anus
|
1
|
0
|
s/o
|
s/o
| |
Tumeur stromale gastro-intestinale
|
1
|
0
|
s/o
|
s/o
| |
Abréviations: RP, rémission partielle.
a Les CPNPC sont exclus (n = 6).
b DdR médiane 9,8 mois (IC à 95%: 5,3; 20,4).
c DdR médiane 13,6 mois (IC à 95%: 5,5; 26,7).
d Correspond à une DdR censurée à droite.
|
Des différences dans l'évaluation de l'efficacité, qui comprenaient également la constatation de rémissions complètes et partielles ainsi que des progressions de la maladie, ont été observées entre l'examen indépendant et les centres investigateurs. Dans l'étude BRF117019, le taux de concordance pour le TRG sur l'ensemble des cohortes de tumeurs était compris entre 46% et 67%; dans l'étude NCI-MATCH bras H, il était de 61%.
Étude CTMT212X2101 (X2101)
Dans l'étude X2101, étude multicentrique ouverte menée chez des patients pédiatriques présentant des tumeurs solides réfractaires ou récidivantes, l'efficacité de Tafinlar en association avec le tramétinib a été évaluée chez 48 patients, dont 34 patients atteints de GBG et 2 patients atteints de GHG. L'âge moyen des patients atteints de GBG était de 10 ans (tranche d'âge: 1 à 17).
La posologie de Tafinlar et du tramétinib dans les études cliniques dépendait de l'âge et du poids, Tafinlar ayant été administré à la posologie de 2,625 mg/kg deux fois par jour pour le groupe d'âge < 12 ans et de 2,25 mg/kg deux fois par jour pour le groupe d'âge 12 ans et plus; le tramétinib a été administré par voie orale à la posologie de 0,032 mg/kg une fois par jour pour les enfants de moins de 6 ans et de 0,025 mg/kg une fois par jour pour les enfants de 6 ans et plus. Les doses de Tafinlar ont été limitées à 150 mg deux fois par jour et les doses de tramétinib à 2 mg une fois par jour.
Le TRG, d'après l'évaluation indépendante, a été de 25% (IC à 95%: 12%, 42%), et consistait en une rémission partielle dans tous les cas. L'estimation de la DdR, avec 2 événements de DdR chez 9 sujets répondeurs, n'a pas été possible.
|

