CompositionPrincipes actifs
Dexlansoprazole.
Excipients
Color: Indigotinum (E 132); excip. pro capsula.
Indications/Possibilités d’emploiDexilant est indiqué chez les adultes et les adolescents à partir de 12 ans pour:
·la guérison de l'œsophagite érosive;
·le traitement d'entretien de l'œsophagite érosive guérie et le soulagement des brûlures d'estomac.
·le traitement de courte durée des brûlures d'estomac et des régurgitations acides associées au reflux gastro-œsophagien (RGO) symptomatique non érosif.
Posologie/Mode d’emploiAdultes et adolescents à partir de 12 ans
Guérison de l'œsophagite érosive
La dose recommandée est de 60 mg une fois par jour pendant 4 semaines. Le traitement peut être prolongé à la même dose pendant 4 semaines supplémentaires chez les patients qui ne sont pas complètement guéris après cette période.
Traitement d'entretien de l'œsophagite érosive guérie et soulagement des brûlures d'estomac
Si une suppression prolongée de la production d'acide est nécessaire, la dose recommandée est de 30 mg une fois par jour.
Durée du traitement:
·Adultes: jusqu'à 6 mois.
·adolescents à partir de 12 ans: jusqu'à 4 mois
Traitement du reflux gastro-œsophagien (RGO) symptomatique non érosif
Après exclusion d'une œsophagite, la dose recommandée est de 30 mg une fois par jour pendant 4 semaines maximum. En cas de persistance des symptômes au bout de 4 semaines, d'autres examens sont indiqués.
Mode d'emploi
Voie orale.
Les capsules à libération modifiée doivent être avalées entières avec du liquide et peuvent être administrées avec ou sans nourriture (voir «Pharmacocinétique»).
Les capsules peuvent aussi être ouvertes et les granulés être mélangés avec une cuillerée à soupe de compote de pommes. Une fois le mélange préparé, le médicament doit être administré immédiatement.
Les granulés ne doivent pas être mâchés.
Instructions posologiques particulières
Enfants âgés de moins de 12 ans
La sécurité et l'efficacité de Dexilant n'ont pas été évaluées chez les enfants de moins de 12 ans. Par conséquent, une utilisation dans cette catégorie d'âge n'est pas recommandée.
Patients âgés
La sécurité et l'efficacité ne diffèrent pas fondamentalement entre les patients âgés et les patients plus jeunes. Un ajustement de la dose n'est pas nécessaire chez les patients âgés (voir «Pharmacocinétique»).
Patients présentant des troubles de la fonction hépatique
Aucune adaptation posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère. Une dose quotidienne maximale de 30 mg ne doit pas être dépassée chez les patients présentant une insuffisance hépatique modérée. Aucune étude n'a été réalisée chez les patients présentant une insuffisance hépatique sévère (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Patients présentant des troubles de la fonction rénale
Il n'est pas nécessaire d'ajuster la dose chez les patients présentant une insuffisance rénale (voir «Pharmacocinétique»).
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients.
Mises en garde et précautionsAffections malignes de l'estomac et de l'œsophage
Avant toute utilisation de Dexilant, une éventuelle tumeur gastrique maligne doit être exclue, car le dexlansoprazole peut en masquer les symptômes et retarder le diagnostic. De même, avant d'instaurer le traitement d'une œsophagite par reflux, il convient d'exclure toute pathologie maligne de l'œsophage.
Infections gastrointestinales
Une diminution de l'acidité gastrique augmente le nombre de bactéries gastriques physiologiquement présentes dans le tractus gastro-intestinal. Un traitement par d'inhibiteurs de la pompe à protons (IPP) peut ainsi entraîner un risque légèrement accru d'infections gastro-intestinales, telles que les infections par exemple de Salmonella, Campylobacter et Clostridium difficile.
Hypomagnésémie
Des cas d'hypomagnésémie sévère ont été rapportés chez des patients traités par des IPP comme le dexlansoprazole pendant au moins 3 mois (mais dans la plupart des cas pendant un an). Des manifestations sévères d'hypomagnésémie telles que fatigue, vertiges, crampes, tétanie, délire et arythmies ventriculaires peuvent survenir. Elles peuvent se déclarer de manière insidieuse et passer inaperçues. Chez la plupart des patients concernés, l'hypomagnésémie s'est améliorée après l'arrêt de l'IPP et un apport en magnésium.
Chez les patients nécessitant un traitement prolongé ou en cas d'association des IPP avec de la digoxine ou avec des médicaments pouvant induire une hypomagnésémie (p.ex. des diurétiques), une surveillance des taux de magnésium doit être envisagée avant d'instaurer le traitement par IPP, puis régulièrement pendant le traitement (voir «Posologie/Mode d'emploi»).
Absorption de la vitamine B12
Le traitement quotidien prolongé (pendant plusieurs années) par des médicaments qui bloquent la sécrétion acide peut provoquer une malabsorption de la cyanocobalamine (vitamine B12) par hypochlohydrie ou achlorhydrie. Une carence en cyanocobalamine doit être envisagée chez les patients atteints d'états hypersécrétoires pathologiques nécessitant un traitement prolongé, chez les personnes présentant une baisse des réserves de l'organisme ou des facteurs de risque de réduction de l'absorption de la vitamine B12 (telles que les personnes âgées) pendant un traitement au long cours ou en présence de symptômes cliniques importants.
Fractures
Les IPP's peuvent légèrement augmenter le risque de fractures de la hanche, du poignet et de la colonne vertébrale, en particulier chez les patients âgés ou en presence d'autres facteurs de risque, notamment lorsqu'ils sont utilisés à fortes doses et pendant une longue période (> 1 an). Des études d'observation indiquent que les IPP's peuvent augmenter le risque général de fractures de 10 à 40%. Cette hausse peut en partie être imputable à d'autres facteurs de risque. Les patients présentant un risque d'ostéoporose doivent être traités selon les directives cliniques actuelles et recevoir un apport suffisant en calcium et vitamine D.
Réactions médicamenteuses cutanées sévères (SCAR)
Des réactions médicamenteuses cutanées sévères (SCAR), telles que le syndrome de Stevens-Johnson (SSJ), la nécrolyse épidermique toxique (NET), l'exanthème médicamenteux avec éosinophilie et manifestations systémiques (DRESS), la pustulose exanthématique aiguë généralisée (PEAG) et l'érythème polymorphe ont été rapportées chez les patients traités par dexlansoprazole et d'autres IPP's (voir «Effets indésirables»). Le dexlansoprazole doit être arrêté dès les premiers signes ou symptômes de réactions médicamenteuses cutanées sévères ou d'autres signes d'hypersensibilité et des examens complémentaires doivent être considérés.
Lupus érythémateux cutané subaigu (LECS)
Les IPP's sont associés à de très rares cas de lupus érythémateux cutané subaigu (LECS). Si des lésions se développent, notamment sur les zones cutanées exposées au soleil, et si elles s'accompagnent d'arthralgie, le patient doit consulter un médecin rapidement et le professionnel de santé doit envisager l'arrêt de Dexilant. La survenue d'un LECS après un traitement par un IPP peut augmenter le risque de LECS lors de la prise d'autres IPP's.
Néphrite interstitielle
Des cas de néphrite interstitielle aiguë ont été rapportés durant l'utilisation d'IPP qui doivent probablement être interprétés comme une réaction d'hypersensibilité. Si une néphrite interstitielle se manifeste, il faut arrêter la préparation.
Méthotrexate
Chez certains patients, une augmentation des taux sériques de méthotrexate a été rapportée lors de l'administration concomitante d'IPP et de méthotrexate. Une interruption temporaire du traitement par le dexlansoprazole peut être envisagée chez les patients recevant des doses élevées de méthotrexate.
Traitement de longue durée
On ne dispose que de données limitées sur le traitement d'une durée de plus d'un an. Par conséquent, une analyse rigoureuse du rapport risque/bénéfice et un contrôle régulier du traitement seront effectués.
Insuffisance hépatique
Chez les patients présentant une insuffisance hépatique modérée ou sévère, le dexlansoprazole doit être utilisé avec prudence (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Influence sur les analyses en laboratoire
Au cours du traitement par des médicaments antiacides, la gastrine sérique et la chromogranine A (CgA) augmentez en réponse à la diminution de la sécrétion acide. Cette augmentation du taux de CgA peut interférer avec les analyses réalisées lors de tumeurs neuroendocriniennes. Des données de la littérature mentionnent que tout traitement par un IPP doit être interrompu 5 à 14 jours avant un dosage de la CgA réalisé dans le cadre du bilan ou du contrôle de l'évolution de tumeurs neuroendocriniennes, car les taux de CgA accrus suite au traitement se normalisent en l'espace de 5 à 14 jours – ou plus dans de rares cas. Le dosage doit être répété si les taux de CgA sont encore trop élevés après ce délai.
Intolérance aux sucres
Dexilant contient du saccharose. Par conséquent, les patients présentant une intolérance au fructose, une malabsorption du glucose et du galactose ou un déficit en sucrase-isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
InteractionsLes études sur les interactions ont été exclusivement menées auprès d'une population d'adultes.
Effets d'autres médicaments sur le dexlansoprazole
Une implication du CYP2C19 et du CYP3A4 dans le métabolisme du dexlansoprazole a été démontrée.
CYP2C19 inhibiteurs
Les inhibiteurs du CYP2C19 (tels que la fluvoxamine) pourraient augmenter la disponibilité systémique du dexlansoprazole. Une réduction de la dose de dexlansoprazole doit donc être envisagée.
Les CYP2C19 et les CYP3A4 inducteurs
Les inducteurs enzymatiques qui agissent sur le CYP2C19 et le CYP3A4, comme la rifampicine et le millepertuis (Hypericum perforatum), peuvent induire une baisse de la concentration plasmatique de dexlansoprazole.
Autres
Sucralfate/Antiacides
Le sucralfate et les antiacides sont susceptibles de diminuer la biodisponibilité du dexlansoprazole. Le dexlansoprazole doit donc être administré au moins une heure après la prise de ces médicaments.
Effets du dexlansoprazole sur d'autres médicaments
Médicaments dont l'absorption dépend du pH
Le dexlansoprazole est susceptible d'interférer avec l'absorption de médicaments, dont la biodisponibilité dépend fortement du pH gastrique. Ceci est particulièrement vrai pour:
·Inhibiteurs des protéases du VIH: La prise concomitante de dexlansoprazole et d'inhibiteurs de protéases du VIH dont l'absorption est dépendante d'un faible pH gastrique (tels que l'atazanavir et le nelfinavir) n'est pas recommandée, car ceci diminue nettement leur biodisponibilité. Dans une étude, l'administration concomitante de lansoprazole et d'atazanavir à des volontaires sains entraîne une réduction considérable de la disponibilité à l'atazanavir. Des effets similaires pourraient se produire avec le dexlansoprazole.
·Azole antifongique: L'absorption gastro-intestinale de l'itraconazole et du posaconazole est augmentée par la présence d'acide gastrique. L'administration de dexlansoprazole est susceptible d'entraîner des concentrations subthérapeutiques d'itraconazole et de posaconazole. Il convient donc d'éviter cette association.
·Erlotinib: La résorption de l'erlotinib au niveau du tractus gastro-intestinal est augmentée en présence d'acide gastrique. L'administration de dexlansoprazole peut, par conséquent, entraîner des concentrations inférieures au seuil thérapeutique d'erlotinib et l'association au dexlansoprazole doit être évitée.
·Digoxine: L'administration concomitante de dexlansoprazole et de digoxine peut entraîner une résorption accrue de la digoxine et entraîner ainsi des taux plasmatiques accrus de digoxine. C'est pourquoi les concentrations plasmatiques de digoxine doivent être surveillées lors de l'instauration et de l'arrêt du traitement par le dexlansoprazole et la dose de digoxine doit être ajustée si nécessaire.
Médicaments métabolisés par les enzymes P450
Des études in vitro ont montré que dexlansoprazole n'inhibe probablement pas les isoformes CYP 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 2E1 et 3A4. Par conséquent, aucune interaction cliniquement pertinente avec des médicaments métabolisés par ces enzymes du CYP ne devrait se produire. De plus, des études in vivo ont montré que dexlansoprazole ne modifie pas la pharmacocinétique de doses uniques de phénytoïne (substrats du CYP2C9) ou de théophylline (substrat du CYP1A2) administrées simultanément. Les génotypes du CYP1A2 des sujets n'ont pas été déterminés dans l'étude d'interaction avec la théophylline. Bien que les études in vitro aient indiqué que dexlansoprazole pourrait inhiber le CYP2C19, une étude d'interactions in vivo réalisée principalement sur les métaboliseurs rapides et intermédiaires du CYP2C19 a montré que dexlansoprazole ne modifie pas la pharmacocinétique du diazépam (substrat du CYP2C19).
Le lansoprazole pourrait augmenter les concentrations plasmatiques des médicaments métabolisés par le CYP3A4. La prudence est de mise lors de l'association du dexlansoprazole avec des médicaments métabolisés par cette enzyme et possédant une marge thérapeutique étroite.
Tacrolimus
L'administration concomitante de dexlansoprazole, en particulier chez les patients ayant subi une transplantation et qui sont des métaboliseurs intermédiaires ou lents du CYP2C19, peut augmenter la concentration plasmatique de tacrolimus (un substrat du CYP3A et de la glycoprotéine P [P-gp]). Il est recommandé de surveiller les concentrations plasmatiques de tacrolimus lors de l'instauration ou de l'arrêt d'un traitement concomitant par le dexlansoprazole.
Antagonistes de la vitamine K
Lors d'une étude, la coadministration de dexlansoprazole et de warfarine n'a pas révélé de différences significatives dans la pharmacocinétique de la warfarine ou l'International Normalised Ratio (INR) comparativement à l'administration de la warfarine avec un placebo. Néanmoins, une augmentation de l'INR et du temps de prothrombine a été rapportée chez des patients recevant simultanément des inhibiteurs de la pompe à protons (IPP) et de la warfarine. Chez les patients traités simultanément par des IPP et de la warfarine, il pourrait donc être indiqué de surveiller l'INR et le temps de prothrombine, afin de détecter une augmentation de ceux-ci.
A ce jour, aucune donnée relative à l'acénocoumarol et à la phénprocoumone n'est disponible. L'INR doit être également surveillé lors de l'instauration ou de l'arrêt du traitement avec ces substances.
Clopidogrel
Lors d'une étude, l'administration concomitante de dexlansoprazole (60 mg une fois par jour) et de clopidogrel (75 mg) à des sujets sains mener à une diminution de l'exposition au métabolite actif du clopidogrel (diminution d'env. 9% de l'ASC et de 27% de la Cmax). L'administration concomitante de dexlansoprazole n'a pas eu d'effet clinique sur la pharmacodynamique du clopidogrel. Aucun ajustement posologique du clopidogrel n'est nécessaire lors de l'administration d'une dose autorisée de dexlansoprazole.
Méthotrexate
Des rapports de cas, des études de pharmacocinétique publiées et des analyses rétrospectives indiquent que l'administration concomitante de méthotrexate (principalement à des doses élevées; voir l'information professionnelle du méthotrexate) et d'IPP's pourrait augmenter les taux sériques de méthotrexate et/ou de son métabolite, l'hydroxyméthotrexate, et en prolonger la présence dans le sang. Toutefois, aucune étude formelle d'interactions entre de fortes doses de méthotrexate et des IPP's n'a été menée.
Médicaments transportés par la glycoprotéine P
Une inhibition de la protéine de transport glycoprotéine P (P-gp) par le lansoprazole a été observée in vitro. On peut s'attendre à un effet similaire avec le dexlansoprazole. La pertinence clinique en est inconnue.
Autres
Aucune cliniquement significative interaction n'a été démontrée entre le dexlansoprazole et les anti-inflammatoires non stéroïdiens, bien qu'aucune étude formelle d'interactions n'ait été menée.
Grossesse, allaitementGrossesse
Il n'existe pas ou peu de données concernant l'emploi du dexlansoprazole chez les femmes enceintes. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs relatifs à une toxicité sur la reproduction (voir «Données précliniques»).
Par mesure de précaution, Dexilant ne doit pas être administré pendant la grossesse.
Allaitement
On ignore si le dexlansoprazole est excrété dans le lait maternel humain. Les expérimentations animales ont révélé une excrétion du lansoprazole dans le lait.
Un risque pour le nourrisson ne peut pas être exclu. C'est pourquoi il convient de renoncer à l'allaitement ou d'interrompre le traitement par Dexilant.
Fertilité
Des études menées chez l'animal n'ont mis en évidence aucune altération de la fertilité après l'administration de lansoprazole (voir «Données précliniques»). Il faut s'attendre à des résultats similaires avec le dexlansoprazole.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée. En raison des effets indésirables potentiels (p.ex. céphalées, troubles visuels et vertiges), Dexilant peut affecter l'aptitude à la conduite et à l'utilisation de machines.
Effets indésirablesLa sécurité d'emploi du dexlansoprazole aux doses de 30, 60 ou 90 mg a été évaluée dans des études cliniques menées sur des patients traités pendant un an maximum. Lors de ces études cliniques, l'incidence globale des effets indésirables de Dexilant a été similaire à celle observée avec le placebo et le lansoprazole. Elle n'a pas été affectée de manière pertinente par le sexe ou l'âge.
L'effet indésirable le plus fréquemment rapporté dans les études cliniques de phase III était la diarrhée (à l'exception de la diarrhée infectieuse). L'apparition des diarrhées et des douleurs abdominales a été indépendante de la durée de l'exposition. Les autres effets indésirables les plus fréquemment rapportés dans les études cliniques étaient des douleurs abdominales, des céphalées, des nausées, une gêne abdominale, des flatulences et de la constipation.
Au total, 2,4% des patients ont arrêté prématurément le traitement par le dexlansoprazole en raison d'un effet indésirable. Les effets indésirables les plus fréquents (≥0,5%) entraînant un arrêt prématuré du traitement étaient la diarrhée et les douleurs abdominales.
Les effets indésirables rapportés avec Dexilant (30 mg, 60 mg ou 90 mg) lors des études cliniques et/ou après sa commercialisation sont listés ci-dessous par classe de système d'organes et par fréquence. Les fréquences sont définies comme suit: très fréquents (≥1/10), fréquents (≥1/100 à < 1/10), occasionnels (≥1/1 000 à < 1/100), rares (≥1/10 000 à < 1/1 000), très rares (< 1/10 000), fréquence indéterminée (basée principalement sur les rapports spontanés émanant des données issues de la surveillance postérieure à la mise sur le marché, la fréquence exacte ne peut être estimée sur la base des données disponibles).
Infections
Rares: candidose (du tractus gastro-intestinal).
Affections hématologiques et du système lymphatique
Fréquence inconnue: anémie hémolytique auto-immune (au bout d'environ 4 à 7 mois de traitement par 60 mg de dexlansoprazole), purpura thrombopénique idiopathique.
Affections du système immunitaire
Fréquence inconnue: hypersensibilité, réaction anaphylactique, choc anaphylactique.
Troubles du métabolisme et de la nutrition
Occasionels: modifications de l'appétit.
Fréquence inconnue: hyponatrémie, hypomagnésémie (voir également «Mises en garde et précautions», une hypomagnésémie sévère peut être accompagnée d'une hypocalcémie et/ou d'une hypokaliémie).
Affections psychiatriques
Occasionnels: insomnie, dépression.
Rares: hallucinations auditives.
Affections du système nerveux
Fréquents: céphalées.
Occasionnels: étourdissements, altération du goût.
Rares: paresthésies, convulsions.
Affections oculaires
Rares: troubles de la vision.
Fréquence inconnue: vision floue.
Affections de l'oreille et du labyrinthe
Rares: vertiges.
Fréquence inconnue: surdité.
Affections vasculaires
Occasionnels: hypertension, bouffées de chaleur.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: toux.
Affections gastro-intestinales
Fréquents: diarrhée, douleurs abdominales, nausées, inconfort abdominal, flatulences, constipation, polypes bénins sur les glandes du fundus.
Occasionnels: vomissements, sécheresse buccale.
Affections hépatobiliaires
Occasionnels: anormal test de la fonction hépatique
Fréquence inconnue: hépatite médicamenteuse.
Affections de la peau et du tissu sous-cutané
Occasionnels: éruption, prurit, urticaire.
Très rares: Lupus érythémateux cutané subaigu.
Fréquence inconnue: Syndrome de Stevens-Johnson (SSJ), syndrome de Lyell, nécrolyse épidermique toxique (NET), exanthème médicamenteux avec éosinophilie et symptômes systémiques (DRESS), pustulose exanthématique aiguë généralisée (PEAG), érythème polymorphe.
Affections musculo-squelettiques et du tissu conjonctif
Occasionnels: fractures de la hanche, du poignet ou de la colonne vertébrale
Affections du rein et des voies urinaires
Fréquence inconnue: néphrite tubulo-interstitielle (pouvant entraîner une insuffisance rénale).
Troubles généraux et anomalies au site d'administration
Occasionnels: asthénie.
Description de certains effets indésirables
Réactions d'hypersensibilité
Les réactions d'hypersensibilité étaient plus fréquentes chez les femmes (74%). Après l'autorisation de mise sur le marché, de rares cas de réactions d'hypersensibilité et de réactions cutanées sévères telles que nécrolyse épidermique toxique (NET), syndrome de Stevens-Johnson (SSJ), exanthème médicamenteux avec éosinophilie et symptômes systémiques (DRESS), pustulose exanthématique aiguë généralisée (PEAG) et érythème polymorpheont été rapportés. La plupart du temps, les cas sévères ont également pu être maîtrisés en arrêtant le médicament et en instaurant une thérapie par antihistaminiques et/ou stéroïdes.
Sécurité dans la population pédiatrique
Le profil de sécurité chez les adolescents à partir de l'âge de 12 ans a été examiné dans des études cliniques auprès de 166 patients et était semblable à celui des adultes.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage significatif de Dexilant n'a été rapporté.
Signes et symptômes
L'administration de plusieurs doses de Dexilant 120 mg et d'une dose unique de Dexilant 300 mg n'a pas induit de décès ni d'autres effets indésirables graves.
Des effets indésirables tels que hypertension, bouffées de chaleur, hématomes, douleurs oro-pharyngées et perte de poids liés à des doses de 60 mg de Dexilant deux fois par jour ont été rapportés.
Traitement
Une surveillance médicale étroite du patient s'impose si un surdosage est suspecté. Le dexlansoprazole n'est pas significativement éliminé par hémodialyse. Lorsque cela s'avère nécessaire, une vidange gastrique, l'administration de charbon activé et un traitement symptomatique sont recommandés.
Propriétés/EffetsCode ATC
A02BC06
Mécanisme d'action
Le dexlansoprazole est l'énantiomère R du lansoprazole. Il s'agit d'un IPP gastrique. Il inhibe le dernier stade de la formation d'acide gastrique en bloquant l'activité de la H+/K+ ATPase au niveau des cellules pariétales de l'estomac. L'inhibition est dose-dépendante et réversible. Ses effets s'exercent à la fois sur les sécrétions d'acide gastrique basale et stimulée.
Le dexlansoprazole se concentre dans les cellules pariétales; il devient actif dans leur milieu acide et réagit avec le groupe sulfhydrique de la H+/K+ ATPase entraînant ainsi une inhibition de l'activité de l'enzyme.
Pharmacodynamique
Activité antisécrétoire
L'activité antisécrétoire du dexlansoprazole a été évaluée chez des sujets sains ayant pris 60 mg de dexlansoprazole ou 30 mg de lansoprazole une fois par jour pendant 5 jours. La valeur moyenne du pH gastrique s'élevait à 4,55 pour le dexlansoprazole et à 4,13 pour le lansoprazole. Sous dexlansoprazole, le pH gastrique s'est maintenu pendant 71% de la journée (17 heures) et sous lansoprazole pendant 60% de la journée (14 heures) au-delà de 4.
Effets sur les concentrations de gastrine sérique
Les effets de dexlansoprazole sur les concentrations sériques de gastrine ont été évalués chez des patients lors d'études cliniques menées sur une période maximale de 12 mois. Durant le traitement par des doses de dexlansoprazole de 30 mg et 60 mg, les concentrations sériques moyennes de gastrine à jeun ont augmenté par rapport à la valeur initiale. Chez les patients traités pendant plus de 6 mois, les taux sériques moyens de gastrine sérique à jeun ont augmenté durant les 3 premiers mois environ de traitement, puis sont demeurés stables durant le reste du traitement.
Dans le mois suivant la fin du traitement, les taux sériques moyens de gastrine sérique sont retournés aux niveaux antérieurs au traitement.
Effets sur les cellules entérochromaffines-like (cellules ECL)
Aucun cas d'hyperplasie des cellules ECL n'a été signalé dans les échantillons de biopsie gastrique de patients traités par 30 mg, 60 mg ou 90 mg de Dexilant pendant une période allant jusqu'à 12 mois.
Effets sur la repolarisation cardiaque
Dans une étude contrôlée contre placebo et moxifloxacine menée pour évaluer la capacité éventuelle du dexlansoprazole à allonger l'intervalle QT/QTc, des doses de Dexilant de 90 mg ou 300 mg n'ont pas retardé la repolarisation cardiaque.
Efficacité clinique
Guérison de l'œsophagite érosive
Deux études multicentriques, à double insu, contrôlées contre un traitement actif et randomisées ont été menées pendant 8 semaines auprès de patients atteints d'œsophagite érosive confirmée par endoscopie. La sévérité de la maladie avant le traitement était classée selon le système de classification de Los Angeles. Selon cette classification, 71% des patients souffraient d'une œsophagite érosive de grade A et B (légère) et 29% des patients d'une œsophagite érosive de grade C et D (modérée à sévère). Les patients ont été attribués par randomisation à l'un des trois groupes de traitement suivants: une dose quotidienne de 60 mg de Dexilant, une dose quotidienne de 90 mg de Dexilant et une dose quotidienne de 30 mg de lansoprazole. Les patients présentant un test H. pylori positif ou souffrant de l'œsophage de Barrett et/ou présentant certaines modifications dysplastiques au début de l'étude ont été exclus de celle-ci. Au total, 4092 patients de 18 à 90 ans ont participé à l'étude.
Le pourcentage de patients dont l'œsophagite érosive a été guérie après 4 semaines (critères d'efficacité secondaire) ou 8 semaines de traitement (critère d'efficacité primaire) est représenté ci-dessous dans le tableau 1. La non-infériorité de dexlansoprazole par rapport au lansoprazole a été démontrée dans les deux études.
Tableau 1 - Taux de guérison de l'œsophagite érosive*: tous grades confondus
|
Etude
|
Nombre de patients
(N)
|
Groupe de traitement
(prise quotidienne)
|
Semaine 4
% de guérison
|
Semaine 8‡
% de guérison
|
IC à 95% pour la différence du traitement (Dexilant – lanso-prazole) après 8 semaines
| |
1
|
657
|
Dexilant 60 mg
|
69,7
|
86,9§
|
(-1,5; 6,1)
| |
648
|
Lansoprazole 30 mg
|
65,4
|
84,6
| |
2
|
639
|
Dexilant 60 mg
|
66,2
|
85,3§ **
|
(2,2; 10,5)
| |
656
|
Lansoprazole 30 mg
|
64,8
|
79,0
|
IC= Intervalle de confiance
* Sur la base de l'analyse des taux bruts. Les patients dont la guérison de leur œsophagite érosive n'a pas été documentée par endoscopie et qui ont arrêté l'étude prématurément ont été considérés comme «non guéris».
‡ Critère d'efficacité primaire de l'étude
§ Non-infériorité démontrée par rapport au lansoprazole
Statistiquement significatif par rapport au lansoprazole (p=0,004)
La dose de 90 mg de Dexilant a été étudiée également et n'a pas présenté toutefois de bénéfice clinique supplémentaire par rapport à la dose de 60 mg de Dexilant.
Traitement d'entretien de l'œsophagite érosive guérie
Une étude multicentrique, à double insu, contrôlée par placebo et randomisée a été menée chez des patients qui avaient terminé avec succès une étude sur l'œsophagite érosive et dont la guérison de l'œsophagite érosive avait été confirmée par endoscopie. L'étude visait à évaluer pendant une période de 6 mois le maintien de la guérison et le soulagement des symptômes obtenu avec l'administration d'une dose quotidienne de 30 mg ou de 60 mg de Dexilant, par rapport au placebo. Au total, 445 patients âgés de 18 à 85 ans ont participé à l'étude.
Selon l'analyse par la méthode des taux bruts, Dexilant 30 mg a entraîné à 6 mois des taux statistiquement plus élevés de maintien de la guérison de l'œsophagite érosive comparativement au placebo (Tableau 2).
Tableau 2 - Taux de maintien de la guérison* de l'œsophagite érosive à 6 mois
|
Nombre de patients
(N)
|
Groupe de traitement
(prise quotidienne)
|
Semaine 8
%
de guérison
| |
125
|
Dexilant 30 mg
|
66,4‡
| |
119
|
Placebo
|
14,3
|
* Sur la base de l'analyse des taux bruts. Les patients dont la guérison de leur œsophagite érosive n'a pas été documentée par endoscopie et qui ont arrêté l'étude prématurément ont été considérés comme «en rechute».
‡ Statistiquement significatif par rapport au placebo (p<0,00001)
Durant la période de traitement, Dexilant 30 mg a permis d'obtenir un pourcentage statistiquement supérieur de soulagement des brûlures d'estomac (Tableau 3).
Tableau 3 - Pourcentages médians de nuits et de périodes de 24 heures sans brûlures d'estomac dans l'étude sur le traitement d'entretien de l'œsophagite érosive guérie
|
Groupe de traitement
(prise quotidienne)
|
Nombre de patients
(N)
|
Nuits sans brûlures d'estomac*
(en %)
|
Nombre de patients
(N)
|
Périodes de 24 heures sans brûlures d'estomac*
(en %)
| |
Dexilant 30 mg
|
132
|
98,9†
|
132
|
96,1†
| |
Placebo
|
140
|
71,7
|
141
|
28,6
|
* Critère d'efficacité secondaire de l'étude
† Statistiquement significatif par rapport au placebo (p<0,00001)
La dose de 60 mg de Dexilant n'a pas présenté de bénéfices cliniques supplémentaires par rapport à la dose de 30 mg de Dexilant.
Reflux gastro-œsophagien (RGO) symptomatique non érosif
L'efficacité du dexlansoprazole dans le traitement du reflux gastro-œsophagien (RGO) symptomatique non érosif a été examinée dans deux études randomisées, menées en double aveugle, contrôlées contre placebo, multicentriques, ayant chacune une durée de traitement de 4 semaines. Une œsophagite érosive a été exclue chez tous les patients avant le début de l'étude.
Dans l'étude principale, 947 patients ont été inclus, mentionnant comme symptôme principal des brûlures d'estomac permanentes depuis au moins 6 mois. Les patients ont reçu une fois par jour du Dexilant 30 mg, du Dexilant 60 mg ou un placebo. Le critère d'évaluation principal était le pourcentage de jours pendant le traitement au cours desquels aucune brûlure d'estomac n'était observée ni pendant la journée ni pendant la nuit. L'évaluation a eu lieu par la tenue d'un journal électronique. Dexilant 30 mg était significativement supérieur au placebo avec en moyenne 50,3% versus 25,0% jours sans brûlures d'estomac (p<0,0001). En ce qui concerne le pourcentage moyen des nuits sans brûlures d'estomac, Dexilant 30 mg était également significativement supérieur au placebo (67,6% contre 47,1%). Aucun bénéfice clinique supplémentaire n'a été observé pour Dexilant 60 mg par rapport à Dexilant 30 mg.
Ont été inclus dans l'étude de soutien 305 patients atteints de brûlures d'estomac nocturnes et de troubles du sommeil y inhérents; ils ont reçu du Dexilant 30 mg ou un placebo. Le critère d'évaluation principal était le pourcentage de nuits sans brûlures d'estomac pendant 4 semaines, évalué au moyen de la tenue d'un journal. Avec 60,1% versus 37,5% en moyenne, le pourcentage moyen des nuits sans brûlures d'estomac était significativement plus élevé pour Dexilant 30 mg que pour le placebo (p<0,001).
Population pédiatrique
Cicatrisation de l'œsophagite érosive, thérapie d'entretien de l'œsophagite érosive cicatrisée et soulagement des brûlures d'estomac
Dans une étude multicentrique de 24 semaines, 62 adolescents avec anamnèse documentés d'un reflux gastro-œsophagien pendant au moins 3 moins, présentant une œsophagite érosive confirmée par endoscopie ont été traités pendant 8 semaines avec Dexilant 60 mg une fois par jour afin. Les patients étaient âgés de 12 à 17 ans (âge moyen: 15 ans) et 61% étaient du sexe masculin. Sur la base de la classification de Los Angeles, 96,8% des patients avec œsophagite érosive présentaient avant le traitement une œsophagite érosive légère (grades A et B) et 3,2% des patients une œsophagite érosive modérée à sévère (grades C et D). Au cours du traitement jusqu'à 8 semaines, le taux de guérison de l'œsophagite érosive était de 87,9%, un taux comparable à celui des adultes.
Après le traitement initial de 8 semaines, les patients ont été randomisés sur la guérison de l'œsophagite érosive confirmée par endoscopie pour être traités par 30 mg de Dexilant ou un placebo une fois par jour pendant 16 semaines supplémentaires. La guérison confirmée par endoscopie s'est maintenue pendant la période de traitement de quatre mois chez 82% des patients traités par 30 mg de Dexilant par rapport à 58% dans le groupe placebo.
Pendant la phase d'entretien de 16 semaines, le pourcentage médian de la période sans brûlures d'estomac sur 24 heures était de 86,6% chez les patients recevant 30 mg de Dexilant et de 68,1% chez les patients recevant un placebo.
Reflux gastro-œsophagien (RGO) symptomatique non érosif
Dans une étude ouverte, non contrôlée, multicentrique, 104 adolescents de l'âge de 12 à <18 ans (âge moyen: 15 ans) atteints de RGO symptomatique non érosif ont été traités par Dexilant 30 mg une fois par jour pendant 4 semaines. 70% des patients étaient de sexe féminin. Les patients présentaient des symptômes de RGO documentés pour au moins 3 mois avant la sélection, des brûlures d'estomac documentées au moins 3 jours sur 7 pendant la sélection et ne présentaient pas d'érosions œsophagiennes à l'endoscopie. Le pourcentage moyen des jours où sous thérapie aucune brûlure d'estomac ne s'est manifestée ni durant la journée ni durant la nuit se situait à 47,1% et était ainsi comparable à celui observé chez les adultes.
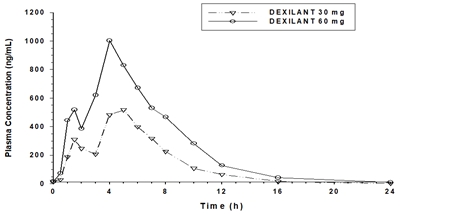
PharmacocinétiqueEn raison de la formule à double libération retardée de Dexilant (technologie dual delayed release), le profil concentration/temps du dexlansoprazole présente deux pics différents: un premier pic apparaît 1 à 2 heures après l'administration du médicament, suivi d'un second pic observé après 4 à 5 heures (voir Figure).
Figure 1: Profil de concentration plasmatique moyenne en fonction du temps du dexlansoprazole après administration orale de 30 mg ou 60 mg de Dexilant une fois par jour pendant 5 jours à des sujets sains
Absorption
Après administration orale de 30 mg ou 60 mg de Dexilant à des sujets sains, les moyennes de la Cmax et de l'ASC de dexlansoprazole ont augmenté de façon quasi proportionnelle à la dose. Les pics de concentrations plasmatiques ont été atteints en 4 à 6 heures.
Distribution
La liaison du dexlansoprazole aux protéines plasmatiques, qui s'élevait à 96,1% - 98,8% chez les volontaires sains, était indépendante de la concentration entre 0,01 et 20 µg/ml. Le volume de distribution apparent (Vz/F) après administration de doses multiples à des patients atteints de RGO symptomatique était de 40,3 litres.
Métabolisme
Le dexlansoprazole est très fortement métabolisé dans le foie en métabolites inactifs par oxydation, réduction et formation subséquente de conjugués de sulfate, de glucuronide et de glutathion. Des métabolites oxydatifs sont formés par le système enzymatique du cytochrome P450 (CYP), notamment une hydroxylation principalement par le CYP2C19 et une oxydation en sulfone par le CYP3A4. Chez les métaboliseurs lents du CYP2C19, l'exposition systémique du dexlansoprazole était environ quatre fois plus élevée que chez les métaboliseurs rapides. Indépendamment du statut de métaboliseur CYP2C19, le dexlansoprazole est le composant le plus important circulant dans le plasma. Chez les métaboliseurs intermédiaires et rapides du CYP2C19, les principaux métabolites plasmatiques sont le 5-hydroxy-dexlansoprazole et son glucuroconjugué, tandis que chez les métaboliseurs lents du CYP2C19, le principal métabolite plasmatique est le dexlansoprazole sulfone.
Élimination
Après administration orale de Dexilant, le dexlansoprazole n'est pas excrété dans l'urine sous forme inchangée.
Après l'administration de [14C]dexlansoprazole à des hommes sains, environ 50,7% de la dose radioactive administrée ont été excrétés dans l'urine et 47,6% dans les fèces. La clairance apparente chez les sujets sains était respectivement de 11,4 à 11,6 l/h, après administration quotidienne d'une dose de 30 ou de 60 mg pendant 5 jours.
Linéarité/non-linéarité
Après administration de doses quotidiennes uniques et multiples de 30 à 120 mg de dexlansoprazole à des sujets sains, les moyennes de la Cmax et de l'ASC du dexlansoprazole ont augmenté de façon quasi proportionnelle à la dose sur tout l'intervalle de doses. La pharmacocinétique du dexlansoprazole était indépendante de la dose et du temps, avec une demi-vie d'élimination terminale estimée d'environ 1 à 2 heures. C'est pourquoi on n'a pas ou quasiment pas observé d'accumulation de la substance après l'administration de doses de dexlansoprazole une fois par jour, ce qui s'est traduit, à l'état d'équilibre, par des de Cmax et d'ASC similaires après administration d'une dose unique ou de plusieurs doses une fois par jour.
Influence des aliments
Lors des études cliniques sur l'effet de la nourriture menées chez des volontaires sains recevant Delixant, l'augmentation de la Cmax a été comprise entre 12% et 55 %, et l'augmentation de l'ASC a été comprise entre 9% et 37% chez les sujets non à jeun par rapport aux sujets à jeun. Cependant, aucune différence pertinente n'a été observée en termes de pH intragastrique. Une étude supplémentaire a montré que l'administration de 60 mg de Dexilant avant la prise d'un déjeuner, d'un repas de midi, d'un repas du soir ou d'une collation en soirée n'a pas eu d'effet sur l'exposition au dexlansoprazole ni d'effet cliniquement pertinent sur le contrôle du pH intragastrique sur 24 heures. Dexilant peut être administré indépendamment de l'absorption de nourriture.
Cinétique pour certains groupes de patients
Enfants et adolescents
Une étude a évalué la pharmacocinétique du dexlansoprazole chez 36 patients âgés de 12 à 17 ans souffrant d'un reflux gastro-œsophagien symptomatique. Les patients ont été randomisés sur Dexilant 30 mg ou Dexilant 60 mg une fois par jour pendant 7 jours. La Cmax moyenne du dexlansoprazole chez les adolescents correspondait à 81 à 105% de la Cmax moyenne chez les adultes. La valeur ASC moyenne était de 78 à 88% de la valeur ASC moyenne de l'adulte et la clairance moyenne apparente CL/F était de 112 à 132% de la valeur CL/F moyenne de l'adulte. La pharmacocinétique chez les patients de 12 à 17 ans était dans l'ensemble comparable à celle observée chez les adultes sains.
Patients âgés
Lors d'une étude réalisée auprès d'hommes et de femmes en bonne santé ayant reçu une dose orale unique de 60 mg de Dexilant, la demi-vie d'élimination terminale du dexlansoprazole était statistiquement plus longue chez les personnes âgées que chez des sujets plus jeunes (respectivement de 2,23 heures et 1,5 heure). De plus, le dexlansoprazole a entraîné une exposition systémique (ASC) plus élevée chez les patients âgés (plus élevée de 34,5%) que chez les patients plus jeunes. Ces différences n'étaient pas cliniquement significatives (voir «Posologie/Mode d'emploi»).
Insuffisance hépatique
Lors d'une étude menée auprès de patients souffrant d'une insuffisance hépatique modérée et ayant reçu une dose orale unique de 60 mg de Dexilant, l'exposition plasmatique (ASC) du dexlansoprazole lié et non lié a été près de deux fois plus élevé dans le groupe avec insuffisance hépatique que chez les sujets ayant une fonction hépatique normale (voir «Posologie/Mode d'emploi»). Cette différence d'exposition n'était pas due à une différence de liaison aux protéines entre les deux groupes. Aucune étude n'a été réalisée chez des patients souffrant d'une insuffisance hépatique sévère (voir «Mises en garde et précautions»).
Insuffisance rénale
Le dexlansoprazole est très fortement métabolisé dans le foie en métabolites inactifs et le principe actif inchangé n'est pas retrouvé dans les urines après une dose orale de dexlansoprazole. Par conséquent, la pharmacocinétique du dexlansoprazole ne devrait pas être modifiée chez les patients souffrant d'insuffisance rénale, mais aucune étude n'a été réalisée auprès de cette catégorie de patients .
Sexe
Lors d'une étude réalisée auprès d'hommes et de femmes en bonne santé ayant reçu une dose orale unique de 60 mg de Dexilant, les femmes ont affiché une exposition systémique (ASC) plus élevée (42,8%) que les hommes.
Aucun ajustement de la dose n'est nécessaire en fonction du sexe.
Données précliniquesLes données précliniques issues des études conventionnelles de pharmacologie de sécurité, de toxicité chronique, de génotoxicité ou de toxicité de la reproduction et du développement n'ont pas révélé de risque particulier pour l'être humain. Le lansoprazole est un mélange racémique d'énantiomères R et S. Après administration du lansoprazole à des êtres humains et à des animaux, le principal composant circulant dans le plasma est le dexlansoprazole, l'énantiomère R du lansoprazole. Par conséquent, le potentiel cancérigène du dexlansoprazole a été évalué à partir des études déjà disponibles sur le lansoprazole.
Mutagénicité
Le lansoprazole a donné un résultat positif au test d'Ames et au test d'aberration chromosomique in vitro sur lymphocytes humains.
Le lansoprazole n'était pas génotoxique dans le test ex vivo de synthèse non programmée de l'ADN (UDS) utilisant des hépatocytes de rats, le test in vivo du micronoyau chez la souris ni dans le test d'aberration chromosomique pratiqué sur moelle osseuse de rats.
Le dexlansoprazole a donné un résultat positif au test d'Ames et au test d'aberration chromosomique in vitro utilisant des cellules pulmonaires de hamster chinois. Il a donné un résultat négatif au test in vivo du micronoyau chez la souris.
Carcinogénicité
Dans des études de cancérogénicité conduites chez le rat, le lansoprazole a engendré une hyperplasie dose-dépendante des cellules ECL gastriques et des tumeurs carcinoïdes à cellules ECL, associées à une hypergastrinémie en rapport avec l'inhibition de la sécrétion acide. Une métaplasie intestinale, ainsi qu'une hyperplasie des cellules de Leydig et des tumeurs bénignes des cellules de Leydig dans les testicules ont également été observées. Après 18 mois de traitement, une atrophie rétinienne a été observée. Ceci n'a pas été constaté chez le singe, le chien et la souris.
Des études de cancérogénicité menées chez la souris ont mis en évidence une hyperplasie dose-dépendante des cellules ECL gastriques, des tumeurs hépatiques et des adénomes du testis.
La pertinence clinique de ces résultats n'est pas connue.
Toxicité sur la reproduction
Les études de reproduction conduites chez des rates gestantes et des lapines gestantes avec des doses orales de lansoprazole (en fonction de la surface corporelle) 40 fois supérieures (rates), resp. 16 fois supérieures (lapines) à la dose recommandée chez l'homme n'ont mis en évidence aucune altération de la fertilité et aucun effet délétère sur le fœtus.
Une étude de toxicité sur le développement prénatal et postnatal a été effectuée au cours de laquelle des rates gestantes ont reçu du lansoprazole par voie orale à une posologie allant jusqu'à 100 mg/jour/kg pendant l'organogenèse jusqu'à la lactation. À la dose de 100 mg/kg/jour (correspondant à 1,8 fois la dose maximale de dexlansoprazole de 60 mg recommandée chez l'homme, reposant sur l'aire sous la courbe des concentrations en fonction du temps [ASC] du dexlansoprazole), les effets suivants entre autres ont été constatés chez les mères: période de gestation prolongée, prise de poids corporel plus faible pendant la gestation et diminution de l'absoprtion de nourriture. Le nombre de mort-nés était accru à cette dose; il pourrait s'agir d'une conséquence de la toxicité maternelle. Les jeunes animaux dont la mère avait reçu 100 mg/kg/jour présentaient un poids corporel et un poids du fémur plus faibles ainsi qu'une réduction de la longueur du fémur et de la longueur cranio-caudale. À des doses de 30 et 100 mg/kg/jour, l'épaisseur de la plaque de croissance était altéré. Des effets sur les paramètres osseux ont été considérés comme la conséquence de l'augmentation du poids corporel.
Études menées sur de jeunes animaux
Cinq études menées sur de jeunes animaux avec le lansoprazole n'ont pas mis en évidence des différences entre les jeunes animaux et les animaux adultes dues au traitement.
Dans une autre étude d'une durée de 8 semaines menée sur des rats juvéniles, un épaississement des valvules cardiaques est survenu à une exposition au lansoprazole (ASC) environ 11 fois supérieure à celle attendue chez l'homme (envrion 5 fois supérieure à l'ASC du dexlansoprazole attendue chez l'homme). Au bout d'une phase de rétablissement de 4 semaines exempte de médicament, ces résultats se sont avérés réversibles ou présentaient au moins une tendance de réversibilité.
Dans une étude réalisée ensuite portant sur la sensibilité aux troubles du développement chez les animaux qui recevaient le médicament à partir du 14e jour après la naissance (âge équivalent à environ 1 an chez l'homme), les rats juvéniles à un âge inférieur au 21e jour après la naissance (âge équivalent à environ 2 ans chez l'homme) se sont avérés être plus sensibles au développement d'un épaississement des valvules cardiaques lors d'une exposition plus faible (environ 4 fois supérieure à l'ASC du lansoprazole attendue et 2 fois supérieure à l'ASC du dexlansoprazole attendue chez l'homme).
La pertinence de ces résultats pour les enfants de moins de 12 ans n'est pas connue. Les résultats de ces études ne sont pas pertinents pour les patients de 12 ans et plus.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Tenir hors de portée des enfants.
Ne pas conserver au-dessus de 25°C.
Numéro d’autorisation62993 (Swissmedic).
PrésentationDexilant 30 mg: boîtes de 14, 28 ou 98 capsules à libération modifiée.
Dexilant 60 mg: boîtes de 14, 28 ou 56 capsules à libération modifiée.
Titulaire de l’autorisationTakeda Pharma AG, 8152 Opfikon.
Mise à jour de l’informationDécembre 2022
|

