CompositionPrincipes actifs
Indacatérol sous forme de maléate d'indacatérol et glycopyrronium sous forme de bromure de glycopyrronium.
Excipients
Lactose monohydraté, stéarate de magnésium.
Indications/Possibilités d’emploiUltibro Breezhaler est indiqué dans le traitement bronchodilatateur d'entretien chez les patients symptomatiques atteints de bronchopneumopathie chronique obstructive (BPCO) chez qui un traitement en monothérapie par LAMA ou LABA à faible dose n'est pas suffisant.
Posologie/Mode d’emploiPosologie
Adultes
La dose recommandée est d'une inhalation du contenu d'une gélule de 110/50 µg d'Ultibro Breezhaler une fois par jour à l'aide de l'inhalateur Ultibro Breezhaler.
Populations particulières de patients
Trouble de la fonction rénale
Ultibro Breezhaler peut être utilisé à la dose recommandée chez les patients présentant une insuffisance rénale légère à modérée. Chez les patients présentant une insuffisance rénale sévère et chez les patients dialysés en insuffisance rénale terminale, Ultibro Breezhaler ne doit être utilisé que si le bénéfice attendu est supérieur au risque potentiel (voir «Mises en garde et précautions» et «Pharmacocinétique»).
Trouble de la fonction hépatique
Ultibro Breezhaler peut être utilisé à la dose recommandée chez les patients présentant une insuffisance hépatique légère à modérée. On ne dispose d'aucune donnée concernant les patients atteints d'une insuffisance hépatique sévère (voir «Pharmacocinétique»).
Enfants et adolescents
Ultibro Breezhaler ne doit pas être utilisé chez les patients âgés de moins de 18 ans.
Patients âgés
Ultibro Breezhaler peut être utilisé à la dose recommandée chez les patients âgés de 75 ans ou plus.
Mode et durée de l'administration
Les gélules d'Ultibro Breezhaler ne doivent être utilisées qu'en inhalation orale et uniquement à l'aide de l'inhalateur Ultibro Breezhaler. Les gélules d'Ultibro Breezhaler ne doivent pas être avalées (voir «Surdosage»).
Ultibro Breezhaler doit être inhalé une fois par jour, toujours à la même heure. En cas d'oubli d'une dose, celle-ci doit être inhalée le plus rapidement possible. Les patients doivent être avertis de ne pas inhaler plus d'une dose par jour.
Les gélules d'Ultibro Breezhaler doivent toujours être conservées dans les plaquettes thermoformées, à l'abri de l'humidité, et ne doivent en être retirées qu'IMMÉDIATEMENT AVANT L'EMPLOI (voir «Remarques particulières»).
Lors de la prescription d'Ultibro Breezhaler, on instruira les patients quant à l'utilisation correcte de l'inhalateur. On demandera aux patients qui ne ressentent aucune amélioration de leur respiration s'ils avalent leur médicament au lieu de l'inhaler.
Contre-indicationsHypersensibilité à l'indacatérol, au glycopyrronium, au lactose ou à l'un des autres excipients.
Mises en garde et précautionsUltibro Breezhaler ne doit pas être administré en même temps que des médicaments contenant d'autres agonistes bêtaadrénergiques à longue durée d'action ou des antagonistes muscariniques à longue durée d'action (classes de substances auxquelles appartiennent aussi les composants d'Ultibro Breezhaler) (voir «Interactions»).
Asthme
Ultibro Breezhaler ne doit pas être utilisé en cas d'asthme, car on ne dispose d'aucune donnée dans cette indication. Les agonistes bêta2adrénergiques à longue durée d'action peuvent, s'ils sont administrés dans le cadre d'un traitement de l'asthme, augmenter le risque d'effets indésirables graves liés à l'asthme, y compris de décès dû à l'asthme.
N'est pas destiné au traitement de symptômes aigus
Ultibro Breezhaler n'est pas indiqué dans le traitement des épisodes aigus de bronchospasme.
Hypersensibilité
Des réactions d'hypersensibilité de type immédiat sont survenues après administration d'indacatérol ou de glycopyrronium, tous deux composants d'Ultibro Breezhaler. En cas de signes suggérant une réaction allergique (en particulier angioœdème (notamment difficultés à respirer ou à déglutir, gonflement de la langue, des lèvres et du visage), urticaire ou rash cutané), il faut arrêter immédiatement le traitement par Ultibro Breezhaler et instaurer un autre traitement.
Bronchospasme paradoxal
Comme d'autres traitements par inhalation, l'utilisation d'Ultibro Breezhaler peut aussi déclencher un bronchospasme paradoxal potentiellement fatal. En cas de bronchospasme paradoxal, il faut arrêter immédiatement le traitement par Ultibro Breezhaler et instaurer un autre traitement.
Effets anticholinergiques associés au glycopyrronium
Comme avec les autres anticholinergiques, la prudence et la retenue sont de mise en cas d'administration d'Ultibro Breezhaler à des patients atteints de glaucome à angle fermé, présentant un risque accru de rétention urinaire ou des maladies cardiovasculaires sévères préexistantes.
Il convient d'attirer l'attention des patients sur les symptômes et les signes de glaucome aigu à angle fermé et de leur demander d'arrêter le traitement par Ultibro Breezhaler et de contacter immédiatement leur médecin en cas d'apparition de l'un de ces signes ou symptômes.
Patients présentant une insuffisance rénale sévère
Chez les patients présentant une insuffisance rénale sévère (débit de filtration glomérulaire estimé inférieur à 30 ml/min/1.73 m2), y compris les patients présentant une insuffisance rénale terminale nécessitant une dialyse, Ultibro Breezhaler ne doit être utilisé que si le bénéfice attendu est supérieur au risque potentiel (voir «Pharmacocinétique»). Ces patients requièrent une surveillance étroite à la recherche d'effets indésirables médicamenteux éventuels.
Effets systémiques
Comme avec les autres agonistes bêta2adrénergiques, la prudence est de mise lors de l'administration d'Ultibro Breezhaler à des patients souffrant de maladies cardiovasculaires. Cette remarque s'applique principalement aux patients présentant une insuffisance coronarienne, un infarctus aigu du myocarde, des troubles du rythme cardiaque ou une hypertension artérielle ainsi qu'aux patients souffrant d'épilepsie ou atteints de thyréotoxicose, ainsi qu'aux patients répondant de manière particulièrement forte aux agonistes bêta2adrénergiques.
Comme les autres médicaments bêta2-adrénergiques inhalés, Ultibro Breezhaler ne doit pas être administré à des doses ni à des fréquences plus élevées que celles recommandées.
Effets des agonistes bêtaadrénergiques sur le système cardiovasculaire
Comme les autres agonistes bêta2-adrénergiques, Ultibro Breezhaler peut aussi influencer de manière cliniquement significative le système cardiovasculaire de certains patients. Ces effets peuvent se manifester sous la forme d'une augmentation de la fréquence cardiaque, d'une augmentation de la tension artérielle et/ou d'autres symptômes. En cas de survenue de tels effets, un arrêt du traitement peut être nécessaire. Les agonistes bêtaadrénergiques peuvent aussi induire des modifications du tracé ECG, par exemple un aplatissement de l'onde T, un allongement de l'intervalle QT et un sous-décalage du segment ST. La signification clinique de ces modifications n'est cependant pas établie.
Les agonistes bêta2adrénergiques à longue durée d'action (LABA) ou les médicaments contenant des LABA tels qu'Ultibro Breezhaler doivent donc être utilisés avec prudence chez les patients présentant un allongement connu ou supposé de l'intervalle QT ou chez les patients traités par des médicaments qui influencent l'intervalle QT.
Un examen des patients présentant une BPCO permettant de détecter des maladies cardiovasculaires concomitantes est nécessaire avant la prescription d'un traitement à long terme par un bêta-agoniste tel qu'Ultibro Breezhaler. Il est en l'occurrence également recommandé de procéder à un ECG et d'évaluer spécifiquement la possibilité d'un allongement de l'intervalle QTc.
Dans les essais cliniques portant sur Ultibro Breezhaler, les patients présentant une coronaropathie instable, une insuffisance cardiaque gauche, un infarctus du myocarde récent, des arythmies (à l'exception de la fibrillation auriculaire) ou un allongement de l'intervalle QTc (Fridericia) étaient exclus. Une prudence particulière est de mise chez ces patients ou ceux sous traitement concomitant par des médicaments susceptibles d'allonger l'intervalle QTc (voir «Interactions»).
Hypokaliémie lors de l'administration de bêta-agonistes
Les agonistes bêta2adrénergiques peuvent induire chez certains patients une hypokaliémie marquée, susceptible de provoquer des effets indésirables cardiovasculaires. La baisse de la kaliémie est habituellement passagère et ne requiert pas de supplémentation. Chez les patients présentant une BPCO sévère, l'hypokaliémie peut être renforcée par l'hypoxie et par des traitements concomitants, ce qui augmente la tendance aux arythmies cardiaques (voir «Interactions»).
On n'a pas observé d'effets cliniquement significatifs d'une hypokaliémie lors des études cliniques portant sur Ultibro Breezhaler utilisé à la dose thérapeutique recommandée (voir «Pharmacocinétique»).
Hyperglycémie lors de l'administration de bêta-agonistes
L'inhalation de fortes doses d'agonistes bêta2adrénergiques peut entraîner une élévation de la glycémie. Il convient donc de surveiller étroitement la glycémie chez les diabétiques au début d'un traitement par Ultibro Breezhaler. Dans les études cliniques au long cours ([ENLIGHTEN] et [RADIATE]), la proportion de patients présentant des modifications cliniquement manifestes de la glycémie était plus élevée sous Ultibro Breezhaler (4.9%) que sous le placebo (2.7%). Ultibro Breezhaler n'a pas été testé chez les patients souffrant d'un diabète sucré insuffisamment contrôlé.
Excipients
Ultibro Breezhaler contient du lactose et ne doit donc pas être utilisé chez les patients atteints d'un déficit sévère en lactase ou d'une galactosémie.
InteractionsL'utilisation simultanée d'indacatérol et de glycopyrronium par inhalation orale, dans les conditions d'état d'équilibre, n'a pas influencé la pharmacocinétique (PC) des principes actifs respectifs.
Aucune étude spécifique des interactions médicamenteuses n'a été menée avec Ultibro Breezhaler. Les informations concernant la survenue éventuelle d'interactions lors de l'utilisation d'Ultibro Breezhaler reposent sur la possibilité de la survenue d'interactions lors de l'utilisation de chacun de ses deux principes actifs en monothérapie.
Interactions avec l'indacatérol
Aucune étude spécifique des interactions médicamenteuses n'a été menée avec Ultibro Breezhaler. Les informations concernant des interactions potentielles reposent sur le potentiel d'interactions de chacun de ses deux principes actifs.
Bêta-bloquants adrénergiques
Les bêta-bloquants adrénergiques peuvent atténuer ou antagoniser l'effet des agonistes bêta2adrénergiques.
Ultibro Breezhaler ne doit par conséquent pas être administré en même temps que des bêta-bloquants adrénergiques (y compris sous forme de collyres), à moins que l'administration de ceux-ci soit cliniquement absolument nécessaire. Le cas échéant, on privilégiera les bêta-bloquants cardiosélectifs, même si leur emploi impose aussi la prudence.
Médicaments allongeant l'intervalle QT
Comme avec les autres agonistes bêta2adrénergiques, la prudence est de mise lors de l'administration d'Ultibro Breezhaler à des patients traités par des inhibiteurs de la monoamine oxydase, des antidépresseurs tricycliques ou des médicaments connus pour allonger l'intervalle QT, car les effets de ces médicaments sur l'intervalle QT peuvent être renforcés. Les médicaments allongeant l'intervalle QT pourraient augmenter le risque d'arythmie ventriculaire (voir «Mises en garde et précautions»).
Sympathicomimétiques
L'administration concomitante d'autres sympathicomimétiques (seuls ou sous forme de traitement combiné) pourrait renforcer les effets indésirables de l'indacatérol (voir «Mises en garde et précautions»).
Hypokaliémie
Le traitement concomitant avec des dérivés de la méthylxanthine, des stéroïdes ou des diurétiques non épargneurs de potassium, pourrait renforcer une hypokaliémie éventuelle due aux agonistes bêta2-adrénergiques (voir «Mises en garde et précautions»).
Interactions métaboliques et interactions liées aux transporteurs
Le CYP3A4 et les inhibiteurs de la glycoprotéine P (Pgp) (c.-à-d. kétoconazole, érythromycine, vérapamil et ritonavir) induisent une augmentation d'un facteur 1.4 à 2 de l'AUC, ainsi qu'une augmentation d'un facteur 1.5 de la Cmax. L'expérience en matière de sécurité d'un traitement par indacatérol acquise au cours d'essais cliniques avec des doses d'indacatérol de 600 µg sur une période allant jusqu'à un an n'a suggéré la présence d'aucun risque particulier, si bien que l'on peut douter de la signification clinique de ces interactions.
Interactions avec le glycopyrronium
Les études in vitro n'ont pas apporté d'éléments permettant de conclure à une action inductrice ou inhibitrice du glycopyrronium sur le métabolisme d'autres substances ou processus impliquant des transporteurs de principe actif.
Anticholinergiques
L'utilisation concomitante d'Ultibro Breezhaler avec d'autres préparations inhalées contenant un anticholinergique n'a pas fait l'objet d'études et n'est donc pas recommandée, comme c'est d'ailleurs le cas avec d'autres médicaments contenant des anticholinergiques.
Interactions significatives
Cimétidine ou autres inhibiteurs du transport de cations organiques
Dans un essai clinique mené chez des volontaires sains, l'administration de cimétidine, un inhibiteur du transport de cations organiques contribuant probablement à l'élimination rénale du glycopyrronium, a donné lieu à une augmentation de 22% de l'exposition totale (AUC) au glycopyrronium, tandis que la clairance rénale a diminué de 23%. Compte tenu de l'ordre de grandeur de cette modification, on ne devrait pas s'attendre à une interaction cliniquement significative lors de l'administration concomitante de glycopyrronium et de cimétidine ou d'autres inhibiteurs du transport de cations organiques.
Grossesse, allaitementGrossesse
On ne dispose pas d'études adéquates et suffisamment contrôlées sur l'utilisation d'Ultibro Breezhaler ni sur l'administration d'indacatérol ou de glycopyrronium durant la grossesse.
Dans une étude sur le développement embryo-fœtal chez le rat avec des administrations par inhalation, on n'a pas constaté d'effets sur l'embryon ou le fœtus pour aucune des doses d'Ultibro Breezhaler administrées. L'indacatérol et le glycopyrronium administrés respectivement par voie sous-cutanée et par inhalation n'ont pas eu d'effet tératogène chez le rat et le lapin. Après l'administration à des lapins, l'indacatérol a donné lieu à des signes suggérant l'existence d'une toxicité sur la reproduction sous la forme d'une incidence augmentée de modifications du squelette (voir «Données précliniques»). Chez les femelles portantes soumises à une césarienne, les concentrations de bromure de glycopyrronium mesurées 86 minutes après une injection intramusculaire unique de 0.006 mg/kg dans le plasma de la veine ombilicale (0.28 (0.25) ng/ml) et dans le plasma de l'artère ombilicale (0.18 (0.11) ng/ml) étaient basses.
Le risque éventuel chez l'être humain n'est pas connu. Comme on ne dispose pas d'une expérience suffisante chez les femmes enceintes, Ultibro Breezhaler ne doit être utilisé durant la grossesse que si le bénéfice attendu pour la patiente le justifie compte tenu du risque potentiel pour le fœtus.
Allaitement
On ignore si l'indacatérol et/ou le glycopyrronium passe dans le lait maternel humain. On ne dispose pas de données concernant l'effet de l'indacatérol ou du glycopyrronium sur l'enfant qui allaite ou sur la production de lait. On a néanmoins détecté de l'indacatérol et du glycopyrronium (y compris leurs métabolites) dans le lait de rates allaitantes après administrations sous-cutanée et intraveineuse. L'administration d'Ultibro Breezhaler durant l'allaitement ne doit donc être envisagée que si le bénéfice attendu pour la patiente est supérieur au risque potentiel pour le nouveau-né (voir «Données précliniques»).
Contractions et accouchement
Informations sur l'indacatérol
Comme les autres agonistes bêta2adrénergiques, Ultibro Breezhaler peut aussi inhiber le travail en raison de son effet relaxant sur la musculature lisse de l'utérus.
Effet sur l’aptitude à la conduite et l’utilisation de machinesL'influence d'Ultibro Breezhaler sur l'aptitude à la conduite et l'utilisation de machines n'a pas été étudiée.
Effets indésirablesLe profil de sécurité d'Ultibro Breezhaler se fonde sur les expériences faites avec Ultibro Breezhaler et chacun de ses composants.
Résumé du profil de sécurité
Les expériences en matière de sécurité d'Ultibro Breezhaler reposent sur des données d'utilisation à la dose thérapeutique recommandée (110/50 µg) sur des périodes allant jusqu'à 15 mois.
Le profil de sécurité est marqué par les symptômes anticholinergiques et bêta-adrénergiques typiques associés aux deux composants du médicament. Les céphalées, la toux et la rhinopharyngite figuraient parmi les autres effets indésirables les plus fréquents associés au médicament (fréquence ≥3% et supérieure à celle observée dans le groupe placebo).
Le profil d'effets indésirables d'Ultibro Breezhaler à la posologie recommandée chez les patients présentant une BPCO a mis en évidence des effets systémiques sous la forme d'une stimulation bêta2-adrénergique. Les changements de fréquence cardiaque moyens étaient inférieurs à un battement par minute. Les cas de tachycardie étaient rares et leur fréquence n'était pas supérieure à celle sous placebo.
Les effets indésirables médicamenteux sont répertoriés par classes de systèmes d'organes MedDRA. La fréquence des effets indésirables médicamenteux a été déterminée à l'aide des données cumulées de 3 études cliniques de phase III contrôlées contre placebo, d'une durée de 6 et 12 mois. Pour chacun des effets indésirables médicamenteux, la catégorie de fréquences correspondante est mentionnée selon la convention ( II) suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à < 1/10), «occasionnels» (≥1/1000 à < 1/100), «rares» (≥1/10 000 à < 1/1000), «très rares» (< 1/10 000).
Ultibro Breezhaler a induit des effets indésirables médicamenteux comparables à ses composants en monothérapie. Comme Ultibro Breezhaler contient de l'indacatérol et du glycopyrronium, on peut s'attendre à ce que la nature et la sévérité des réactions indésirables associées à chacun de ses composants soient les mêmes lors de l'utilisation de la préparation combinée.
Incidence cumulée selon Kaplan-Meier (en %) des effets indésirables à la semaine 52 (données regroupées sur la BPCO contrôlées contre placebo).
Infections
Très fréquents: infections des voies aériennes supérieures (16.96%).
Fréquents: rhinopharyngite, infection des voies urinaires, sinusite, rhinite.
Système immunitaire
Fréquents: hypersensibilité.
Troubles du métabolisme et de la nutrition
Fréquents: hyperglycémie et diabète sucré.
Troubles psychiatriques
Occasionnels: insomnies.
Troubles du système nerveux
Fréquents: sensations de vertiges, céphalées.
Rares: paresthésie.
Yeux
Occasionnels: glaucome*.
Cœur
Occasionnels: cardiopathie ischémique, fibrillation auriculaire, tachycardie, palpitations.
Organes respiratoires
Fréquents: toux, douleurs bucco-pharyngées, y compris irritations de la gorge.
Occasionnels: épistaxis, bronchospasme paradoxal.
Troubles gastro-intestinaux
Fréquents: dyspepsie, caries dentaires.
Occasionnels: sécheresse buccale, gastro-entérite.
Affections de la peau et du tissu sous-cutané
Occasionnels: prurit/rash cutané.
Système musculo-squelettique
Occasionnels: douleurs de l'appareil locomoteur, spasmes musculaires, myalgie, douleurs dans les extrémités.
Reins et voies urinaires
Fréquents: obstruction vésicale et rétention urinaire.
Troubles généraux et réactions au site d'application
Fréquents: pyrexie*, douleurs thoraciques.
Occasionnels: œdème périphérique, fatigue.
* Nouveaux effets indésirables médicamenteux observés lors de l'utilisation de la préparation combinée Ultibro Breezhaler, mais non observés lors de l'utilisation de chacun de ses composants administrés en monothérapie.
Expériences post-commercialisation
Les effets indésirables médicamenteux suivants ont été observés en relation avec l'utilisation d'Ultibro Breezhaler après sa commercialisation. Comme ces effets indésirables ont été rapportés à titre volontaire dans une population de taille indéterminée, leur fréquence n'est pas estimable de façon fiable et a par conséquent été classée dans la catégorie «fréquence inconnue». Les effets indésirables sont répertoriés selon les classes de systèmes d'organes MedDRA. À l'intérieur de chaque classe de système d'organes, les effets indésirables sont indiqués par ordre décroissant de sévérité.
Effets indésirables médicamenteux documentés dans le cadre d'annonces spontanées et de cas publiés dans la littérature (fréquence non estimable)
Affections du système immunitaire
Angioœdème.
Affections respiratoires, thoraciques et médiastinales
Dysphonie.
Description de certains effets indésirables sélectionnés
L'effet anticholinergique le plus fréquent était la sécheresse buccale (0.64% contre 0.45% sous placebo). Cet événement indésirable a toutefois été rapporté plus rarement sous Ultibro Breezhaler que sous glycopyrronium en monothérapie. La sécheresse buccale était dans la majorité des cas d'intensité légère et selon toute vraisemblance liée au traitement; aucun cas grave n'a été rapporté. La toux était fréquente, mais en règle générale d'intensité faible.
Quelques événements indésirables graves apparus lors de l'utilisation en monothérapie de l'indacatérol sont connus, en particulier des cas de réactions d'hypersensibilité et de cardiopathie ischémique. Les fréquences des réactions d'hypersensibilité et des cardiopathies ischémiques annoncées sous Ultibro Breezhaler étaient de 2.06% contre 1.9% sous placebo et de 0.67% contre 0.78% sous placebo respectivement.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageInformations concernant Ultibro Breezhaler
On ne dispose d'aucune information concernant un surdosage cliniquement significatif d'Ultibro Breezhaler. Un surdosage pourrait entraîner des effets correspondant aux effets de surdosage typiques d'agonistes bêta2-adrénergiques, p.ex. tachycardie, tremblements, palpitations, céphalées, nausées, vomissements, somnolence, arythmie ventriculaire, acidose métabolique, hypokaliémie, hyperglycémie, ou des effets anticholinergiques, tels qu'hypertension intraoculaire (à l'origine de douleurs oculaires, de troubles de la vision et d'yeux rouges), constipation ou problèmes mictionnels et de défécation. Il n'existe pas de traitement spécifique en cas de surdosage d'Ultibro Breezhaler. Des traitements symptomatiques et adjuvants sont indiqués dans de tels cas. Une hospitalisation peut être nécessaire dans les cas graves. L'utilisation de bêta-bloquants cardiosélectifs peut être envisagée pour le traitement des effets bêta2-adrénergiques, mais uniquement avec une prudence extrême et sous l'étroite surveillance d'un médecin, car l'administration de bêta-bloquants adrénergiques peut provoquer des bronchospasmes.
Informations concernant l'indacatérol
Chez les patients présentant une BPCO, des doses uniques de 3000 µg étaient associées à une augmentation modérée de la fréquence cardiaque et de la tension artérielle systolique, ainsi qu'à un allongement de l'intervalle QTc.
Informations concernant le glycopyrronium
L'inhalation orale répétée de glycopyrronium à des doses totales de 100 et 200 µg une fois par jour durant 28 jours a été bien tolérée par les patients présentant une BPCO.
En raison de la faible biodisponibilité orale (environ 5%), il est improbable que l'ingestion accidentelle de capsules de glycopyrronium conduise à une intoxication aiguë.
Les concentrations plasmatiques maximales et l'exposition systémique totale après l'injection intraveineuse de 150 µg de bromure de glycopyrronium (correspondant à 120 µg de glycopyrronium) à des volontaires sains étaient respectivement environ 50 fois et 6 fois supérieures aux valeurs correspondantes à l'état d'équilibre (steady state) après l'administration de la dose de glycopyrronium recommandée (50 µg une fois par jour). Ces doses étaient bien tolérées.
Propriétés/EffetsCode ATC
R03AL04
Mécanisme d'action
Ultibro Breezhaler
Compte tenu des différences de mécanismes d'action entre l'indacatérol et le glycopyrronium, qui visent des récepteurs différents et agissent par des voies différentes pour produire la relaxation des petits muscles, les deux principes actifs produisent des effets synergiques lorsqu'ils sont administrés sous la forme combinée Ultibro Breezhaler.
Indacatérol
L'indacatérol est un agoniste bêta2-adrénergique d'«ultra» longue durée d'action destiné à une administration unique par jour. L'action pharmacologique des agonistes bêta2adrénergiques, y compris l'indacatérol, est au moins partiellement due à la stimulation de l'adénylcyclase intracellulaire, l'enzyme qui catalyse la transformation de l'adénosine triphosphate (ATP) en adénosine 3', 5' monophosphate cyclique (monophosphate cyclique). Une augmentation de la concentration d'AMP cyclique entraîne une relaxation de la musculature lisse des bronches.
Lors de l'inhalation, l'indacatérol agit localement au niveau du poumon comme un bronchodilatateur. Dans une bronche humaine isolée, l'effet de l'indacatérol est rapide et prolongé.
Les récepteurs bêta2-adrénergiques sont certes les récepteurs adrénergiques prédominants dans la musculature lisse des bronches, tandis que les récepteurs bêta1-adrénergiques prédominent au niveau du cœur chez l'homme; il n'en reste pas moins que l'on trouve également dans le cœur des récepteurs bêta2-adrénergiques où ils représentent 10% à 50% de l'ensemble des récepteurs adrénergiques. La fonction exacte des récepteurs bêta2-adrénergiques cardiaques n'est pas connue, mais leur présence laisse supposer que même les agonistes bêta2adrénergiques très sélectifs agissent sur le cœur.
Glycopyrronium
Le glycopyrronium est un antagoniste des récepteurs muscariniques (anticholinergique) de longue durée d'action administré par voie inhalée une fois par jour en traitement bronchodilatateur d'entretien dans la BPCO. Les nerfs parasympathiques sont les voies nerveuses bronchoconstrictrices les plus importantes des voies aériennes et le tonus cholinergique est la composante réversible centrale de l'obstruction des voies aériennes dans la BPCO. L'action du glycopyrronium repose sur un blocage de l'effet bronchoconstricteur de l'acétylcholine sur les cellules des muscles lisses des voies aériennes, ce qui entraîne une dilatation de ces dernières.
Des cinq sous-types de récepteurs muscariniques connus (M1–5), seuls les sous-types M1–3 ont une fonction physiologique bien définie dans le poumon humain. Le bromure de glycopyrronium est un antagoniste à forte affinité de ces trois sous-types de récepteurs muscariniques. Dans les essais de liaison compétitive, la substance a présenté une sélectivité 4 à 5 fois plus élevée pour les récepteurs M3 et M1 humains que pour les récepteurs M2 humains. L'action du bromure de glycopyrronium intervient rapidement, comme l'ont montré les paramètres cinétiques de l'association/dissociation aux récepteurs et le délai d'entrée en action après l'inhalation au cours des études cliniques.
La longue durée d'action s'explique probablement en partie par la persistance des concentrations de principe actif dans les poumons, comme le suggère la demi-vie d'élimination terminale prolongée du glycopyrronium à la suite de l'inhalation avec l'inhalateur de glycopyrronium par rapport à la demi-vie après une injection intraveineuse (voir «Pharmacocinétique»).
Pharmacodynamique
Effet pharmacodynamique primaire
L'effet de l'association d'indacatérol et de glycopyrronium dans Ultibro Breezhaler se manifeste rapidement, soit en l'espace de 5 minutes après l'inhalation. L'effet est resté constant sur toute la durée de l'intervalle posologique de 24 heures.
D'après les mesures en série du VEMS sur 24 heures, l'effet bronchodilatateur moyen après 26 semaines de traitement était de 0.32 litre, en comparaison avec le placebo. L'effet d'Ultibro Breezhaler était significativement plus puissant que celui de l'indacatérol, du glycopyrronium ou du tiotropium administrés seuls, en protocole ouvert (différence pour chacune des comparaisons: 0.11 litre), (groupe partiel avec réalisation d'une spirométrie sérielle).
Ni la comparaison avec le placebo, ni celle avec chacune des substances en monothérapie n'a suggéré le développement sous Ultibro Breezhaler d'une tachyphylaxie au cours du temps.
Effets pharmacodynamiques secondaires
Les effets indésirables systémiques des agonistes bêta2adrénergiques et des antagonistes des récepteurs muscariniques administrés par voie inhalée résultent d'une activation des récepteurs bêta2-adrénergiques systémiques et d'un blocage des récepteurs muscariniques à la suite de l'absorption des principes actifs. Le profil d'effets indésirables d'Ultibro Breezhaler a été examiné aussi bien chez des sujets sains que chez des patients atteints de BPCO.
Effets sur la fréquence cardiaque
Les effets sur la fréquence cardiaque ont été étudiés chez des volontaires sains après administration d'une dose unique d'Ultibro Breezhaler 440/200 µg, inhalée au cours de quatre étapes posologiques espacées d'une heure, et ils ont été comparés aux effets observés après administration d'un placebo, de 600 µg d'indacatérol, de 200 µg de glycopyrronium, ainsi que de 200 µg de salmétérol.
L'accélération ajustée au temps la plus importante de la fréquence cardiaque après l'inhalation d'Ultibro Breezhaler par rapport au placebo était de +5.69 battements/minute et le ralentissement le plus important était de -2.51 battements/minute. Globalement, on n'a pas observé d'effets pharmacodynamiques consistants sur la fréquence cardiaque sous Ultibro Breezhaler.
Les effets de doses suprathérapeutiques d'Ultibro Breezhaler sur la fréquence cardiaque ont été étudiés chez des patients présentant une BPCO et recevant des doses de 150/100, 300/100 et 600/100 µg. Ultibro Breezhaler n'a pas eu d'effet significatif sur la fréquence cardiaque après 30 minutes, 4 heures et 24 heures, ni sur la fréquence cardiaque moyenne sur 24 heures.
Intervalle QT
Une étude du QT approfondie (TQT) menée chez des volontaires sains ayant inhalé jusqu'à 600 µg d'indacatérol n'a pas montré d'effet cliniquement significatif sur l'intervalle QT. Au cours d'une étude TQT, on n'a pas non plus observé d'allongement de l'intervalle QT à la suite de l'inhalation de 400 µg de glycopyrronium.
Les effets d'Ultibro Breezhaler sur l'intervalle QTc ont été examinés chez des volontaires sains après l'inhalation d'une dose de 440/200 µg d'Ultibro Breezhaler en quatre étapes posologiques espacées d'une heure. La différence ajustée au temps la plus importante par rapport au placebo était de 4.62 ms (IC à 90% 0.40, 8.85 ms) et la diminution ajustée au temps la plus importante était de -2.71 ms (IC à 90% -6.97, 1.54 ms), ce qui suggère qu'Ultibro Breezhaler n'a aucun effet significatif sur l'intervalle QT, comme on pouvait s'y attendre sur la base des propriétés de ses composants.
L'administration de doses suprathérapeutiques comprises entre 150 µg/100 µg et 600 µg/100 µg d'Ultibro Breezhaler à des patients atteints de BPCO a entraîné un allongement de l'intervalle QTcF compris entre 30 et 60 ms par rapport à la valeur initiale (début de l'étude) chez une proportion plus importante de patients (de 16.0% à 21.6% par rapport à 1.9% sous placebo). Aucun allongement de l'intervalle QTcF supérieur à 60 ms par rapport à la valeur initiale n'a cependant été observé. La dose maximale de 600 µg/100 µg d'Ultibro Breezhaler était aussi associée à la plus forte proportion de valeurs absolues de QTcF supérieures à 450 ms (12.2% versus 5.7% sous placebo).
Kaliémie et glycémie
Chez les volontaires sains, les effets d'une dose de 440/200 µg d'Ultibro Breezhaler sur la kaliémie ont été très faibles (différence maximale de -0.14 mmol/l versus placebo). Le changement maximal de la glycémie a été de 0.67 mmol/l. Lors de la comparaison entre une dose de 440/200 µg d'Ultibro Breezhaler et une dose de 200 µg de salmétérol, les effets sur la kaliémie (différence maximale de 0.21 mmol/l) et sur la glycémie (différence maximale de 0.21, resp. 1.19 mmol/l) ont été plus faibles.
Efficacité clinique
Le programme de développement clinique de phase III d'Ultibro Breezhaler [IGNITE] a comporté six études auxquelles au total plus de 8000 patients ont participé: une étude sur 26 semaines, contrôlée contre placebo et substance active (150 µg d'indacatérol une fois par jour, 50 µg de glycopyrronium une fois par jour, 18 µg de tiotropium en protocole ouvert, une fois par jour) [SHINE]; une étude sur 26 semaines contrôlée contre substance active (500/50 µg de salmétérol/fluticasone deux fois par jour) [ILLUMINATE]; une étude sur 64 semaines contrôlée contre substance active (50 µg de glycopyrronium une fois par jour, 18 µg de tiotropium en protocole ouvert, une fois par jour) [SPARK]; une étude sur 52 semaines contrôlée contre placebo [ENLIGHTEN], et une étude de tolérance à l'effort sur trois semaines, contrôlée contre placebo et contre substance active (tiotropium en protocole ouvert, une fois par jour) [BRIGHT], ainsi qu'une étude sur 52 semaines contrôlée contre substance active (salmétérol/fluticasone 500/50 µg deux fois par jour) [FLAME].
Les participants étaient des patients ayant un diagnostic clinique de BPCO modérée à très sévère, âgés de 40 ans au moins et présentant une anamnèse de tabagisme d'au minimum 10 paquets-années. Dans ces 5 études, les sujets inclus dans [SHINE] et [ENLIGHTEN] avaient un VEMS post-bronchodilatateur < 80% et ≥30% de la valeur normale prédite et un rapport post-bronchodilatateur VEMS/CVF inférieur à 70%. L'étude sur 26 semaines contrôlée contre substance active [ILLUMINATE] a inclus des patients avec un VEMS post-bronchodilatateur < 80% et ≥40% de la valeur normale prédite, sans exacerbations modérées ou sévères au cours des 12 mois ayant précédé le début de l'étude. Dans l'étude sur 64 semaines [SPARK], les patients inclus présentaient par contre une BPCO sévère à très sévère, des antécédents d'au moins 1 épisode d'exacerbation modérée à sévère de la BPCO au cours de l'année écoulée, ainsi qu'un VEMS post-bronchodilatateur < 50% de la valeur normale prédite.
L'étude sur 52 semaines contrôlée contre substance active [FLAME] a inclus des patients présentant une BPCO modérée à très sévère, des antécédents d'au moins 1 épisode d'exacerbation modérée à sévère de la BPCO (19% avec des antécédents d'au moins 2 épisodes d'exacerbation) au cours de l'année écoulée, ainsi qu'un VEMS post-bronchodilatateur de ≥25 et < 60% de la valeur normale prédite.
Effets sur la fonction pulmonaire
L'inhalation de 110/50 µg d'Ultibro Breezhaler une fois par jour a entraîné des améliorations cliniquement significatives de la fonction pulmonaire (mesurée par le volume expiratoire maximal en une seconde [VEMS]). Dans les études de phase III, l'effet bronchodilatateur s'est produit dans les 5 minutes après la première dose et a persisté tout au long de l'intervalle posologique subséquent de 24 heures. Dans l'étude sur 26 semaines [SHINE] et dans l'étude sur 52 semaines [ENLIGHTEN], on n'a pas constaté d'atténuation de l'effet bronchodilatateur en fonction du temps.
VEMS résiduel
Dans l'étude [SHINE] le critère d'évaluation principal après 26 semaines, c'est-à-dire le VEMS résiduel post-dose, était augmenté de 200 ml par rapport au placebo (p < 0.001). L'augmentation était significative par rapport à chacun des groupes recevant l'un des composants (indacatérol et glycopyrronium) en monothérapie, ainsi que par rapport au groupe sous tiotropium en protocole ouvert (cf. tableau 1).
Tableau 1: VEMS résiduel post-dose (méthode de la moyenne des moindres carrés, «Least Squares Mean») au jour 1 et à la semaine 26 (critère d'évaluation principal)
|
Différence entre les traitements
|
Jour 1
|
Semaine 26
| |
ULTIBRO BREEZHALER - placebo
|
190 ml (p < 0.001)
|
200 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - indacatérol
|
80 ml (p < 0.001)
|
70 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - glycopyrronium
|
80 ml (p < 0.001)
|
90 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - tiotropium, ouvert
|
80 ml (p < 0.001)
|
80 ml (p < 0.001)
|
Le VEMS moyen avant l'administration de la dose (moyenne des valeurs mesurées -45 min. et -15 min. avant la dose du matin du médicament de l'étude) était cliniquement significatif et statistiquement meilleur sous Ultibro Breezhaler à la semaine 26 par rapport à salmétérol/fluticasone (100 ml, p < 0.001) [ILLUMINATE], à la semaine 52 par rapport au placebo (189 ml, p < 0.001) [ENLIGHTEN] et lors de toutes les visites de contrôle jusqu'à la semaine 64 par rapport au glycopyrronium (70–80 ml, valeur de p < 0.001) et au tiotropium en protocole ouvert (60–80 ml, valeur de p < 0.001) [SPARK].
Dans l'étude [FLAME], le VEMS moyen avant l'administration de la dose était augmenté de façon cliniquement significative (62–86 ml) sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone pendant le traitement en double aveugle lors de toutes les visites jusqu'à la semaine 52.
AUC du VEMS
Dans l'étude contrôlée contre substance active [ILLUMINATE], Ultibro Breezhaler a provoqué une augmentation de 140 ml de l'AUC(0–12h) du VEMS post-dose (p < 0.001) (critère d'évaluation principal) après 26 semaines par rapport à l'association salmétérol/fluticasone.
Des spirométries en série ont été réalisées dans un sous-groupe de patients de l'étude [FLAME]. Dans ce sous-groupe, Ultibro Breezhaler a entraîné une amélioration de l'AUC0–12h du VEMS de 110 ml après 52 semaines de traitement. Le groupe de patients traités par Ultibro Breezhaler a enregistré une amélioration dès le jour 1 par rapport à ceux du groupe salmétérol/fluticasone.
Figure 1 Profil du changement de la moyenne des moindres carrés («Least Squares Mean») du VEMS (l) -45 min à 12 h au début du traitement, à la semaine 12, à la semaine 26 et à la semaine 52 (spirométries en série dans le sous-groupe)
Semaine 12
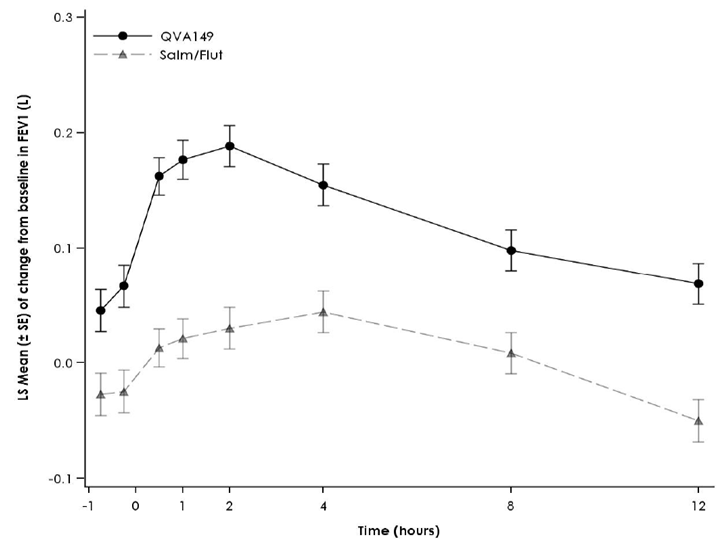
Semaine 26

Semaine 52
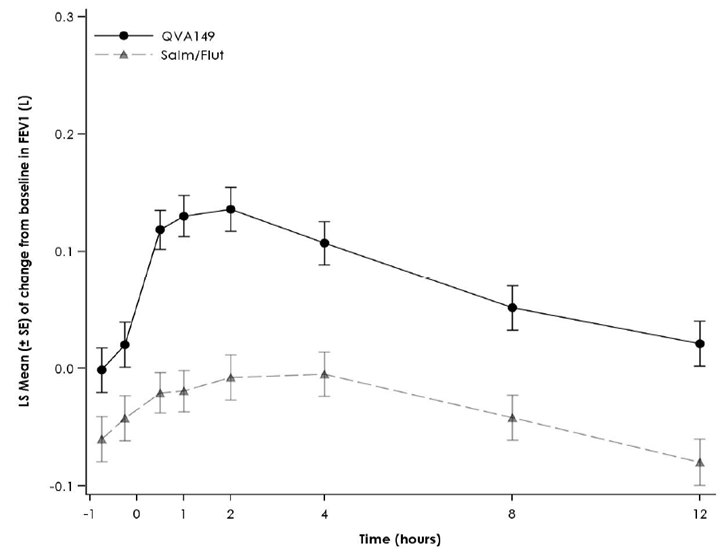
Résultats des traitements symptomatiques
Troubles respiratoires
Ultibro Breezhaler a provoqué une diminution significative des troubles respiratoires (mesurés par le Transitional Dyspnea Index, TDI). L'administration d'Ultibro Breezhaler a en particulier entraîné une amélioration statistiquement et cliniquement significative du score TDI focal à la semaine 26 par rapport au placebo (1.09, p < 0.001), au tiotropium en protocole ouvert (0.51, p = 0.007) [SHINE] et à salmétérol/fluticasone (0.76, p = 0.003) [ILLUMINATE].
Une proportion significativement plus importante de patients sous Ultibro Breezhaler a réagi à la semaine 26 par une amélioration d'au moins un point du TDI focal par rapport aux patients du groupe placebo (68.1% contre 57.5%, p = 0.004). De plus, une proportion significativement plus importante de patients sous Ultibro Breezhaler a obtenu une réponse cliniquement significative à la semaine 26 par rapport au groupe sous tiotropium en protocole ouvert (68.1% sous Ultibro Breezhaler vs 59.2% sous tiotropium, p = 0.016) et au groupe recevant l'association salmétérol/fluticasone (65.1% sous Ultibro Breezhaler vs 55.5% sous salmétérol/fluticasone, p = 0.088) [ILLUMINATE].
Qualité de vie liée à la santé
L'inhalation d'Ultibro Breezhaler une fois par jour a eu par ailleurs des effets statistiquement significatifs sur la qualité de vie liée à la santé, mesurée par le SGRQ (St. George's Respiratory Questionnaire), comme l'a montré la diminution du score SGRQ global à la semaine 26 par rapport au placebo (-3.01, p = 0.002). Dans l'étude [FLAME], Ultibro Breezhaler a entraîné une diminution du score SGRQ global à la semaine 52 par rapport à l'association salmétérol/fluticasone (-1.3).
Parmi les patients sous Ultibro Breezhaler, une proportion plus importante de patients traités a bénéficié d'une amélioration cliniquement significative du score SGRQ (définie comme une réduction d'au moins 4 unités par rapport au score initial), comme on l'a constaté à la semaine 26 par rapport au placebo (63.7% resp. 56.6%, p = 0.088). Dans l'étude [FLAME], Ultibro Breezhaler a entraîné une amélioration cliniquement significative du score SGRQ à la semaine 52 par rapport à l'association salmétérol/fluticasone (49.2% sous Ultibro Breezhaler contre 43.7% sous salmétérol/fluticasone, OU: 1.30) [FLAME].
Activités quotidiennes
Sur 26 semaines, Ultibro Breezhaler a apporté une amélioration numérique du pourcentage de «jours où il était possible d'effectuer les activités quotidiennes habituelles» (8.45%, p < 0.001) par rapport au glycopyrronium (1.87; p = 0.195).
Exacerbations de la BPCO
Dans l'étude [SPARK], Ultibro Breezhaler administré à raison d'une inhalation par jour durant 64 semaines a diminué le taux des exacerbations modérées à sévères de BPCO de 12% par rapport au glycopyrronium (p = 0.038).
Ultibro Breezhaler a réduit le taux des exacerbations de BPCO de tous les degrés de sévérité (légères, modérées et sévères) de 15% par rapport au glycopyrronium (p = 0.001).
En ce qui concerne le temps écoulé jusqu'à la survenue de la première exacerbation modérée ou sévère de la BPCO, Ultibro Breezhaler en a réduit le risque de 7% (p = 0.319) par rapport au glycopyrronium.
L'étude sur 52 semaines contrôlée contre substance active [FLAME], au cours de laquelle les patients ont reçu Ultibro Breezhaler une fois par jour, a atteint son objectif principal, à savoir la non-infériorité pour toutes les exacerbations de la BPCO (légères, modérées ou sévères) par rapport à l'association salmétérol/fluticasone. Le taux annuel des exacerbations de tous les degrés de sévérité (légères, modérées et sévères) a été inférieur de 11% sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone (3.59 contre 4.03, p = 0.003) et le délai jusqu'au premier épisode d'exacerbation a été prolongé de 16% (délai médian: 71 jours sous Ultibro Breezhaler contre 51 jours sous l'association salmétérol/fluticasone).
Le taux annuel des exacerbations modérées ou sévères a été inférieur de 17% sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone (0.98 contre 1.19) et le délai jusqu'au premier épisode d'exacerbation modérée ou sévère a été prolongé avec une réduction de 22% du risque d'exacerbation (25e percentile: 127 jours pour Ultibro Breezhaler contre 87 jours pour l'association salmétérol/fluticasone, p < 0.001). Moins de 50% des patients du groupe traité par Ultibro Breezhaler ont présenté une exacerbation. C'est pourquoi le délai jusqu'au premier épisode d'exacerbation modérée ou sévère de la BPCO a été calculé à la place pour le premier quartile des patients.
Ultibro Breezhaler a tendanciellement diminué le taux annuel des exacerbations sévères par rapport à l'association salmétérol/fluticasone (0.15 contre 0.17). Ultibro Breezhaler a prolongé le délai jusqu'au premier épisode d'exacerbation sévère avec une réduction de 19% du risque d'exacerbation.
L'incidence des pneumonies (confirmées radiologiquement, p.ex. par des radiographies ou un CTscan du thorax) a été de 3.2% dans le bras d'étude sous Ultibro Breezhaler contre 4.8% dans le bras d'étude sous salmétérol/fluticasone. Le délai jusqu'à l'apparition de la première pneumonie a été prolongé sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone.
Utilisation de médicaments d'urgence
Ultibro Breezhaler une fois par jour a entraîné dans l'étude [SHINE] sur 26 semaines une diminution significative de l'utilisation des médicaments d'urgence (salbutamol) de 0.96 bouffée par jour (p < 0.001) par rapport au placebo et de 0.54 bouffée par jour (p < 0.001) par rapport au tiotropium en protocole ouvert, ainsi que de 0.39 bouffée par jour (p = 0.019) par rapport à l'association salmétérol/fluticasone dans l'étude [ILLUMINATE].
Dans l'étude [SPARK], Ultibro Breezhaler a diminué de 0.76 bouffée par jour (p < 0.001) l'utilisation des médicaments d'urgence (salbutamol) par rapport au tiotropium en protocole ouvert sur 64 semaines.
Au cours de 52 semaines, l'utilisation d'Ultibro Breezhaler une fois par jour a diminué les besoins en médicaments d'urgence de 1.01 bouffée par jour par rapport au début du traitement, tandis que l'association salmétérol/fluticasone a diminué le recours à ces derniers de 0.76 bouffée par jour par rapport au début du traitement.
Tolérance à l'effort
Au cours de l'étude sur 3 semaines [BRIGHT] visant à tester la tolérance à l'effort lors d'un effort sous-maximal (75%) sur bicyclette ergométrique (test de tolérance à l'effort sous-maximal), Ultibro Breezhaler à raison d'une dose matinale a diminué l'hyperinflation dynamique et amélioré l'endurance dès la première dose. Dès le premier jour de traitement, la capacité inspiratoire durant l'effort a été significativement améliorée (250 ml, p < 0.001) par rapport au placebo. En comparaison avec le placebo, la capacité inspiratoire a continué à s'améliorer après trois semaines de traitement par Ultibro Breezhaler (320 ml, p < 0.001), de même que l'endurance (durée d'effort 59.5 secondes, p = 0.006).
PharmacocinétiqueAbsorption
Après l'inhalation d'Ultibro Breezhaler, le délai moyen jusqu'à l'obtention des concentrations plasmatiques maximales d'indacatérol et de glycopyrronium était d'environ 15 minutes et 5 minutes, respectivement.
La concentration d'indacatérol à l'état d'équilibre (steady state) après l'inhalation de 110/50 µg d'Ultibro Breezhaler était soit comparable, soit légèrement inférieure aux concentrations systémiques mesurées après l'inhalation de 150 µg d'indacatérol en monothérapie.
La biodisponibilité absolue de l'indacatérol après l'inhalation de 110/50 µg d'Ultibro Breezhaler se situait entre 47% et 66%, celle du glycopyrronium étant d'environ 40%.
La concentration de glycopyrronium à l'état d'équilibre (steady state) après l'inhalation de 110/50 µg d'Ultibro Breezhaler correspondait dans l'ensemble aux concentrations systémiques observées après l'inhalation de 50 µg de glycopyrronium en monothérapie.
Indacatérol
Après l'inhalation d'une dose unique ou de doses répétées d'indacatérol, la concentration maximale d'indacatérol dans le sérum était obtenue après environ 15 minutes en moyenne.
Les concentrations sériques d'indacatérol augmentaient après des inhalations répétées une fois par jour. L'état d'équilibre (steady state) a été atteint après environ 12 à 15 jours. Le taux d'accumulation moyen de l'indacatérol, autrement dit la valeur de l'AUC mesurée au cours de l'intervalle posologique de 24 heures au jour 14 ou 15 par rapport au jour 1, était de 2.9 à 3.8 pour des doses journalières inhalées de 75 µg à 600 µg.
Glycopyrronium
Après l'inhalation orale avec l'inhalateur de glycopyrronium, le glycopyrronium était rapidement absorbé et la concentration maximale dans le plasma était atteinte 5 minutes après l'inhalation.
Environ 90% de la concentration systémique après l'inhalation repose sur une absorption pulmonaire et 10% sur une absorption gastro-intestinale. La biodisponibilité absolue du glycopyrronium administré par voie orale est estimée à environ 5%.
Après des doses répétées à raison d'une inhalation par jour de glycopyrronium chez des patients atteints de BPCO, l'état d'équilibre (steady state) pharmacocinétique a été atteint en l'espace d'une semaine de traitement. Les valeurs moyennes des concentrations plasmatiques maximales et résiduelles de glycopyrronium à des doses de 50 µg une fois par jour étaient de respectivement 166 pg/ml et 8 pg/ml à l'état d'équilibre. Sous des doses de 100 et 200 µg une fois par jour, la concentration de glycopyrronium à l'état d'équilibre (steady state) (AUC mesurée entre deux doses) était environ 1.4 à 1.7 fois plus élevée qu'après la première dose. Des données comparatives sur l'élimination urinaire à l'état d'équilibre ou après la première dose permettent de conclure que l'accumulation systémique dans la plage posologique de 25 à 200 µg est indépendante des doses.
Distribution
Indacatérol
Après perfusion intraveineuse, le volume de distribution (Vz) de l'indacatérol était de 2.361 à 2.557 litres, ce qui indique une distribution importante. La liaison aux protéines sériques et plasmatiques humaines in vitro était de 94.1 à 95.3% resp. 95.1 à 96.2%.
Glycopyrronium
Après perfusion intraveineuse, le volume de distribution à l'état d'équilibre (Vss) du glycopyrronium était de 83 litres et le volume de distribution dans la phase terminale (Vz) était de 376 litres. Le volume de distribution apparent dans la phase terminale après inhalation (Vz/F) était de 7310 litres, ce qui traduit l'élimination beaucoup plus lente de la substance après l'inhalation. La liaison du glycopyrronium aux protéines sériques et plasmatiques humaines in vitro était de 38% à 41% pour des concentrations de 1 à 10 ng/ml. Ces concentrations étaient au moins 6 fois plus élevées que les pics de concentration plasmatiques moyens atteints à l'état d'équilibre (steady state) avec le schéma posologique de 50 µg une fois par jour.
Métabolisme
Indacatérol
Après l'administration orale d'indacatérol marqué par isotope radioactif dans une étude d'ADME (absorption, distribution, métabolisme, élimination) chez l'homme, on a principalement trouvé dans le sérum de l'indacatérol sous forme inchangée, représentant environ un tiers de l'AUC totale du médicament sur 24 heures. Le principal métabolite retrouvé dans le sérum était un dérivé hydroxylé. Les autres métabolites fréquents de l'indacatérol étaient des O-glycuroconjugués phénoliques et l'indacatérol hydroxylé. Les autres métabolites identifiés étaient un diastéréomère du dérivé hydroxylé, un N-glycuroconjugué de l'indacatérol et des produits C- et N-désalkylés.
Des essais in vitro ont montré que l'UGT1A1 est la seule isoforme d'UGT ayant métabolisé l'indacatérol en O-glycuroconjugué phénolique. Les métabolites oxydatifs ont été mis en évidence dans des incubations avec les CYP1A1, CYP2D6 et CYP3A4 recombinants. Le CYP3A4 est considéré comme l'isoenzyme la plus importante dans l'hydroxylation de l'indacatérol. Des essais in vitro ont aussi montré que l'indacatérol est un substrat à faible affinité de la pompe d'efflux Pgp.
Glycopyrronium
Les études du métabolisme in vitro ont mis en évidence des voies métaboliques comparables chez l'animal et chez l'homme pour le bromure de glycopyrronium. On n'a pas trouvé de métabolites uniquement propres à l'homme. Une hydroxylation conduit à la formation de différents métabolites mono- et dihydroxylés et une hydrolyse directe conduit à la formation d'un dérivé de l'acide carboxylique (M9).
Les études in vitro ont montré que plusieurs isoenzymes du CYP contribuent à la biotransformation oxydative du glycopyrronium. L'hydrolyse en M9 est probablement catalysée par des cholinestérases.
Après inhalation, les concentrations systémiques du M9 étaient en moyenne du même ordre de grandeur qu'après l'administration de la substance active de base. Comme les essais in vitro n'indiquent pas de métabolisme pulmonaire et que la présence du M9 dans la circulation à la suite d'une administration intraveineuse était peu importante (environ 4% de la Cmax et de l'AUC de la substance de base), on admet que le M9 est formé par hydrolyse présystémique de la fraction avalée de la dose de bromure de glycopyrronium inhalée et/ou à la suite d'un métabolisme de premier passage. Après inhalation, comme après administration intraveineuse, on n'a retrouvé que des quantités infimes de M9 dans les urines (soit ≤0.5% de la dose administrée). Des glycuroconjugués et/ou des sulfoconjugués du glycopyrronium ont été trouvés dans l'urine chez l'homme après inhalations répétées; ils correspondaient à environ 3% de la dose administrée.
Les essais d'inhibition in vitro suggèrent que le bromure de glycopyrronium n'a pas de propriété significative d'inhibition des CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 et CYP3A4/5, des transporteurs d'efflux MDR1, MRP2 et MXR, ni des transporteurs d'influx OATP1B1, OATP1B3, OAT1, OAT3, OCT1 et OCT2. Les essais d'induction enzymatique in vitro n'ont pas montré d'induction cliniquement significative de l'une des isoenzymes du cytochrome P450 testées, ni de l'UGT1A1, ni des transporteurs MDR1 et MRP2 par le bromure de glycopyrronium.
Élimination
Indacatérol
Dans les essais cliniques qui prévoyaient entre autres le prélèvement d'échantillons d'urine, la quantité d'indacatérol éliminé sous forme inchangée dans l'urine était en règle générale inférieure à 2% de la dose administrée. La clairance rénale moyenne de l'indacatérol était située entre 0.46 et 1.20 l/h. Compte tenu du fait que la clairance sérique de l'indacatérol est de 18.8 à 23.3 l/h, la clairance rénale joue manifestement un rôle secondaire dans l'élimination de l'indacatérol disponible au niveau systémique (environ 2 à 6% de la clairance systémique).
Dans une étude ADME menée chez des patients ayant reçu de l'indacatérol par voie orale, l'élimination par les fèces a prédominé sur l'élimination par voie urinaire. L'indacatérol éliminé chez l'homme par les fèces a principalement été excrété sous forme de substance native inchangée (54% de la dose) et dans une moindre mesure sous forme de métabolites hydroxylés de l'indacatérol (23% de la dose). Le bilan des masses était équilibré avec la présence de ≥90% de la dose dans les excréments.
Les concentrations sériques de l'indacatérol ont diminué selon un mode multiphasique avec une demi-vie terminale moyenne comprise entre 45.5 et 126 heures. La demi-vie effective calculée à partir de l'accumulation de l'indacatérol après des administrations répétées était située entre 40 et 56 heures. Cela est en accord avec le temps mesuré pour atteindre l'état d'équilibre (steady state), qui était de 12 à 15 jours.
Glycopyrronium
Après l'administration intraveineuse de bromure de glycopyrronium marqué au [3H], on a mesuré chez des sujets humains une élimination urinaire moyenne de la radioactivité en 48 heures correspondant à 85% de la dose. 5% de la dose ont en outre été retrouvés dans la bile. Le bilan des masses était donc presque équilibré.
L'élimination rénale de la substance de base représente environ 60 à 70% de la clairance totale du glycopyrronium disponible au niveau systémique, tandis que la clairance extrarénale représente environ 30 à 40%. Bien que la clairance biliaire contribue à la clairance extrarénale, la clairance extrarénale est probablement due en grande partie au métabolisme.
Après l'inhalation de doses monoquotidiennes uniques et répétées comprises entre 50 et 200 µg de glycopyrronium par des volontaires sains et des patients présentant une BPCO, la clairance rénale moyenne du glycopyrronium se situait entre 17.4 et 24.4 litres/h. Une sécrétion tubulaire active contribue à l'élimination rénale du glycopyrronium. Jusqu'à 20% de la dose ont été retrouvés dans l'urine sous forme de substance de base.
Les concentrations plasmatiques du glycopyrronium ont diminué de manière multiphasique. La demi-vie d'élimination terminale moyenne était beaucoup plus longue après inhalation (33 à 57 heures) qu'après injection intraveineuse (6.2 heures) et prise orale (2.8 heures). Le profil d'élimination permet de conclure qu'une absorption pulmonaire persistante a lieu et/ou que le glycopyrronium passe dans la circulation systémique à partir de 24 heures après l'inhalation.
Linéarité/non-linéarité
Indacatérol
Sous des doses croissantes (150 µg à 600 µg), l'exposition systémique à l'indacatérol a augmenté de manière dose-dépendante. L'exposition systémique est le résultat conjoint de l'absorption pulmonaire et intestinale.
Glycopyrronium
Chez les patients présentant une BPCO, les concentrations systémiques et l'élimination urinaire totale du glycopyrronium ont augmenté à peu près proportionnellement aux doses sur une plage posologique allant de 50 µg à 200 µg.
Cinétique pour certains groupes de patients
Une analyse pharmacocinétique de population des données de patients présentant une BPCO après inhalation d'Ultibro Breezhaler a montré que l'âge, le sexe et la masse maigre n'exercent pas d'influence significative sur les concentrations systémiques de l'indacatérol et du glycopyrronium. La masse maigre (fonction du poids et de la taille) a été identifiée comme covariable. Il y avait une corrélation négative entre la concentration systémique et la masse maigre (ou le poids corporel); compte tenu de l'ordre de grandeur des changements et de la précision prédictive de la masse maigre, on ne recommande néanmoins pas d'ajustement de la dose.
Le tabagisme et la valeur initiale du VEMS n'ont eu aucune influence manifeste sur les concentrations systémiques de l'indacatérol et du glycopyrronium après l'inhalation d'Ultibro Breezhaler.
Indacatérol
Selon une analyse de population des effets de l'âge, du sexe et du poids sur la concentration systémique chez des patients présentant une BPCO après inhalation, l'indacatérol peut être utilisé sans crainte à la dose recommandée dans tous les groupes d'âge et de poids et indépendamment du sexe.
La pharmacocinétique de l'indacatérol a été examinée avec deux génotypes UGT1A1 distincts: le génotype [(TA)6, (TA)6] parfaitement fonctionnel et le génotype [(TA)7, (TA)7] faiblement actif (génotype du syndrome de Gilbert). Cette étude a montré que l'AUC et la Cmax de l'indacatérol à l'état d'équilibre (steady state) étaient 1.2 fois supérieures en présence du génotype [(TA)7, (TA)7], ce qui laisse entendre que la concentration systémique de l'indacatérol n'est pas influencée significativement par le génotype UGT1A1.
Glycopyrronium
Une analyse pharmacocinétique de population des données de patients présentant une BPCO a identifié le poids corporel et l'âge comme étant des facteurs contribuant à la variabilité interindividuelle des concentrations systémiques. Le glycopyrronium à raison de 50 µg une fois par jour peut être administré à la dose recommandée dans tous les groupes d'âge et de poids corporel.
Le sexe, un tabagisme et la valeur initiale du VEMS n'ont eu aucune influence manifeste sur l'exposition systémique.
Patients présentant une insuffisance hépatique
Sur la base des caractéristiques pharmacocinétiques cliniques de ses composants administrés en monothérapie, Ultibro Breezhaler peut être administré à la dose recommandée aux patients souffrant d'une insuffisance hépatique légère à modérée. On ne dispose d'aucune donnée sur les patients en insuffisance hépatique sévère.
Indacatérol: chez les patients présentant une insuffisance hépatique légère à modérée, la Cmax ou l'AUC de l'indacatérol n'étaient pas modifiées de façon significative. Concernant la liaison aux protéines, aucune différence n'a été observée entre les patients présentant une insuffisance hépatique légère à modérée et les témoins sains. Aucune étude n'a été réalisée chez les patients présentant une insuffisance hépatique sévère.
Glycopyrronium: aucune étude clinique n'a été réalisée chez des patients présentant une insuffisance hépatique. Le glycopyrronium est essentiellement éliminé de la circulation systémique par excrétion rénale (voir «Pharmacocinétique»). Une inhibition du métabolisme hépatique du glycopyrronium ne devrait pas entraîner une augmentation cliniquement significative de l'exposition systémique.
Patients présentant une insuffisance rénale
Sur la base des caractéristiques pharmacocinétiques cliniques de ses composants administrés en monothérapie, Ultibro Breezhaler peut être administré à la dose recommandée aux patients souffrant d'une insuffisance rénale légère à modérée. Chez les patients présentant une insuffisance rénale sévère ou chez les patients présentant une insuffisance rénale terminale nécessitant une dialyse, Ultibro Breezhaler ne doit être utilisé que si le bénéfice attendu est supérieur au risque potentiel du traitement.
Indacatérol: compte tenu de la faible importance de l'élimination urinaire par rapport à l'élimination totale de l'indacatérol de l'organisme, aucun essai n'a été conduit chez les patients présentant une insuffisance rénale.
Glycopyrronium: les concentrations systémiques du glycopyrronium sont influencées par une insuffisance rénale. Une augmentation modérée de la concentration systémique totale (AUC last) de jusqu'à 1.4 fois la valeur de base a été observée chez les patients présentant une insuffisance rénale légère à modérée. Chez les patients présentant une insuffisance rénale sévère ou terminale, l'augmentation observée était d'un facteur allant jusqu'à 2.2. Une analyse pharmacocinétique de population a montré que le glycopyrronium peut être utilisé à la dose recommandée chez les patients atteints d'une BPCO présentant une insuffisance rénale légère ou modérée (débit de filtration glomérulaire estimé eGFR ≥30 ml/min/1.73 m2).
Origine ethnique
Ultibro Breezhaler: après ajustement à la masse maigre, on n'a pas observé d'incidence statistiquement significative de l'appartenance ethnique (japonais versus non-japonais) sur les concentrations des deux composants.
Indacatérol: on n'a pas observé de différences entre les différents sous-groupes ethniques. On ne dispose que d'une expérience très limitée concernant le traitement de populations noires.
Glycopyrronium: on n'a pas observé de différences significatives, du point de vue de l'exposition systémique totale (AUC), entre des sujets japonais et caucasiens. On ne dispose pas de données pharmacocinétiques suffisantes pour d'autres groupes ethniques ou races.
Données précliniquesUn programme d'études toxicologiques de liaison portant sur Ultibro Breezhaler a comporté des études pharmacologiques de sécurité in vitro et in vivo, des études de toxicité après 2 semaines d'inhalations chez le rat et le chien, une étude de toxicité après 13 semaines d'inhalations chez le chien et une étude du développement embryo-fœtal chez le rat avec des administrations par inhalation. Dans les études pharmacologiques sur la sécurité cardiovasculaire ou sur la toxicité après des administrations répétées chez le chien, on a observé une accélération de la fréquence cardiaque après l'administration de chaque monothérapie et d'Ultibro Breezhaler. L'ordre de grandeur et la durée des effets d'Ultibro Breezhaler sur la fréquence cardiaque ont augmenté de façon additive par rapport aux modifications observées avec chacun des composants isolés. Dans l'étude de toxicité sur 2 semaines chez le chien, les doses d'indacatérol les plus fortes administrées en monothérapie ou en association dans Ultibro Breezhaler étaient associées, chez certains animaux, à une incidence et une sévérité comparables des lésions au niveau du muscle papillaire cardiaque. Après l'administration d'Ultibro Breezhaler dans le cadre de l'étude pharmacologique chez le chien visant à tester la sécurité cardiovasculaire, on a par ailleurs observé des raccourcissements de l'intervalle PR, de l'onde P et de l'intervalle QT, reflétant une augmentation de la fréquence cardiaque et une réduction de la pression systolique et diastolique. Une estimation de la limite de sécurité se fonde sur des lésions du muscle papillaire cardiaque de chiens, en tant qu'espèce la plus sensible. La DSENO (dose sans effet nocif observé) de 0.386/0.125 mg/kg/jour (indacatérol/glycopyrronium) dans l'étude de toxicité de 13 semaines n'était pas associé à des lésions cardiaques. Sur la base des valeurs moyennes de l'AUC 0–24 heures, cette valeur correspond aux concentrations systémiques de chacune des deux substances, qui sont environ respectivement 64 et 59 fois plus élevées qu'en cas d'administration de 110/50 µg (indacatérol/glycopyrronium) chez l'homme.
Informations concernant l'indacatérol
Les données non cliniques issues des études conventionnelles sur la pharmacologie de sécurité, sur la toxicité d'administrations répétées, sur la génotoxicité, sur le potentiel carcinogène et sur la toxicité pour la reproduction n'ont pas révélé de risque particulier pour l'homme. Les effets de l'indacatérol observés lors des études de toxicité chez le chien concernaient essentiellement le système cardiovasculaire et comprenaient des tachycardies, des arythmies et des lésions du myocarde. Ces complications sont des effets pharmacologiques connus, découlant des propriétés bêta2- agonistes de l'indacatérol. Durant une étude de toxicité chronique chez le chien, on a mesuré des augmentations des concentrations de créatinine dans le sang, mais ni cette étude, ni d'autres études n'ont donné d'autres résultats suggérant une influence quelconque sur la fonction rénale. Parmi les effets significatifs observés durant les études de toxicité après administrations répétées, une légère irritation des voies aériennes supérieures chez le rat a en outre été relevée, notamment une rhinite et des modifications de l'épithélium de la cavité nasale et du larynx. Tous ces signes n'ont été observés que pour des concentrations qui dépassaient de manière suffisante les concentrations maximales utilisées chez l'homme, et n'ont donc qu'une importance limitée pour l'utilisation dans la pratique clinique.
Des effets indésirables concernant la fertilité, la grossesse, le développement embryonnaire/fœtal et le développement pré- et postnatal n'ont été observés que pour des doses dépassant de plus de 500 fois la dose journalière maximale de 150 µg recommandée pour l'inhalation chez l'homme (sur la base de l'AUC 0–24 heures). Ces effets, à savoir une augmentation de la fréquence de survenue de modifications squelettiques, ont été rapportés chez le lapin. Chez le rat ou le lapin, l'indacatérol n'était pas tératogène après administration sous-cutanée. Les études de génotoxicité n'ont pas fourni d'indices suggérant un potentiel mutagène ou clastogène. Le potentiel carcinogène de l'indacatérol a été testé dans le cadre d'une étude sur 2 ans avec des administrations par inhalation menée chez le rat et dans une étude sur 26 semaines menée chez des souris transgéniques. Chez les femelles de rats, l'administration à vie de doses environ 30 fois supérieures à la dose journalière de 150 µg (sur la base de l'AUC 0–24 heures) recommandée chez l'homme a entraîné une augmentation de la fréquence des léiomyomes ovariens bénins et de l'hyperplasie focale de la musculature lisse ovarienne. Une augmentation similaire de l'incidence des léiomyomes dans le tractus génital des femelles de rats a également été observée avec d'autres agonistes bêta2adrénergiques. Chez des souris CB6F1/TgrasH2 hémizygotes, l'administration orale de doses d'indacatérol environ 103 fois supérieures à la dose de 150 µg une fois par jour (sur la base de l'AUC 0–24 heures) utilisée par des patients pendant 26 semaines n'a révélé aucun effet tumorigénique.
Informations concernant le glycopyrronium
Les données non cliniques issues des études conventionnelles sur la pharmacologie de sécurité, sur la toxicité d'administrations répétées, sur la génotoxicité, sur le potentiel carcinogène, et sur la toxicité pour la reproduction et pour le développement n'ont pas révélé de risque particulier pour l'homme.
Les effets observés lors des études de toxicité après des inhalations répétées ont pu être attribués à une amplification des effets pharmacologiques attendus du glycopyrronium ou à une légère irritation locale, par exemple des augmentations légères à modérées de la fréquence cardiaque chez le chien et plusieurs modifications réversibles associées à une réduction des sécrétions des glandes salivaires et lacrymales, ainsi que des glandes de Harder et du pharynx chez le rat et le chien. Dans les essais chroniques, des opacifications du cristallin ont également été observées chez le rat avec d'autres antagonistes muscariniques; celles-ci sont cependant considérées comme des altérations spécifiques de l'espèce et sont d'une importance limitée pour les patients dans le contexte thérapeutique. Les modifications dégénératives/régénératives au niveau des voies respiratoires et les inflammations des cavités nasales et du larynx observées chez le rat correspondent à une légère irritation locale. De minimes lésions épithéliales de la zone de transition broncho-alvéolaire dans le poumon ont aussi été relevées chez le rat et sont considérées comme un légère réaction d'adaptation. Toutes ces observations ont été faites lors de l'utilisation de concentrations dépassant dans une mesure suffisante les concentrations maximales utilisées chez l'homme et n'ont donc qu'une importance limitée dans la pratique clinique.
Les études de génotoxicité n'ont pas révélé de potentiel mutagène ni clastogène du glycopyrronium. Les études de carcinogénicité chez des souris transgéniques avec administration par voie orale et chez des rats avec administration par inhalation n'ont pas révélé de carcinogénicité à des concentrations systémiques (AUC 0–24 heures) environ 53 fois supérieures chez des souris et environ 75 fois supérieures chez des rats à la dose de 50 µg une fois par jour recommandée chez l'homme.
Les données publiées sur le glycopyrronium ne suscitent aucune inquiétude quant à la toxicité sur la reproduction. L'administration par voie inhalée de glycopyrronium n'a pas entraîné d'effet tératogène chez le rat ni chez le lapin. Les études de reproduction chez le rat et d'autres données issues de l'expérimentation animale ne suscitent aucune inquiétude quant à la fertilité des femelles ou des mâles ou quant au développement pré- ou postnatal.
Le glycopyrronium et ses métabolites n'ont pas passé de manière significative la barrière placentaire chez des souris, des lapines et des chiennes portantes. Le glycopyrronium (y compris ses métabolites) a été excrété dans le lait de rates allaitantes et y a atteint des concentrations jusqu'à 10 fois supérieures à celles mesurées dans le sang de l'animal allaitant.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine, à l'abri de l'humidité et ne pas conserver au-dessus de 25 °C. Les gélules d'Ultibro Breezhaler doivent toujours être conservées dans les plaquettes thermoformées pour être protégées de l'humidité et ne doivent en être retirées qu'immédiatement avant l'usage. Ne pas avaler les gélules.
Conserver Ultibro Breezhaler hors de portée des enfants.
Remarques concernant la manipulation
Vous trouverez des informations concernant l'administration et l'utilisation correctes du produit dans la rubrique «Posologie/Mode d'emploi». Des instructions détaillées pour l'utilisation figurent dans l'information destinée aux patients. On utilisera l'inhalateur du nouvel emballage avec chaque nouvelle prescription d'Ultibro Breezhaler.
Numéro d’autorisation63132 (Swissmedic).
PrésentationUltibro Breezhaler 110/50 µg d'indacatérol/glycopyrronium, poudre pour inhalation en gélules: emballage de 30 gélules, 1 inhalateur [B]
Ultibro Breezhaler 110/50 µg d'indacatérol/glycopyrronium, poudre pour inhalation en gélules: emballage de 90 gélules, 1 inhalateur [B]
Titulaire de l’autorisationNovartis Pharma Schweiz AG, Risch; domicile: 6343 Rotkreuz.
Mise à jour de l’informationMars 2021.
|



