Propriétés/EffetsCode ATC
R03AL04
Mécanisme d'action
Ultibro Breezhaler
Compte tenu des différences de mécanismes d'action entre l'indacatérol et le glycopyrronium, qui visent des récepteurs différents et agissent par des voies différentes pour produire la relaxation des petits muscles, les deux principes actifs produisent des effets synergiques lorsqu'ils sont administrés sous la forme combinée Ultibro Breezhaler.
Indacatérol
L'indacatérol est un agoniste bêta2-adrénergique d'«ultra» longue durée d'action destiné à une administration unique par jour. L'action pharmacologique des agonistes bêta2adrénergiques, y compris l'indacatérol, est au moins partiellement due à la stimulation de l'adénylcyclase intracellulaire, l'enzyme qui catalyse la transformation de l'adénosine triphosphate (ATP) en adénosine 3', 5' monophosphate cyclique (monophosphate cyclique). Une augmentation de la concentration d'AMP cyclique entraîne une relaxation de la musculature lisse des bronches.
Lors de l'inhalation, l'indacatérol agit localement au niveau du poumon comme un bronchodilatateur. Dans une bronche humaine isolée, l'effet de l'indacatérol est rapide et prolongé.
Les récepteurs bêta2-adrénergiques sont certes les récepteurs adrénergiques prédominants dans la musculature lisse des bronches, tandis que les récepteurs bêta1-adrénergiques prédominent au niveau du cœur chez l'homme; il n'en reste pas moins que l'on trouve également dans le cœur des récepteurs bêta2-adrénergiques où ils représentent 10% à 50% de l'ensemble des récepteurs adrénergiques. La fonction exacte des récepteurs bêta2-adrénergiques cardiaques n'est pas connue, mais leur présence laisse supposer que même les agonistes bêta2adrénergiques très sélectifs agissent sur le cœur.
Glycopyrronium
Le glycopyrronium est un antagoniste des récepteurs muscariniques (anticholinergique) de longue durée d'action administré par voie inhalée une fois par jour en traitement bronchodilatateur d'entretien dans la BPCO. Les nerfs parasympathiques sont les voies nerveuses bronchoconstrictrices les plus importantes des voies aériennes et le tonus cholinergique est la composante réversible centrale de l'obstruction des voies aériennes dans la BPCO. L'action du glycopyrronium repose sur un blocage de l'effet bronchoconstricteur de l'acétylcholine sur les cellules des muscles lisses des voies aériennes, ce qui entraîne une dilatation de ces dernières.
Des cinq sous-types de récepteurs muscariniques connus (M1–5), seuls les sous-types M1–3 ont une fonction physiologique bien définie dans le poumon humain. Le bromure de glycopyrronium est un antagoniste à forte affinité de ces trois sous-types de récepteurs muscariniques. Dans les essais de liaison compétitive, la substance a présenté une sélectivité 4 à 5 fois plus élevée pour les récepteurs M3 et M1 humains que pour les récepteurs M2 humains. L'action du bromure de glycopyrronium intervient rapidement, comme l'ont montré les paramètres cinétiques de l'association/dissociation aux récepteurs et le délai d'entrée en action après l'inhalation au cours des études cliniques.
La longue durée d'action s'explique probablement en partie par la persistance des concentrations de principe actif dans les poumons, comme le suggère la demi-vie d'élimination terminale prolongée du glycopyrronium à la suite de l'inhalation avec l'inhalateur de glycopyrronium par rapport à la demi-vie après une injection intraveineuse (voir «Pharmacocinétique»).
Pharmacodynamique
Effet pharmacodynamique primaire
L'effet de l'association d'indacatérol et de glycopyrronium dans Ultibro Breezhaler se manifeste rapidement, soit en l'espace de 5 minutes après l'inhalation. L'effet est resté constant sur toute la durée de l'intervalle posologique de 24 heures.
D'après les mesures en série du VEMS sur 24 heures, l'effet bronchodilatateur moyen après 26 semaines de traitement était de 0.32 litre, en comparaison avec le placebo. L'effet d'Ultibro Breezhaler était significativement plus puissant que celui de l'indacatérol, du glycopyrronium ou du tiotropium administrés seuls, en protocole ouvert (différence pour chacune des comparaisons: 0.11 litre), (groupe partiel avec réalisation d'une spirométrie sérielle).
Ni la comparaison avec le placebo, ni celle avec chacune des substances en monothérapie n'a suggéré le développement sous Ultibro Breezhaler d'une tachyphylaxie au cours du temps.
Effets pharmacodynamiques secondaires
Les effets indésirables systémiques des agonistes bêta2adrénergiques et des antagonistes des récepteurs muscariniques administrés par voie inhalée résultent d'une activation des récepteurs bêta2-adrénergiques systémiques et d'un blocage des récepteurs muscariniques à la suite de l'absorption des principes actifs. Le profil d'effets indésirables d'Ultibro Breezhaler a été examiné aussi bien chez des sujets sains que chez des patients atteints de BPCO.
Effets sur la fréquence cardiaque
Les effets sur la fréquence cardiaque ont été étudiés chez des volontaires sains après administration d'une dose unique d'Ultibro Breezhaler 440/200 µg, inhalée au cours de quatre étapes posologiques espacées d'une heure, et ils ont été comparés aux effets observés après administration d'un placebo, de 600 µg d'indacatérol, de 200 µg de glycopyrronium, ainsi que de 200 µg de salmétérol.
L'accélération ajustée au temps la plus importante de la fréquence cardiaque après l'inhalation d'Ultibro Breezhaler par rapport au placebo était de +5.69 battements/minute et le ralentissement le plus important était de -2.51 battements/minute. Globalement, on n'a pas observé d'effets pharmacodynamiques consistants sur la fréquence cardiaque sous Ultibro Breezhaler.
Les effets de doses suprathérapeutiques d'Ultibro Breezhaler sur la fréquence cardiaque ont été étudiés chez des patients présentant une BPCO et recevant des doses de 150/100, 300/100 et 600/100 µg. Ultibro Breezhaler n'a pas eu d'effet significatif sur la fréquence cardiaque après 30 minutes, 4 heures et 24 heures, ni sur la fréquence cardiaque moyenne sur 24 heures.
Intervalle QT
Une étude du QT approfondie (TQT) menée chez des volontaires sains ayant inhalé jusqu'à 600 µg d'indacatérol n'a pas montré d'effet cliniquement significatif sur l'intervalle QT. Au cours d'une étude TQT, on n'a pas non plus observé d'allongement de l'intervalle QT à la suite de l'inhalation de 400 µg de glycopyrronium.
Les effets d'Ultibro Breezhaler sur l'intervalle QTc ont été examinés chez des volontaires sains après l'inhalation d'une dose de 440/200 µg d'Ultibro Breezhaler en quatre étapes posologiques espacées d'une heure. La différence ajustée au temps la plus importante par rapport au placebo était de 4.62 ms (IC à 90% 0.40, 8.85 ms) et la diminution ajustée au temps la plus importante était de -2.71 ms (IC à 90% -6.97, 1.54 ms), ce qui suggère qu'Ultibro Breezhaler n'a aucun effet significatif sur l'intervalle QT, comme on pouvait s'y attendre sur la base des propriétés de ses composants.
L'administration de doses suprathérapeutiques comprises entre 150 µg/100 µg et 600 µg/100 µg d'Ultibro Breezhaler à des patients atteints de BPCO a entraîné un allongement de l'intervalle QTcF compris entre 30 et 60 ms par rapport à la valeur initiale (début de l'étude) chez une proportion plus importante de patients (de 16.0% à 21.6% par rapport à 1.9% sous placebo). Aucun allongement de l'intervalle QTcF supérieur à 60 ms par rapport à la valeur initiale n'a cependant été observé. La dose maximale de 600 µg/100 µg d'Ultibro Breezhaler était aussi associée à la plus forte proportion de valeurs absolues de QTcF supérieures à 450 ms (12.2% versus 5.7% sous placebo).
Kaliémie et glycémie
Chez les volontaires sains, les effets d'une dose de 440/200 µg d'Ultibro Breezhaler sur la kaliémie ont été très faibles (différence maximale de -0.14 mmol/l versus placebo). Le changement maximal de la glycémie a été de 0.67 mmol/l. Lors de la comparaison entre une dose de 440/200 µg d'Ultibro Breezhaler et une dose de 200 µg de salmétérol, les effets sur la kaliémie (différence maximale de 0.21 mmol/l) et sur la glycémie (différence maximale de 0.21, resp. 1.19 mmol/l) ont été plus faibles.
Efficacité clinique
Le programme de développement clinique de phase III d'Ultibro Breezhaler [IGNITE] a comporté six études auxquelles au total plus de 8000 patients ont participé: une étude sur 26 semaines, contrôlée contre placebo et substance active (150 µg d'indacatérol une fois par jour, 50 µg de glycopyrronium une fois par jour, 18 µg de tiotropium en protocole ouvert, une fois par jour) [SHINE]; une étude sur 26 semaines contrôlée contre substance active (500/50 µg de salmétérol/fluticasone deux fois par jour) [ILLUMINATE]; une étude sur 64 semaines contrôlée contre substance active (50 µg de glycopyrronium une fois par jour, 18 µg de tiotropium en protocole ouvert, une fois par jour) [SPARK]; une étude sur 52 semaines contrôlée contre placebo [ENLIGHTEN], et une étude de tolérance à l'effort sur trois semaines, contrôlée contre placebo et contre substance active (tiotropium en protocole ouvert, une fois par jour) [BRIGHT], ainsi qu'une étude sur 52 semaines contrôlée contre substance active (salmétérol/fluticasone 500/50 µg deux fois par jour) [FLAME].
Les participants étaient des patients ayant un diagnostic clinique de BPCO modérée à très sévère, âgés de 40 ans au moins et présentant une anamnèse de tabagisme d'au minimum 10 paquets-années. Dans ces 5 études, les sujets inclus dans [SHINE] et [ENLIGHTEN] avaient un VEMS post-bronchodilatateur < 80% et ≥30% de la valeur normale prédite et un rapport post-bronchodilatateur VEMS/CVF inférieur à 70%. L'étude sur 26 semaines contrôlée contre substance active [ILLUMINATE] a inclus des patients avec un VEMS post-bronchodilatateur < 80% et ≥40% de la valeur normale prédite, sans exacerbations modérées ou sévères au cours des 12 mois ayant précédé le début de l'étude. Dans l'étude sur 64 semaines [SPARK], les patients inclus présentaient par contre une BPCO sévère à très sévère, des antécédents d'au moins 1 épisode d'exacerbation modérée à sévère de la BPCO au cours de l'année écoulée, ainsi qu'un VEMS post-bronchodilatateur < 50% de la valeur normale prédite.
L'étude sur 52 semaines contrôlée contre substance active [FLAME] a inclus des patients présentant une BPCO modérée à très sévère, des antécédents d'au moins 1 épisode d'exacerbation modérée à sévère de la BPCO (19% avec des antécédents d'au moins 2 épisodes d'exacerbation) au cours de l'année écoulée, ainsi qu'un VEMS post-bronchodilatateur de ≥25 et < 60% de la valeur normale prédite.
Effets sur la fonction pulmonaire
L'inhalation de 110/50 µg d'Ultibro Breezhaler une fois par jour a entraîné des améliorations cliniquement significatives de la fonction pulmonaire (mesurée par le volume expiratoire maximal en une seconde [VEMS]). Dans les études de phase III, l'effet bronchodilatateur s'est produit dans les 5 minutes après la première dose et a persisté tout au long de l'intervalle posologique subséquent de 24 heures. Dans l'étude sur 26 semaines [SHINE] et dans l'étude sur 52 semaines [ENLIGHTEN], on n'a pas constaté d'atténuation de l'effet bronchodilatateur en fonction du temps.
VEMS résiduel
Dans l'étude [SHINE] le critère d'évaluation principal après 26 semaines, c'est-à-dire le VEMS résiduel post-dose, était augmenté de 200 ml par rapport au placebo (p < 0.001). L'augmentation était significative par rapport à chacun des groupes recevant l'un des composants (indacatérol et glycopyrronium) en monothérapie, ainsi que par rapport au groupe sous tiotropium en protocole ouvert (cf. tableau 1).
Tableau 1: VEMS résiduel post-dose (méthode de la moyenne des moindres carrés, «Least Squares Mean») au jour 1 et à la semaine 26 (critère d'évaluation principal)
|
Différence entre les traitements
|
Jour 1
|
Semaine 26
| |
ULTIBRO BREEZHALER - placebo
|
190 ml (p < 0.001)
|
200 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - indacatérol
|
80 ml (p < 0.001)
|
70 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - glycopyrronium
|
80 ml (p < 0.001)
|
90 ml (p < 0.001)
| |
ULTIBRO BREEZHALER - tiotropium, ouvert
|
80 ml (p < 0.001)
|
80 ml (p < 0.001)
|
Le VEMS moyen avant l'administration de la dose (moyenne des valeurs mesurées -45 min. et -15 min. avant la dose du matin du médicament de l'étude) était cliniquement significatif et statistiquement meilleur sous Ultibro Breezhaler à la semaine 26 par rapport à salmétérol/fluticasone (100 ml, p < 0.001) [ILLUMINATE], à la semaine 52 par rapport au placebo (189 ml, p < 0.001) [ENLIGHTEN] et lors de toutes les visites de contrôle jusqu'à la semaine 64 par rapport au glycopyrronium (70–80 ml, valeur de p < 0.001) et au tiotropium en protocole ouvert (60–80 ml, valeur de p < 0.001) [SPARK].
Dans l'étude [FLAME], le VEMS moyen avant l'administration de la dose était augmenté de façon cliniquement significative (62–86 ml) sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone pendant le traitement en double aveugle lors de toutes les visites jusqu'à la semaine 52.
AUC du VEMS
Dans l'étude contrôlée contre substance active [ILLUMINATE], Ultibro Breezhaler a provoqué une augmentation de 140 ml de l'AUC(0–12h) du VEMS post-dose (p < 0.001) (critère d'évaluation principal) après 26 semaines par rapport à l'association salmétérol/fluticasone.
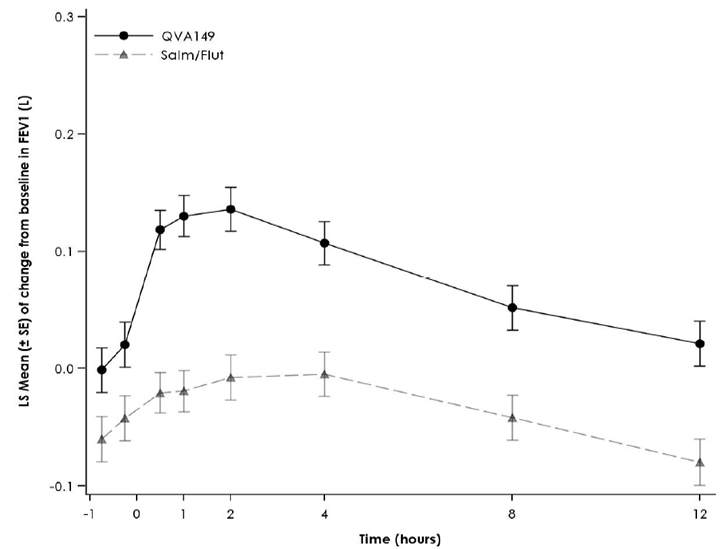
Des spirométries en série ont été réalisées dans un sous-groupe de patients de l'étude [FLAME]. Dans ce sous-groupe, Ultibro Breezhaler a entraîné une amélioration de l'AUC0–12h du VEMS de 110 ml après 52 semaines de traitement. Le groupe de patients traités par Ultibro Breezhaler a enregistré une amélioration dès le jour 1 par rapport à ceux du groupe salmétérol/fluticasone.
Figure 1 Profil du changement de la moyenne des moindres carrés («Least Squares Mean») du VEMS (l) -45 min à 12 h au début du traitement, à la semaine 12, à la semaine 26 et à la semaine 52 (spirométries en série dans le sous-groupe)
Semaine 12
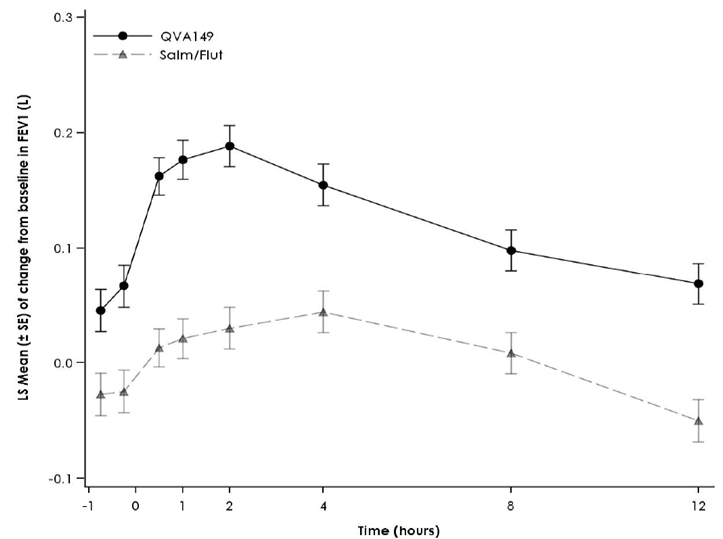
Semaine 26
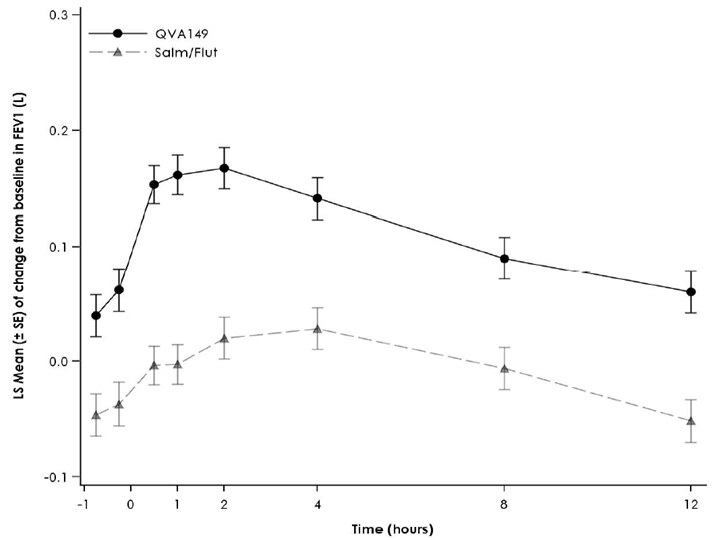
Semaine 52
Résultats des traitements symptomatiques
Troubles respiratoires
Ultibro Breezhaler a provoqué une diminution significative des troubles respiratoires (mesurés par le Transitional Dyspnea Index, TDI). L'administration d'Ultibro Breezhaler a en particulier entraîné une amélioration statistiquement et cliniquement significative du score TDI focal à la semaine 26 par rapport au placebo (1.09, p < 0.001), au tiotropium en protocole ouvert (0.51, p = 0.007) [SHINE] et à salmétérol/fluticasone (0.76, p = 0.003) [ILLUMINATE].
Une proportion significativement plus importante de patients sous Ultibro Breezhaler a réagi à la semaine 26 par une amélioration d'au moins un point du TDI focal par rapport aux patients du groupe placebo (68.1% contre 57.5%, p = 0.004). De plus, une proportion significativement plus importante de patients sous Ultibro Breezhaler a obtenu une réponse cliniquement significative à la semaine 26 par rapport au groupe sous tiotropium en protocole ouvert (68.1% sous Ultibro Breezhaler vs 59.2% sous tiotropium, p = 0.016) et au groupe recevant l'association salmétérol/fluticasone (65.1% sous Ultibro Breezhaler vs 55.5% sous salmétérol/fluticasone, p = 0.088) [ILLUMINATE].
Qualité de vie liée à la santé
L'inhalation d'Ultibro Breezhaler une fois par jour a eu par ailleurs des effets statistiquement significatifs sur la qualité de vie liée à la santé, mesurée par le SGRQ (St. George's Respiratory Questionnaire), comme l'a montré la diminution du score SGRQ global à la semaine 26 par rapport au placebo (-3.01, p = 0.002). Dans l'étude [FLAME], Ultibro Breezhaler a entraîné une diminution du score SGRQ global à la semaine 52 par rapport à l'association salmétérol/fluticasone (-1.3).
Parmi les patients sous Ultibro Breezhaler, une proportion plus importante de patients traités a bénéficié d'une amélioration cliniquement significative du score SGRQ (définie comme une réduction d'au moins 4 unités par rapport au score initial), comme on l'a constaté à la semaine 26 par rapport au placebo (63.7% resp. 56.6%, p = 0.088). Dans l'étude [FLAME], Ultibro Breezhaler a entraîné une amélioration cliniquement significative du score SGRQ à la semaine 52 par rapport à l'association salmétérol/fluticasone (49.2% sous Ultibro Breezhaler contre 43.7% sous salmétérol/fluticasone, OU: 1.30) [FLAME].
Activités quotidiennes
Sur 26 semaines, Ultibro Breezhaler a apporté une amélioration numérique du pourcentage de «jours où il était possible d'effectuer les activités quotidiennes habituelles» (8.45%, p < 0.001) par rapport au glycopyrronium (1.87; p = 0.195).
Exacerbations de la BPCO
Dans l'étude [SPARK], Ultibro Breezhaler administré à raison d'une inhalation par jour durant 64 semaines a diminué le taux des exacerbations modérées à sévères de BPCO de 12% par rapport au glycopyrronium (p = 0.038).
Ultibro Breezhaler a réduit le taux des exacerbations de BPCO de tous les degrés de sévérité (légères, modérées et sévères) de 15% par rapport au glycopyrronium (p = 0.001).
En ce qui concerne le temps écoulé jusqu'à la survenue de la première exacerbation modérée ou sévère de la BPCO, Ultibro Breezhaler en a réduit le risque de 7% (p = 0.319) par rapport au glycopyrronium.
L'étude sur 52 semaines contrôlée contre substance active [FLAME], au cours de laquelle les patients ont reçu Ultibro Breezhaler une fois par jour, a atteint son objectif principal, à savoir la non-infériorité pour toutes les exacerbations de la BPCO (légères, modérées ou sévères) par rapport à l'association salmétérol/fluticasone. Le taux annuel des exacerbations de tous les degrés de sévérité (légères, modérées et sévères) a été inférieur de 11% sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone (3.59 contre 4.03, p = 0.003) et le délai jusqu'au premier épisode d'exacerbation a été prolongé de 16% (délai médian: 71 jours sous Ultibro Breezhaler contre 51 jours sous l'association salmétérol/fluticasone).
Le taux annuel des exacerbations modérées ou sévères a été inférieur de 17% sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone (0.98 contre 1.19) et le délai jusqu'au premier épisode d'exacerbation modérée ou sévère a été prolongé avec une réduction de 22% du risque d'exacerbation (25e percentile: 127 jours pour Ultibro Breezhaler contre 87 jours pour l'association salmétérol/fluticasone, p < 0.001). Moins de 50% des patients du groupe traité par Ultibro Breezhaler ont présenté une exacerbation. C'est pourquoi le délai jusqu'au premier épisode d'exacerbation modérée ou sévère de la BPCO a été calculé à la place pour le premier quartile des patients.
Ultibro Breezhaler a tendanciellement diminué le taux annuel des exacerbations sévères par rapport à l'association salmétérol/fluticasone (0.15 contre 0.17). Ultibro Breezhaler a prolongé le délai jusqu'au premier épisode d'exacerbation sévère avec une réduction de 19% du risque d'exacerbation.
L'incidence des pneumonies (confirmées radiologiquement, p.ex. par des radiographies ou un CTscan du thorax) a été de 3.2% dans le bras d'étude sous Ultibro Breezhaler contre 4.8% dans le bras d'étude sous salmétérol/fluticasone. Le délai jusqu'à l'apparition de la première pneumonie a été prolongé sous Ultibro Breezhaler par rapport à l'association salmétérol/fluticasone.
Utilisation de médicaments d'urgence
Ultibro Breezhaler une fois par jour a entraîné dans l'étude [SHINE] sur 26 semaines une diminution significative de l'utilisation des médicaments d'urgence (salbutamol) de 0.96 bouffée par jour (p < 0.001) par rapport au placebo et de 0.54 bouffée par jour (p < 0.001) par rapport au tiotropium en protocole ouvert, ainsi que de 0.39 bouffée par jour (p = 0.019) par rapport à l'association salmétérol/fluticasone dans l'étude [ILLUMINATE].
Dans l'étude [SPARK], Ultibro Breezhaler a diminué de 0.76 bouffée par jour (p < 0.001) l'utilisation des médicaments d'urgence (salbutamol) par rapport au tiotropium en protocole ouvert sur 64 semaines.
Au cours de 52 semaines, l'utilisation d'Ultibro Breezhaler une fois par jour a diminué les besoins en médicaments d'urgence de 1.01 bouffée par jour par rapport au début du traitement, tandis que l'association salmétérol/fluticasone a diminué le recours à ces derniers de 0.76 bouffée par jour par rapport au début du traitement.
Tolérance à l'effort
Au cours de l'étude sur 3 semaines [BRIGHT] visant à tester la tolérance à l'effort lors d'un effort sous-maximal (75%) sur bicyclette ergométrique (test de tolérance à l'effort sous-maximal), Ultibro Breezhaler à raison d'une dose matinale a diminué l'hyperinflation dynamique et amélioré l'endurance dès la première dose. Dès le premier jour de traitement, la capacité inspiratoire durant l'effort a été significativement améliorée (250 ml, p < 0.001) par rapport au placebo. En comparaison avec le placebo, la capacité inspiratoire a continué à s'améliorer après trois semaines de traitement par Ultibro Breezhaler (320 ml, p < 0.001), de même que l'endurance (durée d'effort 59.5 secondes, p = 0.006).
|



