CompositionPrincipes actifs
Toxine botulique A.
Excipients
Albumine humaine, saccharose.
Indications/Possibilités d’emploiBocouture est utilisé pour améliorer temporairement l'apparence
·des rides verticales intersourcilières modérées à profondes (rides glabellaires) observées lors du froncement des sourcils et/ou
·des rides latérales périorbitaires modérées à profondes (pattes d'oie) visibles lors d'un sourire forcé
chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient.
Posologie/Mode d’emploiRemarques générales
Bocouture ne doit être administré que par des médecins formés au traitement à base de toxine botulique de type A.
En raison de différences entre les méthodes de test de la DL50, les dosages recommandés ci-après sont spécifiques à Bocouture et ne s'appliquent pas à d'autres préparations à base de toxine botulique de type A.
Bocouture est exclusivement destiné à une injection par voie intramusculaire après reconstitution. Pour plus d'informations sur la reconstitution et la dilution des flacons, voir «Remarques particulières, remarques concernant la manipulation».
Après reconstitution, Bocouture est injecté à l'aide d'une aiguille stérile fine (par exemple 30-33G/0,20-0,30 mm de diamètre/13 mm de long).
Afin d'assurer la traçabilité des médicaments biotechnologiques, il est recommandé de documenter le nom commercial et le numéro de lot à chaque traitement.
Posologie usuelle
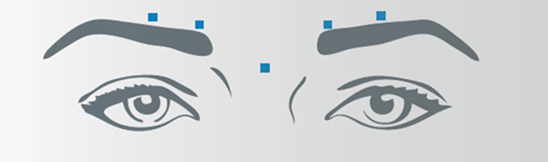
Rides verticales entre les sourcils (rides glabellaires)
Après la reconstitution de Bocouture, le volume d'injection recommandé de 0,1 ml (4 unités) est administré dans chacun des 5 sites d'injection: deux injections dans chaque muscle corrugator et une injection dans le muscle procerus. Cela correspond à une dose standard de 20 unités. Le médecin peut augmenter la dose jusqu'à 30 unités en fonction des besoins de chaque patient.
Une amélioration des rides verticales intersoucilières (rides glabellaires) survient généralement dans les 2 à 3 jours, l'effet maximal étant observé le 30e jour. L'effet peut persister jusqu'à 4 mois après l'injection.
Avant et pendant l'injection, appuyer le pouce et l'index fermement sous le rebord orbitaire afin d'éviter une diffusion de la solution dans cette zone. Pendant l'injection, l'aiguille doit être orientée vers le haut et vers la ligne médiane. Afin de réduire le risque de blépharoptôse, les injections à proximité du muscle releveur de la paupière supérieure et dans la portion crânienne du muscle orbiculaire des paupières doivent être évitées. Les injections dans le muscle corrugator doivent être effectuées dans la partie médiane de ce muscle, ainsi que dans la partie centrale du ventre musculaire, à au moins 1 cm au-dessus du bord osseux de l'arcade sourcilière.
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
Après la reconstitution de Bocouture, le volume d'injection recommandé de 0,1 ml (4 unités) est administré dans chacun des 3 sites d'injection de chaque côté. Une injection est réalisée à environ 1 cm sur le bord latéral de la cavité orbitaire. Les deux autres injections sont réalisées à env. 1 cm au-dessus et 1 cm en-dessous du premier point d'injection.

La dose totale habituellement recommandée par séance d'injection est de 12 unités par côté (soit une dose normale totale de 24 unités).
Une amélioration des rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé est généralement observée au cours des 6 premiers jours, avec un effet maximal au 30e jour. L'effet persiste jusqu'à 4 mois après l'injection.
Aucune donnée d'efficacité ou de sécurité du traitement des rides latérales périorbitaires observées lors d'un sourire forcé n'est actuellement disponible au-delà de deux cycles d'injection espacés de 4 mois.
Pour éviter la diffusion de Bocouture, les injections doivent être réalisées par voie intramusculaire au niveau des muscles orbiculaires, directement sous le derme. Les injections trop proches du muscle grand zygomatique doivent être évitées de manière à prévenir une ptôse de la lèvre.
Toutes les indications
Les intervalles entre deux séances de traitement ne doivent pas être inférieurs à 3 mois.
En cas d'absence d'amélioration un mois après la première séance d'injections, il y a lieu:
·d'analyser les causes de non-réponse, par exemple: dose insuffisante, mauvaise technique d'injection, formation éventuelle d'anticorps qui neutralisent la toxine botulique;
·de réévaluer la pertinence du traitement par la toxine botulique de type A;
·en l'absence d'effets indésirables lors de la première séance d'injections, de pratiquer une deuxième séance d'injections dans les conditions suivantes:
1.ajuster la dose en tenant compte de l'échec du traitement précédent;
2.respecter un intervalle minimal de 3 mois entre les 2 séances d'injections.
En cas d'échec du traitement, il y a lieu d'envisager d'autres méthodes de traitement.
Instructions posologiques particulières
Patients âgés
Les données des études cliniques de phase III chez des sujets de plus de 65 ans sont limitées. Jusqu'à ce que des études soient conduites dans ce groupe d'âge, l'utilisation de Bocouture chez des patients de plus de 65 ans n'est pas recommandée.
Enfants et adolescents
Bocouture n'ayant pas fait l'objet d'études pédiatriques, son utilisation est déconseillée chez les enfants et adolescents de moins de 18 ans, jusqu'à ce que des données supplémentaires soient disponibles.
Contre-indications·Hypersensibilité à la neurotoxine botulique de type A (150 kD) ou à l'un des composants du produit.
·Troubles généralisés de l'activité musculaire (p.ex. myasthénie grave, syndrome de Lambert-Eaton).
·Infection ou inflammation au point d'injection prévu.
Mises en garde et précautionsGénéralités
Avant toute administration de Bocouture, le médecin doit se familiariser avec l'anatomie du patient et avec toute modification anatomique consécutive à des traitements chirurgicaux antérieurs.
Si les points d'injection prévus sont marqués au stylo, le produit ne doit pas être injecté à travers les points marqués car ceci peut entraîner un effet de tatouage permanent.
Des précautions doivent être prises afin de s'assurer que Bocouture ne soit pas injecté dans un vaisseau sanguin.
Bocouture doit être utilisé avec précaution dans les cas suivants:
·en cas de troubles de la coagulation, de quelque sorte qu'ils soient
·chez les patients traités avec des anticoagulants ou d'autres substances ayant un effet anticoagulant
·chez les patients souffrant de sclérose latérale amyotrophique
·chez les patients présentant d'autres maladies provoquant des dysfonctions neuromusculaires périphériques
·en cas de faiblesse prononcée ou d'atrophie des muscles cibles.
Diffusion locale et à distance de l'effet de la toxine
Des effets indésirables liés à une injection mal placée de toxine botulique de type A peuvent temporairement paralyser les muscles situés à proximité.
On a signalé des effets indésirables qui pourraient être associés à la propagation de la toxine botulique de type A vers des sites éloignés du site d'application (voir chapitre «Effets indésirables»).
Maladies neuromusculaires préexistantes
Une faiblesse musculaire excessive peut apparaître, même chez les patients traités à des doses thérapeutiques. Chez les patients atteints de troubles neurologiques sous-jacents tels que des troubles de la déglutition, le risque d'apparition de ces effets indésirables est accru. Chez ces patients, le médicament doit être utilisé exclusivement sous la surveillance d'un spécialiste et uniquement si les bénéfices du traitement sont plus importants que ses risques.
Les patients ou leurs soignants doivent être informés de la nécessité de prévenir immédiatement les services d'urgence en cas de troubles de la déglutition, de la parole ou respiratoires.
L'injection de Bocouture est déconseillée chez les patients ayant des antécédents de dysphagie et de pneumopathie d'inhalation.
Réactions d'hypersensibilité
Des réactions d'hypersensibilité ont été signalées après l'administration de neurotoxine botulique de type A. En cas de réactions d'hypersensibilité graves (p.ex. anaphylaxie) et/ou immédiates, il convient de mettre en place un traitement médical approprié.
Formation d'anticorps
Des injections de neurotoxine botulique de type A trop fréquentes peuvent augmenter le risque de formation d'anticorps, susceptible d'induire un échec thérapeutique quand le produit est utilisé pour d'autres indications.
InteractionsAucune étude d'interaction n'a été menée.
En théorie, l'effet de la neurotoxine botulique de type A peut être potentialisé par l'utilisation d'antibiotiques aminoglycosides ou d'autres médicaments agissant sur la transmission neuromusculaire, tels que les myorelaxants de type tubocurarine. L'utilisation simultanée de Bocouture avec ces substances requiert donc des précautions particulières.
Les myorelaxants périphériques sont à utiliser avec précaution, au besoin en diminuant leur dose de départ ou en utilisant une substance à durée d'action moyenne comme le vécuronium ou l'atracurium plutôt que des substances ayant des effets prolongés.
Les amino-4-quinoléines peuvent atténuer l'effet de Bocouture.
Grossesse, allaitementGrossesse
Il n'existe pas de données suffisantes concernant l'emploi chez la femme enceinte.
Les expérimentations animales ont révélé une toxicité de reproduction (données plus précises sous la rubrique «Données précliniques»).
Le risque potentiel pour l'être humain n'est pas connu.
Bocouture ne doit donc pas être administré pendant la grossesse, à moins d'une nécessité absolue et si le bénéfice potentiel en justifie le risque.
Allaitement
On ignore à l'heure actuelle si la neurotoxine botulique de type A est excrétée dans le lait maternel. Bocouture ne doit donc pas être utilisé pendant l'allaitement.
Fécondité
Il n'existe pas de données cliniques concernant les effets de l'utilisation de Bocouture sur la fertilité. Aucun effet indésirable sur la fertilité mâle ou femelle n'a été observé dans les études sur les animaux (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude correspondante n'a été effectuée. Les patients doivent être informés qu'en cas de symptômes tels que fatigue, étourdissements, troubles de la vision, blépharoptôse, perte de tonus musculaire ou faiblesse musculaire, la capacité à conduire et à exécuter des tâches potentiellement dangereuses peut être limitée et qu'il convient donc d'éviter ce type d'activités.
Effets indésirablesGénéralités
Les effets indésirables surviennent généralement au cours de la première semaine suivant l'injection et sont transitoires. Ils peuvent être liés au principe actif, à la technique de l'injection ou aux deux.
Comme pour toute autre injection, des douleurs locales, inflammations, paresthésies, une hypoesthésie, une sensibilité à la pression, des gonflements/œdèmes, érythèmes, démangeaisons, infections locales, hématomes, saignements et/ou ecchymoses dus à l'injection peuvent survenir.
La douleur liée à l'injection et/ou la peur de l'injection peut induire une réponse vasovagale, y compris une hypotension symptomatique transitoire, des nausées, des acouphènes et des syncopes.
Une faiblesse musculaire localisée est un effet pharmacologique attendu de la toxine botulique type A.
Après le traitement de maladies neurologiques avec de la toxine botulinique, dans de très rares cas, des effets indésirables associés à la propagation de la toxine vers des sites éloignés du site d'injection ont été signalés, où les symptômes de l'effet de la toxine botulinique de type A sont les mêmes (faiblesse musculaire excessive, dysphagie, pneumopathie d'inhalation d'issue parfois fatale). Ces effets indésirables ne peuvent pas non plus être complètement exclus lors de l'administration de Bocouture.
Dans de rares cas, des réactions d'hypersensibilité graves et/ou immédiates aux préparations à base de toxine botulique ont été signalées, incluant anaphylaxie, maladie sérique, dyspnée, œdème des tissus mous et urticaire. Certaines de ces réactions ont été signalées après l'utilisation de préparations conventionnelles à base de complexe de neurotoxine botulique de type A uniquement ou en association avec d'autres substances connues pour déclencher des réactions similaires.
Effets indésirables après commercialisation
Depuis la mise sur le marché de Bocoutre, les effets indésirables suivants independament de l'indictaion ont été rapportés à une fréquence inconnue:
|
Classes de systèmes d'organes
|
Réactions indésirables
| |
Affection du système immunitaire
|
Réactions d'hypersensibilité telles que gonflement, œdème (y compris à distance du site d'injection), érythème, prurit, rash cutané (localisé ou généralisé) et des difficultés respiratoires
| |
Affections musculo-squelettiques et du tissu conjonctif
|
Atrophie musculaire
| |
Troubles généraux et anomalies au site d'administration
|
Syndromes pseudo-grippaux
|
Effets indésirables rapportés dans les études cliniques
La fréquence est définie comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10'000, <1/1000); très rares (<1/10'000), cas isolés basés sur des signalements spontanés après la mise sur le marché, détermination exacte de la fréquence impossible.
Rides verticales entre les sourcils (rides glabellaires)
|
Classes de systèmes d'organes
|
Réaction indésirable
|
Fréquence
| |
Infections et infestations
|
Rhinopharyngite
|
Rares
| |
Affections du système nerveux
|
Céphalées
|
Fréquents
| |
Affections oculaires
|
Oedème palpébral, vision trouble, blépharoptôse
|
Occasionnels
| |
Affections vasculaires
|
Hématome
|
Occasionnels
| |
Affections de la peau et du tissu sous-cutané
|
Prurit, ptôse des sourcils
|
Occasionnels
| |
Affections musculo-squelettiques et du tissu conjonctif
|
Effet Méphisto (soulèvement latéral des sourcils)
|
Fréquents
| |
Asymétrie faciale (asymétrie des sourcils), crampes musculaires (au-dessus des sourcils)
|
Occasionnels
| |
Troubles généraux et anomalies au site d'administration
|
Hématome au site d'injection, douleur au site d'injection, syndrome grippal, douleur de pression, fatigue, sensation de lourdeur de la paupière et/ou des sourcils
|
Occasionnels
|
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
|
Classes de systèmes d'organes
|
Réaction indésirable
|
Fréquence
| |
Affections oculaires
|
Oedème palpébral, sécheresse oculaire
|
Fréquents
| |
Troubles généraux et anomalies au site d'administration
|
Hématome au site d'injection
|
Fréquents
|
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes doses élevées de neurotoxine botulique de type A peuvent déclencher à distance du site d'injection des paralysies neuromusculaires marquées. Les symptômes possibles d'un surdosage sont une faiblesse musculaire générale, une ptôse, une diplopie, des troubles respiratoires et d'élocution, une paralysie des muscles respiratoires ou des troubles de la déglutition. Il peut s'ensuivre une pneumopathie d'inhalation.
Les symptômes n'apparaissent généralement pas immédiatement après l'injection.
En cas de surdosage, le patient doit être placé sous surveillance médicale pendant plusieurs jours (voire plusieurs semaines) afin de détecter l'apparition de symptômes tels qu'une faiblesse musculaire excessive et une paralysie musculaire. Un traitement symptomatique, pouvant aller jusqu'à l'hospitalisation, peut s'avérer nécessaire. En cas de paralysie des muscles respiratoires, une intubation et une assistance respiratoire peuvent être requises.
Propriétés/EffetsCode ATC
M03AX01
Mécanisme d'action
La neurotoxine botulique de type A bloque la transmission cholinergique au niveau de la jonction neuromusculaire en inhibant la libération d'acétylcholine. Les terminaisons nerveuses des connexions neuromusculaires ne réagissent plus aux influx nerveux, empêchant ainsi la sécrétion du neurotransmetteur aux plaques terminales motrices (dénervation chimique). Le rétablissement complet de la fonction motrice/conduction nerveuse survient dans les 3 à 4 mois suivant l'injection grâce à la formation de nouvelles terminaisons nerveuses et à leur reconnexion avec les plaques terminales motrices.
La neurotoxine botulique de type A bloque la libération périphérique d'acétylcholine au niveau des terminaisons présynaptiques par le clivage de la protéine SNAP-25 («synaptosomal-associated protein of 25 kDa»). SNAP-25 est une protéine importante pour assurer la liaison et la libération de l'acétylcholine par les vésicules qui se trouvent dans les terminaisons nerveuses.
L'injection est d'abord suivie d'une liaison à forte affinité de la toxine avec des récepteurs spécifiques présents à la surface des cellules. Un processus d'endocytose déclenché par les récepteurs permet à la toxine de traverser la membrane cellulaire et libère la chaîne légère de la toxine dans le cytosol, induisant le clivage de la protéine SNAP-25 et inhibant ainsi la libération d'acétylcholine par les vésicules de neurotransmetteurs.
Pharmacodynamique
Voir rubrique «Mécanisme d'action»
Efficacité clinique
Rides verticales entre les sourcils (rides glabellaires)
Deux études de phase III identiques randomisées, en double aveugle, multicentriques, contrôlées versus placebo ont été menées afin d'évaluer l'utilisation de Bocouture pour l'atténuation temporaire des rides glabellaires modérées à prononcées. Au total, les études incluaient 547 patients, dont 193 patients >50 ans. 55 sujets étaient des hommes. La réussite du traitement a été définie comme l'amélioration de 2 points lorsque les sourcils sont froncés au maximum le 30e jour, sur une échelle de 4 points (Facial Wrinkle Scale, FWS, 0 = aucun, 1 = léger, 2 = moyen, 3 = prononcé) par rapport à la situation initiale, à la fois pour le médecin investigateur et le patient (critère principal combiné). Au jour 30, la réponse sous 20 unités de Bocouture était, d'un point de vue statistique, significativement supérieure au placebo. Le taux de réussite était de 54,1% dans le groupe sous Bocouture, alors qu'aucun patient n'a manifesté d'amélioration dans le groupe sous placebo. Les critères secondaires étayent les résultats du critère principal.
Dans une troisième étude, 169 patients (≥18 ans) ont été traités avec Bocouture dans la phase contrôlée contre placebo de l'étude de phase III en double aveugle pour l'autorisation, ainsi que 236 patients dans la phase non contrôlée de cette étude. En comparaison avec le placebo, l'étude a montré une efficacité statistiquement significative et cliniquement pertinente de 20 unités de Bocouture. Ceci a été étayé par le nombre de patients ayant répondu au traitement avec les sourcils froncés au maximum le 30e jour lors de l'évaluation, conformément à l'échelle des rides du visage (Facial Wrinkle Scale), par le médecin investigateur respectivement par le patient.
La réponse sous 20 unités de Bocouture était significativement plus élevée par rapport au placebo. Des analyses des sous-groupes ont indiqué une efficacité plus faible chez les patients âgés de 50 ans ou plus par rapport aux patients plus jeunes. 113 patients avaient 50 ans ou moins et 56 patients avaient plus de 50 ans. L'efficacité chez les hommes était plus faible que chez les femmes. 33 patients étaient des hommes et 136 des femmes.
Dans une étude open-label pour l'évaluation de la sécurité à long terme de Bocouture, des patients ayant participé auparavant à des études contrôlées par placebo sur le traitement des rides glabellaires ont été traités de manière répétée jusqu'à 8 fois. Un nombre total de 694, 322, 309, 291, 261, 191 et 48 sujets ont été traités dans les cycles de traitement 2, 3, 4, 5, 6, 7 et 8. Aucune hausse de la fréquence des effets indésirables n'a été constatée après une administration répétée. Aucun effet indésirable nouveau ou inattendu n'est apparu et le profil de sécurité correspondait à celui observé dans les autres études.
La non-infériorité de Bocouture, par rapport à un produit comparatif contenant le complexe de toxine botulique de type A (l'onabotulinumtoxine A 900 kD), a été démontrée dans deux études comparatives, prospectives, multicentriques, randomisées réalisées en double aveugle (n=631) après une administration unique (20 et 24 unités). Les résultats de l'étude indiquent aussi que Bocouture et ce produit de comparaison avaient un profil d'efficacité et de sécurité comparable chez les patients avec des rides glabellaires modérées à sévères, s'ils sont administrés dans un rapport de dose de 1:1.
Rides latérales périorbitaires (pattes d'oie) visibles lors d'un sourire forcé
Dans une étude clinique de phase III, 111 patients présentant des rides latérales périorbitaires (pattes d'oie) moyennes à profondes visibles lors d'un sourire forcé, ont été traités avec 12 unités de Bocouture ou de placebo par côté (région de l'œil droit/gauche) pendant un cycle d'injection. On a comparé un schéma d'injection en 3 points avec un schéma en 4 points. On a considéré que le traitement avait réussi lorsqu'on observait une amélioration d'au moins 1 point sur une échelle de 4 points. L'évaluation a été effectuée pour les deux yeux lors d'un sourire forcé par un comité d'experts indépendant, en s'appuyant sur des photos numériques standardisées en comparaison avec la situation de départ. Les schémas d'injection en 3 et en 4 points se sont tous les deux révélés supérieurs au traitement par le placebo. Avec le schéma d'injection à 3 points, le taux de réussite était de 69,9% dans le groupe Bocouture contre 21,4% dans le groupe placebo, tandis qu'avec le schéma à 4 points, il était de 68,7% contre 14,3%. Aucune détérioration n'a été observée chez les patients traités avec Bocouture. Cela a été confirmé par le grand nombre de patients qui présentaient un résultat positif au bout de 30 jours en se basant sur une évaluation par les experts et les patients eux-mêmes sur une échelle de 4 points. On a observé une proportion de réussite bien plus importante chez les patients ayant reçu 12 unités de Bocouture par région oculaire que chez ceux qui avaient été traités avec le placebo.
Lors du traitement combiné des rides glabellaires et des rides latérales périorbitaires avec Bocouture, l'efficacité et l'innocuité étaient les mêmes que lors du traitement séparé de ces régions.
PharmacocinétiqueAbsorption
Les études cinétiques et de distribution classiques ne peuvent être réalisées avec la neurotoxine botulique de type A car le principe actif est appliqué en quantités infimes (picogramme par injection) et se lie rapidement et de manière irréversible aux terminaisons nerveuses cholinergiques.
La toxine botulique native de sérotype A est un complexe de masse moléculaire élevée (complexe de toxine botulique de type A) qui contient, outre la neurotoxine (150 kD), d'autres protéines non toxiques hémagglutinantes et non hémagglutinantes. Contrairement au complexe de toxine botulique de type A, Bocouture ne contient que la neurotoxine à l'état pur et aucune protéine complexante.
Il a été démontré que la neurotoxine botulique de type A suivait un transport axonal rétrograde après l'injection intramusculaire. Par contre, on n'a pas observé de passage transsynaptique rétrograde de la neurotoxine botulique active de type A dans le système nerveux central à des doses significatives sur le plan thérapeutique.
La neurotoxine botulique de type A liée au récepteur pénètre par endocytose dans la terminaison nerveuse avant d'atteindre sa cible (SNAP-25). Elle est finalement décomposée au niveau intracellulaire. Les molécules de neurotoxine botulique de type A circulant librement et qui ne se sont pas liées aux récepteurs présynaptiques au niveau des terminaisons nerveuses cholinergiques sont capturées par phagocytose ou pinocytose et décomposées à l'instar des autres protéines circulant librement.
Distribution
Voir rubrique «Absorption»
Métabolisme
Voir rubrique «Absorption»
Élimination
Voir rubrique «Absorption»
Données précliniquesPharmacologie de sécurité
Des études précliniques de sécurité pharmacologique portant sur l'effet de Bocouture sur le système cardiovasculaire et intestinal n'ont démontré aucun accroissement du risque chez l'homme.
Mutagénicité et Carcinogénicité
Aucune étude n'a été menée sur le potentiel génotoxique ou cancérigène de Bocouture.
Toxicité sur la reproduction
Dans des études de toxicité pour la reproduction chez le rat et le lapin, aucune atteinte de la fécondité du mâle ou de la femelle ni influence directe sur le développement embryonnaire ou sur le développement pré- et post-natal n'a été observée sous Bocouture. Toutefois, l'administration de Bocouture à différents intervalles (tous les jours ou moins souvent) dans des études d'embryotoxicité, à des doses entraînant une réduction du poids corporel maternel, a entraîné une augmentation du taux d'avortement chez le lapin et une légère réduction du poids corporel fœtal chez le rat.
Autres données (toxicité locale, phototoxicité, immunotoxicité)
Les résultats d'études de toxicité systémique après administration répétée de Bocouture ont été essentiellement conformes aux propriétés pharmacodynamiques, c'est-à-dire relâchement, paralysie et atrophie du muscle injecté.
Aucun cas d'intolérance locale n'a été signalé.
Remarques particulièresIncompatibilités
Ce médicament ne peut être mélangé qu'aux médicaments mentionnés sous Remarques concernant la manipulation.
Stabilité
Le médicament ne doit pas être utilisé après la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
La solution injectable reconstituée ne contient pas de conservateur. Sa stabilité chimique et physique «in use» a été démontrée pendant 24 heures à 2-8 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi doit être utilisée immédiatement après dilution/reconstitution. Si cela n'est pas possible, le délai d'utilisation et les conditions de stockage relèvent de la responsabilité de l'utilisateur mais, de manière générale, l'entreposage ne devrait pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf si la dilution/reconstitution se déroule dans des conditions aseptiques contrôlées et validées.
Remarques particulières concernant le stockage
Conserver le médicament à température ambiante (15-25 °C) ou au réfrigérateur (2-8 °C).
Conserver dans l'emballage d'origine.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
Avant utilisation, Bocouture est reconstitué à l'aide de sérum physiologique stérile. La reconstitution et la dilution doivent s'effectuer en respectant les mesures standard, notamment en termes de manipulation aseptique.
La reconstitution du contenu du flacon et son aspiration dans la seringue doivent être effectuées sur des tissus en papier recouverts de plastique, pour recueillir le produit éventuellement dispersé.
Le tableau suivant indique la dilution pour Bocouture 50 unités et 100 unités:
|
Dose reçue
(en unités pour 0,1 ml)
|
Quantité de solvant ajoutée
(chlorure de sodium 9 mg/ml (0,9%) en solution injectable)
| |
Bouteille de 50 unités à bouchon perçable pour seringue
|
Bouteille de 100 unités à bouchon perçable pour seringue
| |
4 unités
|
1,25 ml
|
2,5 ml
|
On aspire la quantité requise de solution de chlorure de sodium à 0,9% (9 mg/ml) (voir tableau de dilution) avec une seringue. Il est recommandé d'utiliser une canule courte de 20-27 G pour la reconstitution. Nettoyer à l'alcool (70%) la partie exposée du bouchon en caoutchouc du flacon avant d'y enfoncer l'aiguille. Après avoir introduit verticalement l'aiguille à travers le bouchon en caoutchouc du flacon, la reconstitution doit être effectuée lentement afin d'éviter la formation de bulles. Ne pas utiliser le flacon s'il n'y a pas à l'intérieur une dépression qui aspire la solution contenue dans la seringue.
Sortir la seringue du flacon et mélanger lentement Bocouture avec le solvant en faisant tourner le flacon de façon circulaire et en l'inclinant (de droite à gauche et à l'envers) – ne pas secouer fortement. Si nécessaire, la canule avec laquelle la reconstitution a été effectuée doit rester dans le flacon.
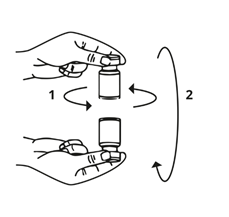
La quantité de solution nécessaire doit être prélevée avec une nouvelle seringue stérile.

La solution reconstituée de Bocouture est limpide, incolore et exempte de particules.
Ne pas utiliser Bocouture si la solution reconstituée conformément aux instructions ci-dessus paraît trouble, contient des particules ou présente une floculation.
Les solutions injectables conservées plus de 24 heures doivent être jetées.
PROCEDURE D'ELIMINATION EN TOUTE SECURITE DES FLACONS, SERINGUES ET MATERIAUX UTILISES
Les flacons non utilisés ou les restes de solution dans les flacons et/ou les seringues doivent être stérilisés à l'autoclave. On peut aussi désactiver le Bocouture restant en y ajoutant l'un des solvants suivants: éthanol à 70%, isopropanol à 50%, solution d'hydroxyde de sodium diluée (0,1 N NaOH) ou solution d'hypochlorite de sodium diluée (au moins 0,1% de NaOCl).
Les flacons, seringues et consommables usagés ne doivent pas être vidés, mais mis au rebut dans des conteneurs appropriés et conformément aux règlements locaux.
1.Tous les médicaments renversés doivent être nettoyés: s'il s'agit de la poudre, à l'aide d'un matériau absorbant imbibé de l'une des solutions mentionnées ci-dessus ou, s'il s'agit de la solution reconstituée, d'un matériau absorbant sec.
2.Les surfaces contaminées doivent être nettoyées avec une matière absorbante imbibée de l'une des solutions mentionnées ci-dessus. Laisser ensuite sécher.
3.En cas de bris d'un flacon, procéder comme indiqué précédemment, les éclats de verre doivent être rassemblés et le médicament essuyé avec prudence afin d'éviter les coupures.
4.Si le médicament entre en contact avec la peau, rincer abondamment la zone de peau touchée avec de l'eau.
5.Si le médicament entre contact avec une plaie, une coupure ou une zone cutanée non intacte, bien rincer avec de l'eau et prendre les mesures médicales qui s'imposent en fonction de la dose injectée.
6.Si le médicament entre en contact avec les yeux, rincer abondamment à l'eau ou à l'aide d'une solution prévue à cet effet.
Numéro d’autorisation63222 (Swissmedic)
PrésentationBocouture lyophilisé:
Emballages d'un flacon de 50 unités [A]
Emballages d'un flacon de 100 unités [A]
Titulaire de l’autorisationMerz Aesthetics (Suisse) SA, 4123 Allschwil
Mise à jour de l’informationJuin 2020
|





