CompositionPrincipes actifs
Poudre: Mitomycine
Excipients
Poudre: Mannitol (E421), Acide chlorhydrique pour ajuster le pH, hydroxyde de sodium pour ajuster le pH
Indications/Possibilités d’emploiAdministration intraveineuse
La mitomycine est utilisée dans le traitement palliatif des tumeurs.
La mitomycine est administrée par voie intraveineuse sous forme de chimiothérapie cytostatique combinée en cas de:
·cancer gastrique avancé ou métastatique
·cancer mammaire avancé ou métastatique
La mitomycine est utilisée en monothérapie pour le traitement post-opératoire du cancer gastrique.
Administration intravésicale
Pour prévenir les récidives de carcinomes vésicaux superficiels après résection transurétrale.
Posologie/Mode d’emploiL'utilisation de la mitomycine doit être réservée aux médecins qualifiés et expérimentés dans ce type de traitement et requiert une indication préalable stricte ainsi qu'une surveillance attentive continue des paramètres hématologiques. L'injection doit être administrée par voie endovasculaire stricte au moyen d'une perfusion fiable. L'injection paravasculaire provoque des nécroses loco-régionales étendues.
Sauf prescription contraire, la posologie de mitomycine doit être la suivante:
Administration intraveineuse
Dans le cadre d'un schéma chimiothérapeutique cytostatique combiné pour traiter des cancers mammaires ou gastriques, la mitomycine est administrée soit par injection intraveineuse en bolus soit par perfusion intraveineuse. La posologie recommandée est de 6 à 12 mg/m2 de surface corporelle toutes les 3 à 4 semaines. Cet intervalle peut être prolongé en fonction du schéma thérapeutique utilisé.
En monothérapie dans le traitement post-opératoire d'un cancer gastrique, la mitomycine est administrée par une ou plusieurs perfusions à raison de 20 mg/m toutes les 6 à 8 semaines. En raison du danger d'effets myélotoxiques, tout écart des protocoles thérapeutiques éprouvés doit être justifié par un motif valable.
Administration intravésicale
Le traitement intravésical comprend une instillation intravésicale par semaine de 20 à 40 mg de mitomycine, correspondant au contenu de 1 à 2 flacons
perforables de Mitem 20 mg dilué dans 20 à 40 ml d'eau pour préparations injectables ou dans une solution injectable de NaCl à 0,9 %.
Cette recommandation de dosage est basée sur les données de la littérature.
Lors de l'administration intravésicale, le pH de l'urine doit être supérieur à 6.
Le dosage alternatif recommandé pour la prévention de récidives d'un cancer superficiel de la vessie est de 4 à 10 mg (0,06 à 0,15 mg/kg de poids corporel) 1 à 3 fois par semaine instillés dans la vessie au moyen d'un cathéter urétral.
Instructions spéciales pour le dosage
La posologie doit être diminuée chez les patients ayant subi un traitement cytostatique antérieur extensif ainsi que chez les patients âgés ou présentant une myélosuppression.
Patients âgés
Les données cliniques disponibles sur l'utilisation de la mitomycine chez les patients âgés de 65 ans ou plus sont insuffisantes.
Le traitement par ce médicament est déconseillé chez les patients présentant des troubles de la fonction rénale (voir section «Contreindications»).
En raison d'un manque de données concernant la sécurité et l'efficacité, l'utilisation de ce médicament n'est pas recommandée chez les patients atteints d'insuffisance hépatique (voir section «Contreindications»).
Enfants et adolescents
La sécurité et l'efficacité de l'utilisation de la mitomycine chez les enfants et les adolescents n'ont pas été démontrées.
Contre-indications·Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique composition.
·Allaitement
·Grossesse
Thérapie systémique
Une pancytopénie ou une leucopénie/thrombocytopénie isolée, une diathèse hémorragique et des infections aiguës constituent des contre-indications absolues.
Des troubles ventilatoires pulmonaires restrictifs ou obstructifs, une atteinte de la fonction rénale et hépatique et/ou un mauvais état de santé général constituent des contre-indications relatives.
Thérapie intravésicale
Une perforation de la paroi vésicale est une contre-indication absolue.
Une cystite représente une contre-indication relative.
Mises en garde et précautionsEn raison des effets toxiques de la mitomycine sur la moelle osseuse, tout traitement par radiothérapie doit être réalisé avec une précaution extrême pour limiter le risque d'une myélosuppression additive.
L'injection doit être administrée par voie endovasculaire stricte. L'injection paravasculaire provoque des nécroses loco-régionales étendues. Pour éviter l'apparition de nécroses, il faut tenir compte des recommandations suivantes:
utiliser toujours les veines de grand calibre du bras pour les injections.
L'administration par injection intraveineuse directe est à proscrire, pratiquer uniquement des injections dans la tubulure d'un système de perfusion fiable.
Avant de retirer l'aiguille après administration veineuse centrale, rincer, pendant quelques minutes, à la solution de perfusion afin de chasser la mitomycine résiduelle.
En cas d'extravasation, il est recommandé de procéder immédiatement à une infiltration locale avec une solution de bicarbonate de sodium à 8,4 % suivie d'une injection de 4 mg de dexaméthasone. Une injection systémique de 200 mg de vitamine B peut s'avérer bénéfique pour la repousse cellulaire au niveau des tissus lésés.
Une association thérapeutique avec d'autres produits peut induire une toxicité additionnée pour la moelle osseuse. Le cycle suivant ne devra être administré qu'après normalisation des paramètres hématologiques. Le cas échéant, une adaptation du dosage de mitomycine peut être nécessaire.
|
Nadir après dose antérieure (cellules/mm3)
|
Dose en pourcent de la dose administrée antérieurement
| |
Leucocytes
|
Thrombocytes
|
| |
> 3000
|
> 75000
|
100 %
| |
2000 - 2999
|
25000 - 75000
|
70 %
| |
> 2000
|
< 25000
|
50 %
|
Un traitement de longue durée peut entraîner une toxicité cumulée pour la moelle osseuse. La myélosuppression peut se manifester sous forme tardive atteignant son intensité maximum au bout de 4 à 6 semaines et cumulant après un traitement prolongé. C'est pourquoi une adaptation posologique personnalisée peut fréquemment s'avérer nécessaire.
Les patients âgés souffrent plus souvent des fonctions physiologiques réduites et d'une myélosuppression persistante. Ainsi, l'administration de mitomycine requiert une prudence particulière et une surveillance étroite de ce groupe de patients.
La mitomycine est une substance mutagène et potentiellement cancérigène pour l'homme. Tout contact avec la peau et les muqueuses doit être évité.
En cas de symptômes d'une atteinte pulmonaire ne pouvant pas être attribués à la pathologie de base, l'arrêt immédiat du traitement s'impose. Dans la plupart des cas, les effets d'une toxicité pulmonaire peuvent être traités par des stéroïdes.
L'apparition de symptômes d'hémolyse ou de signes de troubles de la fonction rénale (néphrotoxicité) impose également l'arrêt immédiat du traitement.
L'administration intravésicale du médicament doit être effectuée avec prudence en raison du risque de perforation de la vessie, qui peut survenir immédiatement ou plusieurs semaines après l'injection du médicament.
A partir d'une dose cumulative seuil >30 mg de mitomycine/m2 de surface corporelle, on a pu observer des manifestations d'anémie hémolytique microangiopathique, et à partir d'une dose cumulative seuil >60 mg de mitomycine/m2 de surface corporelle, un syndrome hémolytique et urémique accompagné d'une anémie hémolytique, d'une thrombocytopénie, de fièvre, d'une insuffisance rénale et occasionnellement de symptômes neurologiques. Il est recommandé de contrôler régulièrement la numération formule sanguine et la fonction rénale.
Des cas de leucémie aiguë (précédée ou non d'une phase préleucémique) et de syndrome myélodysplasique ont été rapportés chez des patients traités concomitamment par d'autres antinéoplasiques.
Un traitement par la mitomycine peut induire une myélosuppression et par là même une thrombocytopénie. Les patients sous traitement anticoagulant doivent être soumis à une surveillance soigneuse de la numération plaquettaire afin d'éviter des thrombocytopénies sévères. La mitomycine ne doit plus être administrée si la numération plaquettaire est <100'000/mm .
Examens de contrôle recommandés et mesures de sécurité à prendre pour un traitement par voie intraveineuse:
Avant le début du traitement:
Bilan sanguin complet.
Contrôle spirométrique en cas de soupçon de troubles préexistants de la fonction pulmonaire.
Evaluation de la fonction rénale pour exclure une insuffisance rénale.
Evaluation de la fonction hépatique pour exclure une insuffisance hépatique.
Pendant le traitement
Contrôle régulier des paramètres hématologiques.
Surveillance étroite de la fonction rénale.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose, c'est-à-dire qu'il est pratiquement «sans sodium».
InteractionsEn cas de traitement concomitant ayant des effets indésirables sur la moelle osseuse (autres agents cytotoxiques et/ou radiothérapie, en particulier), des interactions myélotoxiques sont possibles.
La toxicité pulmonaire peut être amplifiée par l'association de bléomycine ou d'alcaloïdes de la pervenche.
Une thrombocytopénie induite par la mitomycine peut augmenter le risque d'hémorragies en cas de traitement concomitant aux anticoagulants, NSAID ou inhibiteurs plaquettaires tels que l'aspirine et les thrombolytiques.
Il a été rapporté que le traitement concomitant par la mitomycine et le fluorouracil ou le tamoxifène expose à un risque accru de syndrome hémolytique et urémique.
Dans une expérimentation animale, l'administration simultanée d'hydrochlorure de pyridoxine (vitamine B6) a entraîné une perte d'efficacité de la mitomycine.
L'administration de vaccins vivants est contre-indiquée durant le traitement par la mitomycine.
La toxicité cardiaque de l'adriamycine (doxorubicine) peut être majorée par la mitomycine.
La mitomycine est un substrat de la protéine de résistance multidrogue, la glycoprotéine P.
Grossesse, AllaitementGrossesse
Il n'y a pas d'informations suffisantes concernant l'utilisation de la mitomycine chez des femmes enceintes. Des études expérimentales réalisées sur l'animal suggèrent que cette substance peut être toxique pour la reproduction (voir «Données précliniques»). L'utilisation de la mitomycine est contre-indiquée pendant la grossesse.
Allaitement
Il existe des indices concernant le passage de la mitomycine dans le lait maternel. L'utilisation de Mitem 20 mg est donc contre-indiquée chez les femmes qui allaitent.
Fécondité / contraception masculine et féminine
Pendant toute la durée de la chimiothérapie et jusqu'à 6 mois après la fin du traitement, les femmes en âge de procréer doivent prendre des mesures contraceptives efficaces ou s'abstenir de rapports sexuels.
La mitomycine a des effets mutagènes. Ainsi, il est conseillé aux hommes traités par la mitomycine de ne pas concevoir d'enfant pendant toute la durée du traitement et jusqu'à 6 mois après la fin du traitement et de se faire conseiller sur les méthodes de conservation du sperme avant le traitement en raison de la possibilité de stérilité irréversible liée au traitement par la mitomycine.
Effet sur l’aptitude à la conduite et l’utilisation de machinesMême en cas d'utilisation conforme, ce médicament est susceptible, en raison des nausées et des vomissements qu'il déclenche, de modifier la capacité de réaction de telle sorte que l'aptitude à prendre part activement à la circulation routière ou à commander des machines peut en être perturbée. Cet effet peut être accentué par la prise concomitante d'alcool.
Effets indésirablesLes effets indésirables énumérés ci-dessous sont classés par fréquence et par classe de système d'organe. La fréquence des effets indésirables a été classée comme suit:
très fréquent (≥1/10), fréquent (≥1/100, < 1/10), peu fréquent (≥1/1000, < 1/100), rare (≥1/10'000, < 1/1'000), très rare (< 1/10'000) ou fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles).
Effets indésirables possibles sous traitement administré par voie systémique
Les effets indésirables les plus fréquemment rapportés sous traitement par la mitomycine administrée par voie systémique sont des troubles gastrointestinaux tels que nausées et vomissements ainsi qu'une myélosuppression avec leucopénie et (en prédominance) thrombocytopénie. Jusqu'à 65 % des patients présentent une myélosuppression.
Jusqu'à 10 % des patients doivent s'attendre à une toxicité organique sévère sous forme de pneumonie interstitielle ou de néphrotoxicité.
La mitomycine est potentiellement hépatotoxique.
Affections hématologiques et du système lymphatique
Très fréquents: myélosuppression, leucopénie, thrombocytopénie
Rares: infection potentiellement mortelle, septicémie, anémie hémolytique
Affections du système immunitaire
Très rare: réaction allergique grave
Affections cardiaques
Rare: insuffisance cardiaque après traitement aux anthracyclines
Affections respiratoires, thoraciques et médiastinales
Fréquents: pneumonie interstitielle, dyspnée, toux, essoufflement
Rares: hypertonie pulmonaire, maladie veino-occlusive pulmonaire (PVOD)
Affections gastro-intestinales
Très fréquents: nausées, vomissements
Peu fréquents: mucosite, stomatite, diarrhée, anorexie
Affections hépato-biliaires
Rares: troubles de la fonction hépatique, taux élevés des transaminases, ictère, maladie veino-occlusive hépatique (VOD)
Affections de la peau et du tissu cellulaire sous-cutané
Fréquents: exanthème, éruptions allergiques cutanées, dermatite de contact, érythème palmoplantaire
Peu fréquent: alopécie
Rare: exanthème généralisé
Affections du rein et des voies urinaires
Fréquents: troubles de la fonction rénale, taux élevés de créatinine sérique, glomérulopathie, néphrotoxicité
Rares: syndrome hémolytique et urémique (SHU) (souvent mortel), anémie hémolytique microangiopathique (syndrome MAHA)
Troubles généraux et anomalies au site d'administration
Fréquents: après extravasation: cellulite, nécrose tissulaire
Peu fréquent: fièvre
Effets indésirables possibles sous traitement administré par voie intravésicale
Affections de la peau et du tissu cellulaire sous-cutané
Fréquents: prurit, éruptions allergiques cutanées, dermatite de contact, érythème palmoplantaire
Rare: exanthème généralisé
Affections du rein et des voies urinaires
Fréquents: cystite (éventuellement hémorragique), dysurie, nocturie, pollakisurie, hématurie, irritation localisée de la paroi vésicale
Très rares: cystite nécrosante, cystite allergique (éosinophile), sténose des voies urinaires excrétrices, réduction de la capacité vésicale, calcification, fibrose de la paroi vésicale et perforation de la vessie.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas de surdosage, on doit s'attendre à une exacerbation des effets indésirables, et tout particulièrement à une myélotoxicité sévère dont la manifestation clinique complète est généralement retardée d'environ 2 semaines.
Cela peut durer 4 semaines avant que le nadir des leucocytes ne soit atteint. Une surveillance hématologique étroite et des contrôles fréquents de la fonction rénale sur une période prolongée sont nécessaires même si le surdosage n'est que soupçonné.
Etant donné qu'il n'existe aucun antidote efficace pour un surdosage de la mitomycine, une prudence particulière s'impose lors de l'administration de ce médicament.
Propriétés/EffetsCode ATC
L01DC03
Classe pharmacothérapeutique: agent antinéoplasique, autres antibiotiques cytotoxiques.
La mitomycine est un antibiotique cytostatique de la famille des agents alkylants.
Mécanisme d’action
La mitomycine est un antibiotique à effet antinéoplasique, isolé à partir d'une souche de Streptomyces caespitosus. Elle est disponible sous forme inactive.
L'activation pour en faire un alkylant trifonctionnel est rapide, soit en présence d'un pH physiologique et de NADPH dans le sérum soit en intracellulaire pratiquement dans toutes les cellules du corps à l'exception du cerveau, la mitomycine ne franchissant pas la barrière hémato-encéphalique. Les 3 radicaux alkylants proviennent chacun d'un groupe quinone, aziridine et uréthane. Le mécanisme d'action se fonde principalement sur une alkylation de l'ADN (moins de l'ARN) permettant d'inhiber la synthèse de l'ADN. Le degré d'endommagement de l'ADN est en corrélation avec l'effet clinique: il est plus faible dans les cellules résistantes que dans les cellules sensibles. Comme par d'autres agents alkylants, les cellules proliférantes sont plus endommagées que celles qui se trouvent en phase de repos (GO) dans le cycle cellulaire. De plus, particulièrement en cas d'administration de fortes doses, le dégagement de radicaux libres de peroxyde entraîne des ruptures au niveau des filaments d'ADN. La libération de radicaux de peroxyde est mise en rapport avec le tableau des effets indésirables spécifiques aux différents organes.
PharmacocinétiqueAbsorption
Après injection intraveineuse de 10 à 20 mg/m2 de mitomycine, on a mesuré des pics plasmatiques situés entre 0,4 et 3,2 μg/ml. La demi-vie biologique est courte et se situe entre 40 et 50 minutes. La décroissance de la concentration plasmatique suit une courbe biexponentielle, une phase initiale rapide de 45 minutes est suivie d'une phase terminale plus lente.
Distribution/métabolisme
Au bout de 3 heures, les concentrations plasmatiques sont généralement inférieures au seuil de détection. La mitomycine étant essentiellement métabolisée et éliminée par le foie, des concentrations élevées ont été retrouvées dans la vésicule biliaire. L'excrétion rénale ne joue qu'un rôle mineur dans l'élimination de la mitomycine.
Le traitement intravésical ne donne pas lieu à une résorption significative de la mitomycine. Un effet systémique ne peut néanmoins être totalement exclu.
Données précliniquesChez l'animal, la mitomycine a un effet toxique sur tous les tissus proliférants, en particulier sur les cellules de la moelle osseuse et des muqueuses gastrointestinales, et entraîne l'inhibition de la spermatogénèse.
La mitomycine possède des propriétés mutagènes, carcinogènes et tératogènes.
Tolérance locale
Une injection paraveineuse ou le passage extravasculaire de la mitomycine provoque des nécroses sévères des tissus avoisinants.
Remarques particulièresIncompatibilités
Des incompatibilités se produisent avec les substances fortement acides ou alcalines. Le pH optimal de la solution de mitomycine prête à l'emploi est de 7,0.
Stabilité
Le médicament ne doit plus être utilisé après la date de péremption («EXP») mentionnée sur l'emballage.
Remarques particulières concernant le stockage
A conserver à une température ne dépassant pas 25 ºC et à l'abri de la lumière. Tenir hors de portées des enfants.
Mode d'administration
La mitomycine reconstituée est destinée à l'injection ou perfusion intraveineuse ou à l'instillation intravésicale. Une utilisation partielle du contenu du flacon perforable est possible.
Préparation de la solution injectable ou perfusable prête à l'emploi
Le contenu d'un flacon perforable de Mitem 20 mg sera dissous par agitation douce dans 40 ml d'eau pour préparations injectables ou dans une solution injectable de NaCl à 0,9 %.
Agiter jusqu'à ce que la solution reconstituée devienne limpide et ne comporte aucune particule.
Pour l'administration par voie de perfusion intraveineuse, la solution de Mitem 20 mg dissoute dans 40 ml d'eau pour préparations injectables peut être diluée à l'aide d'une solution isotonique pour perfusion à base de chlorure de sodium, de manière à amener la concentration à une valeur comprise entre 20 et 40 microgrammes de mitomycine/ml.
Préparation de la solution prête à l'emploi pour administration intravésicale
Dissoudre le contenu de 1 à 2 flacons perforables de Mitem 20 mg (correspondant à une quantité de 20 à 40 mg de mitomycine) dans 20 à 40 ml d'eau pour préparations injectables ou dans une solution injectable de NaCl à 0,9 %.
En cas d'utilisation du set d'instillation de Mitem 20 mg comprenant le solvant (poche en PVC contenant une solution de NaCl à 0,9 %), respecter les instructions d'utilisation respectives ci-après. Pour la reconstitution de la solution, utiliser la solution de NaCl à 0,9 % contenue dans la poche ci-jointe.
Mode d'emploi pour le solvant destiné à la préparation de la solution intravésicale (set d'instillation)
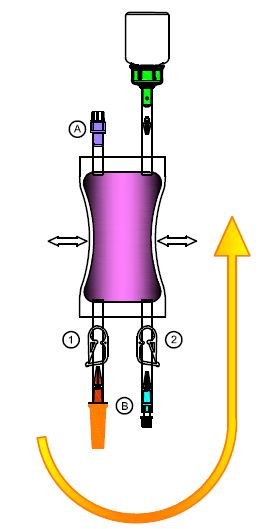
1.Ouvrez l'emballage et vérifiez la poche et son contenu.
Placez le sac à déchets à portée de main.
Fermez les clamps (1) et (2). Retirez le cache protecteur de l'embout (adaptateur vert).
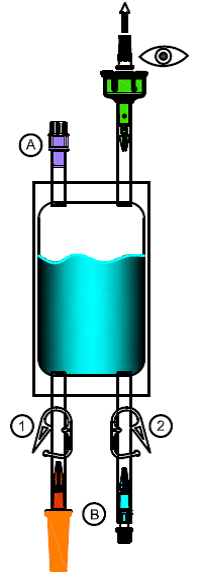
2.Ôtez le flacon perforable de Mitem 20 mg de la boîte pliable et retirez le cache blanc. Enfoncez l'embout (adaptateur vert) verticalement au centre dans le bouchon en caoutchouc du flacon perforable jusqu'à ce qu'il soit bien enclenché.
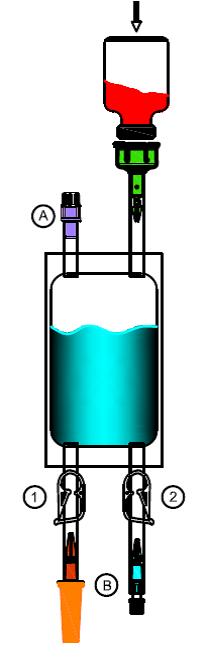
3.Pliez dans plusieurs sens la partie de l'adaptateur à l'intérieur de la tubulure au niveau du point de rupture théorique jusqu'à ce que le cône se détache et que la liaison soit ouverte.
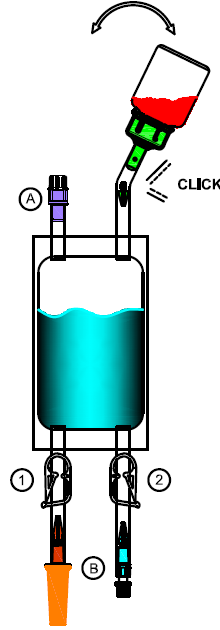
4.Tournez la poche de solvant avec le flacon perforable vers le bas. Comprimez et relâchez la poche de solvant plusieurs fois à la main pour faire passer le solvant dans le flacon perforable.
Agitez ensuite doucement le flacon perforable jusqu'à ce que la substance sèche soit complètement dissoute.
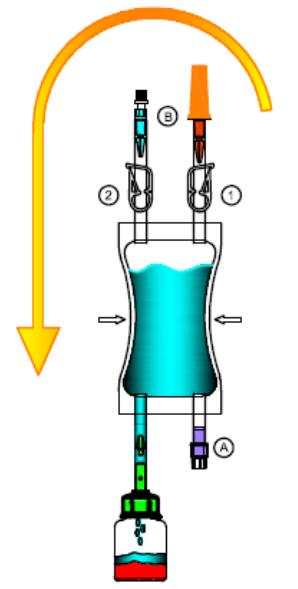
5.Retournez la poche avec le flacon perforable vers le haut.
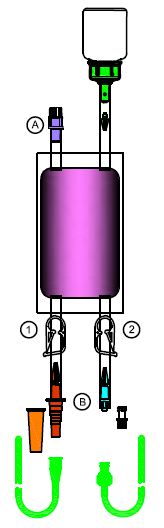
Comprimez et relâchez la poche de solvant plusieurs fois à la main pour que la solution soit collectée complètement dans la poche.
6.Connectez le cathéter à l'adaptateur B correspondant.
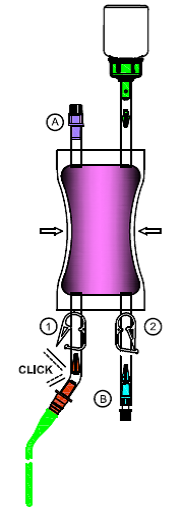
7.Pliez dans plusieurs sens la partie de l'adaptateur connecté au cathéter au niveau du point de rupture théorique jusqu'à ce que le cône se détache et que la liaison soit ouverte.
Ouvrez le clamp (1) ou (2) à l'endroit où le cathéter est connecté à l'adaptateur afin de permettre à la solution de couler à travers le cathéter dans la vessie.
Pour éviter que le reste de liquide ne s'écoule goutte à goutte à la fin de l'instillation, vous pouvez refermer le clamp (1) ou (2). Tout le matériel entré en contact avec la solution de Mitem doit être placé dans le sac à déchets prévu à cet effet et éliminé en tant que déchets à haut risque.
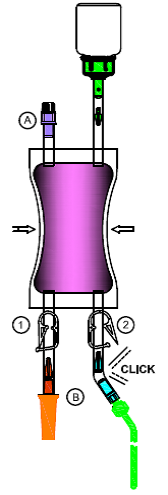
Remarque: il est recommandé d'exécuter toutes les opérations dans des conditions aseptiques.
Solution reconstituée:
N'utiliser que des solutions limpides.
Le contenu des flacons est à usage unique.
Les solutions non utilisées doivent être jetées.
La stabilité chimique et physique à température ambiante et pendant l'exposition à la lumière d'une solution reconstituée est de
·1 heure avec de l'eau pour préparation injectable
·2 heures avec une solution de chlorure de sodium à 9 mg/ml (0,9 %) (Set d'instillation)
Pour des raisons microbiologiques, la préparation prête à l'emploi doit être utilisée immédiatement après la reconstitution.
Autres remarques
·Mitem 20 mg ne doit pas être utilisé pour des injections mixtes.
·Les autres solutions injectables ou perfusables doivent être administrées séparément.
·L'injection doit être administrée par voie endovasculaire stricte au moyen d'une perfusion fiable.
Des précautions particulières pour la préparation et l'élimination des médicaments cytotoxiques non utilisés doivent être respectées.
Numéro d’autorisation63237 (Swissmedic).
PrésentationMitem 20 mg: boîte contenant 1 flacon perforable.
Mitem 20 mg, set d'instillation:
boîte contenant 1 flacon perforable et du solvant (1 poche en PVC contenant 20 ml de solvant de chlorure de sodium à 0,9 %), 1 cathéter Tiemann, 1
sac à déchets.
Titulaire de l’autorisationLeman SKL SA, Lancy.
Mise à jour de l’informationFévrier 2025
| 







