CompositionPrincipes actifs
Quétiapine, sous forme de fumarate de quétiapine
Excipients
Noyau du comprimé
Lactose monohydraté, cellulose microcristalline (E460), citrate de sodium dihydraté (E331), hypromellose (E464), stéarate de magnésium (E470b).
Enrobage du comprimé
Hypromellose (E464), macrogols 400, dioxyde de titane (E171), oxyde de fer rouge (E172 – uniquement contenu dans le comprimé retard 50 mg), oxyde de fer jaune (E172 – uniquement contenu dans les comprimés retard 50 mg, 200 mg et 300 mg).
Sequase XR 50 mg contient 125,72 mg lactose-monohydraté et 8,44 mg sodium.
Sequase XR 150 mg contient 74,65 mg lactose-monohydraté et 16,86 mg sodium.
Sequase XR 200 mg contient 52,87 mg lactose-monohydraté et 17,59 mg sodium.
Sequase XR 300 mg contient 49,31 mg lactose-monohydraté et 23,45 mg sodium.
Sequase XR 400 mg contient 15,50 mg lactose-monohydraté et 23,45 mg sodium.
Indications/Possibilités d’emploiSequase XR est indiqué pour le traitement de la schizophrénie.
Chez les patients schizophrènes stables qui prennent Sequase XR en tant que traitement d’entretien, Sequase XR est efficace pour prévenir les récidives.
Sequase XR est indiqué pour le traitement des épisodes maniaques lors de troubles bipolaires.
Sequase XR est indiqué pour le traitement des épisodes dépressifs lors de troubles bipolaires.
Sequase XR est indiqué pour la prévention des récidives (avec contrôle régulier du rapport bénéfices-risques) chez les patients souffrant de troubles bipolaires qui ont répondu de façon satisfaisante à la quétiapine lors d’épisodes de manie aiguë ou de dépression aiguë.
En particulier pour traiter les épisodes dépressifs lors de troubles bipolaires, le traitement doit être initié et contrôlé par un médecin expérimenté dans le diagnostic et le traitement des troubles affectifs.
Sequase XR est indiqué pour le traitement adjuvant d’épisodes dépressifs chez des patients présentant un trouble dépressif majeur et ayant répondu de façon insuffisante à au moins une monothérapie d’antidépresseur, au sens d’une stratégie d’augmentation après un traitement antidépresseur administré selon les directives cliniques en vigueur (voir également «Propriétés/Effets» ou «Mises en garde et précautions»). Avant de débuter le traitement, le médecin devra prendre en compte le profil de sécurité de Sequase XR (voir «Effets indésirables»).
Posologie/Mode d’emploiPosologie usuelle
Les schémas posologiques diffèrent suivant l’indication. Il convient donc de bien s’assurer que le patient reçoit une information claire sur la posologie adaptée à son état.
Sequase XR doit être pris une fois par jour sans nourriture. Les comprimés retard doivent être avalés entiers. Ils ne doivent jamais être divisés, mâchés ou écrasés. Le patient ne doit pas consommer de jus de pamplemousse pendant le traitement par Sequase XR.
Afin de minimiser le nombre de comprimés requis pour administrer des doses élevées, il convient de choisir les comprimés Sequase XR à libération prolongée plus fortement dosées (meilleure compliance et moindre exposition à la nitrosamine).
Adultes
Traitement de la schizophrénie et des épisodes maniaques dans le cadre de troubles bipolaires
Sequase XR doit être pris une fois par jour sans nourriture, au moins une heure avant un repas. Le traitement commence par une dose journalière de 300 mg le 1er jour, puis de 600 mg le 2e jour. À partir du 3e jour, la dose peut être augmentée jusqu’à 800 mg. La dose doit être adaptée aux besoins individuels du patient, de sorte à atteindre entre 400 et 800 mg par jour en fonction de la réponse clinique et de la tolérance du traitement. La dose efficace se situe entre 400 et 800 mg par jour. Aucune adaptation de la dose n’est nécessaire pour le traitement d’entretien de la schizophrénie.
Épisodes dépressifs dans le cadre de troubles bipolaires
Sequase XR doit être pris une fois par jour avant le coucher, selon un schéma de doses progressives: 50 mg (jour 1), 100 mg (jour 2), 200 mg (jour 3) et 300 mg (jour 4). L’effet antidépresseur a été évalué lors d’études menées avec les comprimés retard Sequase XR en dose de 300 mg ainsi qu’avec les comprimés pelliculés Sequase en doses de 300 et de 600 mg. Aucun bénéfice supplémentaire n’a été constaté avec les comprimés pelliculés Sequase de 600 mg.
Prévention des récidives de troubles bipolaires
Les patients ayant répondu de façon satisfaisante à Sequase XR en phase aiguë lors de troubles bipolaires doivent poursuivre le traitement par Sequase XR à la même dose. La dose de Sequase XR peut être ajustée entre 300 et 800 mg par jour en fonction de la réponse clinique et de la tolérance chez le patient individuel. Il est important d’utiliser la dose efficace la plus faible pour la prévention des récidives.
Utilisation en traitement adjuvant dans les épisodes dépressifs du trouble dépressif majeur
Sequase XR doit être administré avant le coucher. La posologie quotidienne de départ est de 50 mg aux jours 1 et 2, et de 150 mg aux jours 3 et 4. Un effet a été constaté à des doses de 150 et 300 mg/jour au cours d’études à court terme en traitement adjuvant (avec le bupropion, le citalopram, la duloxétine, l’escitalopram, la fluoxétine, la paroxétine, la sertraline et la venlafaxine – voir «Propriétés/Effets»). Le risque d’effets indésirables augmente avec la dose. Le médecin traitant doit donc s’assurer que la dose efficace la plus faible est utilisée pour le traitement, en commençant avec la posologie de 50 mg/jour de quétiapine. La nécessité d’augmenter la dose de 150 à 300 mg/jour de quétiapine reposera sur une évaluation individuelle du patient.
En raison des propriétés d’allongement de l’intervalle QT du citalopram, l’association avec Sequase XR est déconseillée.
Passage de Sequase (à libération immédiate) à Sequase XR (libération prolongée)
Les patients traités par 2 doses de Sequase par jour peuvent passer à Sequase XR en conservant la même dose quotidienne. La totalité de la dose est prise en une seule fois, ce qui simplifie la posologie. Il est possible qu’une adaptation individuelle de la dose soit nécessaire.
Fin du traitement
Après l’arrêt brusque des traitements antipsychotiques, y compris la quétiapine, on a décrit des symptômes aigus de sevrage tels qu’insomnies, nausées et vomissements (voir «Effets indésirables»). Il est recommandé d’arrêter le traitement progressivement sur une période d’au moins une ou deux semaines.
Instructions posologiques particulières
Patients âgés
Sequase XR n’est pas homologué pour le traitement des symptômes psychotiques ou des troubles du comportement chez les patients âgés souffrant de démence (voir «Mises en garde et précautions»). On ne dispose pas de données d’études sur l’utilisation chez les patients âgés de plus de 65 ans lors d’un épisode dépressif dans le cadre d’un trouble bipolaire (voir «Mises en garde et précautions»). Comme d’autres neuroleptiques et antidépresseurs, Sequase XR doit être utilisé avec prudence chez les patients âgés, surtout au début du traitement. L’augmentation de la dose doit être faite plus lentement et les doses quotidiennes seront plus faibles que chez les patients plus jeunes, étant donné que la clairance plasmatique de la quétiapine est réduite chez les patients âgés (voir «Pharmacocinétique»). La dose initiale chez les patients âgés doit être de 50 mg par jour. Elle peut être augmentée par paliers de 50 mg par jour jusqu’à obtention de la dose efficace, laquelle dépendra de la réponse individuelle et de la tolérance du traitement.
Chez les patients âgés souffrant d’épisodes dépressifs (épisodes d’un trouble dépressif majeur), on commencera avec la dose la plus faible (50 mg). Une éventuelle augmentation de la dose doit absolument se faire lentement et en plusieurs paliers, en fonction de la tolérance individuelle du patient. Ce faisant, on tiendra compte en particulier de la médication antidépressive de base mais aussi des éventuelles maladies associées (comorbidité) et des interactions potentielles avec la co-médication (voir également «Mises en garde et précautions»).
Enfants et adolescents
Étant donné que ni la sécurité ni l’efficacité de Sequase XR n’ont été démontrées chez les enfants et les adolescents, il ne faut pas utiliser ce médicament dans ces tranches d’âge.
Patients présentant des troubles de la fonction rénale
Aucune adaptation de la dose n’est nécessaire.
Patients présentant des troubles de la fonction hépatique
La quétiapine est largement métabolisée dans le foie. Par conséquent, Sequase XR doit être utilisé avec prudence – surtout au début du traitement – chez les patients souffrant d’une insuffisance hépatique connue. En cas d’insuffisance hépatique, la dose initiale est de 50 mg le premier jour. Elle peut être augmentée par la suite par paliers de 50 mg par jour jusqu’à obtention de la dose efficace en fonction de la réponse individuelle du patient et de la tolérance du traitement.
Contre-indicationsSequase XR est contre-indiqué chez les patients présentant une hypersensibilité connue à l’un des composants, ainsi qu’en période d’allaitement.
L’utilisation concomitante d’inhibiteurs du CYP450 3A4 tels que les antifongiques azolés, les inhibiteurs de la protéase du VIH, l’érythromycine, la clarithromycine ou la néfazodone est contre-indiquée (voir aussi «Interactions»).
Mises en garde et précautionsComme Sequase XR est indiqué dans le traitement de la schizophrénie, des troubles bipolaires ainsi qu’en traitement adjuvant d’épisodes dépressifs chez des patients présentant un trouble dépressif majeur, le profil de sécurité devra être considéré en fonction du diagnostic individuel du patient et de la dose reçue.
L’efficacité et la sécurité à long terme d’une utilisation en traitement adjuvant chez des patients présentant un trouble dépressif majeur n’ont pas été évaluées.
Système cardio-vasculaire
La prudence est de rigueur lors de l’utilisation de la quétiapine chez des patients dont on sait qu’ils souffrent d’une maladie cardio-vasculaire, d’une maladie cérébrovasculaire ou d’une autre affection prédisposant à une hypotension. La quétiapine peut entraîner une hypotension orthostatique, surtout pendant la phase initiale de titration de la dose. Par conséquent, on envisagera dans de tels cas une réduction de la dose ou une adaptation plus lente de la dose. Chez les patients souffrant d’une maladie cardio-vasculaire connue, on prévoira éventuellement un schéma plus lent d’augmentation de la dose. La prudence est de mise chez les patients présentant une prédisposition à un allongement de l’intervalle QTc.
Problèmes de déglutition et aspiration
Des problèmes de déglutition et des aspirations ont été rapportés chez des patients traités par Sequase XR (voir «Effets indésirables»). La quétiapine doit être utilisée avec prudence chez les patients présentant un risque de pneumonie par aspiration.
Constipation et occlusion intestinale
La constipation est un facteur de risque d’occlusion intestinale. Une constipation et une occlusion intestinale ont été rapportées au cours du traitement par la quétiapine (voir «Effets indésirables»), dont des cas mortels chez des patients présentant un risque élevé d’occlusion intestinale, y compris des patients recevant une polymédication diminuant la motilité intestinale, et/ou chez des patients ne signalant éventuellement pas les symptômes de constipation.
Allongement de l’intervalle QT
Dans des études cliniques et lors d’une administration conformément à l’usage prévu, Sequase XR n’a pas été associé à un allongement persistant de l’intervalle QT absolu. En revanche, un allongement de l’intervalle QT a été observé lors de surdosages. Comme tous les autres neuroleptiques, Sequase XR doit être utilisé avec prudence chez les patients présentant des affections cardio-vasculaires ou des antécédents familiaux d’allongements de l’intervalle QT. De même, la prudence est de rigueur si Sequase XR est administré en même temps que des médicaments connus pour induire un allongement de l’intervalle QTc. Il en va de même pour l’administration concomitante de neuroleptiques, notamment chez les patients âgés et les patients atteints d’un syndrome congénital du QT long, d’insuffisance cardiaque sévère, d’hypertrophie cardiaque, d’hypokaliémie ou d’hypomagnésémie (voir rubrique «Interactions»).
Cardiomyopathie et myocardite
Une cardiomyopathie et une myocardite ont été rapportées au cours d’études cliniques et après la commercialisation; le lien de causalité avec la quétiapine n’a pas pu être exclu. Il convient de reconsidérer le traitement par la quétiapine chez les patients chez qui on suspecte une myocardite ou une myopathie.
Réactions cutanées sévères
Lors du traitement par la quétiapine, des réactions médicamenteuses indésirables pouvant menacer le pronostic vital à type de réactions médicamenteuses cutanées sévères (SCAR), y compris syndrome de Stevens-Johnson (SJS), nécrolyse épidermique toxique (NET), pustulose exanthémateuse aiguë généralisée (PEAG), érythème polymorphe (EP) et syndrome de réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) ont été signalées. Les SCAR surviennent après la première administration de quétiapine, dans la plupart des cas de manière retardée et comprennent fréquemment un ou plusieurs des symptômes: éruption cutanée étendue (pouvant être prurigineuse ou associée à des pustules), dermatite exfoliative (dans le cas du SJS et de la NET, les muqueuses sont atteintes), éosinophilie ou neutrophilie, fièvre, lymphadénopathie, et dans le cas du syndrome DRESS, éventuellement une ou plusieurs complications systémiques telles qu’hépatite, néphrite, pneumonie, myocardite et péricardite. En cas d’apparition de ces réactions, il faut immédiatement arrêter le traitement par la quétiapine.
Crises d’épilepsie
Les études cliniques contrôlées n’ont pas montré de différences entre les patients traités par la quétiapine et ceux du groupe placebo sur le plan de la survenue des crises d’épilepsie. Comme les autres antipsychotiques, la quétiapine doit être utilisée avec prudence chez les patients qui ont des antécédents de crises d’épilepsie ou qui souffrent de maladies qui abaissent le seuil épileptogène (par exemple maladie d’Alzheimer) (voir «Effets indésirables»).
Somnolence
Le traitement par la quétiapine était associé à une somnolence et à des symptômes apparentés tels qu’une sédation (voir «Effets indésirables»). Dans les études cliniques sur le traitement de patients souffrant de dépression dans le cadre d’un trouble bipolaire ou un trouble dépressif majeur, les symptômes sont apparus normalement dans les 3 premiers jours du traitement et ont été d’intensité légère à modérée. Les patients en phase de dépression bipolaire et les patients présentant un épisode dépressif majeur qui souffrent d’une somnolence d’intensité sévère doivent être contrôlés plus fréquemment, au moins pendant les deux premières semaines suivant la première apparition de la somnolence ou jusqu’à une régression des symptômes / jusqu’à ce qu’un arrêt du traitement soit envisagé.
Apnée du sommeil
La quétiapine doit être utilisée avec prudence chez les patients qui prennent simultanément un médicament dépresseur du système nerveux central et qui ont des antécédents d’apnée du sommeil ou qui ont un risque d’apnée du sommeil.
Dyskinésies tardives et symptômes extrapyramidaux (EPS)
Les dyskinésies tardives sont des mouvements dyskinétiques involontaires, en partie irréversibles, pouvant se développer chez les patients traités par des neuroleptiques, y compris la quétiapine. Elles peuvent également apparaître peu de temps déjà (quelques mois) après l’instauration d’un traitement par un neuroleptique. S’il apparaît des signes ou symptômes de dyskinésie tardive, il faut envisager une réduction de la dose ou un arrêt du traitement. Les symptômes d’une dyskinésie tardive peuvent encore s’aggraver après la fin du traitement, ou même n’apparaître qu’après la fin du traitement (voir «Effets indésirables»). L’utilisation de la quétiapine a été associée à l’apparition d’une akathisie, caractérisée par une agitation subjectivement désagréable ou inquiétante et la nécessité de bouger souvent liée à une incapacité à rester tranquillement assis ou debout. Ce tableau survient principalement au cours des premières semaines du traitement. Une augmentation de la dose peut s’avérer nuisible chez les patients qui développent ces symptômes.
Des taux plus élevés de symptômes extrapyramidaux ont été observés chez des patients traités par la quétiapine par comparaison avec des patients sous placebo lors d’études cliniques à court terme, contrôlées versus placebo, portant sur le trouble dépressif majeur et la dépression bipolaire. Lors d’études cliniques à court terme, contrôlées versus placebo, portant sur la dépression bipolaire, l’incidence totale des symptômes extrapyramidaux était de 8,9% pour la quétiapine comparée à 3,8% pour le placebo. Dans la dépression bipolaire et le trouble dépressif majeur, l’incidence des effets indésirables individuels (tels qu’akathisie, troubles extrapyramidaux, tremblements, dyskinésie, dystonie, agitation, contractions musculaires involontaires, hyperactivité psychomotrice et rigidité musculaire) n’excédait pas 4% dans aucun des groupes de traitement. Lors d’études cliniques à court terme, contrôlées versus placebo, portant sur la schizophrénie ou la manie bipolaire chez des patients adultes, l’incidence totale de symptômes extrapyramidaux a été similaire sous toutes les doses thérapeutiques de quétiapine et sous placebo (schizophrénie: quétiapine 7,8% et placebo 8,0%; manie bipolaire: quétiapine 11,2% et placebo 11,4%). Lors d’études à long terme contrôlées versus placebo, portant sur la schizophrénie ou la manie bipolaire chez des patients adultes, les EPS observés au cours du traitement se sont manifestés avec une incidence totale (ajustée à la dose) similaire sous quétiapine et sous placebo.
Syndrome malin des neuroleptiques
Des cas de syndrome malin des neuroleptiques ont été observés sous quétiapine (voir section «Effets indésirables»). Cliniquement, ce syndrome se manifeste comme suit: hyperthermie, modification de l’état mental, rigidité musculaire, instabilité végétative et augmentation du taux de créatine phosphokinase. Dans ce cas, il faut arrêter le traitement par la quétiapine et instaurer un traitement médical approprié.
Syndrome sérotoninergique
Dans des cas isolés, un syndrome sérotoninergique peut se développer sous traitement par la quétiapine, sans toutefois qu’un rapport de causalité ne soit obligatoirement présent. Le syndrome se manifeste notamment lors de l’administration concomitante de substances sérotoninergiques ainsi que d’autres substances ayant une composante sérotoninergique comme par ex. les inhibiteurs de la MAO et les sels de lithium. Parce que ces syndromes peuvent conduire à des états menaçant le pronostic vital, le traitement par la quétiapine devra être interrompu si de tels cas surviennent (caractérisés par une série de symptômes apparaissant ensemble tels qu’hyperthermie, rigidité, myoclonie, instabilité du système nerveux autonome accompagnée d’éventuelles fluctuations rapides des signes vitaux, modifications de l’état psychique incluant confusion mentale, irritabilité, agitation extrême évoluant vers un délire et un coma) et un traitement symptomatique devra être instauré. Dans certaines conditions, un traitement aux soins intensifs avec des mesures spécifiques peut être nécessaire.
Inhibiteurs et inducteurs enzymatiques
On peut noter un allongement de l’intervalle QTc, surtout en cas d’administration concomitante d’inhibiteurs de l’iso-enzyme 3A4 du cytochrome P450 (voir «Interactions»).
Lors d’une prise concomitante de quétiapine et d’inducteurs puissants des enzymes hépatiques tels que la carbamazépine ou la phénytoïne, la concentration plasmatique de quétiapine est considérablement réduite, ce qui peut influencer l’efficacité du traitement par la quétiapine. Chez les patients traités par des médicaments inducteurs des enzymes hépatiques, le traitement par la quétiapine ne doit être initié que si le médecin traitant juge que les bénéfices possibles d’un traitement par la quétiapine sont plus importants que le risque associé à un arrêt du médicament inducteur des enzymes hépatiques. Il est important que toute modification concernant le traitement par le médicament inducteur des enzymes hépatiques soit faite progressivement et que le médicament en question soit remplacé au besoin par un agent non inducteur des enzymes hépatiques (p. ex. valproate de sodium).
Neutropénie sévère et agranulocytose
Dans des études cliniques à court terme, en monothérapie et contrôlées contre placebo, une neutropénie sévère sans infections a été occasionnellement rapportée (granulocytes neutrophiles <0.5 x 109/l). Des cas d’agranulocytose (neutropénie sévère accompagnée de la survenue d’infections) ont été rapportés chez des patients traités par la quétiapine tant dans le cadre d’études cliniques (rares) qu’après la commercialisation (y compris des cas mortels). Les cas de neutropénie sévère sont apparus en majorité dans les deux mois suivant le début du traitement par la quétiapine, mais des cas isolés sont également connus qui sont apparus plus tard. Aucune dose-dépendance n’était décelable. Dans l’expérience post-commercialisation, la leucopénie et/ou neutropénie a régressé après arrêt du traitement par la quétiapine. Les facteurs de risque possibles pour l’apparition d’une neutropénie sont la présence d’un faible taux de leucocytes ainsi que des antécédents de neutropénie médicamenteuse. Des cas d’agranulocytose ont été observés chez des patients sans facteurs de risque préexistants. Une neutropénie doit être suspectée chez les patients présentant des infections, surtout lorsque ceux-ci ne présentent pas de prédisposition manifeste ou ont une fièvre inexpliquée. La neutropénie doit faire l’objet d’un traitement approprié sur le plan clinique. La quétiapine doit être interrompue chez les patients ayant un taux de granulocytes neutrophiles <1,0 x 109/l. Surveiller les patients à la recherche des signes et symptômes d’une infection et contrôler les taux de granulocytes neutrophiles jusqu’à ce qu’ils dépassent 1,5 x 109/l (voir «Effets indésirables»).
Poids
Des prises de poids ont été rapportées chez des patients traités par la quétiapine. Ces prises de poids doivent être contrôlées et traitées sur le plan clinique conformément aux directives en usage pour les maladies psychotiques (voir «Effets indésirables»). Lors d’études à court terme, à doses fixes (de 50 mg/jour à 800 mg/jour), contrôlées versus placebo (portant sur 3 à 8 semaines), la prise de poids moyenne chez les patients traités par la quétiapine était de 0,8 kg pour la dose de 50 mg par jour à 1,4 kg pour la dose de 600 mg par jour (avec une prise de poids plus faible pour la dose de 800 mg par jour), par rapport à 0,2 kg chez les patients sous placebo. Le pourcentage de patients traités par la quétiapine qui ont présenté une prise de poids ≥7% allait de 5,3% pour la dose de 50 mg par jour à 15,5% pour la dose de 400 mg par jour (avec une prise de poids plus faible aux doses de 600 et 800 mg par jour), par rapport à 3,7% pour les patients sous placebo.
Hyperglycémie
Une hyperglycémie et/ou le développement ou l’aggravation d’un diabète – occasionnellement avec acidocétose ou coma – ont été rapportés. Certains de ces cas ont été mortels (voir «Effets indésirables»). Une prise de poids ayant précédé de tels effets indésirables a été rapportée dans certains cas et pourrait éventuellement avoir joué le rôle de facteur prédisposant. Une surveillance clinique appropriée en accord avec les directives en usage pour les maladies psychotiques est recommandée. Il convient de prêter attention aux signes et symptômes éventuels d’une hyperglycémie (par exemple polydipsie, polyurie, polyphagie et état de faiblesse) chez les patients traités avec des médicaments antipsychotiques tels que la quétiapine. Les patients diabétiques ou à risque de développer un diabète doivent être soumis à des examens réguliers pour détecter toute détérioration du contrôle glycémique. Le poids corporel doit être contrôlé régulièrement.
Lipides
Des augmentations des taux de triglycérides, de LDL-cholestérol et de cholestérol total ainsi que des réductions des taux de HDL-cholestérol ont été observées sous quétiapine dans des études cliniques (voir «Effets indésirables»). Des contrôles réguliers doivent être effectués chez les patients présentant des valeurs anormales préexistantes des lipides sanguins. Les dyslipidémies doivent être traitées de façon adéquate.
Risque métabolique
Au vu des variations observées du poids, de la glycémie (voir «Hyperglycémie») et – comme constaté dans des études cliniques – des lipides, il se peut que des patients individuels subissent une détérioration de leur profil de risque métabolique et doivent alors recevoir un traitement clinique approprié.
Pathologie hépatique
La prudence est de rigueur lors de l’utilisation de la quétiapine chez les patients présentant une hépatopathie préexistante, chez les patients qui sont traités par des médicaments potentiellement hépatotoxiques, ou si des signes ou symptômes d’une perturbation de la fonction hépatique surviennent pendant le traitement par la quétiapine. De très rares cas de défaillance hépatique, y compris des cas mortels, ont été rapportés depuis la commercialisation. De rares cas d’hépatites sont survenus au cours des études cliniques. Depuis la commercialisation, on a enregistré de rares cas d’hépatites (avec ou sans ictère) chez les patients avec ou sans antécédents. Des stéatoses hépatiques et des lésions hépatiques cholestatiques ou mixtes sont également survenues rarement après commercialisation. Il est recommandé de réaliser un examen clinique standard, y compris une mesure des transaminases, chez les patients qui, avant le traitement par la quétiapine, présentent une fonction hépatique anormale connue ou suspectée. Pour ces patients, ainsi que pour les patients qui développent pendant le traitement par la quétiapine des signes ou symptômes indiquant une nouvelle flambée de la maladie hépatique, il est recommandé de réaliser une réévaluation clinique périodique par la mesure des taux de transaminases.
Pancréatite
Des cas de pancréatites ont été rapportés lors des études cliniques et après commercialisation, sans qu’un rapport de causalité puisse être démontré. Parmi les cas rapportés après commercialisation, de nombreux patients présentaient des facteurs connus de prédisposition à des pancréatites tels qu’un taux de triglycérides élevés (voir «Lipides» ci-dessus), des calculs biliaires et une consommation d’alcool.
Hypothyroïdie
Des réductions des taux d’hormones thyroïdiennes ont été observées sous quétiapine, surtout pendant les premières semaines du traitement. Les patients dont on sait qu’ils présentent une hyperthyroïdie doivent être soumis à des contrôles réguliers des hormones thyroïdiennes (voir «Effets indésirables»).
Syndrome de sécrétion inadéquate d’ADH (SIADH)
Dans des cas isolés, un syndrome de sécrétion inadéquate d’ADH peut apparaître, sans toutefois qu’un rapport de causalité ne soit obligatoirement présent. Un contrôle régulier des électrolytes est recommandé.
Patients âgés (>65 ans) souffrant d’une démence
La quétiapine n’est pas autorisée dans le traitement des symptômes psychotiques ou des troubles du comportement chez les patients souffrant de démence et n’est donc pas recommandée dans ce groupe de patients.
Dans des études randomisées et contrôlées contre placebo auprès d’une population de patients souffrant de démence, on a observé sous certains neuroleptiques atypiques un risque environ triplé d’effets indésirables cérébrovasculaires. On ignore quel mécanisme est à l’origine de cette augmentation du risque. Une augmentation du risque dans ce sens ne peut pas être exclue pour d’autres neuroleptiques ou pour d’autres populations de patients. La prudence est donc de mise lors d’une utilisation de la quétiapine chez des patients présentant des facteurs de risque d’accidents cérébraux vasculaires.
Dans des études cliniques contrôlées versus placebo, menées auprès de patients âgés souffrant de psychose associée à une démence, l’incidence d’événements cérébrovasculaires indésirables pour 100 années-patients n’était pas plus élevée sous quétiapine que chez les patients sous traitement par placebo.
Une méta-analyse effectuée sur les neuroleptiques atypiques a montré que les patients âgés souffrant d’une psychose due à la démence ont un risque de mortalité plus élevé dans le cadre d’un traitement par ces agents en comparaison avec les patients de ce type sous placebo. Dans deux études de 10 semaines sur la quétiapine, contrôlées versus placebo auprès de la même population de patients (n = 710, âge moyen 83 ans [56 à 99 ans]), le taux de mortalité des patients sous quétiapine a toutefois été de 5,5% versus 3,2% sous placebo. Les causes de décès constatées chez les patients de ces études étaient très variées et correspondaient aux risques attendus dans une telle population. Ces données ne démontrent par conséquent aucun rapport causal entre la quétiapine et une mortalité accrue chez les patients déments âgés.
Suicide, idées suicidaires ou aggravation clinique
Les dépressions sont associées à un risque accru d’idées suicidaires, d’auto-agression et de suicide (événements de type suicidaire). Ce risque reste présent jusqu’à ce qu’une rémission notable soit atteinte. L’amélioration n’étant pas forcément obtenue dès les premières semaines du traitement, les patients doivent être surveillés étroitement jusqu’à une amélioration. L’expérience clinique montre que le risque de suicide peut être accru ou réapparaître au moment où le patient commence à guérir. Les patients (et le personnel soignant) devront être avertis de la nécessité de surveiller l’apparition d’une aggravation éventuelle de l’état (y compris le développement de nouveaux symptômes), de pensées d’auto-agression et/ou d’idées ou de comportements suicidaires, et qu’ils demandent immédiatement une assistance médicale lorsque ces symptômes surviennent. Le risque d’idées suicidaires et de tentatives de suicide est accru chez les patients ayant déjà présenté par le passé des idées ou des comportements suicidaires. La littérature décrit une série d’autres facteurs de risque tels que par exemple les symptômes extrapyramidaux (EPS).
De plus, les médecins doivent tenir compte du risque potentiel de suicides, d’idées suicidaires ou d’auto-agression après l’arrêt abrupt du traitement par la quétiapine.
Les autres troubles psychiatriques pour lesquels Sequase XR est prescrit peuvent également être associés à un risque accru d’événements de type suicidaire. De plus, ces maladies peuvent être accompagnées d’épisodes dépressifs (épisodes dépressifs majeurs). Les mêmes précautions que pour le traitement d’épisodes dépressifs (épisodes dépressifs majeurs) doivent donc être appliquées au traitement des patients souffrant d’autres maladies psychiatriques.
Dans des études cliniques auprès de patients en phase de dépression sévère dans le cadre du trouble bipolaire, le risque de suicide, d’idées suicidaires et d’auto-agression était plus élevé sous quétiapine que sous placebo (3% vs 0%) chez les jeunes adultes de moins de 25 ans. Lors d’études cliniques chez des patients adultes de moins de 25 ans présentant un trouble dépressif majeur, l’incidence des événements de type suicidaire était de 2,1% (3/144) pour la quétiapine et 1,3% (1/75) pour le placebo.
Une méta-analyse réalisée par la FDA, portant sur des études cliniques contrôlées par placebo qui avaient examiné des antidépresseurs chez environ 4400 enfants et adolescents et chez 77000 adultes souffrant de maladies psychiatriques, a révélé un risque plus élevé de comportements suicidaires sous antidépresseurs que sous placebo chez les enfants, les adolescents et les jeunes adultes de moins de 25 ans. La quétiapine n’était pas incluse dans cette méta-analyse (voir «Propriétés/Effets», «Pharmacodynamique»).
Effets anticholinergiques (muscariniques)
La norquétiapine, un métabolite actif de la quétiapine, possède une affinité modérée à forte pour différents sous-types de récepteurs muscariniques. Ceci engendre des effets indésirables attribués aux effets anticholinergiques, lorsque la quétiapine est administrée aux doses recommandées ou en cas d’administration concomitante de quétiapine et de médicaments avec des propriétés anticholinergiques, et lors de surdosage. La quétiapine doit être utilisée avec prudence chez les patients qui prennent un médicament avec des effets anticholinergiques (muscariniques). La quétiapine doit être utilisée avec prudence chez les patients présentant un diagnostic ou des antécédents de rétention urinaire, une hypertrophie prostatique cliniquement significative, une occlusion intestinale ou un état similaire, une pression intra-oculaire élevée ou un glaucome à angle fermé (voir «Interactions», «Effets indésirables», «Propriétés/Effets, Pharmacodynamique et Mécanisme d’action» et «Surdosage»).
Mésusage et abus
Des cas de mésusage et d’abus ont été rapportés. La prudence est requise lorsque la quétiapine est prescrite aux patients ayant des antécédents d’alcoolisme ou de toxicomanie.
Excipients revêtant un intérêt particulier
Lactose
Les comprimés retard Sequase XR contiennent du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Sodium
Comprimé retard de 50 mg, 150 mg et 200 mg
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé retard, c.-à-d. qu'il est essentiellement «sans sodium».
Comprimé retard de 300 mg et 400 mg
Ce médicament contient 23,45 mg de sodium par comprimé retard, ce qui équivaut à 1,18% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
InteractionsÉtant donné que la quétiapine agit sur le système nerveux central, il faut être prudent quand on l’associe à d’autres médicaments d’effet central et éviter la consommation concomitante d’alcool.
Le cytochrome P450 (CYP) 3A4 est la principale enzyme responsable du métabolisme de la quétiapine dépendant du cytochrome P450. Dans une étude d’interaction menée auprès de volontaires sains, l’administration concomitante de quétiapine (25 mg) et de kétoconazole a provoqué une augmentation de 5 à 8 fois de l’AUC de la quétiapine. C’est pourquoi l’administration concomitante de Sequase XR et d’inhibiteurs puissants du CYP 3A4 est contre-indiquée. De même, le patient ne doit pas consommer de jus de pamplemousse pendant le traitement par Sequase XR.
Les paramètres pharmacocinétiques de la quétiapine sont restés inchangés lors d’une administration concomitante de cimétidine, un inhibiteur modérément puissant du CYP2D6 et du CYP3A4. L’administration de quétiapine en association avec des antidépresseurs tels que l’imipramine (un inhibiteur du CYP2D6) ou la fluoxétine (un inhibiteur du CYP3A4 et du CYP2D6) n’a pas entraîné de modifications significatives des paramètres pharmacocinétiques de la quétiapine.
La prudence est de mise lors de l’administration à des patients qui sont traités par d’autres médicaments exerçant des effets anticholinergiques (muscariniques) (voir «Mises en garde et précautions»).
Lors de co-médication au lithium, les taux de lithium devront être régulièrement déterminés, car une augmentation des taux de lithium ne peut pas être complètement exclue.
Les paramètres pharmacocinétiques du valproate de sodium et de la quétiapine ne sont pas modifiés de manière cliniquement significative lorsque les deux substances sont administrées simultanément.
L’administration concomitante de rispéridone ou d’halopéridol (des antipsychotiques) ne modifie pas notablement les paramètres pharmacocinétiques de la quétiapine.
Une étude avec des doses multiples a examiné la pharmacocinétique de 300 mg de quétiapine avant et pendant un traitement simultané avec 200 mg de carbamazépine (un inducteur enzymatique microsomal connu) chez les patients. L’administration simultanée de carbamazépine a entraîné, par rapport à la prise de quétiapine seule, une hausse significative de la clairance de la quétiapine, qui a provoqué une diminution de la biodisponibilité de la quétiapine (mesure de l’AUC) jusqu’à 13% en moyenne. Cet effet a même été observé de manière renforcée chez quelques patients. En raison de cette interaction marquée, le traitement simultané par la carbamazépine, qui ne s’est d’ailleurs pas montré supérieur au traitement par la carbamazépine seule, n’est pas recommandé.
L’administration concomitante de quétiapine et de phénytoïne a entraîné une augmentation de la clairance de la quétiapine d’environ 450%. Chez les patients traités par des médicaments inducteurs des enzymes hépatiques, le traitement par la quétiapine ne doit être initié que si les bénéfices possibles d’un traitement par la quétiapine sont plus importants que le risque associé à un arrêt du médicament inducteur des enzymes hépatiques. Toute modification concernant l’inducteur des enzymes hépatiques doit être faite progressivement. Au besoin, l’inducteur doit être remplacé par un agent non inducteur des enzymes hépatiques (p. ex. valproate de sodium).
Chez des patients qui prenaient de la quétiapine, des résultats faux positifs des tests immuno-enzymatiques de détection de la méthadone et des antidépresseurs tricycliques ont été rapportés. En cas de résultats douteux de tests immunologiques, il est recommandé de procéder à une vérification à l’aide de méthodes chromatographiques appropriées.
Grossesse, AllaitementGrossesse
Il n’existe pas de données cliniques concernant l’emploi chez la femme enceinte. Des troubles de la fertilité et du développement fœtal sont apparus chez des animaux à des doses élevées, toxiques pour la mère. C’est pourquoi la quétiapine ne devrait pas être utilisée durant la grossesse, sauf en cas de nécessité absolue. Si une interruption du traitement est nécessaire pendant la grossesse, l’arrêt de l’administration ne doit pas être abrupt (voir «Posologie/Mode d’emploi»).
Troisième trimestre
Effets non tératogènes: les nouveau-nés dont les mères ont pris des neuroleptiques (y compris la quétiapine) pendant le troisième trimestre de la grossesse ont un risque de symptômes extrapyramidaux et/ou de symptômes de sevrage après la naissance (voir «Effets indésirables»). Ces symptômes chez le nouveau-né peuvent inclure une agitation, un tonus musculaire anormalement augmenté ou réduit, des tremblements, une somnolence, des difficultés respiratoires ou des difficultés d’alimentation. Ces complications peuvent se manifester avec une intensité variable. Elles ont été autolimitées dans certains cas, tandis qu’elles ont exigé dans d’autres cas une surveillance du nouveau-né à l’unité des soins intensifs ou une hospitalisation prolongée du nouveau-né.
Allaitement
Des rapports publiés ont montré que la quétiapine est sécrétée dans le lait maternel. Le degré de cette sécrétion a cependant été inégal. C’est pourquoi les mères ne doivent pas allaiter pendant un traitement par la quétiapine.
Effet sur l’aptitude à la conduite et l’utilisation de machinesSequase XR a une certaine influence sur l’aptitude à la conduite ou l’utilisation de machines.
En raison de son effet central, Sequase XR peut perturber les activités qui exigent une bonne vigilance intellectuelle. C’est pourquoi les patients ne doivent ni conduire des véhicules ni utiliser des machines tant que leur sensibilité individuelle à ces effets n’est pas déterminée.
Effets indésirablesLes effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante:
Très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10’000 à <1/1000), très rares (<1/10’000), <0,01%, fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique
Fréquents: leucopénie (réduction d’une valeur initiale normale à une valeur pouvant être cliniquement significative [définie à <3 x109 leucocytes par litre] à un moment quelconque de toutes les études cliniques), neutropénie.
Occasionnels: anémie1, thrombocytopénie
Rares: agranulocytose (neutropénie sévère (<0,5 x 109/l) avec survenue d’infections, la fréquence fait référence aux données de toutes les études cliniques).
Affections du système immunitaire
Occasionnels: hypersensibilité
Très rares: choc anaphylactique
Troubles du métabolisme et de la nutrition
Très fréquents: prise de poids (définie comme une augmentation du poids correspondant à >7% du poids initial): 8 à 23%. Augmentation des taux sériques de triglycérides (taux de glycérides au moins une fois ≥200 mg/dl chez les patients âgés de ≥18 ans ou ≥150 mg/dl chez les patients âgés de <18 ans) et de cholestérol total (essentiellement LDL-cholestérol) (taux de cholestérol total au moins une fois >240 mg/dl chez les patients âgés de >18 ans ou ≥200 mg/dl chez les patients <18 ans). Réduction du taux de HDL-cholestérol (taux de HDL <40 mg/dl chez les hommes ou <50 mg/dl chez les femmes à un moment quelconque).
Fréquents: appétit accru
Occasionnels: perte de poids1
Très rares: diabète sucré, troubles diabétiques de l’équilibre hydrique, avec déshydratation ou hyperhydratation (celle-ci entre autres dans le cadre d’un SIADH, syndrome de sécrétion inappropriée d’hormone antidiurétique).
Affections psychiatriques
Fréquents: rêves inhabituels et cauchemars, idées et comportements suicidaires. Des cas d’idées et de comportements suicidaires ont été rapportés pendant un traitement par la quétiapine ou peu après l’arrêt du traitement (voir «Mises en garde et précautions»).
Rares: somnambulisme ou autres activités de ce type pendant le sommeil.
Fréquence indéterminée: agitation2
Affections du système nerveux
Très fréquents: somnolence (31,3%), surtout pendant les deux premières semaines du traitement; vertige (11,3%). Le vertige et la somnolence peuvent provoquer des chutes.
Symptômes extrapyramidaux (de façon générale)
Fréquents: dysarthrie
Occasionnels: crises convulsives, syndrome des jambes sans repos, dystonie aiguë, dyskinésie tardive, syncope (peut provoquer des chutes), état confusionnel
Très rares: hyperkinésie1
Fréquence indéterminée: akathisie2
Affections oculaires
Fréquents: vision trouble
Affections vasculaires
Fréquents: tachycardie, palpitations cardiaques, hypotension artérielle orthostatique (peut provoquer des chutes)
Occasionnels: vasodilatation, migraine, bradycardie, ischémie cérébrale, pouls irrégulier, anormalité de l’onde T, bloc AV, événements cérébrovasculaires, thrombose veineuse profonde, inversion de l’onde T
Rares: angine de poitrine, fibrillation auriculaire, bloc AV du 1er degré, insuffisance cardiaque congestive, sus-décalage du segment ST, thrombophlébite, aplatissement de l’onde T, anomalies du segment ST, allongement de l’espace QRS, allongement de l’intervalle QTc, thrombo-embolies veineuses
Fréquence indéterminée: cardiomyopathie, myocardite
Affections respiratoires, thoraciques et médiastinales
Fréquents: pharyngite1, toux accrue1, dyspnée1
Occasionnels: rhinite, asthme1, épistaxis1
Rares: hyperventilation1, hoquet1
Affections gastro-intestinales
Très fréquents: sécheresse buccale
Fréquents: constipation, dyspepsie, douleurs abdominales, vomissements (surtout chez les patients âgés de plus de 65 ans)
Rares: occlusion intestinale
Très rares: dysphagie, pancréatite1
Fréquence indéterminée: bézoard3
Affections hépatobiliaires
Fréquents: élévation de l’alanine aminotransférase sérique (ALAT), augmentation des taux de γ-GT
Occasionnels: augmentation du taux sérique d’aspartate aminotransférase (ASAT)
Rares: hépatite (avec ou sans ictère)
Très rares: stéatose hépatique, lésions hépatiques cholestatiques ou mixtes après commercialisation
Affections de la peau et du tissu sous-cutané
Fréquents: rash
Très rares: angioœdème
Fréquence indéterminée: nécrolyse épidermique toxique2, syndrome de Stevens-Johnson2, pustulose exanthémateuse aiguë généralisée (PEAG), érythème polymorphe (EP), syndrome de réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) ou complications (voir également «Mises en garde et précautions»), vascularite cutanée
Affections musculosquelettiques et du tissu conjonctif
Rares: augmentation du taux de CPK
Très rares: rhabdomyolyse2
Affections du rein et des voies urinaires
Occasionnels: rétention urinaire
Affections gravidiques, puerpérales et périnatales
Fréquence indéterminée: symptômes moteurs extrapyramidaux et/ou symptômes de sevrage chez le nouveau-né.
Affections des organes de reproduction et du sein
Rares: priapisme, galactorrhée
Troubles généraux
Très fréquents: céphalées, symptômes de sevrage (12%) tels qu’insomnie, nausées, diarrhées, vomissements, vertiges et irritabilité. Dans les études correspondantes, les symptômes de sevrage ont généralement disparu une semaine après l’arrêt du traitement.
Fréquents: asthénie, œdèmes périphériques, irritabilité, fièvre
Rares: syndrome malin des neuroleptiques (voir également «Mises en garde et précautions»), hypothermie
Très rares: syndrome sérotoninergique
Investigations
Très fréquents: réduction des taux d’hémoglobine (au moins une fois une réduction du taux d’hémoglobine à ≤13 g/dl chez l’homme ou à ≤12 g/dl chez la femme: chez 11% des patients sous quétiapine dans le cadre d’études cliniques, y compris l’étude d’extension ouverte. Dans le cadre d’études à court terme contrôlées par placebo, au moins une fois une réduction du taux d’hémoglobine à ≤13 g/dl chez l’homme ou à ≤12 g/dl chez la femme chez 8,3% des patients sous quétiapine, par rapport à 6,2% des patients sous placebo).
Fréquents: augmentation du nombre de granulocytes éosinophiles (passant d’une valeur initiale normale à une valeur pouvant être cliniquement significative [définie comme >1x109 granulocytes éosinophiles par litre] à un moment quelconque de toutes les études cliniques), augmentation du taux de sucre dans le sang allant jusqu’au niveau de l’hyperglycémie (au moins une fois un taux de glycémie ≥ 126 mg/dl à jeun ou un taux de glycémie ≥ 200 mg/dl pas à jeun) (voir «Mises en garde et précautions»), augmentation du taux sérique de prolactine (taux de prolactine chez les patients âgés de ≥18 ans: >20 μg/l chez les hommes, >30 μg/l chez les femmes à un moment quelconque), variations des taux d’hormones thyroïdiennes (réduction du taux de T4 totale, de T4 libre et de T3 totale; augmentation du taux de TSH; sur la base d’un passage de valeurs initiales normales à des valeurs pouvant être cliniquement significatives à un moment quelconque de toutes les études. Les variations des taux de T4 totale, de T4 libre, de T3 totale et de T3 libre étaient définies comme <0,8 x la LIN (pmol/l) et les variations des taux de TSH comme >5 mUI/l à un moment quelconque).
Occasionnels: réduction du taux de T3 libre.
Des élévations asymptomatiques (augmentations à plus de 3x la limite supérieure de la normale à un moment quelconque) des transaminases sériques (ALAT, ASAT) ou des taux de g-GT ont été observées chez quelques patients. Ses élévations étaient normalement réversibles lors de la poursuite du traitement.
Rares: augmentation des taux sanguins de créatinine phosphokinase. Les augmentations des taux sanguins de créatine phosphokinase signalées dans le cadre des études cliniques n’étaient pas associées à un syndrome malin des neuroleptiques.
Taux d’hormones thyroïdiennes
Le traitement par la quétiapine s’est accompagné de faibles diminutions dose-dépendantes des taux des hormones thyroïdiennes. Dans des études à court terme contrôlées par placebo, les incidences des variations des taux d’hormones thyroïdiennes pouvant être cliniquement significatives ont été les suivantes: T4 totale: 3,4% sous quétiapine versus 0,6% sous placebo; T4 libre: 0,7% sous quétiapine versus 0,1% sous placebo; T3 totale: 0,54% sous quétiapine versus 0,0% sous placebo; T3 libre: 0,2% sous quétiapine versus 0,0% sous placebo. L’incidence des variations des taux de TSH a été de 3,2% sous quétiapine versus 2,7% sous placebo. Dans les études de monothérapie à court terme contrôlées par placebo, l’incidence des variations réciproques des taux de T3 et de TSH pouvant être cliniquement significatives a été de 0,0% aussi bien sous quétiapine que sous placebo et l’incidence des variations du taux de T4 et de TSH a été de 0,1% sous quétiapine versus 0,0% sous placebo. D’une manière générale, de telles variations des taux d’hormones thyroïdiennes ne sont pas associées à une hypothyroïdie cliniquement symptomatique. La réduction des taux de T4 totale et de T4 libre était maximale pendant les six premières semaines de traitement par la quétiapine. Cette diminution ne s’est pas accentuée pendant la poursuite du traitement (traitement au long cours). Dans presque tous les cas, la diminution des taux de T4 totale et de T4 libre a été réversible après l’arrêt du traitement, indépendamment de la durée d’administration de la quétiapine. Chez 8 patients dont le taux de TBG (thyroxine binding globuline) a été déterminé, celui-ci était resté inchangé.
(1) Rapport causal incertain
(2) Sur la base de rapports post-commercialisation
(3) Uniquement en cas de surdosage
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn décès après un surdosage de 13,6 g de quétiapine (monothérapie) a été rapporté pendant une étude clinique. Dans le cadre des observations post-commercialisation, on a également enregistré des cas de décès après l’administration de doses de quétiapine à partir de 6 g déjà (monothérapie). En revanche, dans des études cliniques, des patients ont survécu à des surdosages aigus allant jusqu’à 30 g de quétiapine. La plupart des patients qui avaient ingéré une surdose n’ont rapporté aucun effet indésirable ou se sont rétablis sans séquelles ultérieures.
Signes et symptômes
Les symptômes observés étaient généralement imputables à un renforcement des effets pharmacologiques connus, c’est-à-dire somnolence et sédation, tachycardie, hypotension et effets anticholinergiques.
Dans le cadre des observations post-commercialisation, on a enregistré de rares cas de surdosage de quétiapine en monothérapie ayant entraîné le décès du patient ou un coma ou un allongement de l’intervalle QTc.
Les effets d’un surdosage peuvent représenter un risque pour les patients ayant une affection cardio-vasculaire sévère préexistante.
Traitement
On ne connaît pas d’antidote spécifique de la quétiapine. Dans les cas graves, il faut se demander si plusieurs médicaments ne sont pas en cause. Envisager un lavage gastrique (après intubation si le patient est sans connaissance) puis l’administration de charbon activé et d’un laxatif. Il est recommandé de traiter le patient en réanimation, avec notamment maintien de la respiration et surveillance du système cardio-vasculaire. En relation avec les symptômes anticholinergiques, des rapports publiés décrivent la suppression d’effets sévères sur le SNC, y compris d’un coma et d’un délire, suite à l’administration IV de physostigmine (1-2 mg) sous surveillance ECG continue.
Dans le cas d’un surdosage de quétiapine, on traitera une hypotension réfractaire et une syncope par des mesures appropriées telles qu’un apport liquidien i.v. et/ou une administration d’agents sympathomimétiques. On évitera l’administration d’adrénaline et de dopamine, étant donné qu’une stimulation β-adrénergique peut aggraver une hypotension lors d’un blocage α-adrénergique induit par la quétiapine.
Il faut étroitement surveiller le patient jusqu’à son rétablissement.
Un surdosage de Sequase XR peut entraîner la formation d’un bézoard de l’estomac. Il est donc recommandé de procéder aux examens diagnostiques appropriés par imagerie médicale afin d’orienter la suite de la prise en charge du patient. Il est possible qu’un lavage gastrique de routine ne permette pas d’éliminer le bézoard en raison de sa consistance gommeuse et gluante. L’élimination endoscopique du pharmacobézoard a été réalisée avec succès dans de nombreux cas.
Propriétés/EffetsCode ATC
N05AH04
Mécanisme d’action
La quétiapine est un antipsychotique atypique. La quétiapine et son métabolite actif norquétiapine (N-désalkyl-quétiapine) dans le plasma humain réagissent avec de nombreux types de récepteurs des neurotransmetteurs. La quétiapine et la norquétiapine présentent une affinité pour les récepteurs cérébraux de la sérotonine (récepteurs 5-HT2) et de la dopamine (récepteurs D1 et D2). On suppose que la combinaison de l’antagonisme des récepteurs (sélectivité plus importante pour les récepteurs 5HT2 que pour les récepteurs D2) explique les propriétés antipsychotiques de la quétiapine et la rareté des symptômes extrapyramidaux (EPS) en comparaison avec les neuroleptiques typiques. La quétiapine n’a pas d’affinité pour le transporteur de la noradrénaline (NET) et a une faible affinité pour le récepteur sérotoninergique 5-HT1A, tandis que la norquétiapine présente une forte affinité pour les deux. On suppose que l’inhibition du NET et l’activité agoniste partielle au niveau du site 5-HT1A provoquées par la norquétiapine contribuent à l’efficacité thérapeutique antidépressive de Sequase XR. La quétiapine et la norquétiapine ont une forte affinité pour les récepteurs histaminiques et α1-adrénergiques et une affinité modérée pour les récepteurs α2-adrénergiques. En outre, la quétiapine a une affinité faible ou nulle pour les récepteurs muscariniques, tandis que la norquétiapine a une affinité modérée à élevée pour différents sous-types de récepteurs muscariniques, ce qui permet d’expliquer les effets anticholinergiques (muscariniques).
Pharmacodynamique
La quétiapine se montre efficace dans les tests d’activité antipsychotiques tels que le test «d’évitement conditionné». De plus, elle neutralise l’effet des agonistes dopaminergiques tel qu’évalué sur la base de l’électrophysiologie ou de l’observation du comportement et provoque une augmentation de la concentration des métabolites de la dopamine, ce qui constitue un signe neurochimique de blocage des récepteurs D2.
Dans des études précliniques permettant de tirer des conclusions au sujet des EPS, la quétiapine se distingue des neuroleptiques standard et présente un profil atypique. La quétiapine administrée de façon chronique ne provoque pas une hypersensibilité du récepteur dopaminergique D2. À des doses provoquant un blocage efficace des récepteurs dopaminergiques D2, la quétiapine ne provoque qu’un faible degré de catalepsie. Après une administration chronique, on observe une sélectivité de la quétiapine envers le système limbique, avec bloc dépolarisant des neurones dopaminergiques mésolimbiques, mais non nigrostriataux. Chez des singes du genre Cebus avec ou sans sensibilisation à l’halopéridol, la quétiapine en administration à court terme ou chronique ne provoque qu’une dystonie minimale (voir «Effets indésirables»).
Cataracte/opacification du cristallin
Le potentiel d’induction d’une cataracte de Sequase et de la rispéridone a été évalué dans une étude clinique sur le traitement au long cours chez des patients souffrant de schizophrénie ou d’une maladie schizo-affective. Sequase, administré à des doses de 200 à 800 mg/jour, n’a pas été inférieur à la rispéridone, administrée à des doses de 2 à 8 mg/jour, en ce qui concerne le taux à 2 ans des événements caractérisés par une augmentation du degré d’opacité du cristallin (opacification du noyau, opacification corticale, opacification postérieure/sous-capsulaire) estimé selon le système LOCS II de classification de l’opacité du cristallin, chez des patients traités pendant au moins 21 mois (voir aussi à ce sujet «Données précliniques»). La surveillance dans d’autres études cliniques n’a révélé aucune opacification cornéenne d’origine médicamenteuse chez l’homme.
Efficacité clinique
Schizophrénie
L’efficacité de Sequase XR dans le traitement de la schizophrénie a été démontrée dans une étude de 6 semaines, contrôlée contre placebo, auprès de patients remplissant les critères de schizophrénie DSM-IV. Le critère primaire était la différence atteinte au score PANSS total entre le début de l’étude et le dernier contrôle. Sequase XR en doses de 400 mg par jour, 600 mg par jour et 800 mg par jour a permis une amélioration statistiquement significative des symptômes psychiques en comparaison avec le placebo. L’amélioration a été plus importante avec les doses de Sequase XR de 600 et de 800 mg qu’avec la dose de 400 mg.
Dans une autre étude, effectuée sur une durée de 6 semaines avec substance de contrôle active, des patients schizophrènes stables extra-hospitaliers sont passés de Sequase à Sequase XR. Le critère primaire était défini comme le pourcentage de patients non-répondeurs, c’est-à-dire quittant prématurément l’étude en raison d’une efficacité insuffisante ou présentant à un quelconque moment un score PANSS total augmenté de ≥20% par rapport au moment de la randomisation. Chez les patients prenant une dose constante de Sequase comprise entre 400 et 800 mg, l’efficacité a été maintenue lors d’un passage à la dose équivalente de Sequase XR (prise une fois par jour).
Dans une étude à long terme auprès de patients schizophrènes stables traités pendant 16 semaines par Sequase XR, ce traitement a été plus efficace que le placebo pour prévenir les récidives. Le risque estimé de récidives en 6 mois de traitement a été de 14,3% sous Sequase XR et de 68,2% sous placebo. La dose moyenne a été de 669 mg. Il n’y a pas eu de rapport supplémentaire jouant un rôle pour la sécurité dans le cadre du traitement par Sequase XR sur une période de jusqu’à 9 mois (7 mois en moyenne). Plus particulièrement, les rapports d’effets indésirables concernant des EPS et des prises de poids n’ont pas augmenté dans le cadre du traitement à long terme par Sequase XR.
Manie bipolaire
Une étude clinique de 3 semaines contrôlée contre placebo a démontré que Sequase XR utilisé en monothérapie à des doses de 400 à 800 mg par jour réduit significativement les symptômes de manie chez les patients bipolaires. La démonstration de l’efficacité de Sequase XR lors de troubles bipolaires s’appuie en partie sur une extrapolation de données obtenues dans les études sur Sequase comprimés pelliculés.
Dépression bipolaire
Une étude clinique de 8 semaines contrôlée contre placebo, menée auprès de patients subissant des épisodes dépressifs dans le cadre d’un trouble bipolaire de type I ou II, a montré que Sequase XR était efficace en dose de 300 mg par jour. Sequase XR a été supérieur au placebo en termes de réduction du score MADRS total. La démonstration de l’efficacité s’appuie en partie sur une extrapolation de données de Sequase comprimés pelliculés.
Dans une étude à long terme (jusqu’à 2 années de traitement) pour l’évaluation de la prévention des récidives chez des patients souffrant d’épisodes maniaques, dépressifs ou mixtes, le traitement par la quétiapine s’est montré supérieur au traitement par un placebo: la période jusqu’à un nouvel épisode aigu (maniaque, dépressif ou mixte) chez les patients atteints d’un trouble bipolaire de type I a été prolongée. Le nombre des patients subissant de nouveaux épisodes a été de 91 (22,5%) dans le groupe sous quétiapine, de 208 (51,5%) dans le groupe sous placebo et de 95 (26,1%) dans le groupe sous lithium. Chez les patients qui ont répondu à la quétiapine, les résultats ont montré qu’en comparaison avec une poursuite du traitement par la quétiapine, un passage au traitement par le lithium ne semble pas être associé à une prolongation de la durée jusqu’à la survenue d’un nouvel épisode affectant l’humeur.
Dans deux études de prévention des récidives pour l’évaluation de traitements associant Sequase à des thymorégulateurs chez des patients souffrant d’épisodes maniaques, dépressifs ou mixtes, le traitement associé à la quétiapine s’est montré supérieur aux thymorégulateurs seuls: il a prolongé la période jusqu’à un nouvel épisode aigu (maniaque, dépressif ou mixte). Sequase a été administré deux fois par jour à des doses quotidiennes de 400 à 800 mg, en association avec du lithium ou du valproate.
Épisodes dépressifs dans le trouble dépressif majeur
Deux études à court terme (6 semaines) ont inclus des patients qui avaient présenté une réponse insuffisante à au moins un antidépresseur. Sequase XR aux doses de 150 mg et 300 mg/jour, administré en traitement adjuvant d’un traitement antidépresseur en cours (amitriptyline, bupropion, citalopram, duloxétine, escitalopram, fluoxétine, paroxétine, sertraline ou venlafaxine), a montré une efficacité supérieure à l’antidépresseur seul dans la réduction des symptômes dépressifs, sur la base de la mesure de l’amélioration du score total MADRS (variation moyenne de 2 à 3,3 points comparativement au placebo).
Dans une analyse des items individuels du MADRS, la plus grande variation par rapport à la valeur initiale et la plus grande différence entre l’association Sequase XR + antidépresseur versus placebo + antidépresseur a été enregistrée pour l’item individuel «Insomnie» (voir graphique suivant).
Quétiapine XR comme traitement adjuvant
Analyse des items du MADRS - variation de la moyenne des moindres carrés (LSM change)
des items individuels du MADRS au bout de 6 semaines par rapport à la valeur initiale, données groupées des deux études 06 et 07 (les valeurs p sont indiquées dans les barres)
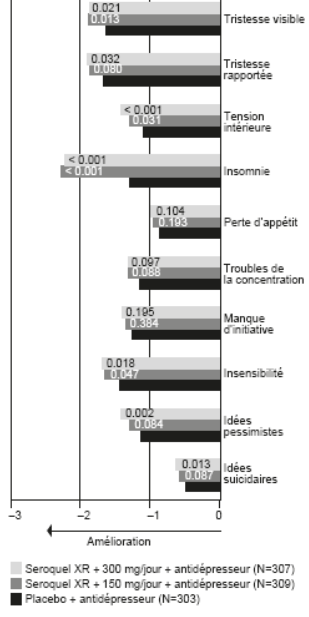
Prière de noter que, dans ces études, il n’a pas été procédé à des ajustements de multiplicité pour la prise en compte des items individuels du MADRS. Aussi les valeurs p nominales des items individuels du MADRS doivent-elles être interprétées en conséquence. Les valeurs individuelles ne sont présentées qu’à l’appui du critère primaire (nombre total de points du MADRS au bout de 6 semaines par rapport à la valeur initiale).
L’efficacité et l’innocuité à long terme n’ont pas été évaluées dans le traitement adjuvant de patients présentant des épisodes dépressifs (épisodes d’une dépression majeure).
PharmacocinétiqueAbsorption
Après administration orale, la quétiapine est bien résorbée. L’influence de l’ingestion de nourriture a été examinée dans une étude sur la biodisponibilité de la quétiapine. Un repas riche en graisses a provoqué une augmentation statistiquement significative de la Cmax et de l’AUC de Sequase XR. La Cmax était augmentée d’environ 50% et l’AUC d’environ 20%. Un repas léger, par contre, n’a pas eu d’influence significative sur la Cmax et l’AUC de la quétiapine. Il est recommandé de prendre Sequase XR une fois par jour sans ingestion de nourriture, au moins une heure avant un repas.
La pharmacocinétique de la quétiapine et de son métabolite actif, la norquétiapine, (N-désalkyl-quétiapine) est linéaire et proportionnelle à la dose pour les doses jusqu’à 800 mg avec prise 1x par jour.
La quétiapine et la norquétiapine atteignent leurs concentrations plasmatiques maximales environ 6 h (tmax) après l’administration de Sequase XR.
En comparant Sequase XR (administré 1x par jour) avec la même dose journalière de la formule à libération immédiate de quétiapine (Sequase, administré en 2 doses partielles par jour), l’aire sous la courbe de la concentration plasmatique en fonction du temps (AUC) est approximativement égale, mais la concentration plasmatique maximale (Cmax) à l’état d’équilibre est plus faible de 13%. En comparaison avec la formule à libération immédiate de quétiapine (Sequase), l’AUC du métabolite principal, la norquétiapine, après administration de Sequase XR est inférieure de 18%.
Distribution
Le taux de liaison de la quétiapine aux protéines plasmatiques est d’environ 83%. Le volume de distribution est d’environ 10 ± 4 litres/kg de poids corporel. À l’état d’équilibre, la concentration molaire maximale de norquétiapine représente 35% de la valeur observée pour la quétiapine.
Métabolisme
La quétiapine est largement métabolisée dans le foie. Des études menées in vitro montrent que c’est essentiellement l’iso-enzyme CYP3A4 du cytochrome P450 qui est responsable du métabolisme de la quétiapine. La norquétiapine est essentiellement formée et éliminée par l’iso-enzyme CYP3A4. On a observé in vitro que la quétiapine et plusieurs de ses métabolites (y compris la norquétiapine) inhibaient faiblement les iso-enzymes 1A2, 2C9, 2C19, 2D6 et 3A4 du cytochrome P450 humain; ce phénomène n’a toutefois été observé qu’à des concentrations 5 à 50 fois supérieures à celles obtenues avec la dose journalière recommandée, qui est de 300 mg à 800 mg. Au vu de ces données obtenues in vitro, il est peu vraisemblable que l’administration concomitante de quétiapine et d’autres médicaments induise une inhibition cliniquement notable du métabolisme cytochrome P450-dépendant des autres substances.
Élimination
La demi-vie d’élimination de la quétiapine et de la norquétiapine est respectivement d’environ 7 et 12 heures.
Environ 73% du médicament radiomarqué sont éliminés dans l’urine, 21% dans les selles. Moins de 5% de la fraction molaire moyenne de quétiapine libre et de norquétiapine sont excrétés dans les urines. Des études menées avec de la quétiapine marquée par un isotope radioactif montrent que moins de 5% de la molécule mère sont excrétés sous forme inchangée dans les urines et les selles.
Cinétique pour certains groupes de patients
Patients âgés
Chez les patients âgés, la clairance plasmatique moyenne de la quétiapine est réduite d’environ 30 à 50% par rapport à celle des adultes âgés de 18 à 65 ans.
Sexe
Il n’y a pas de différence entre les sexes du point de vue de la cinétique de la quétiapine.
Troubles de la fonction rénale
Chez des patients souffrant d’insuffisance rénale sévère (clairance de la créatinine inférieure à 30 ml/min/1,73 m²), on a observé une diminution d’environ 25% de la clairance plasmatique moyenne de la quétiapine, mais les valeurs individuelles de la clairance se situaient dans la fourchette normale (voir «Posologie/Mode d’emploi»).
Troubles de la fonction hépatique
En cas d’insuffisance hépatique (cirrhose alcoolique stable), la clairance plasmatique moyenne de la quétiapine est réduite d’environ 25%. Étant donné que la quétiapine est largement métabolisée dans le foie, les concentrations plasmatiques peuvent être augmentées en cas d’insuffisance hépatique, ce qui exige un ajustement de la dose chez ces patients (voir «Posologie/Mode d’emploi»).
Données précliniquesUne série d’études in vitro et in vivo sur la génotoxicité n’ont montré aucun signe indiquant une génotoxicité. En expérimentation animale, les modifications suivantes ont été observées après exposition cliniquement significative, sans toutefois être confirmées par des études cliniques à long terme: des dépôts de pigments ont été observés dans la thyroïde du rat; une hypertrophie des cellules thyroïdiennes folliculaires, une diminution du taux plasmatique de la T3 ainsi qu’une diminution de l’hémoglobinémie, des érythrocytes et des leucocytes ont été notées chez le singe cynomolgus; des opacifications du cristallin et des cataractes ont été trouvées chez le chien. Ces résultats doivent être pris en compte lors de l’évaluation du rapport risques-avantages chez un patient.
Des opacités du cristallin et des cataractes ont été observées chez le chien. Les cataractes postérieures triangulaires observées chez des chiens au bout de 6 mois d’administration de doses de 100 mg/kg/jour étaient en accord avec l’inhibition de la biosynthèse de cholestérol dans le cristallin. Aucune cataracte n’a été observée chez des singes cynomolgus traités avec des doses allant jusqu’à 225 mg/kg/jour ni chez des rongeurs (voir «Propriétés/Effets, Pharmacodynamique» pour des informations sur la clinique).
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C.
Conserver hors de portée des enfants.
Numéro d’autorisation63255 (Swissmedic)
PrésentationSequase XR 50 mg: 60 comprimés retard [B]
Sequase XR 150 mg: 60, 100 comprimés retard [B]
Sequase XR 200 mg: 60, 100 comprimés retard [B]
Sequase XR 300 mg: 60, 100 comprimés retard [B]
Sequase XR 400 mg: 60, 100 comprimés retard [B]
Titulaire de l’autorisationCHEPLAPHARM Schweiz GmbH, 4102 Binningen
Mise à jour de l’informationMars 2025
|

