Propriétés/EffetsCode ATC
A10BK01
Mécanisme d'action
La dapagliflozine est un inhibiteur sélectif et réversible du co-transporteur de sodium-glucose de type 2 (SGLT2), qui améliore le contrôle glycémique chez les patients diabétiques et présente des bénéfices cardio-rénaux.
L'inhibition du SGLT2 induite par la dapagliflozine réduit la réabsorption du glucose depuis le filtrat glomérulaire dans le tubule rénal proximal, tout en diminuant la réabsorption du sodium. Il en résulte une élimination du glucose par l'urine et une diurèse osmotique. La dapagliflozine augmente ainsi l'afflux de sodium vers le tubule distal, ce qui entraîne probablement une amplification du feedback tubulo-glomérulaire et une diminution de la pression intraglomérulaire. Parmi les effets secondaires de l'inhibition du SGLT2 par la dapagliflozine, on compte également une légère diminution de la tension artérielle, la perte de poids et l'augmentation de l'hématocrite.
La dapagliflozine améliore la glycémie à jeun et postprandiale en réduisant la réabsorption rénale du glucose et en favorisant ainsi son excrétion urinaire. Cette excrétion de glucose (effet glycosurique) est observée dès la première dose déjà, reste effective durant l'intervalle posologique de 24 heures et se maintient pendant toute la durée du traitement.
La quantité de glucose éliminée par le rein via ce mécanisme dépend de la glycémie et du TFG. Chez les sujets présentant un taux normal de glycémie et/ou un DFG faible, la dapagliflozine n'a donc qu'un faible potentiel d'induction d'hypoglycémie. La raison de ce phénomène est que la quantité de glucose filtrée est faible et qu'elle ne peut pas être réabsorbée par les transporteurs SGLT1 et les transporteurs SGLT2 non bloqués. La dapagliflozine agit indépendamment de la sécrétion et de l'action de l'insuline.
Le SGLT2 est exprimé sélectivement dans le rein. La dapagliflozine n'inhibe pas d'autres transporteurs du glucose importants pour le transport du glucose dans les tissus périphériques et est >1400 fois plus sélective pour le SGLT2 que pour le SGLT1, le principal transporteur intestinal chargé de l'absorption du glucose.
Pharmacodynamique
Une augmentation de la quantité de glucose excrétée dans l'urine a été observée chez les sujets sains et chez ceux atteints de diabète de type 2 suite à l'administration de la dapagliflozine. Près de 70 g de glucose ont été excrétés dans l'urine chaque jour avec une dose quotidienne de 10 mg de dapagliflozine administrée pendant 12 semaines à des patients atteints de diabète de type 2. Le taux d'excrétion maximale du glucose a été observé à une dose quotidienne de 20 mg de dapagliflozine. Une glycosurie était toujours manifeste chez des patients atteints de diabète de type 2 qui avaient reçu 10 mg/jour de dapagliflozine pendant 2 ans.
L'excrétion urinaire de glucose à 24 heures à l'état d'équilibre dépendait fortement de la fonction rénale. Les patients atteints d'un diabète de type 2 et présentant une fonction rénale normale ou une insuffisance rénale légère, modérée ou sévère ont ainsi respectivement éliminé 85, 52, 18 et 11 g de glucose/jour.
Cette glycosurie induite par la dapagliflozine entraîne également une diurèse osmotique ainsi qu'une augmentation du volume urinaire chez les patients présentant un diabète de type 2. L'augmentation du volume urinaire après un traitement par dapagliflozine 10 mg pendant 12 semaines et s'élevait à environ 375 ml/jour. L'augmentation du volume urinaire était associée à une augmentation légère et transitoire de l'excrétion urinaire du sodium, elle-même non liée à une modification de la concentration de sodium sérique.
L'excrétion urinaire de l'acide urique a également augmenté de manière transitoire (pendant 3 à 7 jours) et a été accompagnée d'une diminution durable de la concentration sérique d'acide urique. À 24 semaines, la diminution de la concentration sérique d'acide urique était comprise entre -18,3 à -48,3 µmol/l (de -0,33 à -0,87 mg/dl).
Efficacité clinique
Diabète
Afin d'évaluer l'efficacité et la sécurité de Forxiga, 22 études cliniques contrôlées, randomisées, menées en double aveugle ont été effectuées sur un total de 28'000 patients atteints de diabète de type 2; plus de 15'000 patients ont été traités par la dapagliflozine dans ces études. Dans la plupart des études, la durée du traitement était de 24 semaines; lors de la période d'extension en ouvert qui a suivi, les patients ont été traités sur une période allant jusqu'à 156 semaines.
L'effet de la dapagliflozine sur les événements cardiovasculaires chez les patients avec diabète de type 2 avec ou sans maladie cardiovasculaire manifeste a été évalué dans une importante étude des issues CV (DECLARE).
Contrôle glycémique
Monothérapie
Une étude en double aveugle contrôlée versus placebo de 24 semaines (avec une période d'extension additionnelle) a été menée afin d'évaluer la tolérance et l'efficacité de la dapagliflozine en monothérapie chez des patients atteints de diabète de type 2. Le traitement par une dose quotidienne de dapagliflozine a entraîné des diminutions statistiquement significatives de l'HbA1c par rapport au placebo (Tableau 2). Durant la période d'extension, la baisse de l'HbA1c s'est maintenue jusqu'à la semaine 102 (variation moyenne ajustée par rapport aux valeurs initiales de -0,63%, -0,77% et -0,18% pour dapagliflozine 10 mg, dapagliflozine 5 mg et le placebo, respectivement).
Tableau 2. Résultats à la semaine 24 (LOCFa) d'une étude contrôlée versus placebo avec la dapagliflozine en monothérapie
|
|
Monothérapie
| |
|
Dapagliflozine
10 mg
|
Dapagliflozine
5 mg
|
Placebo
| |
Nb
|
70
|
64
|
75
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
8,01
|
7,83
|
7,79
| |
Variation par rapport à la valeur initialec
|
-0,89
|
-0,77
|
-0,23
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,66*
(-0,96; -0,36)
|
-0,54*
(-0,84; -0,24)
|
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
94,13
|
87,17
|
88,77
| |
Variation par rapport à la valeur initialec
|
-3,16
|
-2,83
|
-2,19
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,97
(-2,20; 0,25)
|
-0,65
(-1,90; 0,61)
|
|
a LOCF (last observation carried forward): dernière observation reportée pour chaque patient (avant intervention de secours, le cas échéant)
b Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
c Moyenne des moindres carrés ajustée par rapport à la valeur initiale
* Valeur p <0,0001 versus placebo
Traitement associé
Lors d'une étude de non-infériorité contrôlée versus un comparateur actif sur 52 semaines (avec une période d'extension de 52 semaines), la dapagliflozine a été évaluée en association à la metformine par rapport à une sulfonylurée (glipizide) en association à la metformine chez des patients dont le contrôle glycémique est inadéquat (HbA1c >6,5% et ≤10%). Les résultats ont mis en évidence une diminution moyenne de l'HbA1c entre le début de l'étude et la semaine 52 similaire à celle observée avec le glipizide, démontrant ainsi une non-infériorité (Tableau 3). À la semaine 104, la variation moyenne ajustée par rapport à la valeur initiale de l'HbA1c était de -0,32% pour la dapagliflozine 10 mg et de -0,14% pour le glipizide. Aux semaines 52 et 104, le pourcentage de patients ayant développé au moins un événement hypoglycémique était significativement moins élevé dans le groupe traité par la dapagliflozine (3,5% et 4,3% respectivement) que dans le groupe traité par le glipizide (40,8% et 47,0% respectivement). À la semaine 104, 56,2% des patients du groupe dapagliflozine étaient encore dans l'étude contre 50,0% pour le groupe glipizide.
Tableau 3. Résultats à la semaine 52 (LOCFa) d'une étude contrôlée versus produit actif comparant la dapagliflozine au glipizide en association à la metformine
|
Paramètres
|
Dapagliflozine
+ metformine
|
Glipizide
+ metformine
| |
Nb
|
400
|
401
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
7,69
|
7,74
| |
Variation par rapport à la valeur initialec
|
-0,52
|
-0,52
| |
Différence par rapport au glipizide + metforminec
(IC 95%)
|
0,00d
(-0,11; 0,11)
|
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
88,44
|
87,60
| |
Variation par rapport à la valeur initialec
|
-3,22
|
1,44
| |
Différence par rapport au glipizide + metforminec
(IC 95%)
|
-4,65*
(-5,14; -4,17)
|
|
a LOCF: dernière observation reportée pour chaque patient
b Patients randomisés et traités, avec valeur initiale et au moins 1 mesure de l'efficacité en cours d'étude
c Moyenne des moindres carrés ajustée par rapport à la valeur initiale
d Non infériorité versus l'association glipizide + metformine
* Valeur p <0,0001
La dapagliflozine en association à la metformine, au glimépiride, à la sitagliptine (avec ou sans metformine) ou à l'insuline a entraîné des diminutions statistiquement significatives de l'HbA1c à 24 semaines par rapport aux patients recevant le placebo (p <0,0001; tableaux 3 à 6).
Les diminutions de l'HbA1c constatées à la semaine 24 se sont maintenues dans les études en association (glimépiride et insuline) sur 48 semaines (glimépiride) et jusqu'à 104 semaines (insuline). A la semaine 48, en association à la sitagliptine (avec ou sans metformine), les variations moyennes ajustées par rapport à la valeur initiale pour dapagliflozine 10 mg et le placebo étaient de -0,30% et 0,38% respectivement. Pour l'étude en association à la metformine, les diminutions de l'HbA1c se sont maintenues jusqu'à la semaine 102 (variation moyenne ajustée par rapport à la valeur initiale de -0,58%, -0,78% et 0,02% pour dapagliflozine 5 mg, dapagliflozine 10 mg et le placebo, respectivement).
À la semaine 104 pour l'étude avec l'insuline (associée ou non à un hypoglycémiant oral supplémentaire), les variations moyennes ajustées de l'Hb1Ac par rapport à la valeur initiale avaient diminué de −0,71% pour dapagliflozine 5 mg, de −0,71% pour dapagliflozine 10 mg et de -0,06% pour le placebo. Aux semaines 48 et 104, la dose d'insuline est restée stable par rapport à la valeur initiale chez les patients traités par dapagliflozine 5 mg ou 10 mg à une dose moyenne dans une fourchette de 75 à 79 UI/jour. Dans le groupe placebo, l'augmentation moyenne était de 10,5 UI/jour et 18,3 UI/jour par rapport à la valeur initiale (dose moyenne de 84 UI/jour et 92 UI/jour), aux semaines 48 et 104 respectivement. À la semaine 104, 72,4% des patients du groupe dapagliflozine étaient encore dans l'étude contre 54,8% pour le groupe glipizide.
Tableau 4. Résultats d'études contrôlées versus placebo de 24 semaines (LOCFa) portant sur la dapagliflozine en association à la metformine
|
|
Traitement adjuvant associé
| |
|
Metformine1
| |
|
Dapagliflozine
10 mg
|
Dapagliflozine
5 mg
|
Placebo
| |
Nb
|
135
|
137
|
137
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
7,92
|
8,17
|
8,11
| |
Variation par rapport à la valeur initialec
|
-0,84
|
-0,70
|
-0,30
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,54*
(-0,74; -0,34)
|
-0,41*
(-0,61; -0,21)
|
| |
Patients (%) atteignant une HbA1c <7%
Données ajustées sur la valeur initiale
|
40,6**
|
37,5**
|
25,9
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
86,28
|
84,73
|
87,74
| |
Variation par rapport à la valeur initialec
|
-2,86
|
-3,04
|
-0,89
| |
Différence par rapport au placeboc
(IC 95%)
|
-1,97*
(-2,63; -1,31)
|
-2,16*
(-2,81; -1,50)
|
|
1 Metformine ≥1500 mg/jour
a LOCF: dernière observation reportée pour chaque patient (avant intervention de secours, le cas échéant)
b Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
c Moyenne des moindres carrés ajustée par rapport à la valeur initiale
* Valeur p <0,0001 versus placebo + hypoglycémiant oral
** Valeur p <0,05 versus placebo + hypoglycémiant oral
Tableau 5. Résultats d'études contrôlées versus placebo de 24 semaines (LOCFa) portant sur la dapagliflozine en association au glimépiride
|
|
Traitement adjuvant associé
| |
|
Sulfonylurée
(glimépiride1)
| |
|
Dapagliflozine 10 mg
|
Dapagliflozine 5 mg
|
Placebo
| |
Nb
|
151
|
142
|
145
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
8,07
|
8,12
|
8,15
| |
Variation par rapport à la valeur initialec
|
-0,82
|
-0,63
|
-0,13
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,68*
(-0,86; -0,51)
|
-0,49*
(-0,67; -0,32)
|
| |
Patients (%) atteignant une HbA1c <7%
Données ajustées sur la valeur initiale
|
31,7*
|
30,3*
|
13,0
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
80,56
|
81,00
|
80,94
| |
Variation par rapport à la valeur initialec
|
-2,26
|
-1,56
|
-0,72
| |
Différence par rapport au placeboc
(IC 95%)
|
-1,54*
(-2,17; -0,92)
|
-0,84*
(-1,47; -0,21)
|
|
1 Glimépiride 4 mg/jour
a LOCF: dernière observation reportée pour chaque patient (avant intervention de secours, le cas échéant)
b Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
c Moyenne des moindres carrés ajustée par rapport à la valeur initiale
* Valeur p <0,0001 versus placebo + hypoglycémiant oral
Tableau 6. Résultats d'études contrôlées versus placebo de 24 semaines (LOCFa) portant sur la dapagliflozine en association à la sitagliptine (avec ou sans metformine)
|
|
Traitement adjuvant associé
| |
|
Inhibiteur de la DPP-4 (sitagliptine2) ± metformine1
| |
|
Dapagliflozine 10 mg
|
Placebo
| |
Nb
|
223
|
224
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
7,90
|
7,97
| |
Variation par rapport à la valeur initialec
|
-0,45
|
0,04
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,48*
(-0,62; -0,34)
|
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
91,02
|
89,23
| |
Variation par rapport à la valeur initialec
|
-2,14
|
-0,26
| |
Différence par rapport au placeboc
(IC 95%)
|
-1,89*
(-2,37; -1,40)
|
|
1 Metformine ≥1500 mg/jour
2 Sitagliptine 100 mg/jour
a LOCF: dernière observation reportée pour chaque patient (avant intervention de secours, le cas échéant)
b Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
c Moyenne des moindres carrés ajustée par rapport à la valeur initiale
* Valeur p <0,0001 versus placebo + hypoglycémiant oral
Tableau 7. Résultats à la semaine 24 (LOCFa) d'une étude contrôlée versus placebo portant sur la dapagliflozine associée à l'insuline (seule ou avec un hypoglycémiant oral)
|
Paramètres
|
Dapagliflozine 10 mg
+ insuline
± hypoglycémiants oraux2
|
Dapagliflozine 5 mg
+ insuline
± hypoglycémiants oraux2
|
Placebo
+ insuline
± hypoglycémiants oraux2
| |
Nb
|
194
|
211
|
193
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
8,58
|
8,61
|
8,46
| |
Variation par rapport à la valeur initialec
|
-0,90
|
-0,82
|
-0,30
| |
Différence par rapport au placeboc
(IC 95%)
|
-0,60*
(-0,74; -0,45)
|
-0,52*
(-0,66; -0,38)
|
| |
Poids corporel (kg)
| |
Valeur initiale moyenne
|
94,63
|
93,20
|
94,21
| |
Variation par rapport à la valeur initialec
|
-1,67
|
-0,98
|
0,02
| |
Différence par rapport au placeboc
(IC 95%)
|
-1,68*
(-2,19; -1,18)
|
-1,00*
(-1,50; -0,50)
|
| |
Dose quotidienne moyenne d'insuline (UI)1
| |
Valeur initiale moyenne
|
77,96
|
77,10
|
73,96
| |
Variation par rapport à la valeur initialec
|
-1,16
|
-0,61
|
5,08
| |
Différence par rapport au placeboc
(IC 95%)
|
-6,23*
(-8,84; -3,63)
|
-5,69*
(-8,25; -3,13)
|
|
a LOCF: dernière observation reportée pour chaque patient (avant ou le jour de la première augmentation de la dose d'insuline, le cas échéant)
b Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
c Moyenne des moindres carrés ajustée sur la valeur initiale et présence d'un hypoglycémiant oral
* Valeur p <0,0001 versus placebo + insuline ± hypoglycémiant oral
1 Augmentation de la dose d'insuline (dont insuline à action rapide, à action intermédiaire et basale) autorisée uniquement chez les patients répondant à des critères de glycémie à jeun (GAJ) prédéfinis
2 Cinquante pour cent des patients étaient traités par de l'insuline en monothérapie au début de l'étude; 50% prenaient 1 ou 2 hypoglycémiants oraux en plus de l'insuline: dans ce dernier groupe, 80% étaient sous metformine seule, 12% recevaient une thérapie associant de la metformine et une sulfonylurée, et le reste des patients était traité par d'autres hypoglycémiants oraux.
Association de la dapagliflozine à un agoniste du récepteur du GLP-1 (GLP-1-RA).
Les effets hypoglycémiants de l'association de dapagliflozine (dose quotidienne de 10 mg) à un GLP-1-RA (exénatide à libération prolongée à une dose hebdomadaire de 2 mg) et des monothérapies avec le GLP-1-RA ou la dapagliflozine ont été évalués dans le cadre d'une étude en double aveugle, à 3 bras randomisée (1:1:1), de 28 semaines. 694 patients adultes atteints de diabète de type 2 dont le contrôle glycémique était insuffisant (HbA1c ≥8,0 et ≤12,0%) sous traitement antérieur par la metformine en monothérapie (≥1500 mg/jour; traitement par la metformine poursuivi sans changement pendant la phase de traitement) ont été inclus dans l'étude. Le critère d'évaluation principal était la variation de l'HbA1c entre le début de l'étude et la semaine 28. L'association de la dapagliflozine et du GLP-1-RA était supérieure aux deux monothérapies concernant la baisse de l'HbA1c (voir tableau 8).
Tableau 8: Effets hypoglycémiants de la dapagliflozine en association à l'exénatide à libération prolongée, de la dapagliflozine et de l'exénatide à libération prolongée chez des patients traités par la metformine (phase de traitement de 28 semaines)
|
Paramètres
|
Dapagliflozine 10 mg QD
+
Exénatide à libération prolongée 2 mg QW
|
Dapagliflozine 10 mg QD
+
placebo QW
|
Exénatide à libération prolongée 2 mg QW
+
placebo QD
| |
Nc
|
228
|
230
|
227
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
9,29
|
9,25
|
9,26
| |
Variation par rapport à la valeur initialea
|
-1,98
|
-1,39
|
-1,60
| |
Différence par rapport au placebo (IC 95%)
|
-0,59*
(-0,84, -0,34)
|
|
| |
Différence par rapport à l'exénatide à libération prolongée QW (IC 95%)
|
-0,38§
(-0,63, -0,13)
|
|
| |
Proportion de patients ayant atteint une
HbA1c <7,0%b
|
44,7%
|
19,1%
|
26,9%
|
QD = dose quotidienne, QW = dose hebdomadaire, N = Nombre de patients dans le groupe de traitement, IC= intervalle de confiance.
a La modélisation des moyennes des moindres carrés (moyennes des MC) ajustées et de la(des) différence(s) entre les différents groupes de traitement de la variation à la semaine 28 par rapport à la valeur initiale a été effectuée au moyen d'un modèle mixte à mesures répétées (MMRM; mixed model with repeated measures) en tenant compte des facteurs fixes (traitement, région, strate de valeur initiale de l'HbA1c (<9,0% ou ≥9,0%), semaine et interaction traitement-semaine) et de la covariable (valeur initiale).
b Catégories déterminées à partir des mesures continues. Imputation des non-répondeurs pour tous les patients dont les données des critères d'évaluation sont manquantes. Comparaison du traitement au moyen du test de Cochran-Mantel-Haenszel (CMH), stratification selon la valeur initiale de l'HbA1c (<9,0% oder ≥9,0%). Valeurs p selon la statistique d'association générale.
c Patients qui ont reçu au moins une fois le médicament de l'étude et pour lesquels au moins une mesure de l'HbA1c post-valeur initiale est disponible
* p <0,001.
§ p <0,01.
Toutes les valeurs p sont ajustées pour la multiplicité.Les valeurs après l'intervention de secours et après l'arrêt prématuré du médicament de l'étude sont exclues de l'analyse.
Traitement associé initial avec la metformine
L'efficacité et la sécurité d'un traitement par la metformine XR, la dapagliflozine, la metformine XR plus dapagliflozine ont été évaluées dans le cadre de deux études contrôlées à 3 bras de 24 semaines chez au total 1236 patients naïfs de traitement atteints de diabète de type 2 insuffisamment contrôlé (HbA1c ≥7,5% et ≤12%). La dose de metformine XR était de 2000 mg dans les deux études. La dose de dapagliflozine était respectivement de 5 mg et de 10 mg dans chacune des études. Une diminution significative de l'HbA1c a été observée dans les trois bras de traitement des deux études. Le traitement associé (metformine XR plus dapagliflozine) était supérieur aux monothérapies par la metformine XR ou la dapagliflozine dans les deux études (Tableau 9).
Tableau 9: résultats de deux études contrôlées évaluant la dapagliflozine dans le cadre d'un traitement associé initial avec la metformine XR (phase de traitement de 24 semaines)
|
Paramètres
|
Dapagliflozine +
metformine XR
|
Dapagliflozine +
placebo
|
Metformine XR +
placebo
| |
Posologie de dapagliflozine dans l'étude
|
5 mg
|
10 mg
|
5 mg
|
10 mg
|
5 mg
|
10 mg
| |
N†
|
194
|
211
|
203
|
219
|
201
|
208
| |
HbA1c (%)
| |
Valeur initiale moyenne
|
9,21
|
9,10
|
9,14
|
9,03
|
9,14
|
9,03
| |
Variation par rapport à la valeur initiale (moyenne ajustée‡)
|
-2,05
|
-1,98
|
-1,19
|
-1,45
|
-1,35
|
-1,44
| |
Différence par rapport à la dapagliflozine (moyenne ajustée‡) (IC 95%)
|
-0,86§
(-1,11,-0,62)
|
-0,53§
(-0,74, -0,32)
|
|
|
|
| |
Différence par rapport à la metformine XR (moyenne ajustée‡) (IC 95%)
|
-0,70§
(-0,94,-0,45)
|
-0,54§
(-0,75, -0,33)
|
|
-0,01¶
(-0,22, 0,20)
|
|
| |
Proportion de patients ayant atteint une HbA1c <7,0% ajustée pour la valeur initiale
|
52,4%
|
46,6%#
|
22,5%
|
31,7%
|
34,6%
|
35,2%
| |
Variation de l'HbA1c par rapport à la valeur initiale chez les patients ayant une valeur initiale de l'HbA1c ≥9% (moyenne ajustée‡)
|
-3,01
|
-2,59#
|
-1,67
|
-2,14
|
-1,82
|
-2,05
| |
Différence par rapport à la dapagliflozine (moyenne ajustée‡) (IC 95%)
|
-1,34§
(-1,72, -0,96)
|
-0,45#
(-0,81, -0,09)
|
|
|
|
| |
Différence par rapport à la metformine XR (moyenne ajustée‡) (IC 95%)
|
-1,19§
(-1,57, -0,82)
|
-0,53
(-0,89, -0,18)
|
|
|
|
|
* LOCF (last observation carried forward): la dernière observation reportée pour chaque patient (avant l'éventuelle mise en place d'une intervention de secours) a été utilisée pour l'évaluation finale
† Tous les patients randomisés ayant pris au moins une dose du médicament pendant la période de l'étude en double aveugle à court terme
‡ Moyenne des moindres carrés ajustée pour la valeur initiale
§ valeur p <0,0001.
¶ Non infériorité versus metformine XR
# valeur p <0,05
Glycémie à jeun (fasting plasma glucose, FPG)
Le traitement par dapagliflozine 5 mg ou 10 mg en monothérapie ou en association à la metformine, au glimépiride ou à la sitagliptine (avec ou sans metformine) a entraîné une réduction statistiquement significative de la glycémie à jeun (-1,90 à -1,18 mmol/l) par rapport au placebo (-0,33 à 0,21 mmol/l). Cet effet a été observé à la semaine 1 du traitement et s'est maintenu dans les études prolongées jusqu'à la semaine 102.
Glycémie postprandiale
Le traitement par dapagliflozine 10 mg en association au glimépiride a entraîné une réduction statistiquement significative de la glycémie postprandiale à 2 heures à la semaine 24. Cet effet s'est maintenu jusqu'à la semaine 48.
Le traitement par dapagliflozine 10 mg en association à la sitagliptine (avec ou sans metformine) a entraîné une réduction statistiquement significative de la glycémie postprandiale à 2 heures à la semaine 24. Cet effet s'est maintenu jusqu'à la semaine 48.
Pression artérielle
Dans une analyse poolée de 13 études contrôlées versus placebo, le traitement par dapagliflozine 10 mg a entraîné une variation de la pression artérielle systolique de -3,7 mmHg et de la pression artérielle diastolique de -1,8 mmHg par rapport aux valeurs initiales, versus -0,5 mmHg pour la pression systolique et -0,5 mmHg pour la pression diastolique dans le groupe placebo à la semaine 24. Cet effet s'est maintenu jusqu'à la semaine 104. Dans le pool de données comprenant 12 études à court terme contrôlées versus placebo, le traitement par dapagliflozine 5 mg a entraîné une variation de la pression artérielle systolique de -3,5 mmHg par rapport à la valeur initiale et de -2,1 mmHg pour la pression diastolique.
Patients atteints d'insuffisance rénale
Insuffisance rénale modérée (TFGe ≥45 à <60 ml/min/1,73 m2)
Dans une étude contrôlée contre placebo, randomisée, menée en double aveugle, l'efficacité de la dapagliflozine a été examinée sur un total de 321 patients adultes atteints de diabète de type 2 et présentant un TFGe de ≥45 à <60 ml/min/1,73 m2 (c.-à-d. présentant un trouble modéré de la fonction rénale correspondant à une IRC 3A) ainsi qu'une stabilisation de la glycémie insuffisante sous le traitement actuel. Les patients ont été traités soit par 10 mg de dapagliflozine (N=159) soit par placebo (N=161). L'HbA1c des patients inclus était au début de l'étude en moyenne de 8,2%. Le critère d'évaluation principal, la variation de l'HbA1c par rapport à la valeur initiale, montrait une supériorité statistiquement significative à la semaine 24 pour 10 mg de dapagliflozine par rapport au placebo. La variation moyenne de l'HbA1c par rapport à la valeur initiale était de -0,37% sous dapagliflozine, de -0,03% sous placebo, correspondant à une différence thérapeutique de -0,34% (IC 95% -0,53, -0,15).
Le profil de sécurité de la dapagliflozine correspondait à celui des études antérieures menées dans la population totale de patients atteints de diabète de type 2. Dans le groupe dapagliflozine, le TFGe moyen a diminué au début du traitement (dapagliflozine: -3,39 ml/min/1,73 m2, placebo: -0,90 ml/min/1,73 m2) et est resté stable pendant la phase de traitement ultérieure d'une durée de 24 semaines. Trois semaines après l'arrêt de la dapagliflozine, aucune différence pertinente n'était plus constatée au niveau du TFGe entre le groupe recevant le traitement actif et le groupe placebo.
Dans une étude antérieure portant sur un total de N=252 diabétiques, en outre, des patients présentant un TFGe entre 30 et <45 ml/min/1,73 m2 avaient été également inclus (TFGe moyen dans cette étude: 45 ml/min/1,73 m2). Dans cette étude, aucune efficacité n'a pu être mise en évidence ni pour la dose de 5 mg ni pour la dose de 10 mg (voir «Posologie/Mode d'emploi»).
Patients avec une valeur initiale d'Hb1Ac ≥9%
Chez des patients avec une valeur initiale d'Hb1Ac ≥9,0%, le traitement en monothérapie par dapagliflozine 10 mg entraînait des baisses statistiquement significatives de l'Hb1Ac à 24 semaines tant en monothérapie (variation moyenne ajustée par rapport à la valeur initiale, respectivement: -2,04% et 0,19% pour dapagliflozine 10 mg et le placebo) qu'en traitement adjuvant par la metformine (variation moyenne ajustée par rapport à la valeur initiale, respectivement: -1,32% et -0,53% pour dapagliflozine 10 mg et le placebo).
Étude sur les issues cardiovasculaires (DECLARE)
L'effet d'un traitement par dapagliflozine sur les événements cardiovasculaires a été analysé pendant une période d'observation médiane de 4,2 ans dans le cadre d'une étude internationale, multicentrique, en double aveugle sur les issues cardiovasculaires (DECLARE), au cours de laquelle les patients avec diabète de type 2 (durée moyenne de la maladie de 11,9 ans) ont été randomisés sur dapagliflozine (N=8582) ou placebo (N=8578) en plus de leur traitement existant. La pharmacothérapie du diabète et des autres comorbidités pouvait être ajustée pendant l'étude selon les «Standard of Care (SoC)».
Au début de l'étude, la valeur HbA1c moyenne ou de l'IMC était de 8,3% ou de 32,1 kg/m2. La population d'étude d'un âge moyen de 63,9 ans était composée à 59,4% de patients sans maladie CV établie présentant les facteurs de risque suivants: âge ≥55 (hommes) ou ≥60 ans (femmes) ainsi que dyslipidémie, hypertension ou tabagisme. Les autres 40,6% des patients présentaient déjà une maladie CV manifeste au début de l'étude. L'anamnèse indiquait une insuffisance cardiaque confirmée chez 10,0% des patients. Le TFGe moyen était de 85,2 ml/min/1,73 m2 (seuls 7,4% des patients présentaient un TFGe <60 ml/min/1,73 m2), tandis que 30,3% des patients présentaient une albuminurie.
Au début de l'étude, 82,0% des patients recevaient de la metformine pour abaisser leur glycémie ; les autres traitements antihyperglycémiants incluaient l'insuline (40,9%), les sulfonylurées (42,7%), les inhibiteurs de la DPP4 (16,8%) et les agonistes du GLP-1 (4,4%). Pour le traitement des comorbidités CV, les patients recevaient des inhibiteurs de l'ECA ou des antagonistes des récepteurs de l'angiotensine II (81,3%), des statines (75,0%), des inhibiteurs de l'agrégation plaquettaire (61,1%), de l'acide acétylsalicylique (55,5%), des bêtabloquants (52,6%), des bloquants des canaux calciques (34,9%), des diurétiques thiazidiques (22,0%) et des diurétiques de l'anse (10,5%).
Les résultats de l'analyse primaire sont résumés dans le tableau 10.
|
Critère d'évaluation
|
Dapagliflozine (N = 8582)
|
Placebo (N = 8578)
|
HR [IC à 95%]
| |
|
Patients avec événement
n (%)
|
Taux d'événements (par 1000 patients-années)
|
Patients avec événement
n (%)
|
Taux d'événements (par 1000 patients-années)
|
| |
MACE
|
756 (8,8)
|
22,6
|
803 (9,4)
|
24,2
|
0,93 [0,84 ; 1,03]
| |
Décès CV
|
245 (2,9)
|
7,0
|
249 (2,9)
|
7,1
|
0,98 [0,82 ; 1,17]
| |
Infarctus du myocarde
|
393 (4,6)
|
11,7
|
441 (5,1)
|
13,2
|
0,89 [0,77 ; 1,01]
| |
Accident vasculaire cérébral
|
235 (2,7)
|
6,9
|
231 (2,7)
|
6,8
|
1,01 [0,84 ; 1,21]
| |
Critère composite insuffisance cardiaque
|
417 (4,9)
|
12,2
|
496 (5,8)
|
14,7
|
0,83 [0,73 ; 0,95]
| |
Hospitalisation pour insuffisance cardiaque
|
212 (2,5)
|
6,2
|
286 (3,3)
|
8,5
|
0,73 [0,61 ; 0,88]
| |
Décès CV
|
245 (2.9)
|
7.0
|
249 (2.9)
|
7,1
|
0,98 [0,82 ; 1,17]
|
Insuffisance cardiaque
Étude DAPA-HF: insuffisance cardiaque à fraction d'éjection ventriculaire réduite (FEVG ≤40%)
L'étude Dapagliflozin And Prevention of Adverse outcomes in Heart Failure (DAPA-HF) était une étude internationale, multicentrique, randomisée, en double aveugle, contrôlée contre placebo, réalisée auprès de 4744 patients atteints d'insuffisance cardiaque (classe fonctionnelle II-IV de la New York Heart Association [NYHA]) à fraction d'éjection réduite (fraction d'éjection du ventricule gauche [FEVG] ≤40%) visant à évaluer l'effet de la dapagliflozine, en complément d'un traitement de fond standard, sur la mortalité d'origine CV et l'aggravation de l'insuffisance cardiaque (hospitalisation pour insuffisance cardiaque et consultation d'urgence pour insuffisance cardiaque).
Les patients ayant été traités par un traitement contre l'insuffisance cardiaque correspondant au traitement standard (tableau 11) ont été répartis dans le bras dapagliflozine 10 mg (N=2373) ou dans le bras placebo (N=2371).
Tableau 11: Traitement concomitant de l'insuffisance cardiaque au début de l'étude
|
Traitement concomitant de l'insuffisance cardiaque
|
Pourcentage des patients au début de l'étude (%)
| |
Inhibiteur de l'ECA ou antagonistes des récepteurs de l'angiotensine ou inhibiteur du récepteur de l'angiotensine et de la néprilysine (ARNI)
|
94%
| |
ARNI
|
11%
| |
Bêtabloquants
|
96%
| |
Antagonistes du récepteur minéralocorticoïde (ARM)
|
71%
| |
Diurétique
|
93%
| |
Dispositif implantable
|
26%
|
L'objectif principal de l'étude était d'évaluer si la dapagliflozine empêchait les décès cardiovasculaires et l'aggravation de l'insuffisance cardiaque et améliorait les symptômes de l'insuffisance cardiaque.
La période d'observation s'étendait sur une durée médiane de 18 mois. La population de patients était âgée de 66 ans en moyenne et composée à 77% d'hommes; 70% des patients étaient d'origine caucasienne, 5% d'origine africaine ou afro-américaine et 24% d'origine asiatique.
Au début de l'étude, 67,5% des patients étaient dans la classe NYHA II, 31,6% dans la classe III et 0,9% dans la classe IV. La FEVG médiane était de 32%. Dans chacun des deux groupes de traitement, 42% des patients présentaient, d'après l'anamnèse, un diabète de type 2 connu, 3% de patients supplémentaires dans chaque groupe ont également été classés comme diabétiques de type 2 suite à une valeur HbA1c ≥6,5% mesurée à l'inclusion dans l'étude et lors de la randomisation.
Les patients présentant une insuffisance rénale sévère (TFGe <30 ml/min/1,73 m2) n'étaient pas autorisés à participer à l'étude. Le TFGe moyen au début de l'étude était de 66 ml/min/1,73 m2.
Mortalité cardiovasculaire et aggravation de l'insuffisance cardiaque
La dapagliflozine 10 mg était supérieure au placebo dans la prévention des décès CV et de l'aggravation de l'insuffisance cardiaque et était associée à un effet thérapeutique uniforme sur les critères d'évaluation primaire et secondaire.
La dapagliflozine a réduit la fréquence du critère d'évaluation composite primaire, constitué des décès CV, des hospitalisations pour insuffisance cardiaque et des consultations d'urgence pour insuffisance cardiaque (HR 0,74 [IC 95%: 0,65, 0,85]; p<0,0001). Le nombre de traitements nécessaires par an (NST) était de 26 [18, 46]IC 95%. Les courbes d'événements pour la dapagliflozine et le placebo se sont séparées à un stade précoce et ont continué à diverger pendant toute la durée de l'étude (figure 1).
Figure 1: Temps jusqu'à la première apparition du critère composite constitué des décès CV, des hospitalisations pour insuffisance cardiaque et des consultations d'urgence pour insuffisance cardiaque
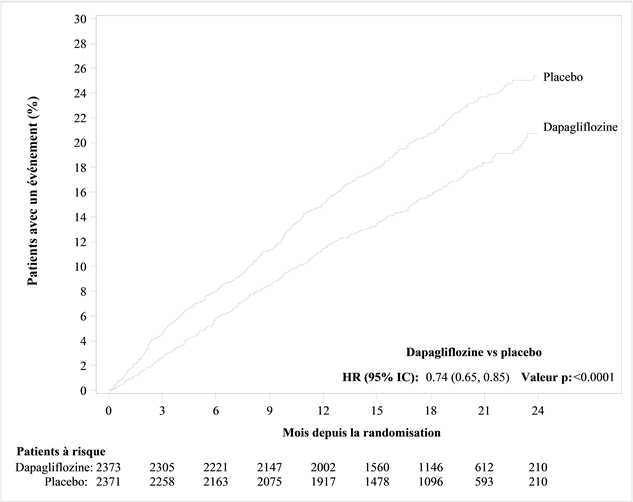
Une consultation d'urgence pour insuffisance cardiaque a été définie comme étant une évaluation urgente et non prévue effectuée par un médecin, p.ex. dans un service d'urgence, avec une nécessité thérapeutique existante (allant au-delà d'une simple augmentation de la dose de diurétiques oraux) en raison d'une aggravation de l'insuffisance cardiaque.
Les patients à risque («patients at risk») sont les patients n'ayant encore présenté aucun événement au début de la période.
Les trois composants du critère d'évaluation composite primaire ont tous contribué à l'effet thérapeutique (figure 2): la dapagliflozine a réduit la fréquence des décès cardiovasculaires et des hospitalisations pour insuffisance cardiaque (HR 0,75 [IC 95%: 0,65; 0,85], p <0,0001).
Figure 2: Effets thérapeutiques pour le critère d'évaluation composite primaire, ses composants et la mortalité globale
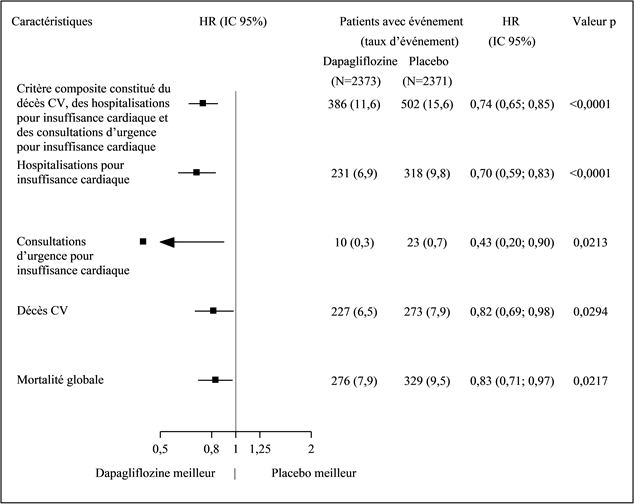
Une consultation d'urgence pour insuffisance cardiaque a été définie comme étant une évaluation urgente et non prévue effectuée par un médecin, p.ex. dans un service d'urgence, avec une nécessité thérapeutique existante (allant au-delà d'une simple augmentation de la dose de diurétiques oraux) en raison d'une aggravation de l'insuffisance cardiaque.
Le nombre de premiers événements pour chaque composant représente le nombre réel de premiers événements pour chaque composant, et leur somme n'est pas équivalente au nombre d'événements dans le critère d'évaluation composite.
Le taux d'événements est représenté comme le nombre de patients concerné par l'événement pour 100 patients-années de la période d'observation.
Les valeurs p pour les différents composants et la mortalité globale sont nominales.
Les bénéfices du traitement par dapagliflozine ont été observés chez les patients atteints d'insuffisance cardiaque, qu'ils soient atteints ou non d'un diabète de type 2 (figure 3).
Figure 3: Effets thérapeutiques chez tous les patients, c.-à-d. chez les patients avec et sans diabète de type 2
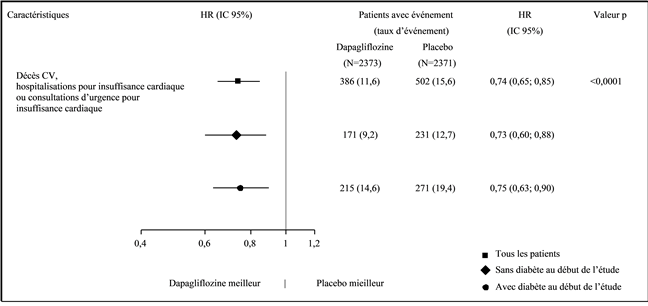
Une consultation d'urgence pour insuffisance cardiaque a été définie comme étant une évaluation urgente et non prévue effectuée par un médecin, p.ex. dans un service d'urgence, avec une nécessité thérapeutique existante (allant au-delà d'une simple augmentation de la dose de diurétiques oraux) en raison d'une aggravation de l'insuffisance cardiaque.
Le taux d'événements est représenté comme le nombre de patients concerné par l'événement pour 100 patients-années de la période d'observation.
Les bénéfices du traitement par dapagliflozine par rapport au placebo en ce qui concerne le critère d'évaluation primaire sont également cohérents dans d'autres sous-groupes importants.
Étude DELIVER: insuffisance cardiaque à fraction d'éjection ventriculaire gauche >40%
L'étude Dapagliflozin Evaluation to Improve the LIVEs of Patients with PReserved Ejection Fraction Heart Failure (DELIVER) était une étude internationale, multicentrique, randomisée, en double aveugle, contrôlée contre placebo réalisée chez des patients âgés de ≥40 ans atteints d'insuffisance cardiaque (classe fonctionnelle II-IV de la NYHA) à FEVG ≤40% chez lesquels une cardiopathie structurelle a été mise en évidence dans les 12 mois précédents. L'étude comparait la dapagliflozine 10 mg à un placebo en complément d'autres traitements médicamenteux de l’insuffisance cardiaque chronique en termes d'effet sur la mortalité cardiovasculaire et sur l'aggravation de l'insuffisance cardiaque.
Dans l'étude DELIVER, 6263 patients ont été randomisés (1:1) et traités par la dapagliflozine (n = 3131) ou par un placebo (n = 3132) pendant une durée médiane de ~ 28 mois; parmi eux, 654 (10%) patients étaient atteints d'insuffisance cardiaque subaiguë (définie par une randomisation pendant une hospitalisation pour insuffisance cardiaque ou dans les 30 jours qui suivent la sortie de l'hôpital).
L'âge moyen de la population de l'étude était de 72 ans, 56% des patients étaient des hommes, 71% étaient d'origine caucasienne, 3% d'origine africaine ou afro-américaine et 20% d'origine asiatique.
Au début de l'étude, 75% des patients étaient dans la classe NYHA II, 24% dans la classe III et 0,3% dans la classe IV. La FEVG médiane était de 54% avec une répartition plus ou moins homogène dans les différentes strates de la FEVG: FEVG ≤49% (34% des patients), FEVG comprise entre 50 et 59% (36% des patients) et FEVG ≥60% (30% des patients). Dans chacun des deux bras de traitement, 45% des patients présentaient, d'après l'anamnèse, un diabète de type 2 connu. Le DFGe moyen [ml/min/1,73 m2] était de 61 (49% des patients avaient un DFGe <60, 23% un DFGe <45 et 3% un DFGe <30). Les patients présentant un DFGe <25 ml/min/1,73 m2 ont été exclus de l'étude.
Au début de l'étude, le traitement comprenait: inhibiteurs de l'ECA/ARA/ARNI (77%), bêtabloquants (83%), diurétiques (98%) et ARM (43%).
Mortalité cardiovasculaire ou aggravation de l'insuffisance cardiaque
La dapagliflozine était supérieure au placebo dans la prévention des décès d'origine cardiovasculaire (CV) et de l'aggravation de l'insuffisance cardiaque. La dapagliflozine a réduit de manière significative l'incidence du critère d'évaluation composite primaire constitué de la mortalité CV, de l'hospitalisation pour insuffisance cardiaque ou de la consultation d'urgence pour insuffisance cardiaque (HR: 0,82 [IC 95% 0,73, 0,92]; p = 0,0008). Le nombre de traitements nécessaires (NST) par durée d'étude (durée médiane 28 mois) était de 32 [20, 82]IC 95%. Les courbes d'événements pour la dapagliflozine et le placebo se sont séparées à un stade précoce et l'effet a pu être observé pendant toute la durée de l'étude (Figure 4).
Figure 4: Délai jusqu'à la première apparition d'un événement du critère d'évaluation composite primaire constitué du décès d'origine cardiovasculaire, de l'hospitalisation pour insuffisance cardiaque et de la consultation d'urgence pour insuffisance cardiaque
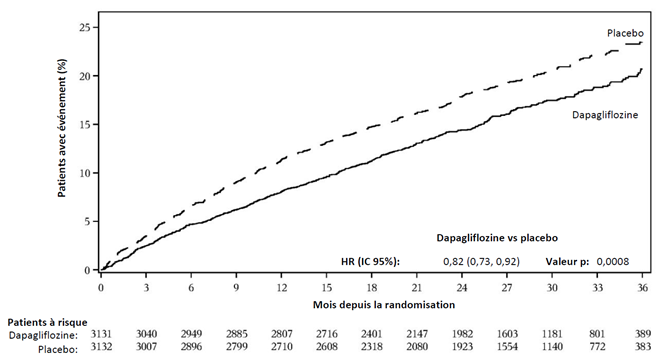
Une consultation d'urgence pour insuffisance cardiaque a été définie comme étant un examen urgent et non prévu effectué par un médecin, p.ex. dans un service d'urgence, avec une nécessité thérapeutique existante (allant au-delà d'une simple augmentation de la dose de diurétiques oraux) en raison d'une aggravation de l'insuffisance cardiaque.
Les patients à risque sont les patients n'ayant encore présenté aucun événement au début de la période.
Les trois composants du critère d'évaluation composite primaire ont tous contribué à l'effet thérapeutique (Figure 5).
Figure 5: Effets thérapeutiques pour le critère d'évaluation composite primaire et ses composants
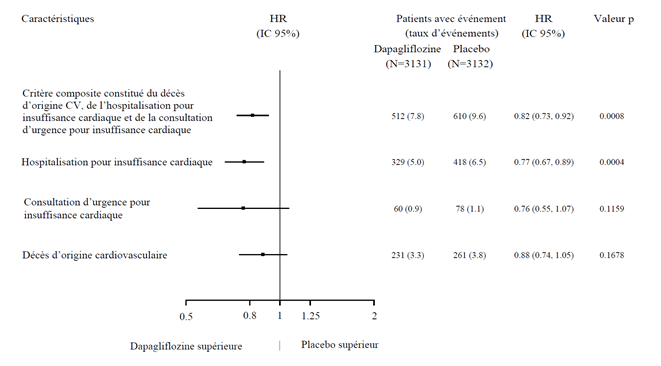
Une consultation d'urgence pour insuffisance cardiaque était définie comme étant un examen urgent et non prévu effectué par un médecin, p.ex. dans un service d'urgence, avec une nécessité thérapeutique existante (allant au-delà d'une simple augmentation de la dose de diurétiques oraux) en raison d'une aggravation de l'insuffisance cardiaque.
Le nombre de premiers événements pour chaque composant représente le nombre réel de premiers événements pour chaque composant, et leur somme n'est pas équivalente au nombre d'événements dans le critère d'évaluation composite.
Les taux d'événements sont représentés comme le nombre de patients concernés par l'événement pour 100 patients-années de la période d'observation.
Les valeurs p pour les différents composants sont nominales. La mortalité d'origine cardiovasculaire, représentée ici comme un composant du critère d'évaluation primaire, a été également évaluée comme critère d'évaluation secondaire pour le contrôle formel de l'erreur de type 1.
Le bénéfice du traitement par la dapagliflozine par rapport au placebo en ce qui concerne le critère d'évaluation primaire était consistant dans tous les groupes de patients importants y compris dans les sous-groupes en fonction de la FEVG (Figure 6).
Figure 6: Effets thérapeutiques pour le critère d'évaluation composite principal par sous-groupes

a Définie par une randomisation pendant une hospitalisation pour insuffisance cardiaque ou dans les 30 jours qui suivent la sortie de l'hôpital.
b Défini par des antécédents de diabète de type 2. Dans cette analyse, le diabète de type 2 n'est pas pris en compte comme facteur de stratification.
n/N# Nombre de patients avec événement/nombre de sujets dans le sous-groupe.
Insuffisance cardiaque dans les études DAPA-HF et DELIVER combinées
Dans une analyse poolée des études DAPA-HF et DELIVER, le HR relatif à la dapagliflozine était, en comparaison avec le placebo, de 0,78 (IC 95 % [0,72; 0,85], p <0,0001) pour le critère d'évaluation composite constitué du décès d'origine cardiovasculaire, de l'hospitalisation pour insuffisance cardiaque et de la consultation d'urgence pour insuffisance cardiaque. L'effet thérapeutique de la dapagliflozine était cohérent pour l'ensemble du spectre de la FEVG sans atténuation de l'effet en raison de la FEVG.
Dans une analyse poolée déterminée au préalable des études DAPA-HF et DELIVER, la dapagliflozine, comparée au placebo, a réduit le risque de décès cardiovasculaire (HR 0,85 [IC 95 % 0,75; 0,96], p = 0,0115). Les deux études ont contribué à l'effet thérapeutique.
Néphropathie chronique
L'étude DAPA-CKD était une étude internationale, multicentrique, guidée par les événements, randomisée, contrôlée contre placebo, réalisée en double aveugle et comportant des groupes parallèles évaluant les effets de la dapagliflozine et du placebo, en complément d'un traitement standard, sur les issues rénales et la mortalité cardiovasculaire chez des patients atteints de néphropathie chronique présentant un DFGe ≥25 à ≤75 ml/min/1,73m² et une albuminurie (rapport albuminurie/créatininurie dans l'urine [RAC] ≥200 et ≤5000 mg/g). L'objectif principal était de déterminer l'effet de la dapagliflozine versus placebo en termes de réduction constante de l'incidence du critère d'évaluation composite constitué de la diminution constante du DFGe de ≥50%, de l'insuffisance rénale terminale (IRT) (définie par un DFGe constamment <15 ml/min/1,73 m², une dialyse chronique ou une transplantation rénale) et du décès CV ou rénal.
Les patients présentant une polykystose rénale, une glomérulonéphrite avec des poussées (néphrite lupique ou vascularite associée aux ANCA), les patients traités actuellement ou ayant récemment nécessité des traitements rénaux cytotoxiques, immunosuppresseurs ou autres traitements rénaux immunomodulateurs ont été exclus de l'étude DAPA-CKD.
Au total, 4304 patients ont été répartis dans le bras dapagliflozine comportant une administration de 10 mg une fois par jour (n = 2152) ou dans le bras placebo (n = 2152) et ont été observés pendant une durée médiane de 28,5 mois. Lorsque le DFGe atteignait au cours de l'étude une valeur inférieure à 25 ml/min/1,73 m², le traitement était poursuivi. Le traitement pouvait également être poursuivi lorsque le patient nécessitait une dialyse.
Au début de l'étude, le DFGe moyen était de 43,1 ml/min/1,73 m² et la valeur médiane du RAC de 949,3 mg/g. 44,1% des patients avaient un DFGe de 30 à <45 ml/min/1,73 m² et 14,5% un DFGe de <30 ml/min/1,73 m². 67,5% des patients avaient un diabète sucré de type 2.
Les patients recevaient un traitement correspondant au traitement standard; 97,0% des patients étaient traités par un inhibiteur de l'ECA ou un antagoniste des récepteurs de l'angiotensine.
L'âge moyen de la population de l'étude était de 61,8 ans. 66,9% des patients étaient des hommes, 53,2% étaient d'origine caucasienne, 4,4% d'origine africaine ou afro-américaine et 34,1% d'origine asiatique.
La dapagliflozine était supérieure au placebo en termes de réduction de l'incidence du critère d'évaluation composite primaire constitué des diminutions du DFGe de ≥50%, de la survenue d'une IRT et d'un décès CV ou rénal (HR: 0,61 [IC 95%: 0,51; 0,72]; p <0,0001). Le nombre de traitements nécessaires pour atteindre ce critère en 27 mois était de 19 (IC 95%: 15; 27). Le diagramme de Kaplan-Meier a montré que les courbes d'événements pour la dapagliflozine et le placebo se sont séparées à un stade précoce (4 mois) et ont continué à diverger pendant toute la durée de l'étude (Figure 7).
Figure 7: Temps jusqu'à la première apparition d'un événement du critère d'évaluation composite primaire constitué de la diminution constante du DFGe de ≥50%, des IRC et du décès CV ou rénal.
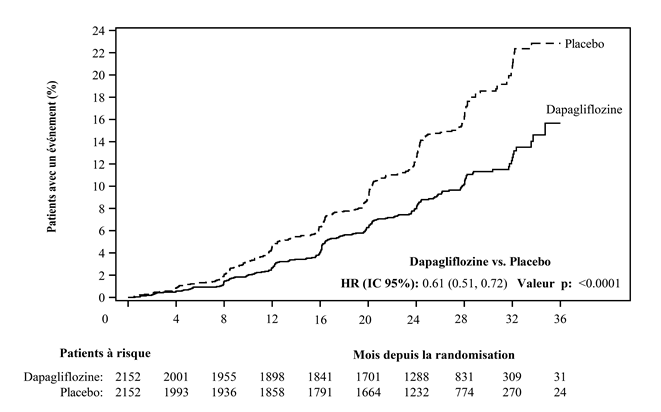
Les patients à risque («patients at risk») sont les patients n'ayant encore présenté aucun événement au début de la période.
Les quatre composants du critère d'évaluation composite primaire ont tous contribué à l'effet thérapeutique (Figure 8). La dapagliflozine a également réduit l'incidence du critère d'évaluation composite constitué de la diminution du DFGe de ≥50%, des IRT ou du décès rénal (HR: 0,56 [IC 95%: 0,45; 0,68]; p <0,0001), du critère d'évaluation composite constitué du décès CV ou de l'hospitalisation pour insuffisance cardiaque (HR: 0,71 [IC 95%: 0,55; 0,92], p = 0,0089) et de la mortalité globale (HR 0,69 [IC 95% 0,53; 0,88]; p = 0,0035).
Figure 8: Effets thérapeutiques pour le critère d'évaluation composite primaire et les critères d'évaluation composites secondaires, leurs composants et la mortalité globale
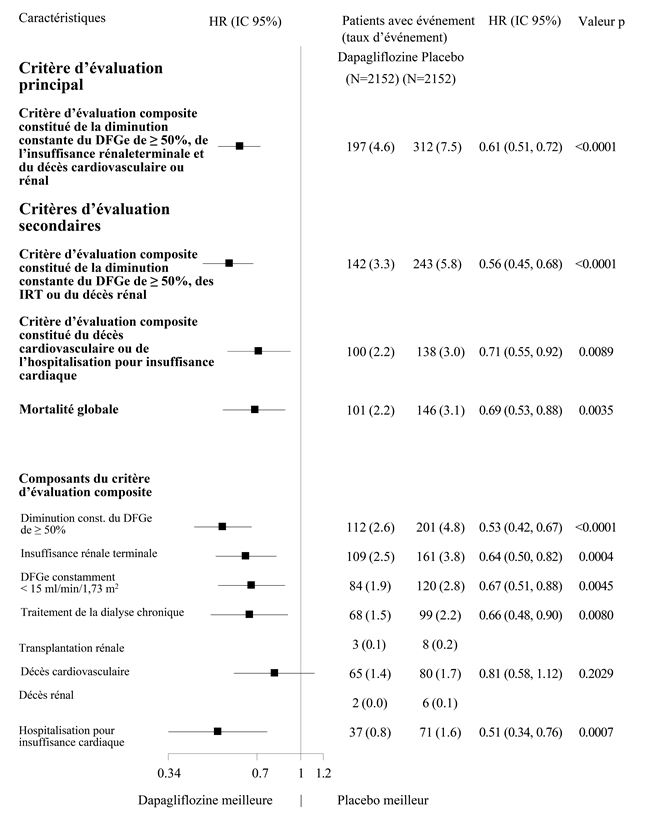
Le nombre de premiers événements pour chaque composant représente le nombre réel de premiers événements pour chaque composant. Leur somme n'est pas équivalente au nombre d'événements dans le critère d'évaluation composite.
Le taux d'événements est représenté comme le nombre de patients concernés par l'événement pour 100 patients-années de la période d'observation.
Les estimations des hazard ratios pour les sous-groupes dans lesquels, les deux groupes de traitement considérés dans leur ensemble, au total moins de 15 événements sont survenus, ne sont pas représentées.
Les valeurs p pour les composants des critères d'évaluation composites sont nominales.
L'effet thérapeutique de la dapagliflozine était cohérent chez les patients présentant une néphropathie chronique, qu'ils soient atteints ou non d'un diabète de type 2 (Figure 9).
Figure 9: Effets thérapeutiques chez les patients, qu'ils soient atteints ou non d'un diabète de type 2
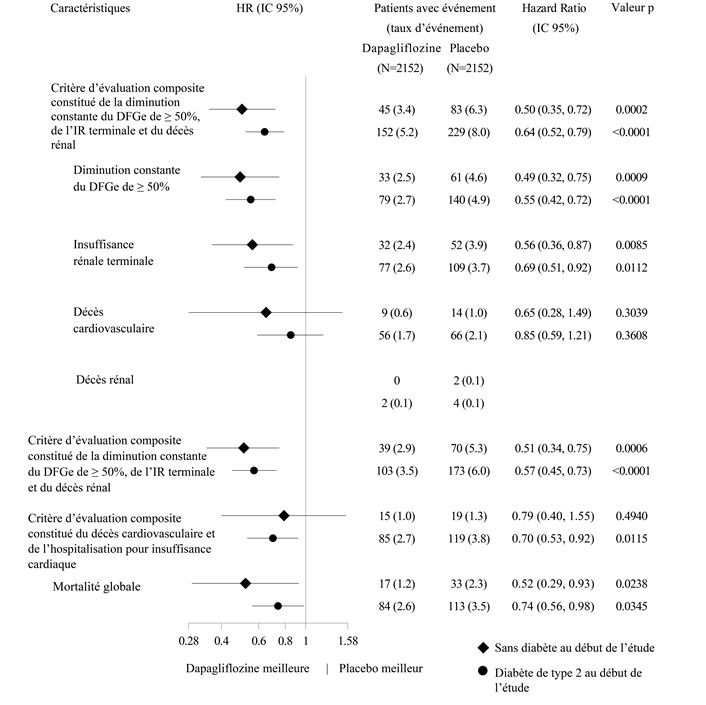
Le nombre de premiers événements pour chaque composant représente le nombre réel de premiers événements pour chaque composant. Leur somme n'est pas équivalente au nombre d'événements dans le critère d'évaluation composite. Les estimations des hazard ratios pour les sous-groupes dans lesquels, les deux groupes de traitement considérés dans leur ensemble, au total moins de 15 événements sont survenus, ne sont pas représentées.
Le taux d'événements est représenté comme le nombre de patients concernés par l'événement pour 100 patients-années de la période d'observation.
Les valeurs p sont nominales.
Les bénéfices du traitement par dapagliflozine par rapport au placebo en ce qui concerne le critère d'évaluation composite principal sont également cohérents dans les sous-groupes importants (Figure 10).
Figure 10: Effets thérapeutiques pour le critère d'évaluation composite principal par sous-groupes
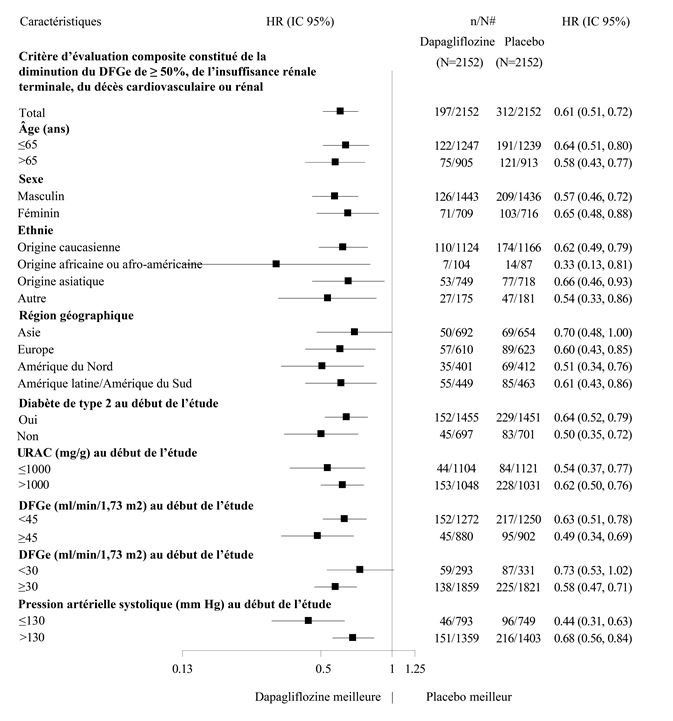
n/N# Nombre de patients concernés par l'événement/nombre de patients dans le sous-groupe.
Le bénéfice du traitement de la dapagliflozine par rapport au placebo sur les critères d'évaluation secondaires était généralement cohérent dans tous les sous-groupes. Pour le composite de décès cardiovasculaire et d'hospitalisation pour insuffisance cardiaque, des rapports de risque de 0,47 (IC 95 % 0,29; 0,75) et de 0,86 (IC 95 % 0,63; 1,17) ont été observés pour les femmes et les hommes, respectivement.
|










