Propriétés/EffetsCode ATC: L04AC11
Mécanisme d'action
Le siltuximab est un anticorps monoclonal chimérique homme/souris qui forme des complexes stables de plus haute affinité avec les formes bioactives solubles de l'IL-6 humaine. Le siltuximab empêche la liaison de l'IL-6 humaine aux récepteurs solubles et membranaires de l'IL-6 (IL-6R), inhibant ainsi la formation du complexe de signalisation hexamérique avec la gp130 à la surface cellulaire. L'IL-6 est une cytokine pro-inflammatoire produite par différents types de cellules, notamment les lymphocytes T et B, d'autres types de lymphocytes, les monocytes, les macrophages et les fibroblastes, ainsi que les cellules malignes. Il a été déterminé que l'IL-6 participait à différents processus physiologiques normaux, tels que l'induction de la sécrétion d'immunoglobulines, l'initiation de la synthèse des protéines hépatiques de la phase aiguë et la stimulation de la prolifération et de la différenciation des cellules précurseurs hématopoïétiques. L'hyperproduction d'IL-6, au cours des maladies inflammatoires chroniques et des affections malignes, a été liée à l'anémie et à la cachexie, et il a été supposé qu'elle jouait un rôle central dans la prolifération des plasmocytes et les manifestations systémiques observées chez les patients atteints de la maladie de Castleman multicentrique.
Propriétés pharmacodynamiques
In-vitro, le siltuximab a inhibé de manière dose-dépendante la croissance d'une lignée cellulaire de plasmocytome murin dépendant de l'IL-6 en réponse à l'IL-6 humaine. Dans des cultures de cellules d'hépatome humain, la production stimulée par l'IL-6 de la protéine sérique de la phase aiguë, l'amyloïde A, a été inhibée de manière dose-dépendante par le siltuximab. De même, dans des cultures de cellules humaines de lymphome de Burkitt, la production d'immunoglobulines M (IgM) en réponse à l'IL-6 a été inhibée de manière dose-dépendante par le siltuximab.
Biomarqueurs
L'IL-6 stimule au cours de la phase aiguë l'expression de la CRP. Le mécanisme d'action du siltuximab est la neutralisation de la bioactivité de l'IL-6, qui peut être mesurée indirectement par la suppression de la CRP. Le traitement par Sylvant de la MC multicentrique entraîne une diminution rapide et prolongée des concentrations sériques de CRP. Le dosage des concentrations d'IL-6 dans le sérum ou le plasma au cours du traitement ne doit pas être utilisé comme un marqueur pharmacodynamique, dans la mesure où les complexes entre l'anticorps neutralisé par le siltuximab et l'IL-6 interfèrent avec les méthodes de quantification immunologiques actuelles de l'IL-6.
Efficacité clinique
Étude 1
Une étude de phase 2 internationale, randomisée (2:1), en double aveugle, contrôlée versus placebo a été menée pour évaluer l'efficacité et la sécurité de Sylvant (11 mg/kg toutes les 3 semaines) par rapport au placebo en association avec les soins de soutien optimaux (Best Supportive Care, BSC) chez des patients atteints de MC multicentrique. Le traitement a été poursuivi jusqu'à un échec thérapeutique (défini par une progression de la maladie basée sur l'augmentation des symptômes, une progression radiologique ou une détérioration de l'indice de performance) ou une toxicité inacceptable. Au total, 79 patients atteints de MC multicentrique symptomatique ont été randomisés et traités. L'âge moyen était de 47 ans (intervalle de 20 à 74 ans) dans le bras sous Sylvant et de 48 ans (intervalle de 27 à 78 ans) dans le bras sous placebo. Un nombre plus important de patients masculins a été inclus dans le bras sous placebo (85% dans le groupe sous placebo contre 56% dans le groupe sous Sylvant). L'indice de performance ECOG (0/1/2) au début du traitement a été respectivement de 42%/45%/13% dans le bras sous Sylvant et de 39%/62%/0% dans le bras sous placebo. Au début de la thérapie, 55% des patients dans le bras sous Sylvant et 65% des patients dans le bras sous placebo avaient reçu des traitements systémiques antérieurs pour la MC multicentrique et 30% des patients dans le bras sous Sylvant et 31% dans le bras sous placebo utilisaient des corticoïdes. Les sous-types histologiques ont été similaires dans les deux bras de traitement, avec 33% de sous-type hyalino-vasculaire, 23% de sous-type plasmocytaire et 44% de sous-type mixte. Les paramètres biologiques relatifs à la maladie sont présentés dans le tableau 3. La vitesse de sédimentation de la CRP et des érythrocytes (ESR) a montré une grande diversité dans les deux bras de traitement.
Tableau 3: Paramètres biologiques relatifs à la maladie
|
|
Sylvant + BSC*
|
Placebo + BSC
| |
Patients appartenant à la population en intention de traiter
|
53
|
26
| |
Moyenne en hémoglobine (g/l) (écart-type)
|
115,8 (24,70)
|
130,0 (25,70)
| |
Moyenne des plaquettes (109/l) (écart-type)
|
323,2 (156,58)
|
302,6 (123,54)
| |
Moyenne de l'albumine (g/dl) (écart-type)
|
3,5 (0,76)
|
3,6 (0,46)
| |
Moyenne de l'ESR (mm/h) (écart-type)
|
68,3 (48,66)
|
34,6 (35,06)
| |
Moyenne de la CRP (mg/l) (écart-type)
|
43,2 (53,63)
|
24,8 (34,53)
| |
Moyenne du fibrinogène (µmol/l) (écart-type)
|
16,9 (7,52)
|
15,3 (7,48)
|
* Best Supportive Care (soins de soutien optimaux).
Le critère d'évaluation principal de l'étude était la réponse tumorale et symptomatique durable, définie comme une réponse tumorale examinée de manière indépendante et une résolution complète ou une stabilisation des symptômes de MC multicentrique collectés de manière prospective, pendant au moins 18 semaines sans échec thérapeutique.
L'étude 1 a démontré une amélioration statistiquement significative du taux de réponse tumorale et symptomatique examinée de manière indépendante dans le bras sous Sylvant, par rapport au bras sous placebo (34% vs 0%, intervalle de confiance à 95%: 11,1; 54,8; p=0,0012). Les analyses de sensibilité ont également soutenu l'analyse du critère d'évaluation principal qui a présenté un taux de réponse tumorale et symptomatique durable évaluée par l'investigateur significativement plus élevé de 45% chez les patients traités par Sylvant par rapport à 0% des patients traités par le placebo (p <0,0001). Le taux de réponse tumorale global a été évalué de manière indépendante et par l'investigateur, sur la base des critères de Cheson modifiés.
Les principaux résultats d'efficacité de l'étude 1 sont présentés dans le tableau 4.
Tableau 4: Critères d'efficacité de l'étude 1
|
Critères d'efficacité:
|
Sylvant + BSC
|
Placebo + BSC
|
valeur pa
| |
Critère d'efficacité principal
| |
Réponse tumorale et symptomatique durable (examen indépendant)
|
18/53 (34,0%)
|
0/26 (0%)
|
0,0012
| |
Critères d'efficacité secondaires
| |
Meilleure réponse tumorale (examen indépendant)
|
20/53 (37,7%)
|
1/26 (3,8%)
|
0,0022
| |
Meilleure réponse tumorale (évaluation de l'investigateur)
|
27/53 (50,9%)
|
0/26 (0%)
|
<0,0001
| |
Délai avant un échec thérapeutique
|
Non atteint
|
134 jours
|
0,0084; RR 0,418
| |
Augmentation de l'hémoglobine >15 g/l à la semaine 13/population évaluable pour la réponse sur l'hémoglobine
|
19/31 (61,3%)
|
0/11 (0%)
|
0,0002
| |
Durée de la réponse tumorale et symptomatique (jours) – examen indépendant; médiane (min, max)
|
340 (55, 676)b
|
Non applicablec
|
| |
Réponse symptomatique complète durabled
|
13/53 (24,5%)
|
0/26 (0%)
|
0,0037
| |
Durée de la réponse symptomatique complète durable (jours), médiane (minimum, maximum)
|
472 (169, 762)e
|
Non applicablec
|
|
a Ajustée pour l'utilisation des corticoïdes lors de la randomisation.
b Au moment de l'analyse principale, les données de 19 répondeurs tumoraux et symptomatiques sur 20 ont été censurées à cause d'une réponse en cours.
c Non applicable, il n'y a eu aucun répondeur dans le bras placebo, par conséquent la durée n'est pas applicable.
d Une réponse symptomatique complète est définie par une réduction de 100% du score global initial des symptômes de MC multicentrique, maintenue pendant au moins 18 semaines avant échec thérapeutique.
e Les données de 11 répondeurs symptomatiques complets sur 13 ont été censurées à cause d'une réponse en cours.
Les signes et les symptômes liés à la MC multicentrique ont été collectés de manière prospective. Un score global pour l'ensemble des symptômes (désigné par le terme de Score global des symptômes liés à la MC multicentrique) a été constitué par la somme des grades de sévérité (grade NCI-CTCAE) des signes et des symptômes liés à la MC multicentrique [symptômes généraux liés à la MC multicentrique (fatigue, malaise, hyperhidrose, sueurs nocturnes, fièvre, perte de poids, anorexie, douleur tumorale, dyspnée et prurit), phénomènes auto-immuns, rétention liquidienne, neuropathie et troubles cutanés]. Le pourcentage de changement par rapport aux valeurs initiales du score des signes et des symptômes liés à la MC multicentrique et du score global des symptômes liés à la MC multicentrique à chaque cycle a été calculé. Une réponse symptomatique complète a été définie par une réduction de 100% par rapport aux valeurs initiales du score global des symptômes liés à la MC multicentrique, maintenue pendant au moins 18 semaines avant échec thérapeutique.
La réponse sur l'hémoglobine a été définie comme un changement lors de l'inclusion à ≥15 g/l à la Semaine 13. La valeur moyenne de l'hémoglobine à chaque cycle au cours de la période de traitement en aveugle est représentée dans le schéma 1.
Schéma 1: Valeur moyenne de l'hémoglobine à chaque cycle au cours de la période de traitement en aveugle
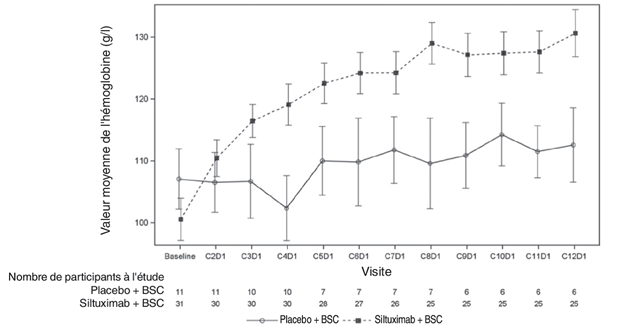
Le taux de survie d'un an a augmenté de 100% dans le bras Sylvant et de 92% dans le bras placebo.
Analyses en sous-groupes:
Les analyses des critères d'évaluation principaux et secondaires dans différents sous-groupes définis selon l'âge (<65 ans et ≥65 ans); l'ethnie (origine caucasienne et non caucasienne); la région (Amérique du Nord, EMEA [Europe, Moyen-Orient, Afrique] et Asie-Pacifique); l'utilisation initiale de corticoïdes (oui et non); l'utilisation de traitements antérieurs (oui et non); et l'histologie de la MC multicentrique (plasmocytaire et mixte) ont montré de façon cohérente un effet thérapeutique en faveur du bras Sylvant, sauf pour le sous-groupe hyalino-vasculaire. Un effet thérapeutique cohérent en faveur des patients traités par Sylvant a été mis en évidence dans le sous-groupe hyalino-vasculaire pour tous les critères secondaires majeurs.
Étude 2
En plus de l'étude 1, des données d'efficacité chez des patients atteints de la maladie de Castleman (MC) issus de l'étude de phase I à bras unique (étude 2) sont disponibles. Dans cette étude, 37 patients atteints de MC ont été traités par Sylvant. 35 de ces patients étaient atteints de MC multicentrique. Au total, 16 patients atteints de MC multicentrique ont reçu 11 mg/kg toutes les 3 semaines. Les données démographiques des patients et les caractéristiques de la maladie des patients ayant reçu 11 mg/kg toutes les 3 semaines étaient similaires à celles de l'étude 1. L'âge moyen était de 51 ans (21 à 76 ans) et 50% des patients étaient des hommes. L'indice de performance ECOG (0/1/2) au début du traitement était de 6%/69%/25%. Soixante-neuf pour cent (69%) des patients avaient reçu des traitements systémiques antérieurs pour la MC multicentrique. Les sous-types histologiques étaient de 44% pour le sous-type hyalino-vasculaire, 50% pour le sous-type plasmocytaire et 6% pour le sous-type mixte. Ce taux d'hémoglobine moyen (écart-type) s'élevait à 125 (23) g/l.
Les données cliniques observées dans l'étude 1 ont été soutenues par l'étude 2. La durée moyenne du traitement par Sylvant s'élevait à 1278 jours et le nombre moyen des administrations de Sylvant s'élevait à 51 patients sous Sylvant. Chez les 16 patients atteints de MC multicentrique traités à la posologie de 11 mg/kg toutes les 3 semaines, le taux de réponse tumorale global déterminé par un examen indépendant a été de 43,8% avec 6,3% de réponse complète. Toutes les réponses tumorales ont été durables pendant >18 semaines. Pour les patients ayant une valeur de l'hémoglobine inférieure au seuil de la valeur normale, le taux de réponse de l'hémoglobine s'élevait à 50% à la semaine 13. Le taux de survie à un an des patients traités par Sylvant s'élevait à 100%.
Étude 3
Dans cette étude de phase II ouverte, multicentrique et non randomisée, la sécurité et l'efficacité d'un traitement prolongé par le siltuximab ont été évaluées chez 60 patients atteints de MC multicentrique qui avaient été inclus auparavant dans l'étude 1 (41 patients) ou l'étude 2 (19 patients). La durée médiane du traitement par le siltuximab a été de 5,52 ans (intervalle: de 0,8 à 10,8 ans); plus de 50% des patients ont été traités pendant ≥5 ans par le siltuximab. Après un suivi médian de 6 ans, aucun des 60 patients n'était décédé et le maintien du contrôle de la maladie a été observé chez 58 des 60 patients.
|

