CompositionPrincipes actifs
Buprénorphine (sous forme de chlorhydrate de buprénorphine).
Excipients
Stéarate de magnésium, crospovidone A (uniquement dans les comprimés sublinguaux à 2 mg et 8 mg), citrate de sodium, povidone K-29/32, acide citrique (E330), amidon prégélatinisé, mannitol (E421 – uniquement dans les comprimés sublinguaux à 2 mg et 8 mg), lactose monohydraté, jaune orangé S (E110 – uniquement dans les comprimés sublinguaux à 2 mg et 8 mg).
Un comprimé sublingual Buprenorphin-Mepha 0.4 mg contient 0.144 mg de sodium et 63.6 mg de lactose monohydraté.
Un comprimé sublingual Buprenorphin-Mepha 2 mg contient 0.468 mg de sodium, 43.90 mg de lactose monohydraté et 0.19 mg de jaune orangé S (E110).
Un comprimé sublingual Buprenorphin-Mepha 8 mg contient 1.872 mg de sodium, 175.60 mg de lactose monohydraté et 0.76 mg d'orange jaune S (E110).
Indications/Possibilités d’emploiTraitement de substitution dans la toxicomanie aux opioïdes, dans le cadre d'une prise en charge médicale, sociale et psychologique.
Posologie/Mode d’emploiLe traitement doit se faire sous le contrôle d'un médecin expérimenté dans la prise en charge de la dépendance/l'addiction aux opioïdes.
Un traitement par comprimés sublinguaux de Buprenorphin-Mepha peut être envisagé en cas de toxicomanie aux opioïdes chez des adultes ou des adolescents de plus de 16 ans. Ces patients nécessitent une surveillance stricte et un soutien constant. Pour des raisons de sécurité, il est recommandé de dispenser le traitement quotidiennement au cabinet médical, sous bonne surveillance.
Précautions avant l'instauration du traitement
Avant le début du traitement par Buprenorphin-Mepha, le médecin doit savoir que Buprenorphin-Mepha se lie aux récepteurs µ en tant qu'agoniste partiel, ce qui peut déclencher un syndrome de sevrage chez les patients dépendants aux opioïdes. C'est pourquoi, le type de dépendance aux opioïdes (c.-à-d. opioïdes à durée d'action longue ou courte), l'intervalle de temps écoulé depuis la dernière prise d'opioïdes et le niveau de dépendance aux opioïdes doivent être pris en compte. Afin d'éviter de précipiter l'apparition d'un syndrome de sevrage, l'induction avec la buprénorphine doit être effectuée dès l'apparition de signes objectifs et évidents de sevrage.
Chez les patients dépendants à l'héroïne et les patients dépendants aux opioïdes à courte durée d'action (tels que la codéine, l'oxycodone ou la morphine à courte durée d'action), le premier comprimé de buprénorphine doit être pris au plus tôt 6 heures après la dernière prise d'opioïdes par le patient ou lors de l'apparition des premiers signes de sevrage.
Un score supérieur à 12 sur l'échelle clinique validée des symptômes de sevrage aux opioïdes (Clinical Opioid Withdrawal Scale, COWS) peut être utilisé comme valeur de référence).
Chez les patients sous méthadone, la dose de cette dernière doit être réduite un maximum de 30 mg/jour avant de commencer le traitement par Buprenorphin-Mepha. La première dose de Buprenorphin-Mepha doit être prise dès l'apparition des premiers signes de sevrage (p.ex. un score supérieur à 12 sur l'échelle COWS), et au plus tôt 24 heures après la dernière prise de méthadone par le patient. Il convient ici de tenir compte de la longue demi-vie de la méthadone. La buprénorphine peut accélérer un syndrome de sevrage chez les patients dépendants à la méthadone.
Un bilan de la fonction hépatique et la recherche d'une hépatite virale doivent être effectués avant de débuter le traitement. Les patients présentant une hépatite virale, recevant des médicaments concomitants et/ou présentant un trouble de la fonction hépatique courent le risque d'une détérioration hépatique accélérée. Une surveillance régulière de la fonction hépatique est conseillée (voir «Mises en garde et précautions»).
Ajustement de la posologie/titration
Après l'instauration du traitement, la posologie du patient doit être ajustée aussi rapidement que possible pour atteindre une posologie d'entretien adéquate en fonction de l'effet clinique. La dose de Buprenorphin-Mepha administrée doit être augmentée progressivement en fonction de l'effet clinique obtenu chez chaque patient et ne doit pas dépasser la posologie maximale de 24 mg de buprénorphine par jour. La posologie doit être augmentée en fonction de la réévaluation de l'état clinique et psychologique du patient et doit se faire par paliers de 2 à 8 mg. Lors de l'instauration du traitement, une remise quotidienne de buprénorphine aux patients est recommandée.
Instauration du traitement
Dose initiale: 0,8–4 mg/jour.
En règle générale, il est recommandé de donner une première dose de 2 mg. En cas de besoin et si la dose initiale a été bien tolérée, on peut répéter la même dose une seconde fois dans la même journée (intervalle minimum de 4 heures). En cas de nécessité et si la tolérance le permet, la dose du second jour peut ensuite être portée à 4 mg ou 8 mg en une seule prise.
Une dose initiale de 0,8 mg ne devrait être utilisée que dans les cas de dépendance légère.
Traitement d'entretien
La posologie de Buprenorphin-Mepha devrait être adaptée au cas par cas, en fonction de la réponse au traitement et de l'état clinique et psychologique du patient. En cas de nécessité, la dose peut être augmentée par paliers. Des études cliniques ont montré que la dose quotidienne habituellement efficace se situe entre 8 et 16 mg. On ne dispose que de données limitées sur la sécurité d'emploi avec des posologies supérieures à 20 mg. Dans des cas isolés, des doses quotidiennes plus faibles ou plus élevées (au max. 32 mg) se sont avérées thérapeutiquement efficaces ou nécessaires.
Au cours du traitement d'entretien, il peut être nécessaire que le patient s'adapte à une nouvelle dose d'entretien à intervalles réguliers en fonction de l'évolution de ses besoins.
Fréquence d'administration inférieure à une fois par jour
Une fréquence d'administration inférieure à une fois par jour peut faciliter le traitement chez les patients dont la posologie doit être supervisée et ne pose pas de problème même en présence d'une dépendance concomitante à des substances activant le SNC, y compris l'alcool.
Après obtention d'une stabilisation satisfaisante, normalement en l'espace de deux semaines, la posologie de Buprenorphin-Mepha peut être réduite à une administration tous les deux jours en doublant la posologie quotidienne individuellement titrée du patient. Par exemple, un patient stabilisé recevant une dose quotidienne de 8 mg peut recevoir 16 mg un jour sur deux, sans traitement les jours intermédiaires. Cependant, la posologie administrée ne doit pas dépasser 24 mg par jour.
Dans certains cas, après l'obtention d'une stabilisation satisfaisante, la fréquence de l'administration de Buprenorphin-Mepha peut être réduite à trois administrations par semaine (par exemple lundi, mercredi et vendredi). La dose du lundi et du mercredi doit être égale à deux fois la dose quotidienne individuellement titrée du patient, et la dose du vendredi doit être égale à trois fois la dose quotidienne individuellement titrée du patient, sans traitement les jours intermédiaires. Cependant, la dose administrée les jours concernés ne doit pas dépasser 24 mg.
Ce schéma thérapeutique n'est éventuellement pas adapté aux patients nécessitant une posologie quotidienne individuellement titrée >8 mg/jour.
Le patient doit être surveillé pendant au moins 1,5 heure après la première administration multidose. Les patients prenant sporadiquement des médicaments ou des substances actives sur le SNC doivent être étroitement surveillés.
Surveillance clinique
Le traitement doit être initié sous surveillance médicale, ce qui peut conduire à une administration indépendante si la stabilité clinique du patient le permet. Au cours de l'initiation du traitement, une surveillance plus étroite est recommandée pour assurer la posologie sublinguale et pour observer la réponse du patient au traitement, ce qui devrait servir à une titration efficace de la dose en termes d'effet clinique.
Si le patient se stabilise pendant le traitement, des intervalles plus longs entre les évaluations du patient en fonction de l'efficacité du plan de traitement, des progrès généraux du patient et tant que le patient respecte le traitement sont appropriés.
Il est également recommandé que le nombre de prescriptions comprenne l'administration indépendante en fonction de la fréquence des visites du patient et de sa capacité à s'administrer lui-même les médicaments reçus à domicile.
Durée du traitement
Si on estime que la période de stabilité a été suffisamment longue, on peut progressivement diminuer les doses de Buprenorphin-Mepha et fixer de nouveaux paliers d'entretien, jusqu'à ce que le traitement puisse être complètement interrompu. Le patient devra dans tous les cas rester sous étroite surveillance.
Patients présentant des troubles de la fonction hépatique
Les conséquences d'une altération de la fonction hépatique sur la pharmacocinétique de la buprénorphine ont été évaluées dans une étude après la commercialisation. La buprénorphine étant largement métabolisée dans le foie, on peut s'attendre à des taux plasmatiques plus élevés chez les patients atteints d'une insuffisance hépatique modérée à sévère, en comparaison avec les sujets sains. C'est pourquoi Buprenorphin-Mepha doit être utilisé avec prudence en cas d'insuffisance hépatique. Une adaptation de la posologie doit être envisagée et les patients doivent être surveillés quant aux éventuels signes et symptômes de sevrage aux opioïdes, de toxicité ou de surdosage causés par des concentrations élevées de buprénorphine. La buprénorphine est contre-indiquée chez les patients présentant une insuffisance hépatique sévère.
Patients présentant des troubles de la fonction rénale
Chez les patients présentant des troubles de la fonction rénale, une modification de la posologie de Buprenorphin-Mepha n'est en règle générale pas nécessaire. Chez les patients atteints d'insuffisance rénale sévère (Clcr <30 ml/min), la prudence est recommandée (voir «Pharmacocinétique»).
Patients âgés
Un ajustement de la posologie n'est généralement pas nécessaire chez les patients âgés de plus de 65 ans; cependant, la buprénorphine doit être administrée avec précaution lorsque l'âge augmente.
Enfants et adolescents
L'utilisation de Buprenorphin-Mepha est déconseillée chez les enfants de moins de 16 ans en raison de l'absence de données sur l'innocuité et l'efficacité.
Mode d'administration
Le mode d'administration habituel est constitué d'une dose unique par jour, par voie sublinguale.
Pour obtenir un effet thérapeutique optimal, il est impératif de laisser fondre le comprimé sublingual sous la langue jusqu'à dissolution complète (5 à 10 minutes). Les patients ne doivent pas mâcher ou avaler le comprimé sublingual, ni consommer de nourriture ou de boisson avant que le comprimé sublingual ne soit complètement dissous.
Il faut absolument expliquer au patient que la seule manière efficace et sûre de prendre Buprenorphin-Mepha est l'administration strictement sublinguale.
Une dose est composée de plusieurs comprimés de Buprenorphin-Mepha sublinguaux de différentes posologies, qui peuvent être pris simultanément ou en deux fois. La deuxième dose doit être prise dès que la première s'est dissoute.
Pour des instructions posologiques spécifiques pendant les ajustements de dose, voir les rubriques Instauration du traitement, Ajustement de la posologie/titration et Traitement d'entretien.
Contre-indicationsBuprenorphin-Mepha ne doit pas être utilisé dans les cas suivants:
·Hypersensibilité à la buprénorphine ou à un autre excipient,
·Association thérapeutique avec des agonistes des récepteurs µ tels que la méthadone ou l'héroïne,
·Insuffisance respiratoire sévère,
·Insuffisance hépatique sévère,
·Alcoolisme aigu ou delirium tremens,
·Enfants/adolescents de moins de 16 ans.
Mises en garde et précautionsLes comprimés sublinguaux de Buprenorphin-Mepha sont uniquement recommandés dans le traitement de la toxicomanie aux opioïdes.
Utilisation non conforme et abus
La buprénorphine peut, comme d'autres opioïdes légaux ou illégaux, être utilisée de façon abusive ou non conforme. Parmi les risques d'abus ou d'utilisation non conforme figurent le surdosage, la propagation d'infections hématogènes virales et d'infections locales ou systémiques, une dépression respiratoire et des lésions hépatiques.
Une utilisation abusive de la buprénorphine par des personnes auxquelles elle n'a pas été prescrite comporte de plus le risque que de nouvelles personnes, qui utiliseraient de manière abusive la buprénorphine comme drogue principale, deviennent toxicomanes, lorsque le médicament est directement mis en circulation pour une utilisation illégale par le patient en question ou lorsque le médicament n'est pas suffisamment protégé contre le vol.
Un traitement par buprénorphine insuffisamment optimal peut entraîner une utilisation abusive du médicament par le patient, ce qui peut conduire à un surdosage ou à l'interruption du traitement. Un patient qui reçoit une dose trop faible de buprénorphine pourrait, face à un syndrome de sevrage non contrôlé, réagir en continuant à consommer des opioïdes, de l'alcool ou d'autres sédatifs/hypnotiques, en particulier les benzodiazépines, en automédication.
Les cliniciens doivent, surtout au début du traitement, prendre en considération le risque d'abus et de mauvais usage (p.ex. administration iv).
Afin de minimiser le risque d'utilisation non conforme et d'abus, les médecins doivent prendre toutes les précautions appropriées lors de la prescription et de la distribution de buprénorphine. C'est pour cette raison qu'il ne faut pas prescrire plusieurs doses en même temps lors de la phase précoce du traitement et qu'il faut fixer des rendez-vous pour le suivi clinique selon les besoins du patient.
Dépression respiratoire
Comme avec tous les opioïdes, il existe un risque de dépression respiratoire cliniquement significative liée à l'utilisation de la buprénorphine, notamment en cas d'utilisation concomitante de la buprénorphine avec les benzodiazépines (voir rubrique «Interactions») ou si la buprénorphine n'a pas été utilisée conformément à l'information professionnelle.
La dépression respiratoire, si elle n'est pas reconnue et traitée immédiatement, peut entraîner un arrêt respiratoire et la mort.
Le traitement d'une dépression respiratoire comprend, selon l'état clinique du patient, une surveillance étroite, des mesures de soutien et l'administration d'antagonistes opioïdes. Une dépression respiratoire grave, potentiellement mortelle ou fatale, peut survenir à tout moment du traitement, le risque étant maximal au début du traitement ou après une augmentation de la dose.
Buprenorphin-Mepha doit être utilisé avec précaution chez les patients atteints d'asthme bronchique ou d'insuffisance respiratoire (telle qu'une maladie pulmonaire obstructive chronique, un cœur pulmonaire, une diminution de la réserve respiratoire, une hypoxie, une hypercapnie, une dépression respiratoire préexistante ou une cyphoscoliose (déformation de la colonne vertébrale pouvant entraîner une détresse respiratoire)).
Troubles respiratoires du sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l'apnée centrale du sommeil (ACS) et l'hypoxémie du sommeil. L'utilisation d'opioïdes s'accompagne d'une augmentation dose-dépendante du risque d'apnée centrale du sommeil. Chez les patients présentant une apnée centrale du sommeil, une réduction de la dose totale d'opioïdes doit être envisagée.
Utilisation concomitante avec des substances à effet dépresseur central
L'utilisation concomitante d'opioïdes avec des benzodiazépines ou d'autres substances à effet dépresseur central peut entraîner une forte sédation, une dépression respiratoire, un coma et la mort. En raison de ces risques, les opioïdes et les benzodiazépines ou autres médicaments à effet dépresseur central doivent uniquement être administrés de manière concomitante aux patients chez qui aucune autre option thérapeutique n'est envisageable. Si Buprenorphin-Mepha est prescrit en association avec des benzodiazépines ou d'autres médicaments à effet dépresseur central, il convient de choisir la dose efficace la plus faible et une durée minimale d'utilisation concomitante. Les patients doivent être étroitement surveillés afin de détecter tout signe ou symptôme de dépression respiratoire et de sédation (voir la rubrique «Interactions»).
Effet dépresseur sur le SNC
La buprénorphine peut provoquer un étourdissement, en particulier lorsqu'elle est prise avec de l'alcool ou des médicaments ayant un effet dépresseur sur le système nerveux central (benzodiazépines, tranquillisants, sédatifs ou hypnotiques) (voir «Interactions» et «Effet sur l'aptitude à la conduite et l'utilisation de machines»).
Les patients auxquels on administre de la buprénorphine en même temps que d'autres analgésiques opioïdes, des anesthésiques généraux, des antihistaminiques, des benzodiazépines, des phénothiazines ou d'autres tranquillisants, des sédatifs/hypnotiques ou d'autres dépresseurs du SNC (y compris l'alcool) peuvent présenter une dépression accrue du SNC. Si une telle association thérapeutique est envisagée, il est extrêmement important que la dose de l'un ou des deux substances soit réduite à la dose efficace la plus faible.
Exposition accidentelle
Les patients et le personnel soignant doivent être informés que Buprenorphin-Mepha contient une quantité de substance active qui peut être mortelle, en particulier pour les enfants. Les patients et le personnel soignant doivent être informés de la nécessité de conserver toutes les doses hors de la portée des enfants et d'éliminer correctement les doses entamées ou non utilisées.
Dépendance aux médicaments et potentiel d'abus
Buprenorphin-Mepha est destiné au traitement de substitution de la dépendance aux opioïdes. L'utilisation répétée d'opioïdes peut entraîner le développement d'une tolérance et d'une dépendance physique et/ou psychique. Une dépendance iatrogène peut apparaître après l'utilisation d'opioïdes. La buprénorphine, comme d'autres opioïdes, peut faire l'objet d'un abus et tous les patients recevant des opioïdes doivent être surveillés afin de détecter tout signe d'abus ou de dépendance. Les patients présentant un risque accru d'abus d'opioïdes peuvent néanmoins être traités de manière appropriée par des opioïdes, mais ces patients doivent faire l'objet d'une surveillance supplémentaire afin de détecter tout signe de mésusage, d'abus ou de dépendance. L'utilisation répétée de Buprenorphin-Mepha peut entraîner un trouble de l'usage des opioïdes. L'abus ou le mésusage intentionnel de la buprénorphine peut entraîner un surdosage et/ou la mort. Le risque de développer un trouble lié à l'utilisation d'opioïdes est plus élevé chez les patients ayant des antécédents de troubles liés à l'utilisation de substances (y compris un trouble lié à l'utilisation d'alcool), personnels ou familiaux (parents ou frères et sœurs), chez les fumeurs ou chez les patients ayant des antécédents d'autres maladies psychiatriques (p.ex. dépression majeure, troubles anxieux et troubles de la personnalité). Les patients doivent être surveillés afin de détecter tout signe de comportement addictif (drug-seeking behavior) qui s'intensifie (p.ex. demande trop précoce d'ordonnances de renouvellement). Cela inclut le contrôle de l'utilisation concomitante d'opioïdes avec des médicaments psychoactifs (comme les benzodiazépines). Chez les patients présentant des signes et des symptômes de troubles liés à l'utilisation d'opioïdes qui s'aggravent, il convient d'envisager de consulter un spécialiste des addictions.
Syndrome de sevrage
La buprénorphine est un agoniste partiel des récepteurs opioïdes µ. Un traitement sur le long terme entraîne une dépendance de type opioïde, mais d'un niveau plus faible que les agonistes entiers des récepteurs μ (p.ex. la morphine). Le syndrome de sevrage est plus léger qu'avec les agonistes entiers et peut survenir de façon retardée.
L'interruption soudaine du traitement n'est pas recommandée car elle peut entraîner un syndrome de sevrage qui peut éventuellement survenir de façon retardée.
Syndrome de sevrage néonatal aux opioïdes
L'utilisation prolongée de Buprenorphin-Mepha pendant la grossesse peut entraîner un syndrome de sevrage néonatal aux opioïdes, potentiellement mortel s'il n'est pas détecté et traité à temps. Le traitement doit être effectué selon des protocoles développés par des experts en néonatologie. Si l'utilisation d'opioïdes chez une femme enceinte est nécessaire pendant une période prolongée, veuillez informer la patiente du risque de syndrome de sevrage néonatal aux opioïdes et assurez-vous que le traitement approprié est disponible, le cas échéant.
Insuffisance surrénale
Les opioïdes peuvent provoquer une insuffisance surrénale réversible, qui nécessite une surveillance et un traitement de substitution par glucocorticoïdes. Les symptômes de l'insuffisance surrénale peuvent notamment inclure: nausées, vomissements, perte d'appétit, fatigue, faiblesse, vertiges ou hypotension.
Diminution du taux des hormones sexuelles et augmentation du taux de prolactine
L'utilisation à long terme d'opioïdes peut être associée à une baisse du taux d'hormones sexuelles et à une augmentation du taux de prolactine. Les symptômes incluent une baisse de la libido, l'impuissance ou l'aménorrhée.
Hépatite et événements hépatiques
Dans les études cliniques et les rapports d'événements indésirables après l'introduction sur le marché, des cas de lésions hépatiques aiguës ont été décrits chez les personnes dépendantes aux opioïdes.
Le spectre des modifications anormales comprend des élévations passagères asymptomatiques des transaminases hépatiques jusqu'à des cas documentés d'hépatite cytolytique, d'insuffisance hépatique, de nécrose hépatique, de syndrome hépato-rénal ainsi que d'encéphalopathie hépatique et de décès. Dans de nombreux cas, la présence en amont d'une dysfonction mitochondriale (maladie génétique), de divergences au niveau des valeurs des enzymes hépatiques, d'infections par le virus de l'hépatite B ou C, d'abus d'alcool, d'anorexie, d'une utilisation concomitante d'autres médicaments potentiellement hépatotoxiques ou du maintien de l'abus de drogues par voie intraveineuse peuvent contribuer à ces modifications ou en être la cause.
Les patients qui ont été testés positifs à l'hépatite virale, qui prennent simultanément d'autres médicaments (voir «Interactions») et/ou qui présentent un dysfonctionnement hépatique préexistant ont un risque plus élevé de lésion hépatique. Ces facteurs sous-jacents doivent être pris en compte avant la prescription de buprénorphine ainsi que durant le traitement (voir «Posologie/Mode d'emploi»). Une évaluation biologique et étiologique plus approfondie est nécessaire en cas de suspicion d'événement hépatique. Sur la base des résultats, le médicament peut être interrompu avec précaution afin de prévenir des symptômes de sevrage et un nouvel abus illégal de drogues. En cas de poursuite du traitement, la fonction hépatique doit être étroitement surveillée.
Sevrage accéléré
En commençant un traitement par Buprenorphin-Mepha, le médecin doit être clairement conscient du profil d'action partiellement agoniste de la buprénorphine. La buprénorphine administrée par voie sublinguale peut déclencher des symptômes de sevrage chez les patients dépendants aux opioïdes si elle est administrée avant que les effets agonistes déclenchés par l'utilisation ou l'abus récent d'opioïdes ne se soient dissipés (voir «Posologie/Mode d'emploi»).
Afin d'éviter un sevrage accéléré aux opioïdes à courte ou longue durée d'action, l'initiation du traitement par buprénorphine doit être effectuée lorsque des signes et symptômes objectifs de léger sevrage se manifestent; un nombre de points supérieur à 12 sur l'échelle clinique de sevrage des opioïdes (Clinical Opioid Withdrawal Scale [COWS]) peut par exemple être utilisé comme valeur indicative (voir «Posologie/Mode d'emploi»).
Lors de la phase de transition de la méthadone à la buprénorphine, les patients doivent être étroitement surveillés car des symptômes de sevrage ont été rapportés.
Les symptômes de sevrage peuvent également être associés à une posologie insuffisamment optimale.
Troubles de la fonction hépatique
Chez les patients atteints d'insuffisance hépatique, la métabolisation de la buprénorphine par le foie peut être réduite et entraîner une augmentation des taux plasmatiques de buprénorphine. C'est pourquoi Buprenorphin-Mepha doit être utilisé avec précaution et une réduction de la dose de buprénorphine peut s'avérer nécessaire (voir «Posologie/Mode d'emploi»).
Buprenorphin-Mepha est contre-indiqué en cas d'insuffisance hépatique sévère.
Troubles de la fonction rénale
L'excrétion rénale peut être retardée car 30% de la dose administrée est éliminée par voie rénale. Les métabolites de la buprénorphine s'accumulent chez les patients ayant une insuffisance rénale. La prudence est de mise lors de l'administration à des patients présentant une insuffisance rénale sévère (clairance de la créatinine <30 ml/min) (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Mises en garde générales en ce qui concerne l'utilisation d'opioïdes
·La buprénorphine peut provoquer une hypotension orthostatique chez les patients traités en ambulatoire.
·La buprénorphine peut entraîner une élévation de la pression du liquide céphalo-rachidien, ce qui peut provoquer des convulsions. Les opioïdes sont donc à utiliser avec précaution chez les patients présentant des antécédents de blessures à la tête, de lésions intracrâniennes, d'autres états avec une élévation potentielle de la pression du liquide céphalo-rachidien ou de convulsions.
·Un myosis ainsi que des altérations de l'état de conscience et de la perception de la douleur causés par des opioïdes en tant que symptômes d'une maladie peuvent porter atteinte à l'évaluation du patient et masquer le diagnostic ou l'évolution clinique d'une maladie concomitante.
·La buprénorphine doit être utilisée avec précaution chez les patients ayant un myxœdème, une hypothyroïdie ou une insuffisance rénale (p.ex. maladie d'Addison).
·La prudence est de mise lorsque la buprénorphine est utilisée chez les patients présentant une hypotension, une hypertrophie de la prostate ou une sténose urétrale.
·Il a été démontré que la buprénorphine augmente la pression dans le canal biliaire et qu'elle doit être utilisée avec précaution chez les patients présentant une dysfonction des voies biliaires.
·La prudence est de mise lors de l'administration de buprénorphine à des patients âgés ou affaiblis.
·La buprénorphine doit être utilisée avec précaution en cas de psychose toxique.
Syndrome sérotoninergique
L'administration concomitante de Buprenorphin-Mepha et d'autres agents sérotoninergiques, tels que les inhibiteurs de la MAO, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques, peut engendrer un syndrome sérotoninergique, qui est une maladie potentiellement mortelle (voir «Interactions»).
Si un traitement concomitant avec d'autres agents sérotoninergiques est justifié sur le plan clinique, il est conseillé d'observer attentivement le patient, tout particulièrement pendant l'instauration du traitement et les augmentations de dose.
Les symptômes du syndrome sérotoninergique peuvent comprendre des modifications de l'état mental, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux.
En cas de suspicion de syndrome sérotoninergique, une réduction de dose ou un arrêt du traitement devra être envisagé(e) en fonction de la gravité des symptômes.
Excipients
Ce médicament contient du lactose. Les patients atteints de la rare intolérance héréditaire au galactose, de déficit en lactase ou de malabsorption du glucose et du galactose ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement «sans sodium».
Les comprimés sublinguaux Buprenorphin-Mepha 2 mg et 8 mg contiennent le colorant azoïque jaune orangé S (E110). Les colorants azoïques peuvent provoquer des réactions allergiques.
Chez les patients hypersensibles aux colorants azoïques, à l'acide acétylsalicylique et d'autres inhibiteurs des prostaglandines, Buprenorphin-Mepha doit être utilisé avec prudence.
InteractionsInducteurs enzymatiques
Inducteurs du CYP3A4
L'utilisation concomitante d'inducteurs du CYP3A4 et de la buprénorphine peut réduire la concentration plasmatique de buprénorphine et ainsi éventuellement entraîner un traitement insuffisamment optimal de la toxicomanie aux opioïdespar la buprénorphine.
Il est conseillé de surveiller étroitement les patients qui reçoivent la buprénorphine en association avec un inducteur du CYP3A4 (p.ex. le phénobarbital, la carbamazépine, la phénytoïne, la rifampicine). La dose de buprénorphine ou de l'inducteur du CYP3A4 devra le cas échéant être adaptée en conséquence.
Inhibiteurs enzymatiques
Inhibiteurs du CYP3A4
Les patients qui reçoivent Buprenorphin-Mepha doivent être étroitement surveillés et nécessitent éventuellement une réduction de la dose lors de l'association à un inhibiteur puissant du CYP3A4.
Dans une étude sur l'interaction de la buprénorphine avec le kétoconazole (un inhibiteur puissant du CYP3A4), des augmentations de la Cmax et de l'ASC (aire sous la courbe) de la buprénorphine (respectivement d'environ 50% et 70%) et dans une moindre mesure de la norbuprénorphine ont été mesurées. Des exemples d'inhibiteurs courants du CYP3A4 sont les antibiotiques tels que l'érythromycine ou d'autres macrolides, les antifongiques imidazolés tels que le kétoconazole ou l'itraconazole, les inhibiteurs de la protéase du VIH tels que le ritonavir, le saquinavir, le nelfinavir ou l'indinavir, ou encore les antidépresseurs tels que la fluvoxamine et la fluoxétine.
Autres interactions
Alcool
L'alcool renforce l'effet sédatif de la buprénorphine. Buprenorphin-Mepha ne doit pas être pris avec des boissons alcoolisées et doit être utilisé avec précaution lors de la prise concomitante d'un médicament contenant de l'alcool (voir «Effet sur l'aptitude à la conduite et l'utilisation de machines».
Effet d'autres médicaments sur Buprenorphin-Mepha
Buprenorphin-Mepha doit être utilisé avec précaution en association avec:
Benzodiazépines
Cette association peut entraîner la mort suite à une dépression respiratoire centrale. C'est pourquoi les patients doivent être étroitement surveillés lorsque cette association est prescrite, et elle doit être évitée lorsqu'il existe un risque d'utilisation abusive. Les patients doivent être prévenus qu'il est extrêmement dangereux de prendre des benzodiazépines non prescrites en même temps que ce médicament. Il faut de plus attirer l'attention des patients sur le fait que des benzodiazépines ne doivent être prises avec ce médicament que sur prescription de leur médecin (voir aussi sous «Mises en garde et précautions»).
Autres dépresseurs du système nerveux central
L'utilisation concomitante d'autres médicaments agissant sur le SNC, tels que d'autres opioïdes, des sédatifs et hypnotiques, des anesthésiques généraux, des phénothiazines, des tranquillisants, des relaxants pour les muscles squelettiques, des antihistaminiques sédatifs, des gabapentinoïdes (gabapentine et prégabaline) et l'alcool, peut produire des effets dépresseurs additifs, entraînant une dépression respiratoire, une hypotension, une sédation sévère ou un coma, parfois fatals (voir la rubrique «Mises en garde et précautions»).
Autres analgésiques opioïdes
Les propriétés analgésiques d'autres opioïdes (tels que la méthadone ou les analgésiques de niveau III) peuvent être réduites chez les patients traités par la buprénorphine lors de toxicomanie aux opioïdes. Il peut être difficile d'obtenir une analgésie suffisante lorsqu'un agoniste entier des opioïdes est administré aux patients recevant de la buprénorphine. À l'inverse, la possibilité de surdosage est à prendre en considération avec des doses d'agoniste entier plus élevées que la normale, comme la méthadone ou un analgésique de niveau III, en particulier lorsque l'on tente de surmonter les propriétés partiellement agonistes de la buprénorphine ou lorsque les taux plasmatiques de buprénorphine diminuent.
Les patients qui ont besoin d'un traitement analgésique et d'un traitement de la toxicomanie aux opioïdes sont idéalement encadrés par des équipes pluridisciplinaires, composées d'experts du traitement de la douleur et de celui de la toxicomanie aux opioïdes (voir aussi «Sevrage accéléré»).
Naltrexone et autres antagonistes opioïdes
La naltrexone est un antagoniste des opioïdes qui peut bloquer les effets pharmacologiques de la buprénorphine. Chez les patients présentant une dépendance aux opioïdes actuellement traités par la buprénorphine, l'antagoniste naltrexone peut entraîner la survenue soudaine de symptômes persistants de sevrage aux opioïdes de forte intensité.
Chez les patients actuellement traités par la naltrexone, les effets thérapeutiques recherchés de l'administration de buprénorphine peuvent être bloqués par l'antagoniste naltrexone.
Médicaments sérotoninergiques
Un syndrome sérotoninergique peut survenir en cas d'administration concomitante d'opioïdes avec des inhibiteurs de la monoamine oxydase (inhibiteurs de la MAO) et des agents sérotoninergiques, tels que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) et les antidépresseurs tricycliques (ATC). Les symptômes d'un syndrome sérotoninergique peuvent inclure des modifications de l'état de conscience, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux voir la rubrique «Mises en garde et précautions»).
Aucune interaction avec la cocaïne, la substance la plus souvent consommée avec les opioïdes par les toxicomanes, n'a été observée à ce jour.
Grossesse, allaitementGrossesse
Les études menées chez le rat et le lapin ont démontré la présence d'une toxicité de reproduction (voir section «Données précliniques»).
Buprenorphin-Mepha ne peut être administré durant la grossesse que lorsque l'avantage potentiel pour la mère justifie le risque potentiel pour le fœtus.
En fin de grossesse, la buprénorphine peut provoquer une dépression respiratoire chez le nouveau-né, même après une courte durée d'utilisation.
L'utilisation prolongée de Buprenorphin-Mepha pendant la grossesse peut entraîner un syndrome de sevrage néonatal aux opioïdes, potentiellement mortel s'il n'est pas détecté et traité à temps. Le traitement doit être effectué selon des protocoles développés par des experts en néonatologie. Si l'utilisation d'opioïdes chez une femme enceinte est nécessaire pendant une période prolongée, veuillez informer la patiente du risque de syndrome de sevrage néonatal aux opioïdes et assurez-vous que le traitement approprié est disponible, le cas échéant (voir également la rubrique «Mises en garde et précautions»). Le syndrome apparaît en général avec un décalage de quelques heures à plusieurs jours après la naissance.
En raison de la longue demi-vie de la buprénorphine, une surveillance de l'enfant à naître pendant plusieurs jours en fin de grossesse doit être envisagée afin de prévenir le risque de dépression respiratoire ou de syndrome de sevrage chez le nouveau-né.
Allaitement
La buprénorphine et ses métabolites passent dans le lait maternel. Les études menées chez la rate ont démontré que la buprénorphine inhibait la lactation. L'allaitement doit être arrêté si l'utilisation est absolument nécessaire.
Effet sur l’aptitude à la conduite et l’utilisation de machinesBuprenorphin-Mepha peut affecter l'aptitude à conduire des véhicules et à utiliser des machines lorsqu'il est utilisé chez des patients dépendants aux opioïdes.
Buprenorphin-Mepha peut provoquer une somnolence, un étourdissement, des vertiges ou une perturbation de la pensée, en particulier lors de l'initiation du traitement et de l'adaptation de la dose. Cet effet peut être renforcé lorsque Buprenorphin-Mepha est utilisé en association avec de l'alcool ou des sédatifs à effet dépresseur central (voir «Mises en garde et précautions»).
Les patients doivent éviter de conduire ou d'utiliser des machines tant qu'ils ne sont pas sûrs que Buprenorphin-Mepha ne les perturbe pas dans l'exercice de ces activités.
Effets indésirablesRésumé du profil de sécurité
Les effets indésirables les plus fréquents qui ont été décrits étaient ceux liés aux symptômes de sevrage (c.-à-d. insomnie, céphalées, nausées, hyperhidrose) et aux douleurs. Les patients souffrant de toxicomanie prononcée peuvent manifester des signes de sevrage après l'administration initiale de buprénorphine (myosis, constipation, bradycardie) semblables à ceux observés sous naloxone.
Liste des effets indésirables
Les effets indésirables observés dans les études cliniques pivots sont énumérés dans le tableau 1. Ces effets sont présentés par classes de systèmes d'organes et par fréquence: très fréquents (≥1/10), fréquents (<1/10, ≥1/100), occasionnels (<1/100, ≥1/1'000) et inconnue (fréquence non estimable sur la base des données disponibles).
Tableau 1: Effets indésirables liés au traitement, signalés dans les études cliniques avec la buprénorphine
|
Infections et infestations
| |
Fréquents:
|
Bronchite, infection, grippe, pharyngite, rhinite
| |
Affections hématologiques et du système lymphatique
| |
Fréquents:
|
Lymphadénopathie
| |
Troubles du métabolisme et de la nutrition
| |
Fréquents:
|
Perte d'appétit
| |
Affections psychiatriques
| |
Très fréquents:
|
Insomnie (16%)
| |
Fréquents:
|
Agitation, peur, dépression, hostilité, nervosité, paranoïa, pensées anormales
| |
Frequence inconnue:
|
Dépendance
| |
Affections du système nerveux
| |
Très fréquents:
|
Céphalées (19%)
| |
Fréquents:
|
Évanouissement, vertiges, hypertension, migraine, paresthésie, somnolence, tremblements.
| |
Affections oculaires
| |
Fréquents:
|
Troubles du larmoiement, mydriase
| |
Affections cardiaques
| |
Fréquents:
|
Palpitations
| |
Affections vasculaires
| |
Fréquents:
|
Vasodilatation
| |
Affections respiratoires, thoraciques et médiastinales
| |
Fréquents:
|
Toux, dyspnée, bâillements
| |
Frequence inconnue:
|
Dépression respiratoire, syndrome d'apnée centrale du sommeil
| |
Affections gastro-intestinales
| |
Très fréquents:
|
Nausées (17%)
| |
Fréquents:
|
Constipation, diarrhée, sécheresse buccale, dyspepsie, troubles gastro-intestinaux, flatulence, affections dentaires, vomissements, douleurs abdominales
| |
Affections de la peau et du tissu sous-cutané
| |
Très fréquents:
|
Hyperhidrose (14%)
| |
Fréquents:
|
Éruption cutanée
| |
Affections musculo-squelettiques et du tissu conjonctif
| |
Fréquents:
|
Arthralgie, dorsalgies, douleurs osseuses, spasmes musculaires, myalgie, douleurs cervicales
| |
Affections des organes de reproduction et du sein
| |
Fréquents:
|
Dysménorrhée
| |
Troubles généraux et anomalies au site d'administration
| |
Très fréquents:
|
Syndrome de sevrage (14%), douleurs (16%)
| |
Fréquents:
|
Asthénie, douleurs thoraciques, frissons, malaise, œdème périphérique, pyrexie
|
Effets indésirables identifiés après la mise sur marché
Les effets indésirables rapportés le plus fréquemment depuis la mise sur le marché sont présentés ci-dessous. La liste comprend les événements mentionnés dans au moins 1% des rapports de spécialistes et dont le lien avec le traitement a été classé comme au moins possible. Ces effets sont présentés par classes de systèmes d'organes.
Tableau 2: Notifications spontanées d'effets indésirables après commercialisation
|
Affections psychiatriques
|
Dépendance
| |
Affections du système nerveux
|
Céphalées
| |
Affections gastro-intestinales
|
Nausées, vomissements
| |
Troubles généraux et anomalies au site d'administration
|
Syndrome de sevrage, syndrome de sevrage néonatal, œdèmes périphériques
|
Description d'effets indésirables sélectionnés
Résumé d'autres effets indésirables rapportés après l'introduction sur le marché considérés comme sévères ou notables pour une autre raison:
·En cas d'abus et d'utilisation abusive, des effets indésirables, plutôt attribuables à l'abus qu'au médicament, ont été décrits: réactions locales telles que cellulite ou abcès (parfois septique), une hépatite aiguë potentiellement sévère, une pneumonie, une endocardite et d'autres infections graves (voir «Mises en garde et précautions»).
·Des dépressions respiratoires sont survenues. Des cas de décès à la suite d'une dépression respiratoire ont été décrits, en particulier lors de l'utilisation de buprénorphine en association à des benzodiazépines (voir «Interactions») ou lorsque la buprénorphine n'était pas utilisée conformément à l'information professionnelle. Des cas de décès ont également été rapportés dans le cadre de l'utilisation de buprénorphine en association à d'autres substances ayant un effet dépresseur central, p.ex. l'alcool ou d'autres opioïdes (voir «Mises en garde et précautions»).
·Des réactions d'hypersensibilité, telles qu'un angioœdème ou un choc anaphylactique, ont été rapportées (voir «Contre-indications»).
·Une élévation des transaminases, une hépatite, une hépatite aiguë, une hépatite cytolytique, un ictère, un syndrome hépato-rénal, une encéphalopathie hépatique et une nécrose hépatique sont survenus (voir «Mises en garde et précautions»).
·Un syndrome de sevrage néonatal a été rapporté chez des nouveau-nés dont les mères ont reçu de la buprénorphine pendant la grossesse. Ce syndrome peut être d'une intensité plus modérée et de durée plus courte que celui associé à des agonistes entiers des récepteurs opioïdes μ de courte durée d'action. La nature du syndrome peut varier selon l'historique de la consommation de drogues de la mère (voie «Grossesse/Allaitement).
·Des hallucinations, une hypotension orthostatique, une rétention urinaire et des vertiges ont été rapportés (voir «Mises en garde et précautions»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn raison de ses propriétés partiellement agonistes, la buprénorphine possède une marge de sécurité plus importante que les agonistes purs.
Bien que l'action antagoniste de la buprénorphine puisse se manifester à des doses légèrement supérieures à l'intervalle thérapeutique, les doses comprises dans l'intervalle thérapeutique recommandé peuvent, dans certaines conditions, provoquer une dépression respiratoire cliniquement significative (voir «Mises en garde et précautions»).
Signes et symptômes
Les manifestations d'un surdosage aigu sont le myosis, la somnolence, l'hypotension, la dépression respiratoire et la mort. Des nausées et vomissements ont été observés. Le symptôme principal qui peut rendre une intervention nécessaire est la dépression respiratoire car elle peut provoquer un arrêt respiratoire et la mort (voir «Mises en garde et précautions»).
Une leucoencéphalopathie toxique a été observée en cas de surdosage d'opioïdes.
Traitement
En cas de surdosage accidentel, des mesures de soutien général sont à prendre, comprenant une surveillance étroite de la fonction respiratoire et cardiaque. En cas de vomissements, il faut veiller à éviter l'inhalation des vomissements.
Il faut instaurer un traitement symptomatique de la dépression respiratoire et des mesures standard de soins intensifs. Il faut intuber le patient et assurer une ventilation assistée ou contrôlée.
L'utilisation d'un antagoniste opioïde (c'est-à-dire la naloxone) est recommandée, malgré l'effet potentiellement modeste de la buprénorphine sur la dépression respiratoire par rapport à l'effet des agonistes opioïdes complets.
Si la naloxone est utilisée, la longue durée d'action de Buprenorphin-Mepha doit être prise en compte pour déterminer la durée du traitement et la surveillance médicale nécessaire pour corriger les effets du surdosage. La naloxone est excrétée plus rapidement que la buprénorphine, ce qui peut entraîner une réapparition des symptômes de surdosage à la buprénorphine précédemment contrôlés, et donc une perfusion continue peut être nécessaire. Si la perfusion n'est pas possible, l'administration répétée de naloxone peut être nécessaire.
Les doses initiales de naloxone peuvent aller jusqu'à 2 mg et être répétées toutes les 2 à 3 minutes jusqu'à l'obtention d'une réponse adéquate, la dose initiale de 10 mg ne devant pas être dépassée. Les débits de perfusion doivent être ajustés en fonction de la réponse du patient.
Propriétés/EffetsCode ATC:
N07BC01
Mécanisme d'action
La buprénorphine est un agoniste partiel des opioïdes, avec une affinité pour les récepteurs µ du cerveau et des propriétés antagonistes sur les récepteurs ĸ. Ses effets dans le traitement de substitution des opioïdes au long cours sont attribués à la réversibilité lente de sa liaison avec les récepteurs µ, ce qui réduit chez le toxicomane le besoin de recourir à la drogue.
En raison de ses caractéristiques partiellement agonistes/antagonistes, la buprénorphine offre une marge de sécurité plus grande que les agonistes purs, et n'a donc qu'une action dépressive modérée sur la respiration.
Pharmacodynamique
Les études de pharmacologie clinique qui ont évalué les effets agonistes opioïdes de la buprénorphine administrée par voie sublinguale en comparaison avec ceux d'agonistes complets tels que la méthadone et l'hydromorphone montrent que la buprénorphine administrée par voie sublinguale exerce des effets agonistes opioïdes typiques, limités par un effet plafond.
La buprénorphine provoque une réaction de type opioïde dose-dépendante chez les personnes dépendantes aux opioïdes pour tous les paramètres testés, y compris l'humeur positive, l'«effet positif» et la dépression respiratoire; il y a toutefois eu une saturation pour les doses plus élevées, à partir desquelles la buprénorphine n'a plus développé d'effet supplémentaire, contrairement aux agonistes complets qui ont toujours développé l'effet le plus important aux doses les plus élevées.
Les effets sur le système cardio-vasculaire et les voies respiratoires ainsi que les effets subjectifs de la buprénorphine ont également été examinés chez des personnes dépendantes aux opioïdes qui ont reçu 12 mg par voie sublinguale ou jusqu'à 16 mg par voie intraveineuse. En comparaison avec le placebo, il n'y a pas eu de différences statistiquement significatives entre les conditions de traitement en ce qui concerne la tension artérielle moyenne, la fréquence cardiaque, la fréquence respiratoire, la saturation en O2 et la température cutanée au cours du temps. La tension artérielle systolique a été significativement plus élevée et le diamètre pupillaire significativement plus petit que dans le groupe placebo.
Efficacité clinique
Aucune donnée n'est disponible.
PharmacocinétiqueAbsorption
Lors d'une prise orale, la buprénorphine est métabolisée rapidement, dès son premier passage dans le foie. C'est la raison pour laquelle elle ne se prête pas à l'administration orale.
L'administration sublinguale permet de contourner ce premier passage hépatique. Lors d'une prise sublinguale, le pic plasmatique est atteint en 90 minutes. La courbe dose-réponse de concentration sérique est pratiquement linéaire entre 4 mg et 16 mg.
Biodisponibilité
La biodisponibilité absolue des comprimés sublinguaux de 2 mg et 8 mg n'a pas été examinée. Lors d'une petite étude qui a porté sur 6 sujets volontaires, la biodisponibilité des comprimés sublinguaux (8 mg) a été établie à 51% par rapport à une solution (utilisée dans tous les essais cliniques), avec une importante dispersion des valeurs (intervalle de confiance 90%: 24–81%).
Les premiers résultats d'une autre étude, qui n'est pas encore arrivée à terme, suggèrent que la biodisponibilité relative des comprimés sublinguaux pourrait être supérieure par rapport à une solution (66%, intervalle de confiance 90%: 56–78%).
Distribution
Après absorption, la buprénorphine est distribuée rapidement, avec une demi-vie de 2 à 5 heures.
Métabolisme
La buprénorphine est métabolisée par désalkylation en 14-N-désalkyl-buprénorphine, qui est un agoniste des récepteurs µ avec une faible action intrinsèque. Les enzymes impliqués dans ce processus métabolique n'ont pas été déterminées. Aussi bien la buprénorphine que son métabolite désalkylé sont ensuite inactivés par glucuroconjugaison.
Buprenorphin-Mepha est métabolisé dans le foie. C'est la raison pour laquelle il faut s'attendre à une augmentation ou une prolongation de l'effet du médicament chez les patients souffrant d'insuffisance hépatique ou lors de l'administration simultanée de substances qui abaissent la clearance hépatique.
Elimination
L'élimination de la buprénorphine suit une courbe bi- ou triexponentielle avec une phase terminale d'élimination longue, qui s'étend sur 20 à 25 heures. Cette cinétique est en partie le résultat d'une réabsorption (cycle entéro-hépatique) de la buprénorphine après hydrolyse des conjugués dans l'intestin, et en partie la conséquence de son caractère fortement liposoluble. Cela conduit à une importante accumulation du métabolite primaire (14-N-désalkyl-buprénorphine).
La buprénorphine est éliminée principalement par excrétion biliaire dans les selles, sous forme de métabolites glucuroconjugués (80%). Le reste est éliminé par voie urinaire.
Linéarité-non-linéarité
Les valeurs de la Cmax et de l'ASC de la buprénorphine augmentent linéairement avec la dose (4 mg-16 mg), bien que l'augmentation ne soit pas directement proportionnelle à la dose.
Troubles de la fonction hépatique
L'élimination hépatique joue un rôle relativement important (environ 70%) dans la clairance totale de la buprénorphine. La durée d'action de la buprénorphine peut être prolongée chez les sujets présentant une diminution de la clairance hépatique. Une posologie initiale de Buprenorphin-Mepha plus basse et une adaptation posologique prudente peuvent être nécessaires chez les patients présentant un trouble léger à modéré de la fonction hépatique.
Le tableau 3 résume les résultats d'une étude clinique dans laquelle les concentrations de buprénorphine ont été déterminées chez des sujets sains et des sujets présentant différents degrés d'insuffisance hépatique après administration de buprénorphine 2 mg/naloxone 0,5 mg.
Tableau 3: Effet de l'insuffisance hépatique sur les paramètres pharmacocinétiques de la buprénorphine après administration de buprénorphine/naloxone (variation par rapport aux sujets sains)
|
Paramètres pharmacocinétiques
|
Insuffisance hépatique légère (Child-Pugh de classe A)
(n=9)
|
Insuffisance hépatique modérée (Child-Pugh de classe B)
(n=8)
|
Insuffisance hépatique sévère (Child-Pugh de classe C)
(n=8)
| |
Buprénorphine
| |
Cmax
|
1,2 fois supérieure
|
1,1 fois supérieure
|
1,7 fois supérieure
| |
ASCdéfini
|
Comme le contrôle
|
1,6 fois supérieure
|
2,8 fois supérieure
|
Globalement, l'exposition plasmatique à la buprénorphine était environ 3 fois plus élevée chez les patients atteints d'insuffisance hépatique sévère. Buprenorphin-Mepha est contre-indiqué chez les patients atteints d'insuffisance hépatique sévère.
Troubles de la fonction rénale
Il n'existe pas d'études pharmacocinétiques chez les patients présentant une insuffisance rénale.
L'élimination rénale joue un rôle relativement peu important (environ 30%) dans la clairance totale de Buprenorphin-Mepha. Aucune modification de la posologie basée sur la fonction rénale n'est requise mais la prudence est recommandée chez les patients présentant une insuffisance rénale sévère.
Données précliniquesMutagénicité
La buprénorphine a fait l'objet d'études in vivo et in vitro suffisantes sur les effets mutagènes. Les tests effectués n'ont apporté aucun indice significatif de potentiel mutagène.
Carcinogénicité
Des études à long terme chez le rat et la souris n'ont apporté aucun indice de potentiel cancérogène, significatif pour l'être humain.
Toxicité sur la reproduction
Chez des rattes et des lapines gravides, des doses quotidiennes de 0,05 mg/kg ou de 0,5 mg/kg n'ont pas entraîné d'observations défavorables. L'élévation de la dose quotidienne à 0,5 mg/kg a provoqué, dans les deux espèces, une augmentation des pertes préimplantatoires et une moindre prise de poids des jeunes animaux pendant les trois premiers jours de vie.
Dans une étude péri- et postnatale, des rats ont reçu quotidiennement 0,05, 0,5 ou 5 mg/kg de buprénorphine par voie intramusculaire. Une diminution dose-dépendante du taux de survie des jeunes animaux (contrôles 88%, dose faible 74%, dose moyenne 71% et dose élevée 37%) a été observée. Aucun effet indésirable n'est survenu chez les animaux traités par la plus faible dose. À la dose la plus élevée, correspondant à environ 100 fois la dose thérapeutique, la durée de la gestation a été prolongée et la prise de poids des mères après la mise-bas a été plus faible que d'habitude.
Toxicité placentaire
Des études menées sur des rates gravides indiquent que la buprénorphine traverse la barrière placentaire. Les taux tissulaires de buprénorphine chez le fœtus en début de gestation sont équivalents aux taux plasmatiques maternels. Au cours de la gestation, la buprénorphine est partiellement détectable dans le tractus gastro-intestinal du fœtus.
Ce n'est que peu avant la mise-bas que la buprénorphine peut être métabolisée par le foie du fœtus et qu'elle est ensuite retrouvée dans le tractus gastro-intestinal du fœtus sous forme de conjugués.
Remarques particulièresConseils pour extraire correctement le comprimé sublingual du blister
Ne pas pousser le comprimé sublingual directement à travers la plaquette!
1.Découper une seule alvéole de la plaquette en suivant la ligne prédécoupée.
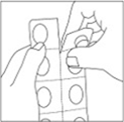
2.Retirer avec précaution la pellicule protectrice supérieure à partir du coin désigné par la flèche.
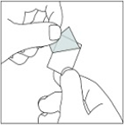
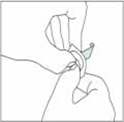
3.Appuyer maintenant sur le comprimé sublingual pour qu'il passe à travers la pellicule restante.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Conserver dans l'emballage d’origine. Ne pas conserver au-dessus de 25°C.
Conserver hors de la portée des enfants.
Numéro d’autorisation65188 (Swissmedic).
PrésentationBuprenorphin-Mepha comprimés sublinguaux 0,4 mg: Emballages de 7 ou 28 comprimés (A+)
Buprenorphin-Mepha comprimés sublinguaux 2 mg: Emballages de 7 ou 28 comprimés (A+)
Buprenorphin-Mepha comprimés sublinguaux 8 mg: Emballages de 7 ou 28 comprimés (A+)
Titulaire de l’autorisationMepha Pharma AG, Basel.
Mise à jour de l’informationFévrier 2024
Numéro de version interne: 6.1
|



