CompositionPrincipes actifs:
Facteur VIII de coagulation sanguine et facteur von Willebrand humain.
Excipients
Poudre: Chlorure de calcium, albumine, chlorure de sodium, citrate de sodium, saccharose, trométamol (correspond à 2,9 mg/ml ou env. 0,6 mmol de sodium par flacon de 500/1200 UI et env. 1,3 mmol de sodium par flacon de 1000 UI/2400 UI).
Solvant: Eau pour préparations injectables.
Indications/Possibilités d’emploiMaladie de von Willebrand
Prévention et traitement des épisodes hémorragiques ou des saignements d'origine chirurgicale chez les patients atteints de la maladie de von Willebrand, lorsque le traitement par la desmopressine (DDAVP) seule est inefficace ou contre-indiqué.
Hémophilie A (déficit congénital en FVIII)
Prophylaxie et traitement des hémorragies chez les patients atteints d'hémophilie A préalablement traités.
Posologie/Mode d’emploiLe traitement de la maladie de von Willebrand et de l'hémophilie A doit être instauré sous la supervision d'un médecin expérimenté dans le traitement des troubles de la coagulation sanguine.
Le rapport quantitatif du FVIII:C au facteur von Willebrand:RCo dans un flacon est de 1:2,4.
Afin de garantir la traçabilité des médicaments produits biologiquement, il est recommandé de documenter le nom commercial et le numéro de lot pour chaque traitement.
Maladie de von Willebrand
Il faut absolument veiller à calculer le dosage en unités internationales (UI) sur la base des proportions quantitatives du facteur von Willebrand:RCo.
De manière générale, 1 UI/kg de facteur von Willebrand:RCo élève le taux plasmatique de facteur von Willebrand:RCo de 0,02 UI/ml (2%).
Il convient de viser un taux de facteur von Willebrand:RCo >0,6 UI/ml (60%) et un taux de FVIII:C >0,4 UI/ml (40%).
Traitement à la demande
De manière générale 40 à 80 UI/kg de facteur von Willebrand:RCo, correspondant à 20 à 40 UI de FVIII:C/kg de poids corporel sont recommandés pour obtenir une hémostase.
Il peut être nécessaire d'instaurer une dose initiale de 80 UI/kg de facteur von Willebrand:RCo, notamment chez les patients souffrant d'une maladie de von Willebrand de type 3, pour lesquels le maintien d'une concentration plasmatique adéquate peut nécessiter l'administration de doses plus fortes que dans les autres types de maladie de von Willebrand.
Prévention des hémorragies en cas d'intervention chirurgicale
Pour la prévention des hémorragies importantes pendant ou après une intervention chirurgicale, la préparation doit être administrée 1 à 2 heures avant l'intervention.
Une dose appropriée doit être ré-administrée toutes les 12 à 24 heures. La dose et la durée du traitement dépendent de l'état clinique du patient, du type et de la sévérité de l'hémorragie et des concentrations de facteur von Willebrand:RCo et de FVIII:C.
Lors de l'utilisation d'une préparation de facteur von Willebrand contenant du FVIII, le médecin traitant doit savoir qu'un traitement continu peut provoquer une élévation excessive du FVIII:C. Afin d'éviter une élévation importante de FVIII:C il convient, après un traitement de 24 à 48 heures de réduire la dose et/ou de prolonger l'intervalle d'administration, ou d'administrer une préparation de facteur von Willebrand contenant une faible teneur en FVIII (voir rubrique «Pharmacocinétique»).
Prophylaxie
Pour la prophylaxie à long terme chez les patients atteints de la maladie de von Willebrand, une dose de 25 à 40 UI de facteur von Willebrand:RCo/kg de poids corporel, 1 à 3 fois par semaine doit être envisagée. Chez les patients atteints d'hémorragies gastro-intestinales ou présentant des hémorragies menstruelles, des intervalles de dose plus courts ou des doses plus élevées peuvent être nécessaires. La dose et la durée du traitement dépendent de l'état clinique du patient, ainsi que des concentrations plasmatiques de facteur von Willebrand:RCo et de FVIII:C.
Enfants et adolescents atteints de la maladie de von Willebrand
Traitement des hémorragies:
De manière générale, 40 à 80 UI/kg de facteur von Willebrand:RCo, correspondant à 20 à 40 UI de FVIII:C/kg de poids corporel sont recommandés chez les enfants et les adolescents pour obtenir une hémostase.
Prophylaxie:
Patients âgés de 12 à 18 ans:
La posologie est calculée selon les mêmes recommandations que pour les adultes.
Enfants <12 ans:
Dans une étude clinique avec des enfants de <12 ans, il a été montré qu'ils présentaient une absorption plus faible du facteur de von Willebrand que les patients de ≥12 ans. Sur la base des résultats de cette étude clinique, des doses prophylactiques de 40–80 UI de facteur von Willebrand:RCo/kg 1 à 3 fois par semaine peuvent être envisagées (voir rubrique «Pharmacocinétique»).
La dose et la durée du traitement dépendent de l'état clinique du patient ainsi que des concentrations plasmatiques de facteur von Willebrand:RCo et de FVIII:C.
Hémophilie A
Il faut absolument veiller à calculer le dosage en unités internationales (UI) en fonction de la proportion de FVIII:C.
La dose et la durée du traitement de substitution dépendent de la sévérité du déficit en FVIII, de la localisation et de l'ampleur de l'hémorragie, ainsi que de l'état clinique du patient.
Le nombre d'unités de FVIII à administrer est exprimé en Unités Internationales (UI), d'après la norme OMS actuelle relative aux produits contenant du FVIII. L'activité du FVIII dans le plasma est exprimée en pourcentage (par rapport au plasma humain normal) ou en UI (par rapport à la norme internationale pour le FVIII dans le plasma).
1 UI d'activité de FVIII est équivalente à la quantité de FVIII dans 1 ml de plasma humain normal.
Traitement à la demande
Le calcul de la dose de FVIII nécessaire est basé sur des données empiriques montrant que l'administration d'1 UI de FVIII par kg de poids corporel augmente l'activité plasmatique du FVIII d'environ 2% par rapport à l'activité normale (récupération in vivo 2 UI/dl). Le calcul de la dose nécessaire repose sur la formule suivante:
Unités nécessaires = poids corporel (kg) × augmentation souhaitée du FVIII (% ou UI/dl) × 0,5.
La dose et la fréquence d'administration doivent toujours être adaptées à l'efficacité clinique au cas par cas.
En cas de survenue de l'un des événements hémorragiques suivants, l'activité du FVIII ne doit pas être inférieure à la valeur indiquée (en % de la normale ou en UI/dl) pour la durée de traitement correspondante. Le tableau suivant peut notamment être utilisé à titre indicatif pour établir la posologie lors d'épisodes hémorragiques et en chirurgie:
|
Degré de sévérité de l'hémorragie/Type d'intervention chirurgicale
|
Taux de FVIII nécessaire (% ou UI/dl)
|
Fréquence d'administration (heures)/Durée du traitement (jours)
| |
Hémorragie
| |
Début d'hémarthroses, saignements musculaires ou saignements dans la cavité buccale
|
20 à 40
|
Renouveler la perfusion toutes les 12 à 24 heures pendant au moins 1 jour jusqu'à la résolution de l'épisode hémorragique (indiqué par la douleur) ou l'obtention d'une cicatrisation.
| |
Hémarthrose plus étendue, hémorragies musculaires ou hématomes
|
30 à 60
|
Renouveler la perfusion toutes les 12 à 24 heures pendant 3 à 4 jours ou plus, jusqu'à la résolution de la douleur ou de l'invalidité aiguë.
| |
Hémorragies mettant en jeu le pronostic vital
|
60 à 100
|
Renouveler la perfusion toutes les 8 à 24 heures jusqu'à disparition du risque vital.
| |
Interventions chirurgicales
| |
Interventions mineures y compris extraction dentaire
|
30 à 60
|
Toutes les 24 heures, pendant au moins 1 jour, jusqu'à l'obtention d'une cicatrisation.
| |
Interventions majeures
|
80 à 100 (pré- et postopératoire)
|
Renouveler la perfusion toutes les 8 à 24 heures, jusqu'à cicatrisation satisfaisante de la plaie, puis poursuivre le traitement pendant au moins 7 jours supplémentaires afin de maintenir une activité FVIII de 30% à 60% (UI/dl).
|
Au cours du traitement, il est conseillé de surveiller fréquemment le taux de FVIII pour adapter la dose à administrer et la fréquence des perfusions répétées. En cas d'interventions chirurgicales majeures notamment, il est indispensable d'effectuer régulièrement un bilan de coagulation complet (activité FVIII dans le plasma) afin d'assurer une surveillance précise du traitement de substitution. La réponse au FVIII peut être différente d'un patient à l'autre compte-tenu des variabilités interindividuelles mesurées pour la récupération in vivo et la demi-vie.
Prophylaxie
Pour la prophylaxie à long terme chez les patients atteints d'hémophilie A sévère, la dose habituelle est de 20 à 40 UI de FVIII/kg de poids corporel, à intervalles de 2 à 3 jours. Dans certains cas, en particulier chez les jeunes patients, il peut être nécessaire de raccourcir les intervalles d'administration ou d'administrer des doses plus élevées.
Enfants et adolescents atteints d'hémophilie A
La posologie dans le cadre du traitement de l'hémophilie A chez les enfants et adolescents de moins de 18 ans est basée sur le poids corporel et est par conséquent, généralement calculée selon les mêmes recommandations que pour les adultes. Dans certains cas, des intervalles plus courts entre les doses ou des doses plus élevées peuvent s'avérer nécessaires. La fréquence d'administration doit toujours être adaptée à l'efficacité clinique au cas par cas.
Patients non préalablement traités
La sécurité et l'efficacité de Voncento chez les patients non préalablement traités n'ont pas encore été établies.
Personnes âgées
Aucun ajustement posologique n'est nécessaire chez les personnes âgées.
Schéma d'administration
Le produit doit être dissous comme décrit ci-dessous et administré par voie intraveineuse.
Le débit de perfusion ne doit pas dépasser 6 ml par minute. Le patient doit être surveillé afin de déceler toute réaction immédiate. En cas de survenue d'une réaction pouvant être reliée à l'administration de Voncento, il convient – en fonction de l'état clinique du patient – de diminuer le débit de perfusion ou d'arrêter l'administration (voir également «Mises en garde et précautions»).
Contre-indicationsHypersensibilité aux substances actives ou à l'un des excipients (voir rubrique «Composition»).
Mises en garde et précautionsHypersensibilité
Des réactions d'hypersensibilité allergique sont possibles. Si des symptômes d'hypersensibilité apparaissent, il faut conseiller aux patients d'interrompre immédiatement l'administration du produit et de contacter leur médecin. Les patients doivent être informés des premiers signes de réactions d'hypersensibilité, tels qu'une éruption cutanée de type papuleuse, une urticaire généralisée, une oppression thoracique, des sifflements respiratoires, une hypotension et une anaphylaxie. En cas de choc, les recommandations médicales actuelles relatives à la prise en charge de l'état de choc doivent être suivies.
Sécurité virale
Les mesures habituelles de prévention des maladies infectieuses, qui peuvent survenir dans le cadre de l'utilisation de médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les pools plasmatiques ainsi que la mise en œuvre dans le procédé de fabrication d'étapes efficaces pour l'inactivation/l'élimination des virus. Malgré ces mesures, la possibilité de transmission d'agents infectieux lors de l'utilisation de médicaments préparés à partir de sang ou de plasma humain ne peut être totalement exclue. Cela s'applique également aux virus inconnus ou émergents et autres agents pathogènes.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l'immunodéficience humaine (VIH), le virus de l'hépatite B (VHB) et le virus de l'hépatite C (VHC), et vis-à-vis du virus de l'hépatite A non enveloppé (VHA).
Les mesures prises peuvent être d'efficacité limitée vis-à-vis des autres virus non enveloppés tels que le parvovirus B19. Les infections par le parvovirus B19 peuvent avoir des conséquences graves pour les femmes enceintes (infection fœtale) et chez les personnes atteintes de maladies associées à un déficit immunitaire ou d'érythropoïèse accrue (p.ex. anémie hémolytique).
Une vaccination contre l'hépatite A et l'hépatite B est normalement recommandée pour les patients recevant de façon régulière des préparations de FVIII/facteur von Willebrand humain.
Maladie de von Willebrand
Il existe un risque de survenue d'événements thrombotiques, en particulier chez les patients présentant des facteurs de risque cliniques ou biologiques connus. Par conséquent, une surveillance des premiers signes de thrombose s'avère essentielle chez les patients à risque. Une prophylaxie contre les thromboembolies veineuses doit être instaurée conformément aux recommandations actuelles.
Des anticorps neutralisants (inhibiteurs) contre le facteur von Willebrand peuvent apparaître chez les patients souffrant de la maladie de Willebrand, notamment chez les patients de type 3. Si les niveaux d'activité plasmatique attendus pour le facteur von Willebrand:RCo ne sont pas atteints ou si l'hémorragie n'est pas contrôlée malgré l'administration d'une dose appropriée, un test approprié devra être réalisé afin de rechercher la présence d'inhibiteurs du facteur von Willebrand. Chez les patients présentant des taux élevés d'inhibiteurs, le traitement peut non seulement être inefficace mais également conduire à des réactions anaphylactoïdes et d'autres options thérapeutiques doivent être envisagées.
Hémophilie A
Inhibiteurs
La formation d'anticorps neutralisants (inhibiteurs) contre FVIII est une complication connue dans le traitement des patients souffrant d'hémophilie A. Ces inhibiteurs sont généralement des immunoglobulines IgG dirigées contre l'activité coagulante FVIII. Ils sont quantifiés en Unités Bethesda (UB) par ml de plasma par des tests modifiés. Le risque d'apparition d'inhibiteurs est corrélé à l'exposition au FVIII, ce risque étant le plus élevé pendant les 20 premiers jours d'exposition. Dans de rares cas, les inhibiteurs peuvent apparaître après les 100 premiers jours d'exposition.
Des cas de réapparition d'inhibiteurs (faible titre d'anticorps) ont été observés après le changement d'un FVIII pour un autre, chez des patients préalablement traités ayant plus de 100 jours d'exposition et qui présentaient des antécédents de développement d'inhibiteurs. Par conséquent, une étroite vigilance est recommandée pour tous les patients afin de surveiller l'apparition d'inhibiteurs après chaque changement de traitement.
D'une manière générale, tous les patients traités avec un FVIII humain de coagulation sanguine doivent faire l'objet d'une surveillance étroite par le biais d'examens cliniques ou biologiques appropriés afin de détecter l'apparition d'inhibiteurs. Si les niveaux d'activité plasmatique attendus pour le FVIII ne sont pas atteints, ou si l'hémorragie n'est pas contrôlée par l'administration d'une dose appropriée, un test de recherche d'inhibiteurs du FVIII doit être effectué. Chez les patients présentant des niveaux élevés d'inhibiteurs, le traitement par FVIII peut ne pas être efficace et d'autres options thérapeutiques doivent être envisagées. La prise en charge de ces patients doit être effectuée par des médecins expérimentés dans la prise en charge des patients hémophiles A et des patients qui présentent des inhibiteurs du FVIII.
Enfants et Adolescents
Les mises en garde et les précautions sont valables de façon analogue pour les enfants et les adolescents, comme pour les adultes.
Voncento 500 UI FVIII/1200 vWF contient moins de 1 mmol de sodium (23 mg) par flacon, ce qui signifie qu'il est pratiquement «sans sodium».
Voncento 1000 UI FVIII/2400 vWF contient jusqu'à 29,5 mg de sodium (1,3 mmol) par flacon, ce qui correspond à 1,5% de l'apport journalier maximal de sodium de 2 g recommandé par l'OMS dans l'alimentation d'un adulte.
InteractionsAucune interaction du facteur von Willebrand et du FVIII avec d'autres médicaments n'a été étudiée jusqu'ici.
Grossesse, allaitementMaladie de von Willebrand
On ne dispose pas d'expérience dans le traitement des femmes enceintes ou qui allaitent. Voncento doit être administré pendant la grossesse et l'allaitement seulement en cas d'indication claire et en tenant compte du risque accru d'événements hémorragiques chez ces patientes.
Hémophilie A
Étant donnée la faible fréquence de l'hémophilie A chez les femmes, on ne dispose pas d'expérience concernant l'utilisation du FVIII pendant la grossesse et l'allaitement.
Par conséquent, Voncento ne doit être utilisé pendant la grossesse et l'allaitement qu'en cas d'indication claire.
Fertilité
Il n'y a pas de donnée disponible sur la fertilité.
Aucune étude sur la reproduction n'a été effectuée chez l'animal avec Voncento.
Effet sur l’aptitude à la conduite et l’utilisation de machinesVoncento n'affecte pas l'aptitude à conduire des véhicules ou l'aptitude à utiliser des machines.
Effets indésirablesChez les adultes et les adolescents les effets indésirables suivants peuvent survenir pendant le traitement avec Voncento: des réactions d'hypersensibilité ou des réactions allergiques, des événements thromboemboliques, fièvre, céphalées, dysgueusie et perturbation du bilan hépatique. De plus les patients peuvent développer des inhibiteurs contre le FVIII et le facteur von Willebrand.
La liste présenté ci-dessous est fondé sur la classification par systèmes d'organes MedDRA.
Les fréquences ont été définies selon les conventions suivantes: très fréquents (≥1/10), fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10'000 à <1/1000), très rares (<1/10'000).
Troubles généraux et anomalies au site d'administration:
Très fréquents: céphalées (11,43%).
Fréquents: fièvre.
Affections hématologiques et du système lymphatique:
Fréquents: inhibiteurs de FVIII.
Cas isolés: inhibiteurs du facteur de Willebrand*.
Affections du système immunitaire:
Fréquents: réactions d'hypersensibilité (y compris douleurs thoraciques, gênes thoraciques, tachycardie et et dorsalgies).
Affections du système nerveux:
Occasionnels: dysgueusie.
Affections vasculaires:
Occasionnels: événements thromboemboliques.
Investigations:
Occasionnels: anomalie des tests hépatiques.
* Effets indésirables observés seulement après l'introduction sur le marché, et non lors d'études cliniques avec Voncento.
Description de certains effets indésirables
Hypersensibilité (réactions allergiques): des réactions d'hypersensibilité ou des réactions allergiques qui peuvent inclure: angio-œdème, brûlure et piqûre au site de perfusion, frissons, rougeur avec sensation de chaleur, urticaire généralisée, céphalées, urticaire, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique (y compris douleurs thoraciques et gêne thoracique et douleurs dorsales), fourmillements, vomissements et respiration sifflante ont été observées et peuvent dans certains cas, évoluer vers une anaphylaxie sévère (y compris le choc).
Inhibiteurs de FVIII: les patients atteints d'hémophilie A peuvent développer des anticorps neutralisants (inhibiteurs) contre FVIII. Si de tels inhibiteurs apparaissent, la réaction se manifeste par une réponse clinique insuffisante (p.ex. un saignement durable). Dans de tels cas, il est recommandé de contacter un centre spécialisé dans l'hémophilie. Il n'y a pas d'expérience tirée des études cliniques avec Voncento chez des patients non traités au préalable. Par conséquent, aucune donnée valide concernant l'incidence des inhibiteurs spécifiques cliniquement significatifs n'est actuellement disponible.
Inhibiteurs du facteur von Willebrand: les patients atteints de la maladie de von Willebrand, particulièrement les patients de type 3, peuvent développer des anticorps neutralisants (inhibiteurs) du facteur von Willebrand. Si de tels inhibiteurs apparaissent, la réaction se manifeste par une réponse clinique insuffisante. Étant donné qu'il s'agit d'anticorps précipitants, ils peuvent apparaître en même temps que des réactions anaphylactiques. Par conséquent, une recherche de la présence d'inhibiteurs doit être effectuée chez les patients présentant une réaction anaphylactique. Dans tous ces cas, il est recommandé de contacter un centre spécialisé dans l'hémophilie.
Événements thromboemboliques: chez les patients atteints de la maladie de von Willebrand, il existe un risque de survenue d'événements thromboemboliques, en particulier chez les patients ayant des facteurs de risques cliniques ou biologiques connus. L'administration aux patients de produits contenant du FVIII et du facteur von Willebrand peut s'accompagner d'une élévation prolongée et excessive des taux plasmatiques de FVIII:C, susceptible d'augmenter le risque d'événements thromboemboliques (voir aussi la rubrique «Posologie/Mode d'emploi»).
Enfants et adolescents
La fréquence, le type et la sévérité des effets indésirables chez les enfants et les adolescents sont supposés comparables à ceux de l'adulte.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas de surdosage (deux fois la dose recommandée) ont été observés au cours des essais cliniques. Aucun effet indésirable grave n'a été associé à ce cas. Le risque d'événements thromboemboliques ne peut être exclu dans les cas d'un surdosage majeur, particulièrement chez les patients atteints de maladie de von Willebrand.
Propriétés/EffetsCode ATC
B02BD06
Mécanisme d'action/Pharmacodynamique
Maladie de von Willebrand
Le facteur von Willebrand humain perfusé agit de la même manière que le facteur von Willebrand endogène.
L'administration de facteur von Willebrand permet de corriger à deux niveaux les troubles de l'hémostase observés chez les patients présentant un déficit en facteur von Willebrand:
·Le facteur von Willebrand permet de rétablir l'adhésion des plaquettes au sous-endothélium vasculaire des vaisseaux lésés (le facteur von Willebrand se lie aussi bien au sous-endothélium vasculaire qu'à la membrane plaquettaire), ce qui assure une hémostase primaire, comme en témoigne le raccourcissement du temps de saignement. Cet effet apparaît immédiatement et dépend essentiellement de la teneur élevée en multimères de haut poids moléculaire de facteur von Willebrand.
·Le facteur von Willebrand permet de corriger de façon différée le déficit associé en FVIII. Après l'administration par voie intraveineuse, le facteur von Willebrand se lie au facteur FVIII endogène (celui produit physiologiquement par le patient), stabilise ce facteur et évite ainsi sa dégradation rapide. C'est la raison pour laquelle l'administration de facteur von Willebrand pur (préparation contenant du facteur von Willebrand avec une faible teneur en FVIII) normalise les taux de FVIII:C avec un léger délai après la première perfusion comme effet secondaire.
·L'administration de préparations contenant du facteur von Willebrand combiné avec du FVIII:C permet de normaliser les taux de FVIII:C immédiatement après la première perfusion.
Hémophilie A
Le FVIII humain perfusé agit de la même manière que le FVIII endogène.
Le complexe de FVIII/facteur von Willebrand est composé de deux molécules (FVIII et facteur von Willebrand) qui ont des fonctions physiologiques différentes. Dans le traitement des patients hémophiles, le FVIII se lie au facteur von Willebrand dans la circulation sanguine du patient.
Le FVIII activé agit comme cofacteur du facteur IX activé, accélérant l'activation du facteur X en facteur X activé. Le facteur X activé convertit à son tour la prothrombine en thrombine. La thrombine transforme ensuite le fibrinogène en fibrine, après quoi un caillot de sang peut se former. L'hémophilie A est un trouble héréditaire de la coagulation sanguine lié au sexe qui résulte d'un déficit en FVIII. Il en résulte des hémorragies profuses dans les articulations, les muscles ou les organes internes, qui peuvent être spontanées, accidentelles ou résulter d'interventions chirurgicales. Le traitement de substitution permet d'augmenter les concentrations plasmatiques de FVIII, et donc de corriger temporairement le déficit en facteur ainsi qu'une suppression de la tendance hémorragique.
Efficacité clinique
Dans les études cliniques prospectives, ce sont au total 221 patients, 74 avec une maladie de von Willebrand et 147 avec une hémophilie A, qui ont reçu un traitement par Voncento. 8adolescents âgés de 12 à 18 ans, 3 avec une maladie de von Willebrand et 5 avec une hémophilie A, ainsi que 54 enfants de moins de 12 ans ont été inclus dans l'étude. Chez ces derniers, 36 étaient atteints d'hémophilie A et 18 de la maladie de von Willebrand. Chez un enfant de moins d'un an, le titre des inhibiteurs du FVIII était élevé.
De plus, des données d'efficacité et de sécurité de 3 études publiées, menées par investigateur ont été recueillies dont celles de 43 patients adultes atteints de la maladie de von Willebrand (étude Shortt) et 43 adolescents et 43 enfants atteints de la maladie de von Willebrand (âgés de 5 mois à moins de 18 ans; étude Howman). Des données de sécurité provenant de 15 autres patients pédiatriques atteints d'hémophilie A avec des inhibiteurs du FVIII ayant été traités dans le cadre d'une provocation d'une tolérance immunitaire, sont disponibles (étude Robertson).
Maladie de von Willebrand
Note: L'efficacité et la sécurité de Voncento dans la maladie de von Willebrand, en particulier de type 3, n'ont été étudiées sur le plan clinique que chez un petit nombre de patients.
L'efficacité hémostatique (arrêt du saignement) dans le traitement des hémorragies non chirurgicales (HNC) et chirurgicales (HC) a été évaluée dans 3 études non contrôlées, en ouvert. Dans deux de ces études, l'efficacité du traitement prophylactique a été étudiée chez les patients atteints de la maladie de von Willebrand.
Une échelle d'évaluation à 4 niveaux a été utilisée pour l'évaluation de l'efficacité dans toutes les études: «Aucune» - pas de contrôle des hémorragies; «Modérée» - contrôle modéré des hémorragies avec nécessité d'un traitement supplémentaire; «Bonne» - léger écoulement, avec contrôle partiel mais suffisant des hémorragies; «Excellente» - obtention de l'hémostase.
Dans le cas du traitement à la demande dans la première étude CSLCT-BIO-08-54 chez 22 adultes et adolescents, l'efficacité hémostatique a été jugée par le vérificateur comme «Excellente» ou «Bonne» chez 98,2% (407 HNC évaluables) et comme «Modérée» chez 1,7%.
Pendant cette étude, 125 cas de HNC sévères, dont 7 hémorragies de muqueuses, ont été observés chez un total de 8 patients. L'évaluation globale de l'efficacité par l'évaluateur a donné pour ces HNC sévères dans 1 cas, la note «Excellente» et pour les 6 restants «Modérée». Pour les 6 hémorragies de muqueuses stoppées jugées «Modérées», il s'agissait d'hémorragies utérines, dont 4 ont été évaluées comme «Bonne» contenues en un jour. La majorité des cas de HNC (93,9%) n'a nécessité qu'une perfusion unique. Chez 8 patients de cette étude, un traitement à la demande a été administré pendant 12 mois avant de le substituer par un traitement prophylactique. Le nombre total de cas de HNC a diminué de 306 (18 à 82 par patient pour le traitement à la demande) à 10 chez 5 patients pendant le traitement prophylactique. L'évaluateur a jugé l'efficacité hémostatique de tous les cas traités comme «Excellente».
Dans la deuxième étude CSLCT-BIO-03-97 portant principalement sur les HC, l'efficacité hémostatique chez 9 patients avec au total 10 interventions chirurgicales majeures a été considérée comme «Excellente» ou «Bonne» pour la totalité des 10 cas (100%). Chez 11 patients qui avaient subi 15 interventions chirurgicales mineures, l'efficacité hémostatique était «Excellente» dans 14 cas (93%) et «Bonne» dans 1 cas (7%).
Pour favoriser l'hémostase (coagulation sanguine), la dose moyenne de 27 UI de FVIII:C/kg/jour pendant en moyenne 2 jours dans les HNC (correspondant à 54 à 65 UI de facteur von Willebrand:RCo/kg/jour), 33 UI de FVIII:C/kg/jour pendant en moyenne 2 jours pour les interventions chirurgicales mineures (correspondant à 66 à 79 UI de facteur von Willebrand:RCo/kg/jour) et 41 UI de FVIII:C/kg/jour pendant en moyenne 7,5 jours pour les interventions chirurgicales majeures (correspondant à 82 à 98 UI de facteur von Willebrand:RCo/kg/jour) a été administrée.
Dans la troisième étude CSLCT-BIO-08-52 menée avec 17 patients de moins de 12 ans, l'efficacité hémostatique du traitement à la demande a été jugée comme «Excellente» (45%) ou «Bonne» (55%) dans tous les cas (80 HNC évaluables y compris 26 cas sévères dont 13 hémorragies des muqueuses). Chez trois patients de ce groupe, des interventions dentaires mineures ont été réalisées. Dans le bras sous prophylaxie de l'étude avec 4 patients, 73 cas de HNC ont nécessité un traitement pour lequel l'efficacité a été jugée comme «Excellente» (81%) ou «Bonne» (19%). Comparé à leur traitement précédent, le traitement prophylactique n'a pas nécessairement causé une diminution de la fréquence des événements hémorragiques non chirurgicaux spontanés, mais a diminué la sévérité de l'hémorragie.
Le traitement de 17 patients de l'étude CSLCT-BIO-08-54 et de 3 patients de l'étude CSLCT-08-52 a été poursuivi dans l'étude d'extension CSLCT-BIO-09-64. L'efficacité pendant la période de traitement prolongée était comparable à celle des études initiales. Dans le groupe sous traitement à la demande, dans 98.7% des HNC évaluables, l'efficacité a été jugée comme «Excellente» ou «Bonne», dans le traitement prophylactique, ce chiffre était de 97.9%.
L'efficacité hémostatique chez 43 patients adultes après 58 interventions chirurgicales a été évaluée comme «Excellente» ou «Bonne» dans tous les cas (100%) dans l'étude rétrospective Shortt sur les HC. L'efficacité chez les patients atteints de maladie de von Willebrand de type 3 (n = 5) a été évaluée comme «Excellente» dans 55% des interventions.
Pour obtenir une coagulation sanguine, la dose moyenne de 29 UI de FVIII:C/kg/jour pendant en moyenne 2 jours (plage: 1 à 4 jours) pour les opérations mineures, y compris les interventions dentaires, et de 5 jours (plage: 1 à 13) pour les opérations majeures (correspond à 58 à 70 UI de facteur von Willebrand:RCo/kg/jour) a été administrée. L'utilisation simultanée d'acide tranexamique et de desmopressine a été établie dans certains cas.
Dans la deuxième étude rétrospective Howman avec un total de 43 enfants et adolescents, 42 interventions chirurgicales ont été évaluées: 10 opérations majeures chez 10 patients et 32 interventions chirurgicales mineures chez 21 patients. Quatre épisodes d'hémorragies postopératoires ont également été traités chez 4 patients, qui n'avaient reçu aucun produit favorisant l'hémostase avant l'intervention chirurgicale. De plus, un total de 72 HNC ont été évaluées: 46 hémorragies muco-cutanées chez 11 patients et 26 hémorragies des tissus musculo-squelettiques et des tissus mous chez 13 patients. L'acide tranexamique a été exclusivement administré comme traitement d'appoint.
L'efficacité hémostatique dans toutes les interventions chirurgicales a été évaluée comme «Excellente» ou «Bonne» dans 90% de toutes les interventions chirurgicales (dans 90% des interventions chirurgicales majeures et 91% des interventions chirurgicales mineures). L'efficacité hémostatique dans toutes les HNC a été de 94% et chez les patients atteints de la maladie de von Willebrand de type 3 dans 98% des cas comme «Excellente» ou «Bonne».
Comme dose moyenne quotidienne, 51 UI de FVIII:C/kg/jour (correspondant à 102 à 122 UI de facteur von Willebrand:RCo/kg/jour) pendant une moyenne de 7 jours (plage: 1 à 24 jours) pour les interventions majeures et 45 UI de FVIII/kg/jour (correspondant à 90 à 108 UI de facteur von Willebrand:RCo/kg/jour) pendant une moyenne de 3 jours (plage: 1 à 8 jours) pour les interventions mineures, ont été administrées. Dans les HNC, la dose journalière moyenne était de 45 UI de FVIII:C/kg/jour (correspondant à 90 à 108 UI de facteur von Willebrand:RCo/jour) avec une durée moyenne de traitement de 1 jour (plage: 1 à 13 jours).
L'efficacité et la sécurité dans la maladie de von Willebrand acquise n'ont pas été étudiées.
Hémophilie A
L'efficacité dans l'hémophilie A a été étudiée dans 2 études en ouvert non contrôlées.
Dans la première étude CSLCTBIO-07-47, un total de 81 patients adultes atteints d'hémophilie A et avec au moins 150 jours d'exposition préalable à une autre préparation de FVIII ont été traités soit à la demande (y compris la prophylaxie des hémorragies dans le contexte d'une intervention chirurgicale) ou exclusivement durant la prophylaxie.
Parmi les 656 épisodes hémorragiques exploitables, 96,4% ont été évalués comme «Excellente» ou «Bonne», 3,5% comme «Modérée» et 0,2% comme «Aucune» (1 épisode sans contrôle hémostatique).
Un total de 37 interventions chirurgicales chez 20 patients (12 interventions majeures et 25 interventions mineures) ont été traitées pendant cette étude. L'efficacité hémostatique a été jugée comme «Excellente» par l'évaluateur dans 8 interventions chirurgicales majeures et 10 mineures et comme «Bonne» dans 2 interventions chirurgicales majeures.
Dans la deuxième étude CSLCTBIO-08-53 menée chez des enfants de moins de 12 ans, 35 patients ont reçu un traitement à la demande ou prophylactique. 21 des patients ont été traités pendant un minimum de 50 jours. Dans le groupe sous traitement à la demande, pour tous les 318 cas évaluables, l'efficacité a été évaluée comme «Excellente» ou «Bonne» (respectivement 24.2% et 75.8%), y compris 98 (30.6%) hémorragies sévères, dont 7 étaient de muqueuses. Dans le groupe sous prophylaxie, pour 99.4% des 172 cas évaluables, l'efficacité a été évaluée comme «Excellente» ou «Bonne», pour 1 cas comme «Modérée». Sur les 85 hémorragies sévères (49.1%), aucune n'était mucosique. Cinq patients dans le groupe sous prophylaxie n'ont présenté aucune hémorragie pendant le traitement.
Au total, ce traitement a été administré dans 5 interventions chirurgicales, dont 2 majeures et 3 mineures. L'évaluateur a jugé l'efficacité hémostatique dans les 2 interventions chirurgicales majeures comme «Excellente» et dans les 3 mineures comme «Bonne».
L'efficacité et la sécurité chez les patients non préalablement traités n'ont pas encore été établies.
PharmacocinétiqueMaladie de von Willebrand
Les propriétés pharmacocinétiques de Voncento ont été évaluées chez les patients souffrant de la maladie de von Willebrand en dehors de toute hémorragie.
Selon une étude pharmacocinétique réalisée chez 12 sujets atteints de la maladie de von Willebrand, les caractéristiques pharmacocinétiques suivantes pour le facteur von Willebrand:RCo, le facteur von Willebrand:Ag et le FVIII: C ont été observées:
|
Paramètre
|
vWF:RCo
|
vWF:Ag
| |
N
|
Moy.
|
SD
|
Plage
|
N
|
Moy.
|
SD
|
Plage
| |
Récupération progressive (kg/ml)
|
12
|
0,017
|
0,002
|
0,01 à 0,02
|
12
|
0,018
|
0,002
|
0,01 à 0,02
| |
Demi-vie (h)
|
8
|
13,7
|
9,2
|
6,1 à 35,1
|
12
|
18,3
|
4,0
|
11,4 à 27,0
| |
ASC0-72 (h*UI/ml)
|
12
|
17,7
|
9,7
|
8.6 à 38,0
|
12
|
37,8
|
13,3
|
22,6 à 64,7
| |
TMR (h)
|
8
|
14,0
|
5,0
|
8,6 à 25,5
|
12
|
23,6
|
5,0
|
15,3 à 33,6
| |
Cmax (UI/ml)
|
12
|
1,65
|
0,63
|
0,93 à 3,36
|
12
|
2,29
|
0,59
|
1,52 à 3,66
| |
Tmax (h)
|
12
|
0,25a
|
|
0,25 à 1,03
|
12
|
0,25a
|
|
0,25 à 1,00
| |
Cmin (UI/ml)
|
12
|
0,01
|
0,01
|
0,00 à 0,03
|
12
|
0,10
|
0,05
|
0,02 à 0,17
| |
Clairance totale (ml/kg)
|
12
|
6,09
|
1,66
|
3,06 à 9,32
|
12
|
3,57
|
0,69
|
2,61 à 4,78
| |
Vss (ml/kg)
|
8
|
74,8
|
35,3
|
44,7 à 158
|
12
|
82,8
|
18,6
|
64,5 à 128,4
|
|
Paramètre
|
vWF:CB
|
FVIII:C
| |
N
|
Moy.
|
SD
|
Plage
|
N
|
Moy.
|
SD
|
Plage
| |
Récupération progressive (kg/ml)
|
12
|
0,020
|
0,004
|
0,02 à 0,02
|
12
|
0,025
|
0,006
|
0,02 à 0,04
| |
Demi-vie (h)
|
12
|
16,0
|
4,6
|
9,4 à 25,1
|
10
|
28,0
|
15,7
|
7,7 à 57,5
| |
ASC0-72 (h*UI/ml)
|
12
|
24,8
|
8,8
|
14,8 à 41,1
|
11
|
34,0
|
16,2
|
13,2 à 66,8
| |
TMR (h)
|
12
|
20,0
|
4,4
|
11,6 à 28,6
|
10
|
43,1
|
22,1
|
15,6 à 85,1
| |
Cmax (UI/ml)
|
12
|
1,68
|
0,50
|
1,04 à 2,66
|
12
|
0,96
|
0,25
|
0,57 à 1,32
| |
Tmax (h)
|
12
|
0,25a
|
|
0,25 à 1,00
|
12
|
1,00a
|
|
0,25 à 30,00
| |
Cmin (UI/ml)
|
12
|
0,05
|
0,02
|
0,02 à 0,09
|
12
|
0,21
|
0,18
|
0,03 à 0,59
| |
Clairance totale (ml/kg)
|
12
|
3,53
|
0,89
|
2,32 à 4,77
|
11
|
1,33
|
0,59
|
0,62 à 2,47
| |
Vss (ml/kg)
|
12
|
68,6
|
15,7
|
47,5 à 93,7
|
10
|
48,1
|
15,3
|
24,8 à 72,9
|
a médiane.
ASC = aire sous la courbe; Cmax = concentration plasmatique max.; Cmin = concentration plasmatique minimale; UI = unités internationales; TMR = temps moyen de résidence; N = nombre de sujets; Moyenne = valeur moyenne; SD = écart-type; Tmax = temps pour lequel la concentration plasmatique maximale est atteinte; Vss = volume de distribution à l'état d'équilibre; vWF:Ag = facteur von Willebrand:antigène; vWF:CB = facteur von Willebrand:liaison au collagène; vWF:RCo = facteur von Willebrand:cofacteur de la ristocétine; FVIII:C = activité de FVIII dans le plasma.
La fraction relative du multimère de haut poids moléculaire du facteur von Willebrand dans Voncento par rapport au plasma humain normal est en moyenne de 86%. L'expression relative de multimères de haut poids moléculaire de facteur von Willebrand chez les patients souffrant de la maladie de von Willebrand après la perfusion de Voncento était en moyenne d'environ 10% (en utilisant une analyse semi-quantitative de multimères).
Hémophilie A
Les propriétés pharmacocinétiques de Voncento ont été évaluées chez des patients atteints d'hémophilie A en dehors de toute hémorragie.
Selon une étude pharmacocinétique réalisée chez 16 patients atteints d'hémophilie A, les caractéristiques pharmacocinétiques suivantes de FVIII:C ont été observées:
|
Paramètre
|
FVIII:C
| |
N
|
Moy.
|
SD
|
Plage
| |
Récupération progressive (kg/ml)
|
16
|
0,021
|
0,006
|
0,011 à 0,032
| |
Demi-vie (h)
|
16
|
13,40
|
2,53
|
8,78 à 18,51
| |
ASC0-48 (h*UI/ml)
|
16
|
13,79
|
3,79
|
7,04 à 21,79
| |
TMR (h)
|
16
|
16,96
|
3,68
|
11,29 à 26,31
| |
Cmax (UI/ml)
|
16
|
1,07
|
0,28
|
0,57 à 1,57
| |
Tmax (h)
|
16
|
0,81
|
0,94
|
0,42 à 4,03
| |
Cmin (UI/ml)
|
16
|
0,060
|
0,028
|
0,021 à -0,111
| |
Clairance totale (ml/(h*kg)
|
16
|
3,92
|
1,22
|
2,30 à 7,11
| |
Vss (ml/kg)
|
16
|
65,33
|
20,65
|
35,07 à 113,06
|
ASC = aire sous la courbe; Cmax = concentration plasmatique max.; Cmin = concentration plasmatique minimale; UI = unités internationales; TMR = temps moyen de résidence; N = nombre de patients; Moyenne = valeur moyenne; SD = écart-type; Tmax = temps pour lequel la concentration plasmatique maximale est atteinte; Vss = volume de distribution à l'état d'équilibre; FVIII:C = activité FVIII dans le plasma.
Enfants et adolescents
Bien qu'aucune différence au niveau des paramètres pharmacocinétiques n'ait été observée tant pour la maladie de von Willebrand que pour l'hémophilie A dans les deux groupes pédiatriques (enfants de moins de 6 ans et enfants de 6 à 12 ans), on ne s'attend pas à ce que cela ait une pertinence clinique par rapport à la variabilité inhérente des patients.
Les données pharmacocinétiques chez les patients pédiatriques et chez les adultes sont comparables.
Données précliniquesLes principes actifs de Voncento sont le FVIII et le facteur von Willebrand, provenant de plasma humain et agissant comme les constituants endogènes du plasma. Les études précliniques à doses répétées (toxicité chronique, cancérogénicité et reprotoxicité) ne peuvent pas être réalisées avec des modèles animaux classiques en raison de l'apparition d'anticorps après l'administration de protéines humaines hétérologues.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments, solvants ou diluants, à l'exception de ceux mentionnés dans la rubrique «Composition».
Stabilité
Voncento peut être conservé jusqu'à la date de péremption «EXP» figurant sur l'étiquette et l'emballage. Ne pas utiliser la préparation après la date de péremption mentionnée (EXP).
Stabilité après l'ouverture
Après reconstitution, la stabilité physico-chimique a été démontrée pendant 8 heures à température ambiante (inférieure à +25 °C). D'un point de vue microbiologique, la préparation dissoute doit être utilisée immédiatement. Si l'utilisation n'est pas immédiate, la durée de conservation ne doit pas dépasser 24 heures entre 2 °C et 8 °C.
Remarques particulières concernant le stockage
A conserver à une température ne dépassant pas 25 °C.
Ne pas congeler.
Garder hors de portée des enfants.
Conserver dans son emballage fermé pour protéger le contenu de la lumière.
Remarques concernant la manipulation
Remarques générales
La solution doit être limpide ou légèrement opalescente. Le produit reconstitué doit être examiné visuellement pour la présence de particules ou de colorations après la filtration/le prélèvement de la solution dans la seringue (voir ci-dessous). Les solutions fortement troubles et les solutions contenant des flocons ou un dépôt ne doivent pas être utilisées. La préparation et le prélèvement doivent se faire dans des conditions exemptes de germes (aseptiques).
Après la reconstitution de 500 UI de FVIII/1200 UI de facteur von Willebrand avec 5 ml de solvant, la solution contient 100 UI de FVIII et 240 UI de facteur von Willebrand par ml.
Après la reconstitution de 1000 UI de FVIII/2400 UI de facteur von Willebrand avec 10 ml de solvant, la solution contient 100 UI de FVIII et 240 UI de facteur von Willebrand par ml.
Préparation
Réchauffez le solvant à température ambiante sans ouvrir le flacon. Pour cela, laissez les deux flacons soit environ 1 heure à température ambiante, soit quelques minutes dans vos mains. N'exposez-pas le flacon à une source de chaleur directe. Les flacons ne doivent pas être réchauffés à une température supérieure à la température corporelle (>37 °C).
Avant l'ouverture de l'emballage de Mix2Vial™ (contient un dispositif de transfert filtrant Mix2Vial) retirez le capuchon en plastique coloré des flacons de solvant et de produit, traitez les bouchons avec une solution antiseptique et laissez-les sécher ensuite. Conformez-vous ensuite aux instructions suivantes:
suivantes:
|
|
|
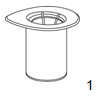
1.Retirer l'opercule de l'emballage du Mix2Vial. Ne pas retirer le Mix2Vial du blister!
| |
|
|
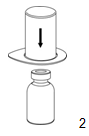
2.Placer le flacon de solvant sur une surface plane et propre et le maintenir fermement. En tenant le dispositif de transfert filtrant Mix2Vial à travers son blister et le côté bleu de l'adaptateur vers l'avant, pousser l'extrémité bleue de l'adaptateur tout droit vers le bas à travers le bouchon du flacon de solvant.
| |
|

|
3.Retirer avec précaution l'emballage du dispositif de transfert filtrant Mix2Vial en tenant les bords du blister et en tirant verticalement vers le haut. Vérifier que seul le blister a été retiré et pas le Mix2Vial.
| |
|
|
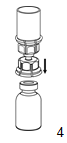
4.Poser le flacon de poudre sur une surface plane et rigide. Retourner l'ensemble flacon de solvant avec le dispositif de transfert filtrant Mix2Vial et pousser l'extrémité transparente de l'adaptateur tout droit vers le bas à travers le bouchon du flacon de produit. Le solvant s'écoule automatiquement dans le flacon du produit.
| |
|

|
5.En maintenant la partie produit d'une main et la partie solvant du Mix2Vial de l'autre main, séparer les flacons en dévissant doucement le dispositif en deux pour éviter une formation excessive de mousse lors de la dissolution du produit. Jeter le flacon de solvant sur lequel est attachée la partie bleue de l'adaptateur Mix2Vial.
| |
|
|
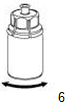
6.Agiter délicatement le flacon de produit avec l'adaptateur transparent jusqu'à ce que le produit soit totalement dissous. Ne pas secouer.
| |
|

|
7.Remplir d'air une seringue stérile vide. Tout en maintenant verticalement le flacon de produit, connecter la seringue au Luer Lock du dispositif de transfert filtrant Mix2Vial et injecter l'air dans le flacon de produit.
| |
|

|
8.En maintenant le piston de la seringue appuyé, tourner l'ensemble et prélever la solution dans la seringue en tirant lentement sur le piston.
| |
|

|
9.Une fois le produit entièrement transféré dans la seringue, tenir le corps de la seringue fermement (maintenir le piston dans sa position) et déconnecter la seringue de l'adaptateur transparent Mix2Vial.
|
Pour la perfusion de Voncento, seul le nécessaire d'administration fourni doit être utilisé car l'échec du traitement peut être une conséquence de l'adsorption du FVIII sur les surfaces internes de certains équipements de perfusion.
Dans le cas où une quantité plus importante de Voncento est nécessaire, il est possible d'utiliser plusieurs flacons de Voncento via un dispositif de perfusion disponible dans le commerce (par exemple une pompe à perfusion pour une application par voie intraveineuse de médicaments). Toutefois, dans ces cas, la solution initialement reconstituée de Voncento ne doit pas être davantage diluée.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux dispositions locales.
Numéro d’autorisation65477 (Swissmedic).
Présentation500 UI/1200 UI:
1 flacon de poudre et 1 flacon de solvant 5 ml (B)
1000 UI/2400 UI:
1 flacon de poudre et 1 flacon de solvant 10 ml (B)
Contenant chacune:
1 dispositif de transfert 20/20
1 set d'administration (carton intérieur):
·1 nécessaire de ponction veineuse
·2 tampons imbibés d'alcool
·1 pansement non stérile
·1 seringue à usage unique
Titulaire de l’autorisationCSL Behring AG, Berne.
Mise à jour de l’informationAvril 2020.
|









