CompositionPrincipes actifs
Nétupitant, palonosétron (sous forme de chlorhydrate).
Excipients
Cellulose microcristalline, laurate de saccharose (corresp. à 20 mg de saccharose), povidone K-30, croscarmellose sodique, silice colloïdale hydratée, fumarate de stéaryle sodique, stéarate de magnésium, caprylocaprate de macrogol-6-glycérol, glycérol, oléate de polyglycéryl-3, eau purifiée, butylhydroxyanisole (E320).
Enveloppe de la capsule: Gélatine, sorbitol (corresp. à 7 mg), 1,4 sorbitane, dioxyde de titane (E171), oxyde de fer jaune (E172), oxyde de fer rouge (E172).
Encre: Gommes laques, oxyde de fer noir (E172), propylèneglycol, hydroxyde d'ammonium.
Chaque gélule contient 0.38 mg de sodium.
Indications/Possibilités d’emploiAkynzeo associé à la dexaméthasone est indiqué chez l'adulte pour:
·la prévention des nausées et vomissements aigus et retardés associés aux chimiothérapies anticancéreuses hautement émétisantes.
·la prévention des nausées et vomissements aigus et retardés associés aux chimiothérapies anticancéreuses modérément émétisantes.
Posologie/Mode d’emploiPosologie
Adultes
1 gélule d'Akynzeo prise par voie orale 1 heure environ avant le début de chaque cycle de chimiothérapie.
Pour l'administration répétée d'Akynzeo, voir Propriétés/Effets et Pharmacocinétique.
La dose orale recommandée de dexaméthasone doit être réduite d'environ 50% en cas d'administration simultanée avec Akynzeo:
·chimiothérapie hautement émétisante: 12 mg de dexaméthasone administrés oralement 30 minutes avant la chimiothérapie au jour 1; 8 mg administrés oralement 1 fois par jour aux jours 2-4.
·chimiothérapie modérément émétisante: 12 mg de dexaméthasone administrés oralement 30 minutes avant la chimiothérapie au jour 1. L'administration de dexaméthasone aux jours 2-4 n'est pas nécessaire (voir le Tableau 2 et le Tableau 4 de la rubrique «Propriétés/Effets» qui rapportent les schémas thérapeutiques utilisés dans les études MEC et HEC).
Patients présentant des troubles de la fonction hépatique
Aucun ajustement posologique n'est nécessaire chez les patients atteints d'insuffisance hépatique légère à modérée (score de Child-Pugh 5-8).
Des données limitées sont disponibles chez des patients atteints d'insuffisance hépatique sévère (score de Child-Pugh ≥9). Les patients atteints d'insuffisance hépatique sévère ne devraient pas être traités avec Akynzeo.
Enfants et adolescents
La sécurité et l'efficacité chez les enfants n'ont pas été démontrées. Aucune donnée n'est disponible.
Patients présentant des troubles de la fonction rénale
Un ajustement posologique n'est pas considéré comme nécessaire chez les patients atteints d'insuffisance rénale légère à modérée.
L'excrétion rénale du nétupitant est négligeable.
Une insuffisance rénale légère à modérée n'affecte pas significativement les paramètres pharmacocinétiques du palonosétron.
En cas d'insuffisance rénale sévère, l'exposition systémique totale au palonosétron intraveineux est augmentée d'environ 28% relativement aux sujets sains. La pharmacocinétique du palonosétron ou du nétupitant n'a pas été étudiée chez les patients sous hémodialyse présentant une insuffisance rénale au stade terminal.
Patients âgés
Aucun ajustement de la posologie n'est nécessaire chez les personnes âgées.
Mode d'administration
Voie orale. La gélule doit être avalée entière.
Akynzeo peut être pris au cours ou en dehors des repas.
Contre-indicationsHypersensibilité à l'un des principes actifs ou à un autre composant du produit.
Grossesse.
Mises en garde et précautionsConstipation:
Comme le palonosétron peut augmenter le temps de transit colique, les patients ayant des antécédents de constipation ou des signes d'occlusion intestinale subaiguë doivent faire l'objet d'une surveillance après l'administration. Des cas graves de constipation et de subiléus ont été observés dans le programme d'étude Akynzeo et dans la période post-commercialisation.
Syndrome sérotoninergique:
Des cas de syndrome sérotoninergique ont été rapportés lors de l'utilisation d'antagonistes 5-HT3, soit seuls, soit en association avec d'autres médicaments sérotoninergiques, y compris les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSNa). Une surveillance appropriée des patients est recommandée afin de détecter des symptômes de type syndrome sérotoninergique.
Allongement de l'intervalle QT:
Une étude ECG spécifique et approfondie conduite sur des volontaires sains masculins et féminins prenant du nétupitant par voie orale (200 mg ou 600 mg) en combinaison avec du palonosétron par voie orale (0,5 mg ou 1,5 mg) a démontré qu'Akynzeo n'avait pas d'effet cliniquement important sur les paramètres d'ECG. Cependant, comme Akynzeo contient un antagoniste des récepteurs 5-HT3, il est recommandé d'être prudent en cas d'utilisation concomitante d'Akynzeo et de médicaments qui allongent l'intervalle QT ou en cas d'administration à des patients présentant ou susceptibles de présenter un allongement de l'intervalle QT.
Les facteurs de risque sont des antécédents personnels ou familiaux d'allongement de l'intervalle QT, des troubles électrolytiques, de l'insuffisance cardiaque congestive, des bradyarythmies, des troubles de la conduction et l'administration d'antiarythmiques ou d'autres médicaments entraînant un allongement de l'intervalle QT ou des troubles électrolytiques. L'hypokaliémie et l'hypomagnésémie devraient être corrigées avant l'administration d'Akynzeo.
Akynzeo ne devrait pas être utilisé pour la prévention ou le traitement des nausées et vomissements au cours des jours suivant la chimiothérapie, sauf si un autre cycle de chimiothérapie est prévu.
La prudence est de mise chez les patients présentant une fonction hépatique fortement altérée, car les données disponibles chez ces patients sont limitées.
Ce médicament devrait être utilisé avec prudence chez les patients traités simultanément par voie orale avec des substances actives principalement métabolisées par le CYP3A4 et présentant une faible marge thérapeutique (voir Interactions).
Les agents chimiothérapeutiques qui sont des substrats du CYP3A4
Le nétupitant est un inhibiteur modéré du CYP3A4 et peut augmenter l'exposition aux agents chimiothérapeutiques qui sont des substrats du CYP3A4, tels que le docétaxel (voir Interactions). Il convient donc de surveiller les patients afin de déceler toute augmentation des effets toxiques des chimiothérapies qui sont des substrats du CYP3A4, comme l'irinotécan. En outre, le nétupitant peut également influencer l'efficacité des agents chimiothérapeutiques dont l'activation nécessite une métabolisation par le CYP3A4.
Excipients:
Akynzeo gélule contient 7 mg de sorbitol et 20 mg de saccharose par gélule. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Akynzeo peut contenir des traces de lécithine de soja. Les patients présentant une hypersensibilité connue aux arachides ou au soja doivent donc être surveillés étroitement pour détecter des signes de réaction allergique.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par gélule, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsL'administration concomitante d'Akynzeo et d'un autre inhibiteur du CYP3A4 peut conduire à une élévation de la concentration plasmatique du nétupitant.
L'administration concomitante d'Akynzeo et d'un inducteur du CYP3A4 peut conduire à une diminution de la concentration plasmatique du nétupitant, ce qui pourrait résulter en une diminution de l'efficacité d'Akynzeo.
Akynzeo peut augmenter les concentrations plasmatiques de médicaments métabolisés par CYP3A4 et administrés simultanément par voie orale.
Chez l'humain, le nétupitant est éliminé principalement par métabolisation hépatique médiée par le CYP3A4, avec une excrétion rénale marginale.
A une dose de 300 mg, le nétupitant est un substrat et un inhibiteur modéré du CYP3A4 chez l'humain.
Le palonosétron est éliminé de l'organisme à la fois par excrétion rénale et par voie métabolique, cette dernière médiée par plusieurs enzymes CYP.
Le palonosétron est métabolisé essentiellement par le CYP2D6, avec une contribution mineure des isoenzymes CYP3A4 et CYP1A2. Sur la base des études in vitro, le palonosétron n'est ni inducteur ni inhibiteur des isoenzymes du cytochrome P450 aux concentrations cliniques.
Interaction avec des médicaments sérotoninergiques (p.ex. ISRS et IRSNa):
Des cas de syndrome sérotoninergique ont été rapportés après l'utilisation concomitante d'antagonistes 5-HT3 et d'autres médicaments sérotoninergiques dont des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSNa).
Interaction entre le nétupitant et le palonosétron administrés par voie orale:
Il n'a pas été observé d'interaction pharmacocinétique cliniquement significative entre le nétupitant et le palonosétron administrés par voie orale.
Interaction avec les substrats CYP3A4:
Dexaméthasone:
Les doses de dexaméthasone doivent être réduites lors d'une administration concomitante avec Akynzeo (voir le schéma d'administration des études cliniques dans la rubrique «Propriétés/Effets»).
La co-administration d'une dose unique de nétupitant (300 mg) avec un schéma de dexaméthasone (20 mg au jour 1, puis 8 mg deux fois par jour aux jours 2-4) a significativement augmenté l'exposition à la dexaméthasone d'une manière temps- et dose-dépendante.
L'AUC0-24 (jour 1), l'AUC24-36 (jour 2) et les AUC84-108 et AUC84-∞ (jour 4) de la dexaméthasone ont été augmentées de 2,4 fois lors d'une co-administration de 300 mg de nétupitant.
Interaction avec les médicaments anticancéreux (docétaxel, étoposide, cyclophosphamide)
L'exposition au docétaxel et à l'étoposide a augmenté respectivement de 37% et 21% lors de la co-administration avec Akynzeo. Il n'a pas été observé d'effet uniforme avec le cyclophosphamide lors de la co-administration de nétupitant.
Interaction avec les contraceptifs oraux
L'administration concomitante d'Akynzeo avec une dose orale unique de 60 μg d'éthinylestradiol et 300 μg de lévonorgestrel n'a pas eu d'effet significatif sur l'AUC de l'éthinylestradiol, mais a augmenté l'AUC du lévonorgestrel de 1,4 fois; des effets cliniques sur l'efficacité de la contraception hormonale sont peu probables. Des modifications pertinentes de la pharmacocinétique du nétupitant et du palonosétron n'ont pas été observées.
Erythromycine et midazolam
L'exposition à l'érythromycine et au midazolam a été augmentée de 1,3 et 2,4 fois, respectivement, lorsque chacune de ces molécules étaient coadministrées avec du nétupitant. Ces effets n'ont pas été considérés comme cliniquement importants. Le profil pharmacocinétique du nétupitant n'a pas été affecté par l'administration concomitante de midazolam ou d'érythromycine. Il est recommandé de tenir compte des effets potentiels de l'augmentation des concentrations plasmatiques du midazolam ou d'autres benzodiazépines métabolisées par le CYP3A4 (alprazolam, triazolam) lorsque ces substances sont coadministrées avec Akynzeo.
Interaction avec les substrats du CYP2C9
Des interactions avec des substrats du CYP2C9 (p.ex. warfarine, tolbutamide) sont peu probables.
Des études in vitro sur des microsomes hépatiques humain indiquent que ni le palonosétron ni le nétupitant ne sont des inducteurs ou des inhibiteurs du CYP2C9.
Effet d'autres médicaments sur la pharmacocinétique d'Akynzeo
Le nétupitant est principalement métabolisé par le CYP3A4; l'administration concomitante d'Akynzeo avec des inducteurs ou des inhibiteurs du CYP3A4 est donc susceptible d'influencer les concentrations plasmatiques du nétupitant. Par conséquent, l'administration concomitante d'Akynzeo avec des inducteurs ou des inhibiteurs puissants du CYP3A4 (p.ex. kétoconazole, rifampicine) doit se faire avec prudence ou être évitée.
Influence du kétoconazole et de la rifampicine
L'utilisation du kétoconazole, un inhibiteur du CYP3A4, avec les capsules de nétupitant/palonosétron a entraîné une augmentation de l'AUC du nétupitant d'un facteur 1,8 et de la Cmax d'un facteur 1,3 par rapport à l'utilisation des capsules de nétupitant/palonosétron seules. L'utilisation concomitante de kétoconazole n'a eu aucune influence sur la pharmacocinétique du palonosétron. L'utilisation de la rifampicine, un inducteur du CYP3A4, avec Akynzeo® a entraîné une diminution de l'AUC du nétupitant d'un facteur 5,2 et de la Cmax d'un facteur 2,6. L'utilisation simultanée de rifampicine n'a pas eu d'influence sur la pharmacocinétique du palonosétron. La prudence est donc de mise en cas d'utilisation concomitante d'inhibiteurs puissants du CYP3A4 (par ex. kétoconazole) et l'utilisation concomitante d'inducteurs puissants du CYP3A4 (par ex. rifampicine) doit être évitée.
Autres interactions
Il est peu probable qu'Akynzeo interagisse avec des médicaments substrats de la glycoprotéine P. Lors de l'administration de nétupitant au 8ème jour d'un traitement de 12 jours avec de la digoxine, aucune modification de la pharmacocinétique de la digoxine n'a été observée.
Une inhibition du transporteur d'efflux BCRP et de l'isoenzyme de glucuronidation UGT2B7 par le nétupitant et ses métabolites est peu probable et, si elle devait se produire, elle n'aurait que peu d'intérêt clinique.
Les données in vitro montrent que le nétupitant inhibe l'UGT2B7; l'ampleur d'un tel effet dans des conditions cliniques n'est pas connue. La prudence est recommandée lorsque le nétupitant est utilisé en association avec un substrat oral de cette enzyme (par exemple, zidovudine, acide valproïque, morphine).
Des données in vitro suggèrent que le nétupitant inhibe le transporteur d'efflux BCRP. La pertinence clinique de cet effet n'est pas connue.
Les données in vitro indiquent que le nétupitant est un inhibiteur de la P-gp. Dans une étude menée sur des volontaires sains, le nétupitant n'a pas montré d'effet sur l'exposition à la digoxine, un substrat de la P-gp, mais a augmenté sa Cmax d'un facteur 1,09 [IC à 90 %: 0,9 - 1,31]. Il n'est pas exclu que cet effet puisse être plus prononcé et alors cliniquement pertinent chez les patients atteint d'un cancer, en particulier en présence de troubles de la fonction rénale. La prudence est donc de mise lorsque le nétupitant est associé à la digoxine ou à d'autres substrats de la P-gp tels que le dabigatran ou la colchicine.
Grossesse, allaitementFemmes en âge de procréer/Contraception chez les femmes
Les femmes en âge de procréer ne doivent pas être enceintes ni le devenir pendant le traitement par les gélules de nétupitant/palonosétron. Chez toutes les femmes pré-ménopausées, un test de grossesse doit être effectué avant le traitement. Les femmes en âge de procréer doivent utiliser une méthode de contraception fiable pendant et jusqu'à un mois après le traitement par ce médicament.
Grossesse
Nétupitant
Il n'y a actuellement pas de données concernant l'utilisation du nétupitant chez la femme enceinte. Les études animales ont montré une toxicité sur la reproduction, notamment des effets tératogènes chez le lapin sans marge de sécurité (voir rubrique «Données précliniques»).
Palonosétron
Il n'y a actuellement pas de données concernant l'utilisation du palonosétron chez la femme enceinte. Les données issues des études animales n'ont pas mis en évidence d'effets nocifs directs ou indirects du palonosétron sur la santé en termes de toxicité pour la reproduction (voir la rubrique «Données précliniques»).
Les capsules de nétupitant/palonosétron sont contre-indiquées pendant la grossesse (voir la rubrique «Contre-indications»).
Allaitement
Il n'est pas connu si le palonosétron ou le nétupitant sont excrétés dans le lait maternel. Un risque pour l'enfant allaité ne peut pas être exclu. Les capsules de nétupitant/palonosétron ne doivent pas être utilisées pendant l'allaitement. L'allaitement doit être interrompu pendant le traitement par ce médicament et pendant 1 mois après la dernière dose.
Fertilité
Aucun effet sur la fertilité n'a été observé dans les études animales à des expositions cliniquement significatives au nétupitant ou au palonosétron (voir la rubrique «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesLes effets d'Akynzeo sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Comme Akynzeo peut provoquer des vertiges, de la somnolence ou de la fatigue, les patients doivent être avertis s'ils doivent conduire un véhicule ou utiliser des machines.
Effets indésirablesLe profil de sécurité d'Akynzeo a été évalué chez 1169 patients cancéreux recevant au moins un cycle de chimiothérapie anticancéreuse hautement émétisante (n=221) ou modérément émétisante (n=958) parmi lesquels 782 ont été exposés à Akynzeo pendant au moins 4 cycles et 321 pendant au moins 6 cycles, jusqu'à un maximum de 12 cycles de chimiothérapie.
Tous les patients ont reçu une dose orale unique d'Akynzeo une heure avant le début de chaque cycle de chimiothérapie. Dans toutes les études, de la dexaméthasone a été administrée conjointement à Akynzeo (voir la rubrique «Propriétés/Effets», Tableaux 2, 4 et 6). Des effets indésirables, considérées par l'investigateur comme liés au médicament, ont été notifiés chez environ 13% des patients traités par Akynzeo. Le traitement par Akynzeo a été interrompu en raison de réactions indésirables chez 3,7% des patients.
Le profil d'effets indésirables a été similaire dans tous les cycles.
Les réactions indésirables suivantes ont été rapportées chez ≥1% des patients traités avec Akynzeo pour un ou plusieurs cycles:
Tableau 1 – Effets indésirables se produisant chez ≥1% des patients ayant reçu Akynzeo dans les études portant sur les nausées et vomissements induits par chimiothérapie (tous les cycles)
|
Effet indésirable
|
Akynzeo
(N=1169)
|
Palonosétron
0.5 mg
(N=1231)
|
Aprépitant
+ 5-HT3
(N=238)
| |
Affections du système nerveux:
| |
Céphalée.
|
3.6%
|
2.9%
|
1.7%
| |
Affections gastro-intestinales:
| |
Constipation.
|
3.0%
|
2.5%
|
1.3%
| |
Troubles généraux et anomalies au site d'administration:
| |
Fatigue.
|
1.2%
|
0.7%
|
---
|
Le tableau suivant contient également des effets indésirables qui ont été rapportés après la commercialisation.
Liste des effets indésirables
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante:
«très fréquents» (≥1/10),
«fréquents» (≥1/100 à <1/10),
«occasionnels» (≥1/1000 à <1/100),
«rares» (≥1/10 000 à <1/1000),
«très rares» (<1/10 000).
«Fréquence inconnue» (ne peut être estimée sur la base des données disponibles)
|
Classe de systèmes d'organes
|
Fréquents
|
Occasionnels
|
Rares
| |
Infections et infestations
|
|
|
Cystite
| |
Affections hématologiques et du système lymphatique
|
|
Neutropénie
|
Leucopénie
| |
|
|
Leucocytose
|
Lymphocytose
| |
Troubles du métabolisme et de la nutrition
|
|
Diminution de l'appétit
|
Hypokaliémie
| |
Affections psychiatriques
|
|
Insomnie
|
Psychose aiguë
| |
|
|
|
Modifications de l'humeur
| |
|
|
|
Troubles du sommeil
| |
Affections du système nerveux
|
Céphalées
|
Sensations vertigineuses
|
Hypesthésie
| |
|
|
|
Somnolence
| |
Affections oculaires
|
|
|
Conjonctivite
| |
|
|
|
Vision trouble
| |
Affections de l'oreille et du labyrinthe
|
|
Vertiges
|
Acouphènes
| |
Affections cardiaques
|
|
Bloc auriculo-ventriculaire du 1er degré
|
Arythmies
| |
|
|
Cardiomyopathie
|
Bloc auriculo-ventriculaire du 2e degré
| |
|
|
Trouble de la conduction
|
Bloc de branche gauche
| |
|
|
Tachycardie
|
Bloc de branche droit
| |
|
|
|
Insuffisance mitrale
| |
|
|
|
Ischémie myocardique
| |
|
|
|
Extrasystoles ventriculaires
| |
Affections vasculaires
|
|
Hypertension
|
Bouffées congestives
| |
|
|
|
Hypotension
| |
Affections respiratoires, thoraciques et médiastinales
|
|
Hoquet
|
| |
Affections gastro-intestinales
|
Constipation
|
Distension abdominale
|
Bouche sèche
| |
|
|
Douleurs abdominales
|
Dysphagie
| |
|
|
Diarrhée
|
Éructations
| |
|
|
Dyspepsie
|
Hémorroïdes
| |
|
|
Flatulences
|
Langue saburrale
| |
|
|
Nausées
|
Vomissements
| |
Affections de la peau et du tissu sous-cutané
|
|
Alopécie
|
Érythème
| |
|
|
Urticaire
|
Prurit
| |
|
|
|
Rash
| |
Affections musculosquelettiques et du tissu conjonctif
|
|
|
Dorsalgies
| |
|
|
|
Douleur dans les membres
| |
Troubles généraux et anomalies au site d'administration
|
Fatigue
|
Asthénie
|
Sensation de chaleur
| |
|
|
|
Douleur thoracique non cardiaque
| |
|
|
|
Dysgueusie médicamenteuse
| |
Investigations
|
|
Élévation des transaminases hépatiques
|
Élévation de la bilirubinémie
| |
|
|
Élévation de la phosphatase alcaline sanguine
|
Augmentation du taux sanguin de créatine phosphokinase
| |
|
|
Élévation de la créatininémie
|
Augmentation du taux sanguin de créatine phosphokinase MB
| |
|
|
Allongement de l'intervalle QT à l'ECG
|
Augmentation du taux d'urée sanguine
| |
|
|
|
Sous-décalage du segment ST à l'ECG
| |
|
|
|
Anomalies du segment ST-T à l'ECG
| |
|
|
|
Augmentation du taux sanguin de myoglobine
| |
|
|
|
Augmentation du nombre de neutrophiles
| |
|
|
|
Élévation du taux de troponine
|
Description d'une sélection d'effets secondaires
Nétupitant
Nétupitant n'est pas associé à des effets secondaires fréquents.
Palonosétron
Des cas de constipation avec impaction fécale ou de subiléus nécessitant une hospitalisation ont été rapportés avec l'administration de palonosétron 0,75 mg. En outre, des effets secondaires tels qu'un gonflement des yeux, une dyspnée et une myalgie ont été rapportés avec le palonosétron administré par voie orale. Tous ces effets secondaires sont survenus occasionnellement.
Des cas de syndrome sérotoninergique ont été rapportés sous administration de palonosétron seul. Les signes sont notamment des tremblements, une agitation, des sueurs, des mouvements myocloniques, une hypertension et de la fièvre.
De très rares cas d'anaphylaxie, de réactions anaphylactiques/anaphylactoïdes et de choc ont été rapportés lors de l'utilisation de palonosétron par voie intraveineuse après sa mise sur le marché. Les signes sont notamment l'urticaire, le prurit, l'œdème de Quincke, l'hypotension, l'oppression pharyngée, l'oppression thoracique, la dyspnée et la perte de connaissance.
Capsule de combinaison avec nétupitant et palonosétron chlorhydrate
Ce médicament peut contenir des traces de lécithine de soja. Les patients présentant une hypersensibilité connue aux arachides ou au soja doivent donc être étroitement surveillés afin de détecter tout signe de réaction allergique. Les signes peuvent inclure de l'urticaire, une éruption cutanée, des démangeaisons, des difficultés à respirer ou à avaler, un gonflement de la bouche, du visage, des lèvres, de la langue ou de la gorge et, parfois, une chute de la tension artérielle.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté. Il n'y a pas d'information spécifique concernant le traitement d'un surdosage avec Akynzeo. Des doses allant jusqu'à 600 mg de nétupitant et 6 mg de palonosétron ont été utilisées lors des études cliniques sans problème de tolérance. Dans le cas peu probable d'un surdosage, la prise d'Akynzeo doit être arrêtée et un traitement symptomatique et de soutien doit être instauré. Les symptômes aigus possibles d'un surdosage peuvent inclure des maux de tête, des vertiges, une constipation, de l'anxiété, des palpitations cardiaques, une humeur euphorique et des douleurs dans les jambes. En raison de l'effet antiémétique du nétupitant et du palonosétron, les médicaments provoquant des vomissements pourraient s'avérer inefficaces.
Aucune étude relative à la dialyse n'a été réalisée; cependant, étant donné le grand volume de distribution du palonosétron et du nétupitant, la dialyse risque de n'être d'aucune utilité en cas de surdosage avec Akynzeo.
Propriétés/EffetsCode ATC
A04AA55, palonosétron, combinaisons
Mécanisme d'action
Le nétupitant est un antagoniste sélectif à affinité élevée pour les récepteurs de la substance P/neurokinine-1 (NK1). Le nétupitant ne présente qu'une très faible affinité ou aucune affinité pour les récepteurs à la sérotonine (5-HT3), à la dopamine, et aux corticostéroïdes.
Le palonosétron est un antagoniste sélectif à haute affinité des récepteurs 5-HT3 de la sérotonine, et ne présente qu'une très faible affinité ou aucune affinité pour d'autres récepteurs.
La chimiothérapie anticancéreuse peut être associée à une incidence élevée de nausées et de vomissements, en particulier lorsque certains agents (p.ex. du cisplatine) sont utilisés.
Les récepteurs 5-HT3 sont situés sur les terminaisons nerveuses du nerf vague (au niveau périphérique) et dans la «chemoreceptor trigger zone» de l'area postrema (au niveau central).
Il est généralement admis que les agents chimiothérapeutiques provoquent des nausées et vomissements par la libération de sérotonine des cellules entérochromaffines de l'intestin grêle, et que la sérotonine ainsi libérée active les récepteurs 5-HT3 situés sur les afférences vagales, ce qui déclenche le réflexe émétique.
Il est connu que les vomissements aigus sont déclenchés par la 5-hydroxytryptamine (sérotonine, 5-HT3), et il a été démontré que le récepteur 5-HT3 participe sélectivement à la réponse émétique.
Les vomissements retardés ont été largement associés avec l'activation par la substance P des récepteurs à la neurokinine 1 (NK1) de la famille des tachykinines (ces récepteurs sont largement distribués dans les systèmes nerveux central et périphérique).
Comme le montrent les études in vitro et in vivo, le nétupitant et le palonosétron peuvent contribuer à inhiber la réponse médiée par la substance P.
Des études in vitro ont démontré que même si le palonosétron ne se lie pas au récepteur NK1, il inhibe la transmission NK1 par la substance P induite par le cisplatine, probablement via une interférence avec la sérotonine, et ce de manière dose-dépendante. Le palonosétron peut donc améliorer la prévention des vomissements retardés obtenue avec le nétupitant.
Pharmacodynamique
Occupation du récepteur NK1
L'occupation des récepteurs pour le schéma posologique du nétupitant lors de NVIC a été déterminée dans une étude chez l'homme utilisant la tomographie par émission de positons (TEP) avec trois doses uniques (100 mg, 300 mg et 450 mg, 2 sujets par dose).
Le nétupitant s'est avéré traverser la barrière hémato-encéphalique avec un taux d'occupation élevé des récepteurs NK1 cérébraux.
Toutes les doses ont permis d'obtenir une inhibition relativement longue des récepteurs NK1.
Le taux d'occupation des récepteurs NK1 dans le striatum à 6, 24, 48, 72 et 96 heures après l'administration de 300 mg de nétupitant a été, respectivement, de 92,5%, 86,5%, 85,0%, 78,0% et 76,0%.
Efficacité clinique
L'administration orale d'Akynzeo en association avec la dexaméthasone s'est avérée prévenir les nausées et vomissements aigus et retardés associés à des chimiothérapies hautement et modérément émétisantes dans deux études pivots distinctes.
Etude portant sur une chimiothérapie hautement émétisante
Dans une étude clinique multicentrique, randomisée, en double aveugle, contrôlée et à groupes parallèles, menée auprès de 694 patients, l'efficacité et l'innocuité de doses uniques de nétupitant oral en association avec du palonosétron oral, ont été comparées à une dose orale unique de palonosétron, chez des patients cancéreux recevant un protocole de chimiothérapie comportant du cisplatine (dose médiane = 75 mg/m²). L'analyse de l'efficacité a inclus 135 patients ayant reçu une dose orale unique d'Akynzeo (nétupitant 300 mg et palonosétron 500 mcg) comparé à 136 patients ayant reçu du palonosétron 500 mcg oral seul.
Les schémas thérapeutiques pour les groupes recevant Akynzeo et du palonosétron 500 mcg sont définis dans le tableau suivant (Tableau 2).
Tableau 2 – Schéma thérapeutique – étude HEC
|
Schéma thérapeutique
|
Jour 1
|
Jours 2 à 4
| |
Akynzeo
|
Nétupitant 300 mg p.o.
Palonosétron 500 mcg p.o.
Dexaméthasone 12 mg p.o.
|
Dexaméthasone 8 mg p.o.
| |
Palonosétron
|
Palonosétron 500 mcg p.o.
Dexaméthasone 20 mg p.o.
|
Dexaméthasone 16 mg p.o.
|
Sur les 135 patients ayant reçu Akynzeo, 43% étaient des femmes et tous les patients étaient Caucasiens.
Leur âge était compris entre 19 et 77 ans, avec un âge moyen de 53 ans.
Durant l'étude, 86% des patients traités dans le groupe Akynzeo ont reçu un agent chimiothérapique concomitant en plus du cisplatine exigé par le protocole.
Les agents chimiothérapiques les plus fréquemment utilisés et le pourcentage de patients exposés ont été les suivants: cyclophosphamide (34%), fluorouracil (24%), étoposide (21%) et doxorubicine (16%).
Le critère d'efficacité primaire était le taux de réponse complète (CR) (définie comme l'absence d'épisodes émétiques et pas de médicament de secours) dans les 120 heures (phase globale) suivant le début de l'administration de la chimiothérapie hautement émétisante.
Les principaux critères d'évaluation secondaires étaient les suivants:
·CR durant l'intervalle 0-24 heures (phase aiguë) et durant l'intervalle 25-120 heures (phase retardée);
·Protection complète (définie comme l'absence de vomissements, pas de médicament de secours, et absence de nausées significatives) durant la phase globale, la phase aiguë et la phase retardée.
·Absence de vomissements durant la phase globale, la phase aiguë et la phase retardée.
·Absence de nausées significatives (maximum VAS <25 mm) et absence de nausées (maximum VAS <5 mm) durant la phase globale, la phase aiguë et la phase retardée.
Un résumé des principaux résultats de cette étude est présenté dans le Tableau 3.
Le pourcentage de patients ayant présenté une CR durant la phase globale a été supérieur de 13,2% (IC à 95%: 4,4 à 21,9%) (valeur de p=0,004) dans le groupe Akynzeo (89,6%) comparativement au groupe palonosétron (76,5%). Durant la phase aiguë, le pourcentage de patients ayant présenté une CR a été supérieur de 8,8% (valeur de p=0,007) dans le groupe Akynzeo (98,5%) comparativement au groupe palonosétron (89,7%). Durant la phase retardée, le pourcentage de patients ayant présenté une CR a été supérieur de 10,2% (valeur de p=0,018) dans le groupe Akynzeo (90,4%) comparativement au groupe palonosétron (80,1%).
Tableau 3 – Pourcentage de patients répondeurs recevant une chimiothérapie de cisplatine par groupe de traitement et par phase
|
|
Akynzeo
N=135
|
Palonosétron
500 mcg p.o.
N=136
|
| |
|
%
|
%
|
Valeur p
| |
Critère d'efficacité primaire
| |
Réponse complète
| |
Phase globale§
|
89.6
|
76.5
|
0.004
| |
Critères d'efficacité secondaires principaux
| |
Réponse complète
| |
Phase aiguë‡
|
98.5
|
89.7
|
0.007
| |
Phase retardée†
|
90.4
|
80.1
|
0.018
| |
Protection complète
| |
Phase aiguë
|
97.0
|
87.5
|
0.006
| |
Phase retardée
|
84.4
|
73.5
|
0.027
| |
Phase globale
|
83.0
|
69.9
|
0.010
| |
Absence de vomissements
| |
Phase aiguë
|
98.5
|
89.7
|
0.007
| |
Phase retardée
|
91.9
|
80.1
|
0.006
| |
Phase globale
|
91.1
|
76.5
|
0.001
| |
Absence de nausées significatives
| |
Phase aiguë
|
98.5
|
93.4
|
0.050
| |
Phase retardée
|
90.4
|
80.9
|
0.004
| |
Phase globale
|
98.5
|
93.4
|
0.021
| |
Absence de nausées
| |
Phase aiguë
|
80.0
|
75.0
|
N.S.
| |
Phase retardée
|
68.1
|
53.7
|
0.014
| |
Phase globale
|
61.5
|
50.7
|
N.S
|
‡ Phase aiguë: 0-24 h après l'administration de cisplatine
† Phase retardée: 25-120 h après l'administration de cisplatine
§ Phase globale: 0-120 h après l'administration de cisplatine
Etude portant sur une chimiothérapie modérément émétisante
Dans une étude de supériorité multicentrique, randomisée, en double insu, contrôlée contre une substance active, à groupes parallèles, l'efficacité et l'innocuité d'une dose orale unique d'Akynzeo ont été comparées à celles d'une dose orale unique de palonosétron 500 mcg chez des patients cancéreux devant recevoir le premier cycle d'une chimiothérapie par anthracycline et cyclophosphamide pour le traitement d'une tumeur solide maligne. Tous les patients ont reçu une dose orale unique de dexaméthasone.
Les schémas thérapeutiques pour les groupes recevant Akynzeo et du palonosétron 500 mcg par voie orale sont présentés dans le tableau suivant (Tableau 4).
Tableau 4 – Schéma thérapeutique – étude MEC
|
Schéma thérapeutique
|
Jour 1
|
Jours 2 à 3
| |
Akynzeo
|
Nétupitant 300 mg p.o.
Palonosétron 500 mcg p.o.
Dexaméthasone 12 mg p.o.
|
Pas de traitement antiémétique
| |
Palonosétron
|
Palonosétron 500 mcg p.o.
Dexaméthasone 20 mg p.o.
|
Pas de traitement antiémétique
|
Une fois le cycle 1 achevé, les patients ont pu choisir de participer à une phase d'extension de plusieurs cycles en recevant le même traitement que celui qui leur avait été attribué pour le cycle 1. Aucune limite n'était prédéfinie quant au nombre maximal de cycles consécutifs. Au total, 1450 patients (Akynzeo n=725; palonosétron n=725) ont effectivement reçu l'un des médicaments à l'étude. Parmi eux, 1438 patients (98,8%) ont achevé le cycle 1 et 1286 patients (88,4%) ont poursuivi le traitement dans le cadre de la phase d'extension de plusieurs cycles. Au total, 907 patients (62,3%) ont achevé la phase d'extension de plusieurs cycles jusqu'à un maximum de huit cycles de traitement.
Sur les 725 patients ayant reçu Akynzeo, 711 (98%) étaient des femmes; 79% étaient Caucasiens, 14% de type asiatique, 6% de type hispanique, et <1% étaient Noirs ou autre. Leur âge était compris entre 22 et 79 ans, avec un âge moyen de 54 ans.
Au total, 724 patients (99,9%) ont reçu du cyclophosphamide. De plus, tous les patients ont reçu soit de la doxorubicine (68,0%) soit de l'épirubicine (32,0%).
Au cours du premier cycle, 32% des 725 patients traités par Akynzeo ont reçu un agent chimiothérapique concomitant. Les agents chimiothérapiques les plus fréquemment utilisés ont été le fluorouracil (28,3%) et le docétaxel (2,6%).
Le critère d'efficacité primaire était le taux de réponse complète (CR) au cours de la phase retardée, càd. 25-120 heures après le début de la chimiothérapie.
Les principaux critères d'évaluation secondaires étaient les suivants:
·CR durant la phase aiguë et la phase globale;
·Protection complète (définie comme l'absence de vomissements, pas de médicament de secours et absence de nausées significatives) durant la phase retardée, la phase aiguë et la phase globale.
·Absence de vomissements durant la phase retardée, la phase aiguë et la phase globale;
·Absence de nausées significatives (maximum VAS <25 mm) et absence de nausées (maximum VAS <5 mm) durant la phase retardée, la phase aiguë et la phase globale.
Un résumé des principaux résultats de cette étude est présenté dans le Tableau ci-dessous.
Tableau 5 – Pourcentage de patients répondeurs recevant une chimiothérapie d'anthracycline et de cyclophophamide par groupe de traitement et par phase – 1er cycle
|
|
Akynzeo
N=724
|
Palonosétron
500 mcg p.o.
N=725
|
| |
|
%
|
%
|
Valeur p*
| |
Critère d'efficacité primaire
| |
Réponse complète
| |
Phase retardée†
|
76.9
|
69.5
|
0.001
| |
Critères d'efficacité secondaires principaux
| |
Réponse complète
| |
Phase aiguë‡
|
88.4
|
85.0
|
0.047
| |
Phase globale§
|
74.3
|
66.6
|
0.001
| |
Protection complète
| |
Phase aiguë
|
82.3
|
81.1
|
N.S.
| |
Phase retardée
|
67.3
|
60.3
|
0.005
| |
Phase globale
|
63.8
|
57.9
|
0.020
| |
Absence de vomissements
| |
Phase aiguë
|
90.9
|
87.3
|
0.025
| |
Phase retardée
|
81.8
|
75.6
|
0.004
| |
Phase globale
|
79.8
|
72.1
|
<0.001
| |
Absence de nausées significatives
| |
Phase aiguë
|
87.3
|
87.9
|
N.S.
| |
Phase retardée
|
76.9
|
71.3
|
0.014
| |
Phase globale
|
74.6
|
69.1
|
0.020
| |
Absence de nausées
| |
Phase aiguë
|
70.4
|
70.1
|
N.S.
| |
Phase retardée
|
53.3
|
49.5
|
N.S.
| |
Phase globale
|
50.3
|
47.2
|
N.S
|
* Valeur p issue du test de Cochran-Mantel-Haenszel, stratifié par classe d'âge et par région.
‡ Phase aiguë: 0-24 h après le traitement par anthracycline et cyclophosphamide
† Phase retardée: 25-120 h après le traitement par anthracycline et cyclophosphamide
§ Phase globale: 0-120 h après le traitement par anthracycline et cyclophosphamide
Réponse complète
L'analyse principale de l'efficacité a été réalisée sur 1449 patients randomisés ayant reçu le schéma de chimiothérapie et le médicament à l'étude.
Le pourcentage de patients ayant présenté une CR durant la phase retardée a été supérieur de 7,4% (IC à 95%: 2,9 à 11,9%) (valeur de p=0,001) dans le groupe Akynzeo (76,9%) comparativement au groupe palonosétron (69,5%).
Durant la phase aiguë, le pourcentage de patients ayant présenté une CR a été supérieur de 3,4% (valeur de p=0,047) dans le groupe Akynzeo (88,4%) comparativement au groupe palonosétron (85,0%).
Durant la phase globale, le pourcentage de patients ayant présenté une CR a été supérieur de 7,7% (valeur de p=0,001) dans le groupe Akynzeo (74,3%) comparativement au groupe palonosétron (66,6%).
Cycles multiples
Durant la phase d'extension de plusieurs cycles, les patients ont continué à recevoir la chimiothérapie pendant 7 cycles au maximum.
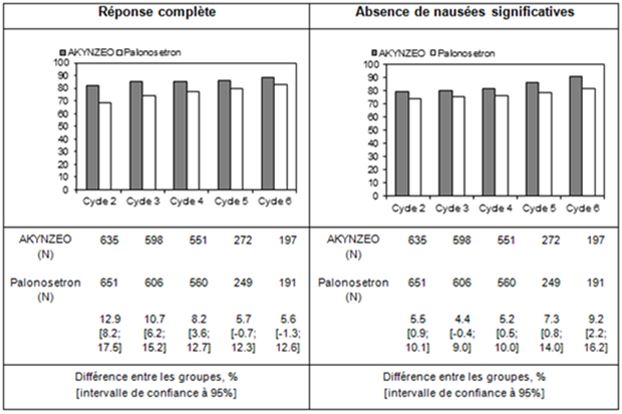
Le pourcentage de patients ayant présenté une réponse complète sans nausées significatives durant la phase retardée lors de chaque cycle (cycles 2 à 6) est présenté par groupe de traitement dans la Figure 1.
Un nombre limité de patients a reçu plus de 6 cycles. Lors de tous les cycles, le taux de CR et le pourcentage de patients sans nausées significatives ont été supérieurs avec Akynzeo comparativement au palonosétron par voie orale.
L'activité antiémétique d'Akynzeo a été maintenue tout au long des cycles multiples.
Figure 1 – Pourcentage de patients répondeurs (réponse complète sans nausées significatives) recevant la chimiothérapie à base d'anthracycline et de cyclophosphamide, par groupe de traitement et par phase durant la phase retardée
Résultats rapportés par les patients
L'impact des nausées et des vomissements sur la vie quotidienne des patients a été évalué à l'aide du «Functional Living Index–Emesis» (FLIE), un questionnaire spécifique validé pour que le patient évalue l'impact des nausées et des vomissements sur la vie quotidienne.
Le pourcentage de patients n'ayant subi, dans l'ensemble, aucun impact sur la vie quotidienne a été supérieur de 6,3% (valeur de p=0,005) dans le groupe Akynzeo (78,5%) comparativement au groupe palonosétron (72,1%).
Le pourcentage de patients n'ayant subi aucun impact des vomissements sur la vie quotidienne a été supérieur de 5,6% (valeur de p=0,001) dans le groupe Akynzeo (90,1%) comparativement au groupe palonosétron (84,4%).
Le pourcentage de patients n'ayant subi aucun impact des nausées sur la vie quotidienne a été supérieur de 5,8% (valeur de p=0,015) dans le groupe Akynzeo (71,5%) comparativement au groupe palonosétron (65,8%).
Etude évaluant l'innocuité chez les patients recevant plusieurs cycles de chimiothérapie soit hautement émétisante soit modérément émétisante
Dans une étude clinique multicentrique, multinationale, contrôlée contre une substance active, randomisée en double insu, à double placebo, non équilibrée (3:1), à groupes parallèles, l'innocuité et l'efficacité d'une dose orale unique d'Akynzeo ont été comparées à celles d'un schéma antiémétique comportant de l'aprépitant et du palonosétron chez des patients cancéreux devant recevoir une chimiothérapie soit hautement émétisante, soit modérément émétisante.
Les patients ont été randomisés (3:1) le Jour 1 avant leur premier cycle de chimiothérapie entre les deux groupes de traitement, comme indiqué dans le tableau 6, en fonction du pouvoir émétisant du schéma:
Tableau 6 – Schéma thérapeutique – études HEC et MEC
|
Schéma thérapeutique
|
Jour 1
|
Jour 2
|
Jour 3
|
Jour 4
| |
Patients HEC
| |
Akynzeo
|
Nétupitant
300 mg p.o.
Palonosétron
500 mcg p.o.
Dexaméthasone
12 mg p.o.
|
Dexaméthasone
8 mg p.o.
|
Dexaméthasone
8 mg p.o.
|
Dexaméthasone
8 mg p.o.
| |
Aprépitant et palonosétron
|
Aprépitant
125 mg p.o.
Palonosétron
500 mcg p.o.
Dexaméthasone
12 mg p.o.
|
Aprépitant
80 mg p.o.
Dexaméthasone
8 mg p.o.
|
Aprépitant
80 mg p.o.
Dexaméthasone
8 mg p.o.
|
Dexaméthasone
8 mg p.o.
| |
Patients MEC
| |
Akynzeo
|
Nétupitant
300 mg p.o.
Palonosétron
500 mcg p.o.
Dexaméthasone
12 mg p.o.
|
Pas de traitement antiémétique
|
Pas de traitement antiémétique
|
Pas de traitement antiémétique
| |
Aprépitant et palonosétron
|
Aprépitant
125 mg p.o.
Palonosétron
500 mcg p.o.
Dexaméthasone
12 mg p.o.
|
Aprépitant
80 mg p.o.
|
Aprépitant
80 mg p.o.
|
Pas de traitement antiémétique
|
Au total, 413 patients ont été randomisés dans l'étude, pour recevoir soit Akynzeo (n=309) soit de l'aprépitant et du palonosétron (n=104).
Au total, 412 patients ont reçu l'un des médicaments à l'étude (Akynzeo n=309; aprépitant et palonosétron n=103), et 23 patients ont interrompu leur traitement après la randomisation et durant l'un des cycles de chimiothérapie prévus.
Sur les 412 patients traités par l'un des médicaments à l'étude, 405 (98,1%) ont achevé le cycle 1 et il a été prévu de traiter 376 patients dans les cycles suivants, jusqu'à un maximum de 14 cycles. Au total, 165 patients (40,4%) ont achevé au moins 6 cycles de traitement.
Sur les 309 patients qui ont été randomisés dans le groupe Akynzeo et ont reçu l'un des médicaments à l'étude, 155 (50,2%) étaient des femmes; 84% étaient Caucasiens, 15% de type asiatique, 6% de type hispanique, et 1% Noirs. Leur âge était compris entre 27 et 76 ans, avec un âge moyen de 57 ans.
Au cours du premier cycle, 75 patients (24,3%) au total ont été randomisés dans le groupe Akynzeo et ont reçu l'un des médicaments à l'étude et ont été traités par un schéma hautement émétisant (cisplatine, 96% ou dacarbazine, 4%). Au total, 234 patients (75,7%) ont reçu un schéma modérément émétisant, les agents chimiothérapiques les plus fréquemment utilisés étant le carboplatine (60,3%), l'oxaliplatine (20,1%) et la doxorubicine (11,1%).
Le critère d'évaluation primaire de l'étude était d'évaluer l'innocuité et la tolérance d'Akynzeo lors du cycle initial et des cycles répétés de chimiothérapie. Le critère d'évaluation secondaire de l'étude consistait à décrire son efficacité.
Le profil d'innocuité d'Akynzeo a été comparable à celui de l'aprépitant et du palonosétron chez les patients recevant un cycle initial et des cycles répétés de chimiothérapie modérément émétisante ou hautement émétisante. Les données relatives à l'innocuité du groupe Akynzeo ont été intégrées et décrites par ailleurs (voir rubrique «Effets indésirables»).
Au cours du cycle 1, le pourcentage de patients présentant une CR a été numériquement supérieur dans le groupe Akynzeo comparativement au groupe aprépitant et palonosétron pour les phases retardées (83,2% contre 77,7%) et globales (80,6% contre 75,7%). L'efficacité a été maintenue tout au long de l'étude.
Aucun effet cliniquement significatif d'Akynzeo sur la pression artérielle, la fréquence cardiaque ou les paramètres ECG, y compris l'intervalle QTc, n'a été observé, soit un résultat comparable à l'aprépitant et au palonosétron dans les études cliniques sur les NVIC.
Administration d'Akynzeo sur 3 jours (aux jours 1 - 3 - 5)
Une étude de phase IIa non contrôlée publiée a évalué l'innocuité et la faisabilité d'Akynzeo administré un jour sur deux pendant un total de 3 jours (1 - 3 - 5) chez des patients atteints de lymphome non hodgkinien éligibles pour une greffe autologue de cellules souches et recevant une chimiothérapie à haute dose sur plusieurs jours (BEAM ou FEAM, N = 70). Le critère d'évaluation primaire était la "réponse complète", qui a atteint 87,1 % au cours de la phase globale.
Population pédiatrique
L'innocuité et l'efficacité de palonosétron n'ont pas été démontrées chez l'enfant. Aucune donnée n'est disponible.
PharmacocinétiqueAbsorption
Nétupitant
Aucune donnée relative à la biodisponibilité absolue du nétupitant n'est disponible chez l'homme. Sur la base des données issues de deux études évaluant le nétupitant intraveineux, la biodisponibilité chez l'homme est estimée à plus de 60%.
Dans des études comportant une dose unique orale, le nétupitant a été mesurable dans le plasma entre 15 minutes et 3 heures après l'administration. Les concentrations plasmatiques ont suivi un processus d'absorption d'ordre un et la Cmax a été atteinte en 5 heures environ. Une augmentation disproportionnée de Cmax et des paramètres de l'AUC a été observée pour des doses comprises entre 10 mg et 300 mg, avec des augmentations proportionnelles à la dose entre 300 mg et 450 mg.
Chez des sujets sains auxquels on a administré une dose orale unique de nétupitant 300 mg, la concentration plasmatique maximale de nétupitant (Cmax) a été de 747 ± 200,4 ng/ml (moyenne ± ET) et le temps médian pour atteindre la concentration maximale (Tmax) de 5,0 heures; l'AUC a été de 25232 ± 6281,7 h.ng/ml.
Dans une analyse de groupes, les femmes ont été plus exposées que les hommes au nétupitant; une augmentation de 31% de la Cmax, une augmentation de 10% de l'AUC et une augmentation de 30% de la demi-vie ont été observées.
Chez des patients cancéreux auxquels on a administré une dose orale unique de nétupitant 300 mg une heure avant la chimiothérapie (docétaxel, étoposide ou cyclophosphamide), la Cmax et l'AUC du nétupitant et de ses métabolites ont été similaires à ceux rapportés chez les sujets sains et ont été indépendants du schéma chimiothérapeutique administré.
L'AUC0-∞ et la Cmax du nétupitant ont augmenté de 16% et 18%, respectivement, après un repas riche en graisses.
Sur la base de données pharmacocinétiques et de modélisation, plusieurs administrations hebdomadaires de nétupitant 300 mg peut augmenter d'un facteur 1,2 l'exposition hebdomadaire cumulée de nétupitant (AUCDays1-7). En cas d'administration de 300 mg q.o.d. de nétupitant (jours 1, 3, 5), l'exposition hebdomadaire cumulée de nétupitant (AUCDays1-7) peut augmenter d'un facteur 2,7.
Palonosétron
Après une administration orale, le palonosétron est bien absorbé, avec une biodisponibilité absolue de 97%. Après administration de doses orales uniques avec une solution tamponnée, les concentrations plasmatiques maximales moyennes (Cmax) et l'aire sous la courbe de concentration plasmatique-temps (AUC0-∞) sont généralement dose-dépendantes dans l'intervalle de doses de 3,0 à 80 μg/kg chez les sujets sains.
Après administration d'une dose orale unique de palonosétron chez 36 hommes et femmes volontaires sains, la concentration plasmatique maximale (Cmax) du palonosétron a été de 0,81 ± 1,66 ng/ml (moyenne ± ET) et le temps pour atteindre la concentration maximale (Tmax) de 5,1 ± 1,7 heures. L'AUC moyenne a été plus élevée de 35% et la Cmax moyenne de 26% chez les femmes (n=18) que chez les hommes (n=18).
Chez 12 patients cancéreux ayant reçu une dose orale unique de 500 microgrammes de palonosétron une heure avant la chimiothérapie, la Cmax a été de 0,93 ± 0,34 ng/ml et le Tmax de 5,1 ± 5,9 heures. L'AUC a été supérieure de 30% chez les patients cancéreux par rapport aux volontaires sains.
Un repas riche en graisses n'a pas eu d'effet sur la Cmax et l'AUC du palonosétron oral.
Distribution
Nétupitant
Après l'administration d'une dose orale unique de 300 mg nétupitant à des patients cancéreux, la cinétique de distribution du nétupitant a été caractérisée par un modèle à deux compartiments, avec une clairance systémique médiane estimée de 20,5 l/h et un volume de distribution important dans le compartiment central (486 l). La liaison aux protéines plasmatiques humaines du nétupitant et de ses deux principaux métabolites M1 et M3 est >99% à des concentrations médicamenteuses comprises entre 10 et 1500 ng/ml. Le troisième métabolite principal, M2, est à plus de 97% lié aux protéines plasmatiques.
Palonosétron
Le palonosétron est largement distribué dans l'organisme, avec un volume de distribution d'environ 8,3 ± 2,5 l/kg. Environ 62% du palonosétron est lié aux protéines plasmatiques.
Métabolisme
Nétupitant
Trois métabolites ont été détectés dans le plasma humain à des doses orales de nétupitant de 30 mg et plus (le dérivé déméthylé, M1; le dérivé N-oxydé, M2; le dérivé OH-méthylé, M3).
Après administration d'une dose orale unique de 300 mg de nétupitant, les ratios moyens nétupitant plasmatique/radioactivité plasmatique étaient compris entre 0,13 et 0,49 plus de 96 heures post-administration.
Les ratios variaient en fonction du temps, avec des valeurs diminuant progressivement au-delà de 24 h post-administration, ce qui indique une métabolisation rapide du nétupitant.
La Cmax moyenne a été d'environ 11%, 47% et 16% du médicament parent pour M1, M2 et M3 respectivement; M2 a présenté l'AUC la plus faible par rapport au médicament parent (14%) tandis que les AUC de M1 et M3 ont été d'environ 29% et 33% de celle du médicament parent, respectivement. Les métabolites M1, M2 et M3 se sont tous trois avérés pharmacologiquement actifs dans un modèle pharmacodynamique animal, M3 étant le plus puissant et M2 le moins actif.
Palonosétron
Le palonosétron est éliminé par des voies multiples; environ 50% sont métabolisés pour former deux métabolites principaux: le N-oxyde-palonosétron et le 6-S-hydroxy-palonosétron. Ces métabolites ont chacun moins de 1% de l'activité antagoniste du récepteur 5-HT3 du palonosétron. Les études de métabolisme in vitro ont montré que les isoenzymes CYP2D6 et, dans une moindre mesure, CYP3A4 et CYP1A2, sont impliqués dans le métabolisme du palonosétron. Cependant, les paramètres pharmacocinétiques ne sont pas significativement différents entre les métaboliseurs lents et les métaboliseurs rapides des substrats du CYP2D6.
Élimination
Nétupitant
Le nétupitant est éliminé de l'organisme de manière multi-exponentielle, avec une demi-vie d'élimination moyenne apparente de 88 heures chez les patients cancéreux après une dose orale unique d'Akynzeo.
La clairance rénale n'est pas une voie d'élimination significative pour le nétupitant et ses métabolites. La fraction moyenne d'une dose orale de nétupitant excrétée inchangée dans l'urine est inférieure à 1%; au total, 3,95% et 70,7% de la dose radioactive ont été retrouvés dans l'urine et les selles, respectivement.
La moitié environ de la radioactivité administrée par voie orale sous forme de [14C]nétupitant a été retrouvée dans l'urine et les selles dans un délai de 120 heures après l'administration. L'élimination par ces deux voies a été estimée terminée 29 à 30 jours après l'administration.
Palonosétron
Après administration d'une dose orale unique de 0,75 mg de [14C]-palonosétron chez 6 volontaires sains, 85% à 93% de la radioactivité totale ont été excrétés dans les urines et 5% à 8% dans les fèces. La quantité de palonosétron excrété sous forme inchangée dans les urines a représenté environ 40% de la dose administrée. Après administration de capsules de 500 microgrammes de palonosétron, la demi-vie terminale d'élimination (t½) a été de 37 ± 12 heures (moyenne ± ET) chez les volontaires sains et de 48 ± 19 heures chez les patients cancéreux. Après administration d'une dose unique d'environ 0,75 mg de palonosétron intraveineux, la clairance corporelle totale chez les volontaires sains a été de 160 ± 35 ml/h/kg (moyenne ± ET) et la clairance rénale de 66,5 ± 18,2 ml/h/kg.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Nétupitant
Les concentrations maximales et l'exposition totale au nétupitant ont été augmentées chez les sujets présentant une insuffisance hépatique légère (n=8), modérée (n=8), et sévère (n=2), en comparaison avec des sujets sains, bien qu'une variabilité individuelle prononcée ait été observée tant chez les sujets présentant une insuffisance hépatique que chez les sujets sains.
L'exposition au nétupitant (Cmax, AUC0-t et AUC0-∞) en comparaison avec des sujets sains a été supérieure de 11%, 28% et 19% chez les sujets présentant une insuffisance hépatique légère, et supérieure de 70%, 88% et 143% chez les sujets présentant une insuffisance hépatique modérée.
Les augmentations des paramètres pharmacocinétiques chez les sujets présentant une insuffisance hépatique sévère ont été similaires à celles du groupe présentant une insuffisance hépatique modérée. Par conséquent, aucun ajustement posologique n'est nécessaire chez les patients atteints d'insuffisance hépatique légère à modérée.
Des données limitées sont disponibles chez des patients atteints d'insuffisance hépatique sévère (score de Child-Pugh ≥10).
Données précliniquesPalonosétron
Des effets secondaires n'ont été observés dans les études précliniques qu'à des posologies largement supérieures à l'exposition maximale observée chez l'homme. La pertinence pour l'homme est considérée faible.
Des études précliniques indiquent que le palonosétron, seulement à de très fortes concentrations, peut bloquer les canaux ioniques qui interviennent dans la dépolarisation et la repolarisation ventriculaires, et prolonger la durée du potentiel d'action.
Les études chez l'animal n'ont pas montré d'effets délétères directs ou indirects sur la fertilité, la gestation, le développement embryonnaire ou fœtal, l'accouchement ou le développement postnatal. Les données issues des études animales concernant le transfert placentaire sont limitées (voir rubrique «Grossesse/Allaitement»).
Le palonosétron n'est pas mutagène. Des doses élevées de palonosétron (représentant chacune au moins 15 fois l'exposition thérapeutique chez l'homme) administrées quotidiennement pendant deux ans ont induit une incidence accrue de tumeurs hépatiques, néoplasmes endocriniens (thyroïde, hypophyse, pancréas, médullosurrénale) et tumeurs cutanées chez le rat, mais pas chez la souris. Les mécanismes sous-jacents ne sont pas totalement élucidés, mais étant donné les doses élevées utilisées et l'administration en dose unique de palonosétron chez l'homme, ces observations ne sont pas considérées pertinentes pour l'homme.
Nétupitant et sa combinaison avec le palonosétron
Des effets n'ont été observés dans les études précliniques et les études de toxicité de doses uniques et répétées qu'à des expositions largement supérieures à l'exposition maximale observée chez l'homme. La pertinence pour l'homme est considérée faible.
Une phospholipidose (macrophages spumeux) a été observée après l'administration répétée de nétupitant chez le rat et le chien. Les effets étaient réversibles ou partiellement réversibles après la période de rétablissement. La pertinence de ces résultats chez l'humain n'est pas connue.
Des études précliniques indiquent que le nétupitant et ses métabolites ainsi que sa combinaison avec le palonosétron, seulement à de très fortes concentrations, peuvent bloquer les canaux ioniques qui interviennent dans la dépolarisation et la repolarisation ventriculaires, et prolonger la durée du potentiel d'action.
Les études de reproduction chez l'animal n'ont pas montré d'effets délétères directs ou indirects sur la fertilité, la gestation, le développement embryonnaire ou fœtal, l'accouchement et/ou le développement postnatal. Après l'administration quotidienne de nétupitant à une dose de 10 mg/kg/jour et plus pendant la phase d'organogenèse, on a observé chez les lapins une augmentation des anomalies fœtales de position des membres et des pattes, des sternèbres fusionnées et une agénésie du lobe pulmonaire accessoire. Dans une étude pilote de détermination de la dose chez les lapins, des fentes palatines, des microphtalmies et des aphakies ont été observées chez quatre fœtus d'une même portée dans le groupe recevant 30 mg/kg/jour. La pertinence de ces résultats pour l'homme n'est pas connue.
Il n'y a pas de données issues d'études animales avec le nétupitant concernant le transfert placentaire et la lactation.
Le nétupitant n'est pas mutagène.
Remarques particulièresIncompatibilités
Non applicable.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C.
Conserver hors de portée des enfants.
Numéro d’autorisation65499 (Swissmedic).
PrésentationEmballage de 1 gélule [B].
Titulaire de l’autorisationMedius AG, 4132 Muttenz
Mise à jour de l’informationFévrier 2022.
|

