PharmacocinétiqueAbsorption
La pharmacocinétique de l’ivermectine a été analysée chez 32 volontaires sains. Les paramètres PC de l’ivermectine 10 mg/dose (=1 g de crème) cutanée utilisée au niveau du visage correspondaient à la description du tableau (dose unique, 1x par jour pendant 28 jours, 2x par jour pendant 28 jours) :
Tableau 4
|
|
Cmax
|
Tmax
|
T1/2
|
AUC0-12 h
|
AUC0-24 h
|
AUCinf
| |
Dose unique 10 mg d’iver.
|
0,49 ng/ml
|
9 h
|
45,01 h
|
3,82 ng.h/ml
|
8,26 ng.h/ml
|
26,56 ng.h/ml
| |
1x 28 jours 10 mg d’iver.
|
1,08 ng/ml
|
679 h
|
87,44 h
|
11,05 ng.h/ml
|
20,86 ng.h/ml
|
133,14 ng.h/ml
| |
2x 28 jours 10 mg d’iver.
|
1,90 ng/ml
|
678 h
|
96,64 h
|
20,29 ng.h/ml
|
37,86 ng.h/ml
|
233,49 ng.h/ml
|
Dans une autre étude, la pharmacocinétique de l’ivermectine (1x par jour, 1 g de crème correspondant à 10 mg d’ivermectine) a été étudiée sur un total de 17 patients atteints de rosacée sévère pendant 28 jours. Chez les 15 patients qui ont entièrement terminé l’étude, les paramètres pharmacocinétiques étaient les suivants :
Tableau 5
|
|
Cmin
|
Cmax
|
Tmax
|
T1/2
|
AUC0-24 h
|
AUCt
|
AUCinf
| |
Dose unique 10 mg d’iver.
|
0,37 ng/ml
|
0,69 ng/ml
|
9 h
uniquement 1-24 h
|
S/O
|
9,29 ng.h/ml
|
S/O
|
S/O
| |
1x 14 jours 10 mg d’iver.
|
1,26 ng/ml
|
2,10 ng/ml
|
10 h
uniquement 0-24 h
|
S/O
|
36,14 ng.h/ml
|
S/O
|
S/O
| |
1x 28 jours 10 mg d’iver.
|
1,36 ng/ml
|
1,74 ng/ml
|
11 h
uniquement 0-24 h
|
145 h
|
35,43 ng.h/ml
|
274,62 ng.h/ml
|
311,74 ng.h/ml
| |
1x 28 jours 10 mg d’iver.
|
|
|
322 h over-all
|
|
|
|
|
À l’état d’équilibre, les concentrations d’exposition d’ivermectine sont en moyenne inférieures (AUC0-24 hr : 36 ± 16 ng.hr/ml) à celles qui ont été mesurées après une dose unique orale de 6 mg d’ivermectine chez les volontaires sains (AUC0-24 hr : 134 ± 66 ng.hr/ml) (voir schéma). La biodisponibilité cutanée relative de l’ivermectine a été, dans cette étude comparative, de 16 % pour Soolantra. :
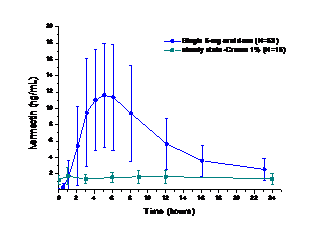
Figure 6 : Concentrations plasmatiques d’ivermectine (moyenne ± SD) pour application orale contre topique (études 18120 et 40064)
Dans les études de phase 3, l’exposition à l’ivermectine pendant la période de traitement de 52 semaines était à peu près comparable à celle après deux semaines de traitement, avec une très grande variabilité interindividuelle. Une petite partie des patients traités par Soolantra crème a atteint une exposition systémique, qui se situait à peu près dans la plage d’exposition moyenne après administration orale de 6 mg d’ivermectine.
Distribution
L’ivermectine est liée à plus de 99 % aux protéines plasmatiques, principalement à l’albumine sérique. Aucune liaison significative de l’ivermectine aux érythrocytes n’a été observée.
Métabolisme
Il n’a pas été réalisé d’étude de bilan massique exhaustive chez les personnes prenant de l’ivermectine et le métabolisme de l’ivermectine chez l’homme n’a pas été totalement clarifié. De nombreuses études animales ont montré que l’excrétion par la P-gp est la principale voie d’élimination de l’ivermectine. La portée exacte de la part de la P-gp dans le métabolisme de l’ivermectine chez l’homme est toutefois inconnue.
La métabolisation de l’ivermectine par le CYP3A4 est moins importante, du point de vue quantitatif, par rapport à la P-gp. Dans une étude sur Soolantra, env. 27 % de la quantité administrée d’ivermectine ont été attestés sous forme de métabolites. Deux de ces métabolites ont été identifiés (3”-Odéméthylivermectine et 4ahydroxy-ivermectine). Ceux-ci ont atteint l’état d’équilibre après 2 semaines de traitement, sans accumulation ultérieure (jusqu’à 12 semaines).
Élimination
Chez les patients chez qui Soolantra a été utilisé une fois par jour pendant 28 jours, la demi-vie terminale était en moyenne de 6 jours (moyenne : 145 heures, fourchette 92-238 heures).
Cinétique des groupes de patients spéciaux
La pharmacocinétique de l’ivermectine n’a pas été étudiée chez les patients souffrant d’insuffisance rénale ou hépatique.
|

