Propriétés/EffetsCode ATC
A10BD20
Classe pharmacothérapeutique:
Association avec des antidiabétiques oraux.
Mécanisme d'action / Pharmacodynamique
L'empagliflozine est un inhibiteur compétitif sélectif, réversible et très puissant (CI50 de 1,3 nmol) du cotransporteur du SGLT2. Il montre une sélectivité 5000 fois supérieure pour SGLT2 par rapport au SGLT1 humain responsable de l'absorption intestinale du glucose (CI50: 6278 nmol).
Un autre effet inhibiteur des transporteurs du glucose GLUT, qui sont responsables du transport du glucose dans les différents tissus, n'a pu être montré.
SGLT2 est principalement exprimé dans les reins. En tant que transporteur prédominant, il est responsable de la réabsorption du glucose du filtrat glomérulaire vers la circulation générale.
L'empagliflozine réduit la réabsorption rénale du glucose d'une manière indépendante de l'insuline. La quantité de glucose éliminée par le rein via ce mécanisme dépend de la glycémie et du taux de filtration glomérulaire.
L'augmentation de l'excrétion rénale du glucose entraîne une diurèse osmotique et, par cet effet diurétique, une baisse de la pression artérielle (4-5 mmHg en moyenne pour la pression systolique et 1-2 mmHg pour la diastolique) ainsi qu'une augmentation de l'hématocrite (environ 2-3 %). L'empagliflozine a également un effet uricosurique et réduit ainsi le taux plasmatique d'urée (environ 50 µmol/L). L'élimination rénale du glucose augmente le risque d'infections urogénitales, particulièrement chez les femmes et les personnes âgées.
L'élimination rénale du glucose après la prise de 10 mg d'empagliflozine est de 64 g par jour (correspondant à environ 256 kcal). Après la prise de 25 mg d'empagliflozine, l'élimination rénale du glucose est de 78 g par jour (correspondant à environ 312 kcal).
Chez les patients avec diabète de type 2, l'élimination rénale du glucose dans l'urine augmente après la première dose d'empagliflozine pour se maintenir au même niveau pendant tout l'intervalle de dosage de 24 heures.
L'augmentation de la glycosurie a mené à une réduction de la concentration plasmatique de glucose chez les patients avec un diabète de type 2.
L'effet hypoglycémiant de l'empagliflozine est indépendant de la fonction des cellules bêta et des voies d'activation de l'insuline.
La metformine est un biguanide aux effets antihyperglycémiants induisant une diminution de la glycémie basale et postprandiale. La metformine ne stimule pas la sécrétion d'insuline et n'entraîne pas d'hypoglycémie.
La metformine peut agir via trois mécanismes:
(1) diminution de la production de glucose dans le foie via l'inhibition de la gluconéogenèse et de la glycogénolyse
(2) augmentation modérée de la sensibilité à l'insuline dans les muscles et en conséquence amélioration de l'absorption et de l'assimilation périphérique du glucose
(3) Retard de l'absorption intestinale du glucose.
La metformine stimule la synthèse intracellulaire du glycogène en agissant sur la glycogène synthétase.
La metformine augmente la capacité de transport de tous les types connus jusqu'ici de protéines transmembranaires de transport du glucose (GLUTs). Dans le cadre des études cliniques la metformine était associée à un poids corporel stable ou à une légère perte de poids.
Chez l'homme, indépendamment de son action sur la glycémie, la metformine exerce en outre des effets positifs sur le métabolisme lipidique. Dans des études cliniques contrôlées, il a été démontré que la metformine à des doses thérapeutiques diminue le cholestérol total, le cholestérol LDL et les triglycérides.
Efficacité clinique
Au total, 10224 patients présentant un diabète sucré de type 2 ont été traités pendant 24 semaines au moins dans le cadre de 9 études en double-aveugle contrôlées contre placebo ou contre comparateur actif; parmi ceux-ci 2947 patients ont reçu de l'empagliflozine 10 mg et 3703 de l'empagliflozine 25 mg en appoint du traitement par la metformine. Au total, 2978 de ces patients ont été traités par la metformine plus l'insuline, dont 988 avec l'empagliflozine 10 mg et 990 avec l'empagliflozine 25 mg comme traitement d'appoint.
Le traitement par empagliflozine en association avec la metformine et avec ou sans traitement de fond (sulfonylurée, inhibiteurs de la DPP4 ou l'insuline), a entraîné des améliorations cliniquement significatives de l'HbA1c, de la glycémie à jeun (GAJ), du poids corporel ainsi que de la pression artérielle systolique et diastolique.
Chez les patients à partir de 75 ans de faibles réductions numériques de l'HbA1c ont été observées. Des valeurs d'HbA1c plus élevées par rapport aux valeurs initiales sont associées à une réduction plus importante de l'HbA1c.
Association thérapeutique
Empagliflozine comme traitement d'appoint à la metformine et à une sulfonylurée
Par rapport au placebo, l'empagliflozine comme traitement d'appoint à la metformine ou à la metformine avec une sulfonylurée a entraîné une réduction statistiquement significative (p<0,0001) de l'HbA1c et du poids corporel (Tableau 2). De plus, elle a entraîné une réduction cliniquement significative de la glycémie à jeun et de la pression artérielle systolique et diastolique par rapport au placebo.
Dans la période d'extension menée en double aveugle et avec contrôle placebo de ces études, les réductions de l'HbA1c, du poids corporel et de la pression artérielle ont été maintenues jusqu'à la semaine 52.
Tableau 2: Résultats d'une étude de 24 semaines (LOCF) contrôlée contre placebo avec l'empagliflozine comme traitement d'appoint à la metformine ou à la metformine et une sulfonylurée (Full Analysis Set)
|
Empagliflozine
comme traitement d'appoint à la metformine
|
Placebo
|
Empagliflozine
10 mg
|
Empagliflozine
25 mg
| |
N
|
207
|
217
|
213
| |
HbA1c (%)
| |
Valeur initiale (moyenne)
|
7,90
|
7,94
|
7,86
| |
Variation par rapport à la valeur initiale1
|
-0,13
|
-0,70
|
-0,77
| |
Différence par rapport au placebo1
(IC 97,5%)
|
|
-0,57* (-0,72, -0,42)
|
-0,64* (-0,79, -0,48)
| |
N
|
184
|
199
|
191
| |
Patients (%) atteignant une valeur d'HbA1c <7% (valeur initiale d'HbA1c ≥7%)2
|
12,5
|
37,7
|
38,7
| |
N
|
207
|
217
|
213
| |
Poids corporel (kg)
| |
Valeur initiale (moyenne)
|
79,73
|
81,59
|
82,21
| |
Variation par rapport à la valeur initiale1
|
-0,45
|
-2,08
|
-2,46
| |
Différence par rapport au placebo1
(IC 97,5%)
|
|
-1,63* (-2,17, -1,08)
|
-2,01* (-2,56, -1,46)
| |
N
|
207
|
217
|
213
| |
Patients (%) avec une perte de poids >5%
|
4,8
|
21,2
|
23,0
| |
N
|
207
|
217
|
213
| |
PAS (mmHg)2
| |
Valeur initiale (moyenne)
|
128,6
|
129,6
|
130,0
| |
Variation par rapport à la valeur initiale1
|
-0,4
|
-4,5
|
-5,2
| |
Différence par rapport au placebo1
(IC 95%)
|
|
-4,1* (-6,2, -2,1)
|
-4.8* (-6.9, -2.7)
|
|
Empagliflozine
comme traitement d'appoint à la metformine et une sulfonylurée
|
Placebo
|
Empagliflozine
10 mg
|
Empagliflozine
25 mg
| |
N
|
225
|
225
|
216
| |
HbA1c (%)
| |
Valeur initiale (moyenne)
|
8,15
|
8,07
|
8,10
| |
Variation par rapport à la valeur initiale1
|
-0,17
|
-0,82
|
-0,77
| |
Différence par rapport au placebo1
(IC 97,5%)
|
|
-0,64* (-0,79, -0,49)
|
-0,59* (-0,74, -0,44)
| |
N
|
216
|
209
|
202
| |
Patients (%) atteignant une valeur d'HbA1c <7% (valeur initiale d'HbA1c ≥7%)2
|
9,3
|
26,3
|
32,2
| |
N
|
224
|
225
|
215
| |
GAJ (mg/dl) [mmol/l]
| |
Valeur initiale (moyenne)
|
151,7 [8,42]
|
151,0 [8,38]
|
156,5 [8,68]
| |
Variation par rapport à la valeur initiale1
|
5,5 [0,31]
|
-23,3 [-1,29]
|
-23,3 [-1,29]
| |
Différence par rapport au placebo1
(IC 95%)
|
|
-28,8* (-34,3, -23,4)
[-1,60 (-1,90, -1,30)]
|
-28,8* (-34,3, -23,3)
[-1,60 (-1,90, -1,29)]
| |
N
|
225
|
225
|
216
| |
Poids corporel (kg)
| |
Valeur initiale (moyenne)
|
76,23
|
77,08
|
77,50
| |
Variation par rapport à la valeur initiale1
|
-0,39
|
-2,16
|
-2,39
| |
Différence par rapport au placebo1
(IC 97,5%)
|
|
-1,76* (-2,25, -1,28)
|
-1,99* (-2,48, -1,50)
| |
N
|
225
|
225
|
216
| |
Patients (%) avec une perte de poids >5%
|
5,8
|
27,6
|
23,6
| |
N
|
225
|
225
|
216
| |
PAS (mmHg)2
| |
Valeur initiale (moyenne)
|
128,8
|
128,7
|
129,3
| |
Variation par rapport à la valeur initiale1
|
-1,4
|
-4,1
|
-3,5
| |
Différence par rapport au placebo1
(IC 95%)
|
|
-2,7 (-4,6, -0,8)
|
-2,1 (-4,0, -0,2)
|
1 Moyenne ajustée par rapport à la valeur initiale
2 Non évalué en termes de signification statistique du fait de la procédure d'analyse de confirmation séquentielle
* p<0,0001
Traitement d'appoint à l'insuline
Empagliflozine comme traitement d'appoint à l'insuline basale
L'efficacité et la tolérance de l'empagliflozine comme traitement d'appoint à l'insuline basale avec ou sans metformine et/ou une sulfonylurée ont été évaluées au cours d'une étude en double aveugle avec contrôle placebo d'une durée de 78 semaines. Pendant les 18 premières semaines, la dose d'insuline a été maintenue à dose constante, mais elle a été ajustée au cours des 60 semaines suivantes pour obtenir une glycémie à jeun <110 mg/dl.
Jusqu'à la semaine 18, l'empagliflozine a entraîné une amélioration statistiquement significative de l'HbA1c (Tableau 3).
Après la semaine 78, le traitement par empagliflozine a entraîné une réduction statistiquement significative de l'HbA1c ainsi qu'une épargne insulinique par rapport au placebo. De plus, l'empagliflozine a également entraîné une réduction de la glycémie à jeun, du poids corporel et de la pression artérielle.
Tableau 3: Résultats d'une étude avec contrôle placebo sur l'empagliflozine comme traitement d'appoint à l'insuline basale avec ou sans metformine ou une sulfonylurée (Full Analysis Set – Compléter) après 18 ou 78 semaines (LOCF)
|
|
Placebo
|
Empagliflozine
10 mg
|
Empagliflozine
25 mg
| |
N
|
125
|
132
|
117
| |
HbA1c (%) à la semaine 18
| |
Valeur initiale (moyenne)
|
8,10
|
8,26
|
8,34
| |
Variation par rapport à la valeur initiale1
|
-0,01
|
-0,57
|
-0,71
| |
Différence par rapport au placebo1
(IC 97,5 %)
|
|
-0,56* (-0,78, -0,33)
|
-0,70* (-0,93, -0,47)
| |
N
|
112
|
127
|
110
| |
HbA1c (%) à la semaine 78
| |
Valeur initiale (moyenne)
|
8,09
|
8,27
|
8,29
| |
Variation par rapport à la valeur initiale1
|
-0,02
|
-0,48
|
-0,64
| |
Différence par rapport au placebo1
(IC 97,5 %)
|
|
-0,46* (-0,73, -0,19)
|
-0,62* (-0,90, -0,34)
| |
N
|
112
|
127
|
110
| |
Dose d'insuline basale (UI/jour) à la semaine 78
| |
Valeur initiale (moyenne)
|
47,84
|
45,13
|
48,43
| |
Variation par rapport à la valeur initiale1
|
5,45
|
-1,21
|
-0,47
| |
Différence par rapport au placebo1
(IC 97,5 %)
|
|
-6,66** (-11,56, -1,77)
|
-5,92** (-11,00, -0,85)
|
1 Moyenne ajustée par rapport à la valeur initiale
* p <0,0001
** p <0,01
Empagliflozine comme traitement d'appoint à l'insuline injectée plusieurs fois par jour
L'efficacité et la tolérance de l'empagliflozine comme traitement d'appoint à l'insuline administrée plusieurs fois par jour avec ou sans traitement associé par metformine ont été évaluées au cours d'une étude en double aveugle avec contrôle placebo d'une durée de 52 semaines. Pendant les 18 premières semaines et les 12 dernières semaines, la dose d'insuline a été maintenue constante, mais elle a été ajustée entre les semaines 19 et 40 pour obtenir des glycémies préprandiales <100 mg/dl (5,5 mmol/l), et des glycémies postprandiales <140 mg/dl (7,8 mmol/l).
Jusqu'à la semaine 18, l'empagliflozine a entraîné une amélioration statistiquement significative de l'HbA1c par rapport au placebo (Tableau 4).
Après la semaine 52, le traitement par empagliflozine a entraîné une réduction statistiquement significative de l'HbA1c ainsi qu'une épargne insulinique par rapport au placebo. De plus, l'empagliflozine a également entraîné une réduction de la GAJ et du poids corporel.
Tableau 4: Résultats d'efficacité aux semaines 18 et 52 d'une étude sur l'empagliflozine avec contrôle placebo comme traitement d'appoint à plusieurs doses d'insuline par jour avec ou sans metformine
|
|
Placebo
|
Empagliflozine
10 mg
|
Empagliflozine
25 mg
| |
N
|
188
|
186
|
189
| |
HbA1c (%) à la semaine 18
| |
Valeur initiale (moyenne)
|
8,33
|
8,39
|
8,29
| |
Variation par rapport à la valeur initiale1
|
-0,50
|
-0,94
|
-1,02
| |
Différence par rapport au placebo1 (IC 97,5 %)
|
|
-0,44* (-0,61, -0,27)
|
-0,52* (-0,69, -0,35)
| |
N
|
115
|
119
|
118
| |
HbA1c (%) à la semaine 522
| |
Valeur initiale (moyenne)
|
8,25
|
8,40
|
8,37
| |
Variation par rapport à la valeur initiale1
|
-0,81
|
-1,18
|
-1,27
| |
Différence par rapport au placebo1 (IC 97,5 %)
|
|
-0,38*** (-0,62, -0,13)
|
-0,46* (-0,70, -0,22)
| |
N
|
113
|
118
|
118
| |
Patients (%) atteignant une valeur d'HbA1c <7 % avec une valeur initiale d'HbA1c ≥7 % à la semaine 52
|
26,5
|
39,8
|
45,8
| |
N
|
115
|
118
|
117
| |
Dose d'insuline (UI/jour) à la semaine 522
| |
Valeur initiale (moyenne)
|
89,94
|
88,57
|
90,38
| |
Variation par rapport à la valeur initiale1
|
10,16
|
1,33
|
-1,06
| |
Différence par rapport au placebo1 (IC 97,5 %)
|
|
-8,83# (-15,69, -1,97)
|
-11,22** (-18,09, -4,36)
| |
N
|
115
|
119
|
118
| |
Poids corporel (kg) à la semaine 522
| |
Valeur initiale (moyenne)
|
96,34
|
96,47
|
95,37
| |
Variation par rapport à la valeur initiale1
|
0,44
|
-1,95
|
-2,04
| |
Différence par rapport au placebo1 (IC 97,5 %)
|
|
-2,39* (-3,54, -1,24)
|
-2,48* (-3,63, -1,33)
|
1 Moyenne ajustée par rapport à la valeur initiale
2 semaine 19-40: régime Treat-to-Target pour l'ajustement de la dose d'insuline, pour l'atteinte des valeurs cibles prédéfinies de la glycémie (préprandiale <100 mg/dl (5,5 mmol/l), postprandiale <140 mg/dl (7,8 mmol/l)
* valeur de p <0,0001
** valeur de p = 0,0003
*** valeur de p = 0,0005
# valeur de p = 0,0040
Empagliflozine deux fois par jour versus une fois par jour comme traitement d'appoint à la metformine
L'efficacité et la sécurité de l'empagliflozine administrée deux fois par jour versus une fois par jour (dose journalière de 10 mg et 25 mg) comme traitement d'appoint chez les patients dont la glycémie était insuffisamment contrôlée sous monotraitement par la metformine ont été évaluées au cours d'une étude en double aveugle, contrôlée contre placebo pendant 16 semaines. Tous les traitements avec l'empagliflozine ont induit une réduction significative de l'HbA1c entre l'inclusion (valeur moyenne globale 7,8 %) et après 16 semaines de traitement en comparaison avec le placebo. L'administration d'empagliflozine deux fois par jour a conduit à une réduction de l'HbA1c comparable à celle obtenue avec le schéma thérapeutique comportant une administration une fois par jour, la différence en termes de réduction de l'HbA1c entre l'inclusion et la semaine 16 est de -0,02 % (IC 95 % -0,16; 0,13) pour l'empagliflozine 5 mg deux fois par jour versus 10 mg une fois par jour et -0,11 % (IC 95 % -026; 0,03) pour l'empagliflozine 12,5 mg deux fois par jour versus 25 mg une fois par jour.
Evénements cardiovasculaires chez des patients présentant une affection cardiovasculaire manifeste
L'étude EMPA-REG a comparé le risque d'événements cardiovasculaires chez des patients présentant un diabète de type 2 et un antécédent cardiovasculaire sous traitement par empagliflozine versus placebo. Un total de 7020 patients présentant une coronaropathie (pathologie concernant un ou plusieurs vaisseaux), après un infarctus du myocarde (IM), après un accident vasculaire cérébral et/ou une maladie artérielle occlusive périphérique a été inclus dans l'étude. Ils ont été traités pendant une durée allant jusqu'à 4,5 ans (durée de traitement médiane 3,1 ans), en plus d'un traitement existant, soit par empagliflozine 10 mg (n=2.345), soit par empagliflozine 25 mg (n=2.342), soit par un placebo (n=2.333).
72,4 % de la population était caucasienne, 21,6 % asiatique et 5,1 % noire. L'âge moyen était de 63 ans (9,3 % des patients ≥75 ans), 71,5 % des patients étaient de sexe masculin. Au début de l'étude, environ 81 % des patients recevaient un inhibiteur du système rénine-angiotensine, 65 % des bêtabloquants, 43 % des diurétiques, 89 % des anticoagulants et 81 % une médication hypolipémiante. Au début de l'étude, environ 74 % des patients prenaient de la metformine, 48 % utilisaient de l'insuline et 43 % recevaient une sulfonylurée. Au cours des 12 premières semaines, le traitement a été observé sans autres modifications. A partir de cette date, le traitement (y compris hypertension et dyslipidémie) pouvait être modifié selon les directives thérapeutiques actuelles.
Le critère d'évaluation primaire (défini pour les deux bras empagliflozine ensemble) était la durée jusqu'au premier événement du critère d'évaluation combiné composé des décès cardiovasculaires, des IM non fatals et des accidents vasculaires cérébraux non fatals (3-point MACE [Major Adverse Cardiovascular Events]). Tous les décès cardiovasculaires ont été catégorisés par un comité d'experts en aveugle (CEC) comme IM fatal, accident vasculaire cérébral fatal, décès suite à une insuffisance cardiaque (par progression ou choc cardiogène), décès subit ou autres événements cardiovasculaires fatals.
Les analyses par sous-groupes pour 3P-MACE et décès cardiovasculaire après traitement antidiabétique au début de l'étude (dont metformine et insuline) affichaient des effets de traitement conformes à ceux de la population totale, dans le cadre d'une estimation des points pour le hazard ratio de la population totale s'inscrivant dans les intervalles de confiance des sous-groupes pour chaque critère d'évaluation.
Réduction du risque de décès cardiovasculaires et mortalité totale
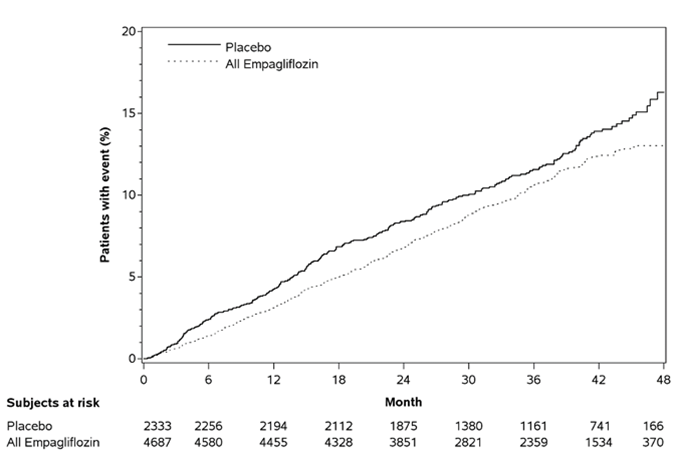
L'empagliflozine était supérieure au placebo en ce qui concerne le critère d'évaluation primaire (c'est-à-dire qu'elle provoquait une diminution du risque d'événements cardiovasculaires). Cet effet n'a pas pu être expliqué uniquement par la différence entre les groupes de traitement dans le contrôle de la glycémie et reposait principalement sur la réduction marquée de l'incidence de décès cardiovasculaires (Tableau 5 et Figure 1). Un effet préventif a été observé pour toutes les catégories de décès cardiovasculaires et était le plus net pour le décès pour cause d'insuffisance cardiaque progressive. Parallèlement, le risque d'infarctus du myocarde non fatals n'a pas été réduit de façon statistiquement significative. L'empagliflozine n'a également eu aucun effet préventif pour les accidents vasculaires cérébraux et a provoqué une augmentation numérique du risque (HR [intervalle de confiance 95 %] d'événements fatals/non fatals: 1,18 [0,89, 1,56]). En outre, il s'est produit une réduction du critère d'évaluation primaire chez les patients qui ont été inclus dans l'étude exclusivement en raison d'antécédents cérébrovasculaires. La plus forte diminution de la mortalité cardiovasculaire a été observée chez les patients présentant 2 ou 3 facteurs de risque.
En raison principalement de la réduction des décès cardiovasculaires (l'empagliflozine n'a pas provoqué de réduction statistiquement significative de la mortalité non cardiovasculaire), la mortalité totale s'est également améliorée dans le cadre du traitement par empagliflozine.
Tableau 5: Effet de traitement eu égard au critère d'évaluation primaire combiné, ses composants et la mortalité (population traitée*)
|
|
Placebo
|
Empagliflozine
(10 et 25 mg, en pool)
| |
N
|
2333
|
4687
| |
Durée jusqu'à la première occurrence d'un décès cardiovasculaire, IM non fatal ou accident vasculaire cérébral non fatal
|
282 (12,1)
|
490 (10,5)
| |
Hazard ratio vs. placebo (IC 95,02 %)**
|
|
0,86 (0,74; 0,99)
| |
Valeur p de supériorité
|
|
0,0382
| |
Décès cardiovasculaires N (%)
|
137 (5,9)
|
172 (3,7)
| |
Hazard ratio vs. placebo (IC 95 %)
|
|
0,62 (0,49; 0,77)
| |
Valeur p
|
|
<0,0001
| |
IM non fatals N (%)
|
121 (5,2)
|
213 (4,5)
| |
Hazard ratio vs. placebo (IC 95 %)
|
|
0,87 (0,70; 1,09)
| |
Valeur p
|
|
0,2189
| |
Accidents vasculaires cérébraux non fatals N (%)
|
60 (2,6)
|
150 (3,2)
| |
Hazard ratio vs. placebo (IC 95 %)
|
|
1,24 (0,92; 1,67)
| |
Valeur p
|
|
0,1638
| |
Mortalité totale N (%)
|
194 (8,3)
|
269 (5,7)
| |
Hazard ratio vs. placebo (IC 95 %)
|
|
0,68 (0,57; 0,82)
| |
Valeur p
|
|
<0,0001
| |
Mortalité non cardiovasculaire N (%)
|
57 (2,4)
|
97 (2,1)
| |
Hazard ratio vs. placebo (IC 95 %)
|
|
0,84 (0,60; 1,16)
|
* c'est-à-dire patients qui ont reçu au moins une dose du médicament à l'étude
** Puisque les données de l'étude ont été prises en compte dans une analyse intermédiaire, un intervalle de confiance bilatéral de 95,02 % s'applique, conforme à une valeur p inférieure à 0,0498 pour le caractère significatif
Figure 1: Durée jusqu'à la première occurrence d'un événement du critère d'évaluation primaire (décès cardiovasculaire/IM non fatal/accident vasculaire cérébral non fatal)
Dans une étude croisée randomisée avec contrôle placebo et comparateur actif portant sur 30 volontaires sains, aucune augmentation de l'intervalle QTc n'a été observée sous 25 mg ou 200 mg d'empagliflozine.
Glycémie postprandiale (à 2 heures)
Le traitement par empagliflozine en appoint à la metformine ou à la metformine et une sulfonylurée a entraîné une réduction cliniquement significative de la glycémie postprandiale à 2 heures (test de tolérance au repas) à 24 semaines (traitement d'appoint à la metformine: placebo +5,9 mg/dl [+0,33 mmol/l], empagliflozine 10 mg: -46,0 mg/dl [-2,56 mmol/l]). Traitement d'appoint à la metformine et à une sulfonylurée: placebo -2,3 mg/dl [-0,13 mmol/l], empagliflozine 10 mg: -35,7 mg/dl [1,98 mmol/l].
Patients présentant une valeur initiale d'HbA1c ≥9 %
Dans une analyse prédéfinie de patients avec une valeur initiale d'HbA1c ≥9,0 %, le traitement a entraîné à la semaine 24 une réduction de l'HbA1c statistiquement significative (variation moyenne corrigée par rapport à la valeur initiale de -1,40 % pour l'empagliflozine 10 mg et de -0,44 % pour le placebo).
Poids corporel
Dans une analyse poolée prédéfinie de 4 études contrôlées versus placebo, le traitement par empagliflozine (68 % de l'ensemble des patients recevaient de la metformine comme traitement de fond) a entraîné une réduction du poids corporel (-2,04 kg pour l'empagliflozine 10 mg, -0,24 kg pour le placebo) à la semaine 24, qui s'est maintenue jusqu'à la semaine 52 (-1,96 kg pour l'empagliflozine 10 mg, -0,16 kg pour le placebo).
Pression artérielle
L'efficacité et la tolérance de l'empagliflozine ont été évaluées au cours d'une étude en double aveugle avec contrôle placebo d'une durée de 12 semaines portant sur des patients avec diabète sucré de type 2 et une hypertension artérielle, traités par divers médicaments antidiabétiques et jusqu'à 2 médicaments antihypertenseurs. Le traitement par empagliflozine une fois par jour a entraîné une amélioration statistiquement significative de l'HbA1c et de la pression artérielle systolique et diastolique moyenne sur 24 heures, déterminée par un suivi ambulatoire de la pression artérielle (Tableau 6). Le traitement par empagliflozine a entraîné une réduction de la PAS et de la PAD en position assise.
Tableau 6: Résultats d'une étude avec contrôle placebo avec l'empagliflozine chez des patients avec diabète sucré de type 2 et pression artérielle non contrôlée (Full Analysis Set) après 12 semaines (LOCF)
|
|
Placebo
|
Empagliflozine
10 mg
|
Empagliflozine
25 mg
| |
N
|
271
|
276
|
276
| |
HbA1c (%) à la semaine 12
| |
Valeur initiale (moyenne)
|
7,90
|
7,87
|
7,92
| |
Variation par rapport à la valeur initiale1
|
0,03
|
-0,59
|
-0,62
| |
Différence par rapport au placebo1
(IC 95 %)
|
|
-0,62* (-0,72, -0,52)
|
-0,65* (-0,75, -0,55)
| |
PAS sur 24 heures à la semaine 12
| |
Valeur initiale (moyenne)
|
131,72
|
131,34
|
131,18
| |
Variation par rapport à la valeur initiale1
|
0,48
|
-2,95
|
-3,68
| |
Différence par rapport au placebo1
(IC 95 %)
|
|
-3,44* (-4,78, -2,09)
|
-4,16* (-5,50, -2,83)
| |
PAD sur 24 heures à la semaine 12
| |
Valeur initiale (moyenne)
|
75,16
|
75,13
|
74,64
| |
Variation par rapport à la valeur initiale1
|
0,32
|
-1,04
|
-1,40
| |
Différence par rapport au placebo1
(IC 95 %)
|
|
-1,36** (-2,15, -0,56)
|
-1,72* (-2,51, -0,93)
|
1 Moyenne ajustée par rapport à la valeur initiale
* p <0,0001
** p < 0,001
Dans une analyse poolée prédéfinie de quatre études contrôlées versus placebo, le traitement par empagliflozine a entraîné une réduction de la pression artérielle systolique (empagliflozine 10 mg: -3,9 mmHg) par rapport au placebo (-0,5 mmHg) et une réduction de la pression artérielle diastolique (empagliflozine 10 mg: -1,8 mmHg) par rapport au placebo (-0,5 mmHg) à la semaine 24; ces améliorations étaient maintenues jusqu'à la semaine 52.
Paramètres de laboratoire
Augmentation de l'hématocrite
Dans une analyse combinée de la sécurité de toutes les études avec de la metformine comme traitement de fond, les modifications moyennes de l'hématocrite par rapport aux valeurs initiales étaient de 3,6 % pour l'empagliflozine 10 mg et de 4,0 % pour l'empagliflozine 25 mg par rapport à 0 % pour le placebo. Dans l'étude EMPA-REG Outcome, les valeurs d'hématocrite étaient redescendues jusqu'aux valeurs initiales à la fin de la phase de suivi de 30 jours après l'arrêt du médicament.
Augmentation des lipides sériques
Dans une analyse combinée de la sécurité de toutes les études avec de la metformine comme traitement de fond, le pourcentage d'augmentation moyen par rapport aux valeurs initiales pour l'empagliflozine 10 mg ou 25 mg comparé au placebo était de 5,0 % ou 5,2 % versus 3,7 % pour le cholestérol total; de 4,6 % ou 2,7 % versus -0,5 % pour le cholestérol HDL; de 9,1 % ou 8,7 % versus 7,8 % pour le cholestérol LDL; de 5,4 % ou 10,8 % versus 12,1 % pour les triglycérides.
Enfants et adolescents
L'efficacité clinique et la sécurité de l'empagliflozine 10 mg une fois par jour (avec possibilité d'une augmentation de la dose à 25 mg une fois par jour) ou de la linagliptine 5 mg une fois par jour ont été étudiées chez des enfants et des adolescents de 10 à 17 ans atteints de diabète sucré de type 2 dans le cadre d'une étude (DINAMO) en groupes parallèles, contrôlée contre placebo, randomisée et menée en double aveugle sur une période de 26 semaines, avec une phase d'extension en double aveugle d'une durée allant jusqu'à 52 semaines visant à évaluer la sécurité du traitement actif. Au total, 157 patients ont reçu l'empagliflozine (10 mg ou 25 mg; N = 52), la linagliptine (N = 52) ou le placebo (N = 53). Parmi les traitements de fond administrés en complément de mesures diététiques et d'une activité physique figuraient la metformine en monothérapie (51%), la metformine associée à l'insuline (40,1%) et l'insuline (3,2%), ou aucun traitement de fond n'a été administré (5,7%). La valeur initiale d'HbA1c moyenne était de 8,03%. La population étudiée comprenait 38,2% de patients de sexe masculin et 61,8% de patients de sexe féminin, avec une moyenne d'âge de 14,5 ans (extrêmes: 10 à 17 ans); 51,6% avaient au moins 15 ans. La population étudiée était en outre composée comme suit: 49,7% des participants étaient d'origine caucasienne, 5,7% d'origine asiatique et 31,2% d'origine africaine/afro-américaine. L'IMC moyen s'élevait à 36,04 kg/m², le poids corporel moyen à 99,92 kg. Seuls les patients avec un DFGe ≥60 ml/min/1,73 m² ont été inclus dans l'étude DINAMO.
L'empagliflozine s'est avérée supérieure au placebo en ce qui concerne le critère d'évaluation principal, à savoir la réduction de l'HbA1c à 26 semaines par rapport à la valeur initiale, et ce, indépendamment d'un traitement de secours ou d'un arrêt du traitement. En outre, le traitement par l'empagliflozine a entraîné une réduction cliniquement significative de la GAJ (Tableau 7).
Tableau 7: Résultats d'une étude de l'empaglifozine contrôlée contre placebo, d'une durée de 26 semaines, menée chez des enfants et des adolescents atteints de diabète sucré de type 2 (analyse modifiée en intention de traiter)
|
|
Placebo
|
Empagliflozine
(10 et 25 mg une fois par jour, données poolées)
| |
N
|
53
|
52
| |
HbA1c (%)¹
| |
Valeur initiale (moyenne)
|
8,05
|
8,00
| |
Variation par rapport à la valeur initiale²
|
0,68
|
-0,17
| |
Différence par rapport au placebo² (IC à 95%)
|
|
-0,84
(-1,50, -0,19)
| |
Valeur p pour la supériorité
|
|
0,0116
| |
N
|
52
|
48
| |
GAJ (mg/dl) [mmol/l] 3,4
| |
Valeur initiale (moyenne)
|
158,6 [8,80]
|
154,4 [8,57]
| |
Variation par rapport à la valeur initiale²
|
15,7 [0,87]
|
-19,5 [-1,08]
| |
Différence par rapport au placebo² (IC à 95%)
|
|
-35,2 (-58,6, -11,7)
[-1,95 (-3,25, -0,65)]
| |
Valeur p nominale
|
|
0,0035
|
¹ Imputation multiple avec 500 itérations pour données manquantes
² Moyenne ajustée en fonction de la valeur initiale et de la stratification
³ Last Observation Carried Forward (LOCF), y compris les valeurs initiales
4 Non évaluée sur le plan de la signification statistique; non incluse dans la procédure de test séquentiel
|

