CompositionPrincipes actifs
Protéine de fusion recombinante composée du facteur de coagulation IX recombinant associé à une albumine recombinante (rIX-FP), (Nom fantaisie (DCI) = albutrépénonacog alfa).
Excipients
Poudre: citrate trisodique dihydraté (correspond à ≤0,2 mmol ou 4,3 mg de sodium par flacon d'IDELVION 250 U.I., d'IDELVION 500 U.I.et d'IDELVION 1000 U.I. ainsi qu'à ≤0,4 mmol ou 8,6 mg par flacon d'IDELVION 2000 U.I. et d'IDELVION 3500 U.I.) polysorbate 80, mannitol, saccharose, acide chlorhydrique (pour l'ajustement du pH).
Solvant: eau pour préparation injectable.
Indications/Possibilités d’emploiProphylaxie et thérapie d'hémorragies chez tous les patients atteints d'hémophilie B (déficit congénital en facteur IX) y compris la maîtrise et la prévention d'hémorragies survenant au cours d'interventions chirurgicales.
Posologie/Mode d’emploiPosologie pour adultes et enfants
Le traitement par IDELVION doit être mis en place sous la surveillance d'un médecin ayant de l'expérience dans le traitement de l'hémophilie B.
La décision concernant un traitement d'hémorragies ou, respectivement, la prophylaxie d'hémorragies chez des patients atteints d'hémophilie B à domicile doit être prise individuellement pour chaque patient par le médecin traitant. Le médecin traitant doit s'assurer qu'une formation adéquate du patient est effectuée et que l'administration est contrôlée à intervalles réguliers.
La posologie et la durée du traitement substitutif dépendent de la sévérité du déficit en facteur IX, de la localisation et de l'étendue de l'hémorragie ainsi que de l'état clinique et de la réponse du patient.
Le nombre des unités de facteur IX administrées est exprimé en unités internationales (UI), qui correspondent à la norme actuelle de l'OMS pour les produits à base de facteur IX. Une unité internationale de l'activité du facteur IX correspond à la teneur en facteur IX de 1 ml de plasma humain normal issu d'individus sains. L'activité du facteur IX dans le plasma est exprimée soit en pourcentage (par rapport au plasma humain normal), soit en unités internationales (sur la base d'une norme internationale du facteur IX dans le plasma).
Traitement à la demande
Le calcul de la dose requise de facteur IX repose sur l'expérience clinique montrant qu'une UI de facteur IX par kg de poids corporel augmente l'activité du facteur IX dans le plasma en moyenne de 1,3 UI/dl (1,3% de la valeur normale) chez les patients âgés de 12 ans ou plus et de 1,0 UI/dl (1,0% de la valeur normale) chez les patients âgés de moins de 12 ans. La dose requise est calculée à l'aide de la formule suivante:
Dose requise (UI) = poids corporel (kg) × augmentation souhaitée du facteur IX (% de la valeur normale ou UI/dl) × {Inverse de la récupération mesurée (UI/kg par UI/dl)}
Augmentation attendue du taux de facteur IX (UI/dl ou % de la valeur normale) = dose (UI) × récupération (UI/dl par UI/kg)/poids corporel (kg)
Pour la détermination d'une dose d'entretien adaptée, il faut tenir compte de la demi-vie prolongée du produit.
La quantité à administrer et la fréquence d'administration doivent toujours s'orienter en fonction de l'efficacité clinique et du taux résiduel de facteur IX chez chaque patient.
Enfants et adolescents
Enfants < 12 ans
Pour une récupération progressive (taux de récupération) de 1 UI/dl pour 1 UI/kg, la dose est calculée comme suit:
Dose (UI) = poids corporel (kg) × augmentation souhaitée du taux de facteur IX (UI/dl) × 1 dl/kg
Exemple:
1.Chez un patient de 20 kg et atteint d'hémophilie B sévère, un taux maximal de 50% est nécessaire. La dose correspondante serait: 20 kg × 50 UI/dl × 1 dl/kg = 1000 UI.
2.Une dose de 1000 UI d'IDELVION, administrée à un patient de 25 kg, devrait conduire après l'injection à une augmentation du taux de facteur IX de 1000 UI/25 kg × 1,0 (UI/dl par UI/kg) = 40 UI/dl (40% de la valeur normale).
Adolescents ≥12 ans
Pour une récupération progressive de 1,3 UI/dl pour 1 UI/kg, la dose est calculée comme suit:
Dose (UI) = poids corporel (kg) × augmentation souhaitée du taux de facteur IX (UI/dl) × 0,77 dl/kg
Exemple:
3.Chez un patient de 80 kg atteint d'hémophilie B sévère, un taux maximal de 50% est nécessaire.La dose correspondante serait: 80 kg × 50 UI/dl × 0,77 dl/kg = 3080 UI.
4.Une dose de 2'000 UI d'IDELVION, administrée à un patient de 80 kg, devrait conduire après l'injection à une augmentation du taux de facteur IX de 2000 UI × 1,3 (UI/dl par UI/kg)/80 kg = 32,5 UI/dl (32,5% de la valeur normale).
Le tableau suivant peut être utilisé comme guide dans la détermination de la posologie pour la maîtrise et la prévention d'épisodes hémorragiques et en cas d'interventions chirurgicales:
La durée de la demi-vie d'IDELVION est plus longue, ce qui permet et exige une posologie différente de celle des préparations de facteur IX dont la durée de la demi-vie ne peut se prolonger aussi longtemps.
|
Sévérité de l'hémorragie/Type de l'intervention chirurgicale
|
Taux de facteur IX-requis (%) (UI/dl)
|
Fréquence des administrations (heures)/Durée du traitement (jours)
| |
Hémorragie
Hémarthroses légères ou modérées, hémorragies musculaires (sauf muscle ilio-psoas) ou saignements dans la cavité buccale
|
30 à 60
|
Pour la majorité des hémorragies, une seule administration devrait être suffisante. En cas de signes persistants d'hémorragies, une dose d'entretien après 48 à 72 heures
| |
Hémorragies majeures
Hémorragies mettant la vie en danger, hémorragies des muscles profonds, muscle ilio-psoas inclus
|
60 à 100
|
Répéter l'administration toutes les 48 à 72 heures pendant la première semaine et ensuite dose d'entretien hebdomadaire jusqu'à l'arrêt des hémorragies et l'achèvement de la cicatrisation.
| |
Interventions mineures
y compris extraction dentaire sans complication
|
50 à 80
(dose initiale)
|
Pour une majorité d'interventions mineures, une seule administration peut être suffisante. Éventuellement une dose d'entretien après 48 à 72 heures jusqu'à l'arrêt des hémorragies et l'achèvement de la cicatrisation.
| |
Interventions majeures
|
60 à 100
(dose initiale)
|
Répéter l'administration toutes les 48 à 72 heures pendant la première semaine et ensuite dose d'entretien 1 ou 2 fois par semaine jusqu'à l'arrêt des hémorragies et l'achèvement de la cicatrisation.
|
Prophylaxie
Dans la prophylaxie de routine destinée à éviter les hémorragies chez des patients adultes atteints d'hémophilie B, on recommande un schéma posologique de 25 à 40 UI/kg une fois par semaine. Il est possible de traiter certains patients qui réagissent bien à la posologie hebdomadaire avec une posologie allant jusqu'à 75 UI/kg tous les 10 ou 14 jours. Les patients traités préalablement (≥18 ans) qui sont bien contrôlés pendant au moins 6 mois avec un régime de 14 jours peuvent passer à 100 UI/kg une fois tous les 21 jours. Le schéma posologique devrait être adapté à l'état clinique et à la réponse clinique du patient individuel.
Patients non traités antérieurement
La sécurité et l'efficacité d'IDELVION chez les patients non traités antérieurement sont en adéquation avec le profil de sécurité et d'efficacité de la rlX-FP chez les patients adultes et pédiatriques atteints d'hémophilie B et traités antérieurement.
Patients agés
La posologie et la durée de l'utilisation chez les patients âgés (> 65 ans) n'ont pas encore été étudiées dans des études cliniques.
Enfants et adolescents
Les données disponibles à ce jour sont décrites dans la rubrique «Pharmacocinétique».
Pour la prophylaxie de routine chez l'enfant et l'adolescent, la posologie recommandée est la même que pour l'adulte (voir rubrique «Pharmacocinétique»).
Chez les patients pédiatriques, un intervalle d'administration plus court doit être déterminé individuellement sur la base des taux résiduels. Le régime de 21 jours n'a pas été étudié chez l'enfant (<12 ans).
Surveillance du développement d'inhibiteurs
Une surveillance des patients s'impose afin de déceler un développement d'anticorps contre le facteur IX (inhibiteurs). Voir également la rubrique «Mises en garde et précautions».
Schéma d'administration
La préparation reconstituée doit être injectée lentement par voie intraveineuse, à un débit ' agréable pour le patient.
Il convient d'observer le patient pour déceler toutes réactions immédiates. S'il survient une réaction qui pourrait être mise en relation avec l'administration d'IDELVION, il faut, en fonction de l'état clinique du patient, réduire le débit de perfusion ou bien interrompre l'administration.
Pour des directives relatives à la préparation du médicament avant l'administration, se rapporter à la rubrique «Remarques concernant la manipulation».
Afin de garantir la traçabilité des médicaments produits par biotechnologie, il est recommandé de documenter le nom commercial et le numéro de lot pour chaque traitement.
Contre-indicationsIDELVION est contre-indiqué chez les patients ayant une hypersensibilité connue au principe actif, à l'un des excipients et composants d'IDELVION et aux protéines de hamster (voir la rubrique «Composition»).
Mises en garde et précautionsHypersensibilité
Des réactions d'hypersensibilité de type allergique peuvent se produire. Cette préparation contient des traces de protéines de hamster.
Si des symptômes d'une hypersensibilité apparaissent, il faut interrompre immédiatement l'administration du médicament et instaurer un traitement correspondant. Les patients doivent être informés des signes précoces de réactions d'hypersensibilité, tels qu'éruptions papuleuses, urticaire généralisée, oppression thoracique, stridor, hypotension et anaphylaxie. Les patients doivent être informés qu'en cas d'apparition de ces symptômes, ils doivent interrompre immédiatement l'administration d'IDELVION et consulter leur médecin.
Étant donné que des risques de réactions allergiques existent avec toutes les préparations de facteur IX, les administrations initiales d'IDELVION devraient être faites sous surveillance médicale en un lieu où une prise en charge médicale appropriée des réactions allergiques peut être assurée.
Inhibiteurs
Lors du traitement substitutif de l'hémophilie B par IDELVION, la formation d'inhibiteurs du facteur IX a été signalée. Les patients doivent par conséquent être surveillés afin de déceler le développement d'anticorps neutralisants (inhibiteurs) au moyen de tests biologiques appropriés (exprimés en unités Bethesda (UB)).
Si les taux d'activité attendus du facteur IX plasmatique n'ont pas été atteints ou si l'hémorragie n'est pas maîtrisée avec la posologie appropriée, il convient d'effectuer un dosage mesurant la concentration des inhibiteurs du facteur IX. Si l'hémorragie n'est pas maîtrisable ou lorsqu'un développement d'inhibiteurs est suspecté, il est recommandé de transférer le patient dans un centre thérapeutique spécialisé dans le traitement de l'hémophilie.
Il existe dans la littérature des rapports qui font état d'une corrélation entre l'apparition d'un inhibiteur du facteur IX et des réactions allergiques. Les patients qui présentent des réactions allergiques doivent par conséquent être testés quant à la présence d'un inhibiteur. Il ne faut pas perdre de vue que, chez des patients présentant des inhibiteurs du facteur IX, il y a un plus grand risque de réactions anaphylactiques avec la forte consommation de facteur IX qui en résulte.
La sécurité et l'efficacité de l'utilisation d'IDELVION sous forme de perfusion continue n'ont pas été établies.
Pour les enfants de moins de 6 ans, il existe des données limitées sur le traitement par IDELVION à la demande ou le traitement lors d'interventions chirurgicales..
Thromboembolies
Comme il existe un risque potentiel de complications thrombotiques, il convient de surveiller cliniquement les premiers signes d'une coagulopathie thrombotique ou d'une coagulation intravasculaire disséminée (CIVD) au moyen de tests biologiques appropriés. Ceci est valable avant tout lors de l'administration de la préparation dans les situations suivantes: pour des patients avec des maladies du foie, après des opérations, pour des nouveau-nés ou pour des patients présentant des risques de complications thrombotiques ou de coagulations intravasculaires disséminées. Dans chacun de ces cas, l'utilisation d'une thérapie avec IDELVION doit être considérée par rapport au risque de ces complications.
Évènements cardiovasculaires
Chez les patients avec des risques cardiovasculaires préexistants, un traitement substitutif par le facteur IX peut augmenter le risque cardiovasculaire.
Complications associées au cathéter
Lorsqu'un cathéter veineux central (CVC) est nécessaire, il convient de prendre en compte le risque de complications associées au cathéter, y compris les infections locales, la bactériémie et les thromboses associées au cathéter.
Tests de laboratoire pour la surveillance
Il faut surveiller l'activité du facteur IX plasmatique à l'aide du test de coagulation en une étape, afin de confirmer que les taux adéquats de facteur IX ont été atteints et sont maintenus. Les résultats des taux de facteur IX peuvent être affectés par la nature du réactif de TCA utilisé. Le dosage au moyen du test de coagulation en une étape à l'aide d'un réactif de TCA à base de kaolin ou d'un réactif de TCA Actin-FS conduira probablement à une sous-estimation du taux d'activité.
Enfants et adolescents
Les mises en garde et précautions indiquées sont valables aussi bien pour les adultes que pour les enfants et les adolescents.
IDELVION contient moins de 1 mmol ou 23 mg de sodium par flacon, ce qui signifie que ce produit est pratiquement exempt de sodium. Il contient néanmoins jusqu'à 1,31 mmol ou 30,21 mg de sodium par dose (70 kg de poids corporel), lorsque la dose maximale (17,5 ml – 7000 U.I.) est administrée. Cela correspond à 1,61 % de l'apport quotidien maximal en sodium de 2 g recommandé par l'OMS pour les adultes.
InteractionsAucune interaction d'IDELVION avec d'autres médicaments n'a été rapportée.
Grossesse, allaitementAucune étude sur la reproduction n'a été menée sur l'animal avec IDELVION. En raison de la rareté de l'hémophilie B chez la femme, on ne dispose pas de données sur l'emploi d'IDELVION pendant la grossesse et l'allaitement.
Par conséquent, lors de la grossesse et de l'allaitement, IDELVION ne doit être utilisé qu'en cas d'absolue nécessité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesIDELVION n'a aucune influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesRécapitulatif du profil de sécurité
Des réactions d'hypersensibilité ou des réactions allergiques, qui peuvent également inclure angio-œdème, brûlures et picotements au site d'injection, frissons, bouffées de chaleur, urticaire généralisée, céphalées, éruptions papuleuses, hypotension, léthargie, nausées, agitation, tachycardie, oppression thoracique, picotements, vomissements ou stridor, ont été observées avec l'administration de préparations contenant du facteur IX. Dans de rares cas, ces réactions se sont développées en réactions anaphylactiques et elles sont apparues en étroite relation temporelle avec le développement d'inhibiteurs du facteur IX. Dans des études cliniques menées sur IDELVION, aucune réaction anaphylactique n'a été observée.
Les patients atteints d'hémophilie B peuvent développer des anticorps neutralisants (inhibiteurs) contre le facteur IX. Lorsque de tels inhibiteurs apparaissent, l'état se manifeste sous forme d'une réponse clinique insuffisante. Dans de tels cas, il est recommandé de contacter un centre spécialisé dans l'hémophilie. Dans des études cliniques menées sur IDELVION avec des patients déjà traités antérieurement, aucun inhibiteur n'a été observé. D'après une étude clinique examinant des patients non traités antérieurement, le développement d'inhibiteurs contre le FIX a été signalé dans un cas.
Lors de l'utilisation de préparations à base de facteur IX provenant de cellules CHO, le développement d'anticorps contre des protéines de hamster a été observé dans de très rares cas. Dans des études cliniques menées sur IDELVION, de tels anticorps n'ont pas été détectés.
Dans les études cliniques menées sur IDELVION, aucun évènement thrombotique n'a été rapporté.
Pendant les études cliniques ouvertes sur IDELVION menées auprès de 114 patients traités auparavant, 1078 effets indésirables dus au traitement ont été notés chez 103 des 114 patients (90,4 %) ayant reçu au total 16'567 injections. Parmi ces 1078 évènements, 18 évènements ont été enregistrés comme étant en relation chez 11 des 114 patients (9,6 %). Dans l'étude terminée menée auprès de patients non traités auparavant, 11 PUP sur 12 ont montré au total 137 effets indésirables dus au traitement dont la plupart étaient légers à modérés. Chez 2 patients non traités auparavant , 5 évènements mis en relation avec IDELVION ont été observés.
Effets indésirables identifiés après la mise sur le marché
Le développement d'inhibiteurs a été observé après la mise sur le marché d'IDELVION.
Liste des effets indésirables
La liste ci-dessous suit la classification des systèmes d'organes MedDRA (SOC - System Organ Classes et niveau hiérarchique des termes préférentiels).
Les effets indésirables, dont la fréquence se base sur le pourcentage par patient et par injection, sont classés comme fréquents (≥1/100 à <1/10), occasionnels (≥1/1000 à <1/100), rares (≥1/10 000 à <1/1000), très rares (<1/10 000) et cas uniques (impossible d'estimer la fréquence sur la base des données disponibles). Les effets indésirables sur la base des études d'études cliniques sont présentés ci-dessous selon les classes de systèmes d'organes et la fréquence de l'apparition.
Les effets indésirables des médicaments figurant dans la liste ci-dessous proviennent d'études cliniques et l'investigateur a conclu à un lien avec l'administration d'IDELVION.
Affections du système nerveux:
Céphalées: fréquence par patient: fréquentes.
Vertiges: fréquence par patient: fréquente.
Affections du système immunitaire
Hypersensibilité: fréquence par patient: fréquente.
Affections de la peau et du tissu sous-cutané
Éruptions: fréquence par patient: fréquentes.
Eczéma: fréquence par patient: occasionnel.
Enfants et adolescents
La fréquence, la nature et la sévérité des effets indésirables chez l'enfant sont semblables à celles de l'adulte.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun cas de surdosage n'a été rapporté à ce jour.
Propriétés/EffetsCode ATC
B02BD04
Protéine de fusion recombinante consistant en facteur de coagulation IX recombinant associé à une albumine recombinante
Mécanisme d'action
IDELVION (INN: albutrépénonacog alfa) est une protéine de fusion recombinante d'un facteur de coagulation IX recombinant avec une albumine recombinante. IDELVION remplace efficacement le facteur de coagulation IX manquant qui est nécessaire pour l'hémostase et permet de plus longs intervalles entre les doses. La prolongation de la demi-vie d'IDELVION et l'exposition systémique accrue sont réalisées par la fusion avec l'albumine humaine recombinante, qui a une longue demi-vie intrinsèque. L'albumine est une protéine porteuse inerte, naturelle dans le plasma, ayant une longue demi-vie d'environ 20 jours. Elle ne participe pas à la réponse immunitaire ni à la défense immunitaire. La fusion génétique du facteur de coagulation IX recombinant avec l'albumine recombinante prolonge la demi-vie du facteur IX.
Pharmacodynamique
L'hémophilie B est une anomalie héréditaire de la coagulation sanguine, liée au chromosome sexuel, qui conduit à des taux réduits de facteur IX et donc à d'abondantes hémorragies dans les articulations, les muscles ou les organes internes, survenant soit spontanément, soit à la suite de traumatismes dus à des accidents ou à des interventions chirurgicales. Les taux plasmatiques de facteur IX sont accrus par la thérapie substitutive et permettent ainsi une correction temporaire du déficit en ce facteur et une correction des tendances aux hémorragies.
Le facteur IX est activé par le complexe facteur VIIa/facteur tissulaire dans la voie extrinsèque ainsi que par le facteur XIa dans la cascade intrinsèque de coagulation. En association avec le facteur VIII activé, le facteur IX activé active le facteur X. Ce résultat conduit finalement à la conversion de la prothrombine en thrombine. La thrombine convertit ensuite le fibrinogène en fibrine, de sorte qu'un caillot peut être formé. Chez des patients atteints d'hémophilie B, l'activité facteur IX est absente ou fortement réduite, ce qui nécessite un traitement substitutif.
Efficacité clinique
Efficacité de la prophylaxie de routine
Les résultats cliniques, qui montrent l'efficacité pour l'indication de la prophylaxie de routine, comprennent les taux annualisés (annuels) d'hémorragies spontanées (TAHs).
Taux annualisés d'hémorragies spontanées
Dans trois études (2004, 3001 et 3002), la survenue d'épisodes hémorragiques au cours de la période de traitement prophylactique a fait l'objet d'enregistrements et les TAHs ont été déterminés.
Sécurité et efficacité chez les adultes et adolescents (≥12 à 65 ans):
Dans l'étude 3001, les patients (n = 19) qui participaient aussi bien au traitement à la demande qu'au traitement prophylactique ont montré une réduction statistiquement significative des taux d'épisodes hémorragiques spontanés ainsi que d'épisodes hémorragiques totaux après le passage du traitement à la demande au traitement prophylactique.
Comparaison des taux annualisés d'hémorragies:
|
Étiologie des épisodes hémorragiques
|
Traitement à la demande
(n = 19)*
|
Prophylaxie hebdomadaire
(n = 19)*
|
Réduction en pourcentage avec la prophylaxie
(n = 19)*
| |
Spontanés (TAHs) *
| |
Moyenne (ET)
Médiane
IIQ
Intervalle
|
14,6 (8,42)
15,4
8,0; 18,0
2,0; 39,5
|
0,9 (1,17)
0,7
0; 1,6
0; 4,2
|
93,5 (8,03)
95,9
89,3; 100
75,2; 100
| |
Totaux (TAH)†
| |
Moyenne (ET)
Médiane
IIQ
Intervalle
|
20,8 (9,19)
19,2
16,7; 25,8
2,0; 46,1
|
2,9 (4,79)
1,6
0; 4,3
0; 21,1
|
88,0 (14,1)
90,94
81,2; 100
54,3; 100
|
* Basés sur un plan de «paires de patients» (matched pairs design)
†Le total comprend les hémorragies spontanées et traumatiques
IIQ = intervalle interquartile, défini pour le 25e et le 75e centile; ET = écart-type; les patients inclus dans l'étude de l'efficacité clinique sont des patients qui ont reçu au moins une dose du traitement à la demande et une dose pour le traitement prophylactique.
Au cours du traitement à la demande, les patients avaient un TAHs médian de 15,4 épisodes hémorragiques par an et par patient. Après le passage au traitement prophylactique hebdomadaire, le TAHs médian était de 0,00 (intervalle 0,0-4,2) épisode hémorragique par an et par patient. La réduction moyenne et la réduction médiane en pourcentage correspondantes du TAHs étaient respectivement de 96% et de 94% (P <0,0001).
Dans l'étude 3001, 26 patients sur 40 sont passés, après environ 26 semaines sous un schéma prophylactique de 7 jours, à un plus long intervalle de traitement prophylactique de soit 10, soit 14 jours. Sur la base d'un plan de paires de patients coordonné de manière correspondante, le schéma de traitement prophylactique de 14 jours par IDELVION s'est avéré aussi efficace que le schéma de traitement prophylactique de 7 jours par IDELVION. Le TAHs médian de 0,00 (intervalle 0,0-4,5) pour les patients qui avaient reçu un traitement de 7 jours était le même que pour les patients à plus longs intervalles de traitement: schéma de 10 jours, 0,00 (intervalle 0,0-0,9); schéma de 14 jours, 0,00 (intervalle 0,0-7,3). La dose médiane pour le traitement prophylactique de 14 jours était de 74,2 UI/kg. La majorité des patients dans le traitement prophylactique avaient reçu avant le passage à un schéma de 14 jours une dose stable de 40 UI/kg ou moins (comme prévu dans le protocole de l'étude).
Dans l'étude 2004, les patients qui avaient reçu un traitement prophylactique hebdomadaire présentaient un TAHs plus faible (médiane: 1,13; n = 13) que les patients qui n'avaient reçu que le traitement à la demande (médiane: 22,2; n = 4).
Sécurité et efficacité chez les patients pédiatriques
Enfants (0 à <12 ans)
Dans l'étude 3002, les 27 patients ont tous reçu un traitement prophylactique de 7 jours. Le TAHs médian était de 0,00 hémorragie par an et par patient. En ce qui concerne l'efficacité d'un traitement prophylactique de routine de 7 jours par la dose médiane de 45,9 UI/kg d'IDELVION, aucune différence n'a été constatée entre les deux groupes d'âge (à savoir patients âgés de moins de 6 ans et patients âgés de 6 à moins de 12 ans). Ces résultats correspondent au TAHs rapporté pour la population adulte qui avait reçu un traitement prophylactique dans l'étude 3001.
Prophylaxie de routine avec des régimes prolongés (étude d'extension):
Dans l'étude d'extension ouverte 3003, 11 des 59 patients ≥18 ans sont passés à un régime prophylactique prolongé d'une fois tous les 21 jours, et 8 des 24 patients <12 ans ont changé, après 6 mois de traitement stable avec les régimes de 14 et 7 jours, à un régime d'une fois tous les 14 jours. Le régime de 21 jours chez les adultes et le régime de 14 jours chez les enfants n'était pas inférieur au régime de 7 jours en termes de réduction des TAH et TAHs.
Taux d'hémorragies spontanées annualisés sous le régime de 21 jours (patients ≥18 ans) et le régime de 14 jours (patients <12 ans) dans l'étude d'extension par rapport au régime de 7 jours:
|
|
Taux d''hémorragies spontanées annualisées
| |
Groupe d''âge
Paramètre
|
Régime 7 jours
|
Régimes d''extension
|
Différence moyenne (IC à 95%)
des régimes 7 jours/d''extension
| |
Adultes (N=11)
|
|
21 jours
|
| |
Valeur moyenne (ET)
|
0,14 (0,477)
|
0,60 (1,408)
|
−0,45
(−1,464; 0,555)
| |
Médiane (min, max)
|
0,00 (0,0; 1,6)
|
0,00 (0,0; 4,7)
|
-
| |
Enfants (N=8)
|
|
14 jours
|
| |
Valeur moyenne (ET)
|
0,58 (1,070)
|
1,74 (2,017)
|
−1,16
(−2,634; 0,312)
| |
Médiane (min, max)
|
0,00 (0,0; 2,4)
|
1,12 (0,0; 5,0)
|
-
|
Remarques: pour le régime de prophylaxie de 7 jours, les données de l'étude d'extension ont été combinées avec celles de l'étude pivot.
Résultats uniquement pour les patients ayant bénéficié de chaque régime pendant ≥12 semaines.
Prise en charge des saignements périopératoires dans toutes les tranches d'âge
Dans les deux études pivots et l'étude d'extension, 21 patients au total (5 à 59 ans) ont reçu IDELVION pour la gestion périopératoire de 30 interventions chirurgicales. La dose a été ajustée individuellement en fonction de la pharmacocinétique et de la réponse clinique du patient au traitement. Il s'agissait de 15 chirurgies orthopédiques, une double liposuccion - mastectomie (n=1), une hémorroïdectomie (n=2), une rhinoplastie, une résection sous-muqueuse et une ablation de cornet nasal inférieur (n=1), des circoncisions (n=2), une hernie ombilicale et circoncision (n=1), des extractions dentaires (n=5), une embolie de varices scrotales (n=1), une excision d'un nævus pigmenté (n=1) et une résection endoscopique de muqueuses (n=1).
Dans 96,7% (n=29) des interventions chirurgicales, un seul bolus préopératoire a été utilisé. L'efficacité hémostatique a été jugée excellente ou bonne dans ≥95,5% des interventions chirurgicales. Au cours de la période postopératoire de 14 jours, les patients ont reçu entre 0 et 11 perfusions et la consommation d'IDELVION a varié de 0 à 444,1 UI/kg. Six patients ayant subi une intervention chirurgicale sont sortis de l'hôpital le jour même.
Patients non traités auparavant (PUP)
La sécurité et l'efficacité d'IDELVION ont également été examinées dans le cadre d'une étude clinique ouverte multicentrique auprès de 12 patients pédiatriques atteints d'hémophilie B non traités auparavant (activité du FIX endogène ≤2 %) et ayant reçu au moins une dose d'IDELVION lors de la prophylaxie de routine une fois tous les 7 jours, dans le cadre du traitement à la demande et pour la maîtrise des épisodes hémorragiques. Onze PUP avaient < 6 ans avec un âge (intervalle) médian de 0,0 (0 à 1) an et un PUP avait 11 ans. La durée médiane globale (intervalle) sous IDELVION était de 22,65 (4,5 à 33,0) mois et le nombre moyen d'ED (ET) sous IDELVION chez les PUP était de 68,3 (37,94).
Prophylaxie de routine chez les PUP
Les 12 PUP ont tous reçu une prophylaxie de routine: 11 PUP après le régime de 7 jours et 1 PUP après le régime de 10 jours. La durée médiane globale sous prophylaxie était de 11,50 (intervalle: 3,1 à 32,3) mois. Des TAH et TAHs bas ont été notés sous le traitement prophylactique par IDELVION chez les PUP. Chez les 11 PUP avec un régime thérapeutique de 7 jours, le taux annualisé d'hémorragies (TAH) allait de 0 à 3,89. Cinq PUP sur les 11 ont montré un TAHs de 0 et 8 PUP ont montré un taux annualisé d'hémorragies spontanées (TAHs) de 0. Au cours de l'étude menée auprès des PUP, la dose mensuelle moyenne (ET) d'IDELVION était de 193,66 (17,066) U.I./kg pour le régime prophylactique de 7 jours (N = 11) et de 132,10 U.I./kg pour le régime prophylactique de 10 jours (N = 1).
Maîtrise des épisodes hémorragiques chez les PUP
Parmi les 37 épisodes hémorragiques observés chez 10 PUP, 16 étaient spontanés, 17 traumatiques et 4 de cause inconnue. 93,8 % des épisodes hémorragiques spontanés ont été maîtrisés avec succès par 1 à 2 perfusions d'IDELVION.
PharmacocinétiqueAdultes
La pharmacocinétique (PC) d'IDELVION a été évaluée après l'injection intraveineuse de doses uniques de 25, 50, 75 et 100 UI/ kg. Les paramètres pharmacocinétiques (voir le tableau ci-dessous) étaient basés sur l'activité du facteur IX plasmatique, qui était mesurée à l'aide d'un test de coagulation en une étape. Les échantillons de sang pour l'analyse PC ont été prélevés avant l'administration de la dose et jusqu'à 504 heures (21 jours) après l'administration de la dose.
Paramètres pharmacocinétiques (moyenne arithmétique, CV en %) après une seule injection d'IDELVION chez l'adulte
|
Paramètre pharmacocinétique
|
50 UI/kg
(N=47)
|
100 UI/kg
(N=16)
| |
RP a
(UI/dl)/(UI/kg)
|
1,30 (23,8)
|
1,02 (12,6)
| |
Cmax a
(UI/dl)
|
66,6 (26,7)
|
102,2 (12,6)
| |
ASC0-inf
(h*UI/dl)
|
7482 (28,4)
|
17 068 (19,2)
| |
t½
(h)
|
104,2 (25,4)
|
143,2 (26,1)
| |
TSM
(h)
|
142,8 (22,7)
|
189,2 (21,2)
| |
CL
(ml/h/kg)
|
0,731 (26,8)
|
0,61 (19,2)
| |
Vss
(dl/kg)
|
1,020 (27,9)
|
1,12 (10,7)
| |
Temps jusqu'à une activité du facteur IX de 1% (j)b
|
25,5
|
34,0
| |
Temps jusqu'à une activité du facteur IX de 3% (j)b
|
16,5
|
24,5
|
a = corrigé pour les niveaux de référence
b = temps estimé jusqu'à ce que l'activité médiane du facteur IX passe au-dessus du pourcentage préétabli
RP = récupération progressive; Cmax = concentration maximale dans le sang;
ASC = aire sous la courbe de l'activité du facteur IX en fonction du temps; CL = clairance ajustée en fonction du poids corporel; Vss = volume de distribution à l'état d'équilibre, ajusté en fonction du poids corporel; t½ = demi-vie; TSM = temps de séjour moyen; Temps jusqu'à une activité du facteur IX de 1% = temps exprimé en jours, après administration de la dose, jusqu'à ce que l'activité du facteur IX ait chuté jusqu'à environ 1 UI/dl au-dessus de la valeur de base.
Les données pharmacocinétiques montrent qu'IDELVION présente une demi-vie prolongée dans la circulation sanguine, une aire plus étendue sous la courbe de l'activité du facteur IX en fonction du temps, une clairance moindre ainsi qu'une récupération progressive accrue par rapport aux produits de remplacement du facteur IX à courte durée d'action.
Dans l'étude principale, la récupération progressive moyenne (CV %) d'IDELVION était de 1,30 (23,8%), une valeur supérieure à la récupération (1,00 ± 25,7%) qui avait été atteinte avec le produit précédent à base de facteur IX (facteur IX issu de plasma ou recombinant). Par conséquent, une UI/kg d'IDELVION conduit à une augmentation moyenne de 1,30 UI/dl du taux de facteur IX dans la circulation sanguine.
Une évaluation répétée de la PC pendant une durée de jusqu'à 30 semaines a donné un profil pharmacocinétique stable et la récupération progressive était cohérente au cours du temps.
L'activité moyenne du facteur IX au jour 21 après une dose unique de 100 UI/kg d'IDELVION était de 6,4%. L'activité moyenne du facteur IX au jour 14 après une dose unique de 75 UI/kg d'IDELVION était de 6,65%. L'activité moyenne du facteur IX aux jours 7, 10 et 14 après une dose unique de 50 UI/kg d'IDELVION était respectivement de 13,76%, 9,59% et 6,1%. L'activité moyenne du facteur IX aux jours 7, 10 et 14 après une dose unique de 25 UI/kg d'IDELVION était respectivement de 8,62%, 5,02% et 2,96%.
Enfants et adolescents
Les paramètres pharmacocinétiques d'IDELVION ont été évalués dans des études multicentriques ouvertes menées auprès de 5 adolescents (âgés de 12 à moins de 18 ans) et 27 enfants (de 1 à moins de 12 ans), après l'injection intraveineuse d'une dose unique de 50 UI/kg. Les échantillons pour analyses pharmacocinétiques ont été prélevés avant l'administration et à divers moments jusqu'à 336 heures (14 jours) après l'administration. Les paramètres pharmacocinétiques (présentés ci-après) ont été déterminés à l'aide du profil de l'activité du facteur IX plasmatique en fonction du temps.
Les paramètres pharmacocinétiques, qui ont été calculés à partir des données pédiatriques de 32 patients âgés de 1 à moins de 18 ans, sont récapitulés dans le tableau suivant. En comparaison avec les adultes, il semble que chez les enfants et les adolescents la récupération progressive soit légèrement plus faible et que la clairance ajustée en fonction du poids corporel soit plus élevée.
Comparaison des paramètres pharmacocinétiques d'IDELVION selon la catégorie d'âge (moyenne arithmétique, CV en %) après une seule injection de 50 UI/kg d'IDELVION
|
Paramètre pharmacocinétique
|
1 à <6 ans
(N = 12)
|
6 à <12 ans
(N = 15)
|
12 à <18 ans
(N = 5)
| |
RP a
(UI/dl)/(UI/kg)
|
0,951 (21,5)
|
1,06 (22,6)
|
1,11 (27,7)
| |
Cmax a
(UI/dl)
|
48,3 (19,0)
|
52,9 (23,2)
|
55,3 (28,1)
| |
ASC0-inf
(h*UI/dl)
|
4583 (33)
|
5123 (31)
|
5347 (48)
| |
t½
(h)
|
89,6 (12,5)
|
92,8 (20,5)
|
87,3 (35,7)
| |
TSM
(h)
|
123 (14,2)
|
129 (19,0)
|
119 (31,2)
| |
CL
(ml/h/kg)
|
1,18 (27,8)
|
1,06 (28,5)
|
1,08 (39,3)
| |
Vss
(dl/kg)
|
1,43 (24,1)
|
1,32 (19,7)
|
1,16 (14,0)
|
a = corrigé pour les niveaux de référence
RP = récupération progressive; Cmax = concentration maximale dans le sang; ASC = aire sous la courbe de l'activité du facteur IX en fonction du temps; CL = clairance ajustée en fonction du poids corporel; Vss = volume de distribution à l'état stationnaire, ajusté en fonction du poids corporel; t½ = demi-vie; TSM = temps de séjour moyen.
Données précliniquesLes données précliniques issues des études conventionnelles sur la pharmacologie de sécurité, la toxicité en administration unique et répétée, la génotoxicité, la thrombogénicité et la tolérance locale n'ont pas révélé de risque particulier pour l'homme.
Carcinogénicité et toxicité sur la reproduction
Aucune étude sur la carcinogénicité et la toxicité sur la reproduction n'ont été menées.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments, diluants ou solvants, à l'exception des substances mentionnées dans la rubrique «Composition».
Stabilité
IDELVION ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Il a été démontré que la stabilité chimique et physique après reconstitution était de 8 heures à température ambiante (jusqu'à 25 °C au maximum). Du point de vue microbiologique, le médicament devrait être utilisé immédiatement. S'il n'est pas utilisé immédiatement, ne pas le conserver plus de 4 heures à la température ambiante (jusqu'à 25 °C au maximum).
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 25 °C.
Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Remarques générales
·La solution doit être limpide ou légèrement opalescente, incolore à jaune. Après filtration/aspiration de la solution dans la seringue (voir ci-dessous) et avant l'administration, contrôler visuellement l'absence de particules et de colorations dans le produit reconstitué.
·Des solutions troubles ou contenant des particules ne doivent pas être utilisées.
·La reconstitution et l'aspiration doivent s'effectuer dans des conditions aseptiques.
Préparation
Porter le solvant à la température ambiante. Avant d'ouvrir le dispositif Mix2Vial™, retirer les capsules amovibles des flacons d'IDELVION et de produit, désinfecter les bouchons avec une solution antiseptique, puis laisser les sécher.
|
|
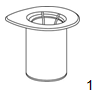
|
1. Ouvrez le dispositif Mix2Vial en retirant l'opercule. Ce faisant, ne retirez pas le Mix2Vial de l'emballage thermoformé!
| |
|
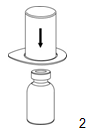
|
2. Placez le flacon de solvant sur une surface plane et propre et maintenez-le fermement. Saisissez le dispositif Mix2Vial avec l'emballage thermoformé et enfoncez la pointe de l'extrémité bleue de l'adaptateur tout droit vers le bas à travers le bouchon du flacon de solvant.
| |
|
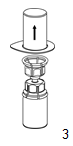
|
3. Retirez avec précautions l'emballage thermoformé du dispositif Mix2Vial en le tenant par le bord thermoformé et en le tirant verticalement vers le haut. Bien s'assurer que seul l'emballage thermoformé est enlevé et non le dispositif Mix2Vial.
| |
|
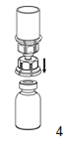
|
4. Posez le flacon d'IDELVION sur une surface plane et rigide. Retournez le flacon de solvant muni du dispositif Mix2Vial et enfoncez la pointe de l'extrémité transparente de l'adaptateur verticalement vers le bas dans le bouchon du flacon d'IDELVION. Le solvant passe automatiquement dans le flacon d'IDELVION.
| |
|
|
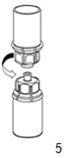
5. Saisissez d'une main le côté IDELVION et de l'autre le côté solvant du dispositif Mix2Vial et séparez les flacons en dévissant le dispositif dans le sens inverse des aiguilles d'une montre, avec précautions afin d'éviter une formation excessive de mousse lors de la dissolution du produit.
Jetez le flacon de solvant sur lequel est fixée la partie bleue de l'adaptateur Mix2Vial.
| |
|
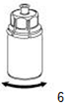
|
6. Faites osciller avec précautions le flacon d'IDELVION sur lequel est attachée la partie transparente de l'adaptateur jusqu'à dissolution complète du produit. Ne pas secouer!
| |
|
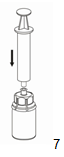
|
7. Aspirez de l'air dans une seringue stérile vide. Maintenez verticalement le flacon d'IDELVION, raccordez la seringue à l'embout Luer-Lock du dispositif Mix2Vial en la vissant dans le sens des aiguilles d'une montre et injectez l'air dans le flacon de produit.
|
Aspiration et administration
|
|
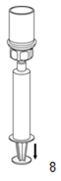
|
8. Maintenez le piston de la seringue enfoncé, retournez l'ensemble du système et aspirez lentement le produit dans la seringue en tirant le piston.
| |
|
|
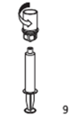
9. Une fois la solution entièrement transférée dans la seringue, saisissez le corps de la seringue (en laissant le piston dirigé vers le bas) et séparez de la seringue l'adaptateur transparent du dispositif Mix2Vial en dévissant dans le sens inverse des aiguilles d'une montre.
|
Pour la perfusion d'IDELVION, seul le nécessaire d'administration fourni devrait être utilisé, sinon un sous-dosage est susceptible de se produire par suite de l'adhérence de facteur IX aux surfaces internes de certains matériaux utilisés pour la perfusion.
Il faut éviter la pénétration de sang dans ' la seringue avec le produit. Il existe un risque que le sang coagule dans la seringue et qu'un caillot de fibrine soit injecté au patient.
S'il est nécessaire d'administrer une plus grande quantité d'IDELVION, il est possible de réunir et d'injecter plusieurs flacons d'IDELVION à l'aide d'un nécessaire d'administration du commerce.
La solution d'IDELVION ne doit pas être diluée.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Numéro d’autorisation65743 (Swissmedic)
PrésentationUn flacon à:
250 UI de poudre avec solvant (2,5 ml) (B)
500 UI de poudre avec solvant (2,5 ml) (B)
1000 UI de poudre avec solvant (2,5 ml) (B)
2000 UI de poudre avec solvant (5 ml) (B)
3500 UI de poudre avec solvant (5 ml) (B)
Pour chaque flacon:
1 dispositif de transfert 20/20
1 set d'administration (carton intérieur):
1 nécessaire de ponction veineuse
2 tampons imbibés d'alcool
1 pansement non stérile
1 seringue à usage unique
Titulaire de l’autorisationCSL Behring Lengnau AG, Lengnau
Mise à jour de l’informationAoût 2025
|









