CompositionPrincipes actifs
Octocog alpha (facteur VIII de coagulation recombinant [rFVIII]), produit à partir de cellules rénales de baby-hamster, dans lesquelles le gène du facteur VIII humain a été introduit.
Excipients
Poudre: Glycinum, Natrii chloridum (contient 1.9 mg de sodium/flacon pour 500, 1000 UI/3.6 mg de sodium/flacon pour 2000 UI), Calcii chloridum dihydricum, Histidinum, Saccharum, Polysorbate 80 (produit à partir de maїs génétiquement modifié, Zea mays).
Solvant: 2,5 ml d'Aqua ad injectabilia (pour 500 UI, 1000 UI)/5 ml d'Aqua ad injectabilia (pour 2000 UI).
Indications/Possibilités d’emploiTraitement et prophylaxie des hémorragies chez les patients de tous âges atteints d'hémophilie A (carence héréditaire en facteur VIII de la coagulation).
Kovaltry ne contient pas de facteur de von Willebrand et n'est par conséquent pas adapté au traitement du syndrome de von Willebrand-Jürgens.
Posologie/Mode d’emploiLa posologie et la durée de la substitution du facteur VIII dépendent du besoin individuel du patient (de son poids, du degré de carence en facteur VIII, de la localisation et de l'intensité de l'hémorragie, du titre des anticorps et du taux plasmatique de facteur VIII souhaité).
Le calcul de la posologie nécessaire de facteur VIII repose sur l'analyse empirique établissant que l'administration de 1 UI de facteur VIII par kg de poids corporel accroît l'activité du facteur VIII dans le plasma de 1,5% à 2,5% – rapportée à la valeur normale.
L'action clinique du facteur VIII est l'élément le plus important pour évaluer l'efficacité du traitement.
Dans certaines circonstances, il peut s'avérer nécessaire de calculer des posologies supérieures de Kovaltry pour obtenir des résultats cliniques satisfaisants. Si la concentration attendue en facteur VIII n'est pas obtenue, ou si l'hémorragie n'est pas maîtrisée par la dose calculée, il faut penser à l'existence d'un inhibiteur du facteur VIII. Les examens de laboratoire appropriés doivent prouver la présence de tels inhibiteurs et permettre d'établir leur taux. Toutefois, la dose nécessaire de Kovaltry varie beaucoup en présence d'inhibiteurs et il est seulement possible de la déterminer à partir de la réponse clinique.
Pour garantir la traçabilité des médicaments produits par biotechnologie, il est recommandé de consigner le nom de spécialité et le numéro de lot pour chaque traitement.
Traitement à la demande
La formule suivante permet de calculer la dose nécessaire:
Unités nécessaires (UI) = poids corporel (kg) x accroissement souhaité du facteur VIII (% ou UI/dl) x valeur inverse de la récupération observée.
La dose unique usuelle est de 10 à 30 UI/kg de poids corporel. En cas d'hémorragies engageant le pronostic vital ou sévères, des posologies supérieures sont recommandées.
Chez les patients associés à une récupération inférieure à 2 [kg/dl] (par exemple chez les enfants en bas âge), des doses supérieures s'imposent dans certains cas.
Le tableau suivant (Tableau 1) présente les valeurs indicatives de la limite inférieure de l'activité en facteur VIII (en % de la norme) chez l'adulte et l'enfant, au-dessous de laquelle on ne devrait pas descendre durant le laps de temps indiqué:
|
Intensité de l'hémorragie/type
d'intervention chirurgicale
|
Taux plasmatique de facteur VIII requis
(%) (UI/dl)
|
Fréquence d'administration (heures)/durée du traitement (jours)
| |
Hémorragies
| |
Hémorragies légères (stades précoces d'hémarthroses, hémorragies musculaires légères, hémorragies de la cavité buccale)
|
20–40
|
Répéter l'injection toutes les 12 à 24 heures, minimum 1 jour, jusqu'à l'arrêt de l'hémorragie (signalée par des douleurs) ou la cicatrisation.
| |
Hémorragies modérées à sévères (hémarthroses marquées, hémorragies musculaires ou hématomes)
|
30–60
|
Répéter l'injection toutes les 12 à 24 heures, pendant 3 à 4 jours ou plus jusqu'à la disparition des douleurs ou de l'invalidité.
| |
Hémorragies engageant le pronostic vital
|
60–100
|
Répéter l'injection toutes les 8 à 24 heures jusqu'à la disparition de la menace pour le patient.
| |
Interventions chirurgicales
| |
Interventions mineures y compris extractions dentaires
|
30–60
|
Injection toutes les 24 heures, minimum 1 jour, jusqu'à la cicatrisation.
| |
Interventions majeures
|
80–100 (pré- et postopératoire)
|
Répéter l'injection toutes les 8 à 24 heures jusqu'à une cicatrisation suffisante; puis poursuivre pendant au moins 7 jours pour maintenir une activité du facteur VIII de 30%-60%.
|
Prophylaxie chez l'adolescent et l'adulte
Pour le traitement prophylactique au long cours des hémorragies chez les patients atteints d'hémophilie A sévère, on recommande 20 à 40 UI/kg de poids corporel deux ou trois fois par semaine.
Dans certains cas, particulièrement chez les patients jeunes, des intervalles plus rapprochés entre les administrations ou des doses uniques plus élevées peuvent se révéler nécessaires.
Mode et durée d'administration
Après dissolution dans le solvant fourni, Kovaltry est administré par voie intraveineuse. Le débit de perfusion dépendra d'une réponse propre à chaque patient.
Instructions posologiques particulières
Patients présentant des troubles de la fonction rénale/Patients présentant des troubles de la fonction hépatique:
L'ajustement posologique chez les insuffisants rénaux/hépatique n'a fait l'objet d'aucune étude clinique.
Enfants et adolescents:
Kovaltry se prête à l'utilisation chez l'enfant et l'adolescent. Des études de la sécurité d'emploi et de l'efficacité ont été menées chez des enfants de 0 à 12 ans. La dose recommandée dans le cadre de la prophylaxie est de 20 à 50 UI/kg de poids corporel 2 fois par semaine, 3 fois par semaine ou tous les deux jours en fonction des besoins individuels. Les recommandations posologiques pour les patients de plus de 12 ans correspondent aux recommandations émises pour l'adulte.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients.
Allergies connues aux protéines de souris ou de hamster.
Mises en garde et précautionsHypersensibilité aux protéines de souris ou de hamster
Kovaltry peut contenir des traces de protéines de souris ou de hamster. Chez certains patients, ces protéines peuvent provoquer des réactions allergiques; des réactions allergiques d'hypersensibilité sont possibles. Les patients doivent être mis au courant des éventuels symptômes initiaux d'une réaction d'hypersensibilité ou anaphylactique pendant la perfusion (oppression thoracique, vertige, chute tensionnelle modérée, nausée). Mettre en route un traitement symptomatique de la réaction d'hypersensibilité sous la forme qui s'impose. Les réactions allergiques ou anaphylactiques exigent une interruption immédiate de l'injection/perfusion. En cas de choc, le traitement médical standard de l'état de choc doit être mis en œuvre.
Inhibiteurs
La formation d'anticorps neutralisant du facteur VIII (facteurs inhibiteurs) est une complication connue du traitement de patients atteints d'hémophilie A. Ces inhibiteurs sont toujours des immunoglobulines IgG dirigées contre l'activité procoagulatrice du facteur VIII, qui est exprimée en unités Bethesda modifiées (B.E.). Le risque de développer des inhibiteurs est corrélé à l'exposition au facteur de coagulation VIII ainsi qu'à d'autres facteurs génétiques et environnementaux, ce risque étant le plus important au cours des 20 premiers jours de l'exposition. Des inhibiteurs ne se développent que rarement après plus de 100 jours d'exposition. Les patients ayant été traités par le facteur VIII recombinant devraient être surveillés étroitement sur le plan clinique et subir des tests de laboratoire adéquats pour détecter la formation d'inhibiteurs.
Infections sur cathéter
Des infections sur cathéter peuvent se produire si Kovaltry est administré par le biais d'un cathéter central (voie veineuse centrale, VVC). De telles infections ne sont pas intrinsèquement liées au médicament.
Affections cardiovasculaires
Dès la normalisation de leur coagulation sous le traitement par le facteur VIII, les patients atteints d'hémophilie et présentant des facteurs de risque cardiovasculaires ou une affection cardiovasculaire ont le même risque d'événement cardiovasculaire que les patients sans hémophilie. Sur ce point, il convient d'évaluer les facteurs de risque cardiovasculaires.
Remarques particulières
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon, c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsAucune interaction médicamenteuse des produits à base de facteur VIII humain de coagulation n'a encore été décrite.
Grossesse, allaitementAucune étude expérimentale sur la reproduction sous facteur VIII n'a été menée sur l'animal.
En raison de la très grande rareté de l'hémophilie A chez la femme, aucune expérience de l'utilisation du facteur VIII durant la grossesse et l'allaitement n'est disponible. Le facteur VIII ne devrait donc être utilisé durant la grossesse et l'allaitement que sous indication stricte.
Effet sur l’aptitude à la conduite et l’utilisation de machinesKovaltry n'a aucune influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesLes données sur le profil de sécurité d'emploi de Kovaltry se basent sur au total 236 patients (193 PTP, 43 PUP/MTP) issus de trois études de phase III. La durée médiane de l'étude pour la population d'analyse de la sécurité d'emploi était de 558 jours (plage de valeurs: 14 – 2 436 jours) avec une médiane de 183 jours d'exposition (plage de valeurs: 1 – 1 230 jours d'exposition). La majorité des patients (n = 201 sur 236 resp. 85 %) ont accumulé ≥100 jours d'exposition. Le nombre total de jours d'exposition pour tous les traitements (prophylaxie, traitement à la demande, prise en charge périopératoire, études pharmacocinétiques (PK) et inductions d'une immunotolérance) était de 65 029 jours d'exposition, dont 59 585 jours d'exposition pour la prophylaxie. Les participants de l'étude qui ont reçu Kovaltry dans le cadre de la prise en charge périopératoire (n = 5) avec des périodes de traitement de 2-3 semaines, et ceux qui ont reçu des doses uniques de Kovaltry dans le cadre des études PK (n = 6), ont été exclus de la population cumulée d'analyse de la sécurité d'emploi. L'effet indésirable le plus fréquent dans la population cumulée était la fièvre (9,3 %), les céphalées (8,5 %) et les éruptions (5,5 %). L'effet indésirable le plus fréquent chez les PUP/MTP était l'inhibition du facteur VIII (voir également «Description d'effets indésirables spécifiques/Immunogénicité»).
Les effets indésirables survenus dans le cadre d'études cliniques sont synthétisés ci-après par système d'organes et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à < 1/10), «occasionnels» (≥1/1000 à < 1/100), «rares» (≥1/10 000 à < 1/1000), «très rares» (< 1/10 000).
Affections hématologiques et du système lymphatique
Occasionels: lymphadénopathie.
Affections du système immunitaire
Très fréquents: inhibition du facteur VIII chez les PUP/MTP.
Occasionnels: réactions d'hypersensibilité, inhibition du facteur VIII chez les PTP.
Affections psychiatriques
Fréquents: insomnie.
Affections du système nerveux
Fréquents: céphalées, vertiges.
Occasionnels: dysgueusie (altération du goût).
Affections cardiaques
Occasionels: palpitations (tachycardie), tachycardie sinusale.
Affections vasculaires
Occasionnels: bouffées de chaleur.
Affections gastro-intestinales
Fréquents: maux de ventre, douleurs abdominales, dyspepsie.
Affections de la peau et du tissu sous-cutané
Fréquents: prurit (démangeaisons), éruptions cutanées, urticaire.
Occasionnels: dermatite allergique.
Troubles généraux et anomalies au site d'administration
Fréquents: fièvre, réactions locales au site d'injection (extravasation, hématome, douleurs au site d'injection, démangeaisons, gonflements).
Occasionels: douleurs dans la poitrine, gêne thoracique.
Description d'effets indésirables spécifiques
Inhibition du facteur VIII chez les PTP (population cumulée de l'étude n = 193).
Immunogénicité
L'immunogénicité de Kovaltry a été étudiée auprès de patients prétraités (193 PTP) et de 37 PUP/6 MTP. Dans le cadre d'études cliniques menées sur Kovaltry auprès d'environ 200 patients pédiatriques et adultes atteints d'hémophilie A sévère (facteur VIII < 1%) qui avaient été prétraités ≥50 jours d'exposition par concentrés de facteur VIII, un cas de titre d'inhibiteurs temporairement faible a été rapporté. Chez un PTP âgé de 13 ans, un titre maximal de 1,0 B.E. a été mesuré après 549 jours d'exposition en parallèle avec une infection aiguë et des anticorps anti-cardiolipine IgG positifs. La récupération du facteur VIII était normale (2,7 UI/dl et UI/kg).
Dans l'étude clinique réalisée auprès de patients non prétraités (PUP) et de patients prétraités minimalement (MTP) (définis comme ayant été exposés ≤3 jours à une préparation de facteur VIII au moment de l'inclusion dans l'étude), on a détecté chez 23 des 42 patients des inhibiteurs du facteur VIII, avec une médiane (plage de valeurs) de 9 (4-42) jours d'exposition au moment de la première analyse positive d'inhibiteurs. 6 de ces 23 patients présentaient un titre d'inhibiteurs faible (≤5,0 B.E.), tandis que 17 patients présentaient un titre élevé (≥5,0 B.E.). Chez les patients ayant développé un titre d'inhibiteurs élevé, les données disponibles sur les mutations du FVIII ont permis de détecter des mutations à haut risque de survenue d'inhibiteurs chez 12 patients sur 14.
Dans le cadre d'études cliniques menées auprès de 51 patients prétraités (PTP) pédiatriques, aucune différence entre les enfants et les adultes n'a été constatée sur le plan de la fréquence, du type et de la gravité des effets indésirables.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageAucun symptôme de surdosage par Kovaltry n'a été décrit à ce jour.
Propriétés/EffetsCode ATC:
B02BD02
Mécanisme d'action
Kovaltry est un concentré stérile, stable, purifié, apyrogène et lyophilisé, produit à partir de cellules rénales de baby hamster dans lesquelles le gène du facteur VIII humain de coagulation a été introduit.
L'activité (UI) est déterminée par test chromogénique; l'activité spécifique de Kovaltry est de 4000 UI/mg de protéine. L'administration de Kovaltry donne lieu à l'augmentation du taux plasmatique du facteur VIII, ce qui permet d'atteindre une correction temporaire du déficit en facteur VIII et de la tendance aux hémorragies.
Le temps partiel de thromboplastine activée (aPTT) est prolongé dans l'hémophilie. La détermination conventionnelle de l'activité biologique du facteur VIII dans le plasma des patients (dosage chronométrique en un temps) repose sur l'aPTT. Une normalisation comparable de l'aPTT s'observe après le traitement par facteur VIII recombinant ou par facteur VIII extrait de plasma.
Pharmacodynamique
Voir la rubrique «Mécanisme d'action»
Efficacité clinique
Traitement et prophylaxie des hémorragies chez les patients (de tous âges) atteints d'hémophilie A
Trois études internationales et multicentriques de Phase III ont été menées auprès de patients prétraités pédiatriques, adolescents et adultes atteints d'hémophilie A sévère (facteur VIII < 1%).
Au total, 247 patients (204 PTP, 37 PUP/6 MTP) ont été traités dans le cadre du programme d'étude: 153 patients ≥12 ans et 94 patients < 12 ans. 208 patients (174 PTP, 31 PUP/3MTP) ont été traités pendant au moins 12 mois et 98 d'entre eux (78 PTP, 19 PUP/1MTP) sur une durée de 24 mois.
Etude 1:
Dans le cadre de cette étude multicentrique, ouverte, non contrôlée et randomisée, on a examiné la pharmacocinétique, la sécurité d'emploi et l'efficacité d'un traitement prophylactique et d'une hémostase lors d'interventions chirurgicales réalisées sur 73 patients de 12 à 61 ans. L'étude s'est étendue sur un an avec une extension facultative d'un an de plus. Les patients suivant le traitement prophylactique (n = 62) ont reçu une dose médiane de 35 UI/kg (24 à 43 UI/kg) (2 x par semaine) ou 31 UI/kg (21 à 42 UI/kg) (3 x par semaine). Le taux médian annuel d'hémorragie chez les patients sous traitement prophylactique atteignait 1,0 (2 x par semaine) ou 2,0 (3 x par semaine). 86,3% des hémorragies ont pu être traitées avec ≤2 perfusions. Au sein du groupe de patients ayant subi des interventions chirurgicales, l'efficacité hémostatique a été jugée bonne, voire excellente pour toutes les interventions (12 majeures, 26 mineures).
Etude 2:
Dans le cadre d'une autre étude multicentrique, ouverte, non contrôlée et randomisée, le traitement prophylactique a fait l'objet d'une comparaison avec le traitement à la demande sur une période de traitement d'un an parmi 80 patients de 14 à 59 ans qui avaient auparavant été traités à la demande. Les patients ont été randomisés au sein de groupes de traitement à la demande (n = 21; posologie au gré du médecin investigateur) ou prophylactique (2 x 20 à 30 UI/kg par semaine, n = 28 ou 3 x 30 à 40 UI/kg, n = 31).
Dans le cadre de la prophylaxie, les patients ont reçu une dose médiane de 30 UI/kg (21 à 34 UI/kg, faible dose, 2 x par semaine) ou 37 UI/kg (30 à 42 UI/kg, dose élevée, 3 x par semaine) et dans celui du traitement à la demande 28 UI/kg (11 à 49 UI/kg).
Le taux médian annuel d'hémorragie des patients sous traitement prophylactique était de 4,0 (2 x par semaine) ou 2,0 (3 x par semaine) contre 60,0 pour les patients sous traitement à la demande. 95,5% des hémorragies ont pu être traitées avec ≤2 perfusions. Pour toutes les interventions chirurgicales (1 majeure, 20 mineures), l'efficacité hémostatique a été jugée bonne, voire excellente.
Etude 3:
Dans le cadre de cette étude multicentrique, ouverte et non contrôlée, on a examiné la sécurité d'emploi, l'efficacité, la pharmacocinétique ainsi que la prise en charge périopératoire de l'hémostase lors des interventions chirurgicales sur 51 patients prétraités (≥50 jours d'exposition) de moins de 12 ans (n = 25 de 1 à 5 ans [âge moyen de 3,8 ans]; n = 26 de 6 à 11 ans [âge moyen de 8,8 ans]) (étude 3, partie A). La posologie médiane était de 36 UI/kg (âge < 6 ans) et de 32 UI/kg (âge ≥6 ans). Au sein de la tranche d'âge de < 6 ans à ≥6 ans, l'efficacité de Kovaltry a été jugée bonne, voire excellente pour 97,8% ou 81,0% des hémorragies traitées, moyenne pour 0% à 18,9% d'entre elles et mauvaise pour 2,3 ou 0% d'entre elles.
Dans le cadre de l'étude clinique menée auprès de PUP et de MTP âgés de moins de 6 ans (étude 3, partie B), 43 patients (37 PUP/6 MTP) ont au total été évalués. La posologie médiane était de 29 UI/kg. L'efficacité dans le traitement des hémorragies a été jugée excellente ou bonne pour 79,0% des hémorragies, moyenne pour 15,2% d'entre elles et mauvaise pour 5,7% d'entre elles.
Étude d'extension de l'étude 3
82 (46 de la partie A, 36 de la partie B) des 94 patients de l'étude 3 ont poursuivi le traitement dans le cadre de l'étude d'extension pendant une durée médiane de 3,1 ans (0,3 – 6,4). Au total (étude 3 plus extension), la durée médiane de l'étude était de 3,8 ans (0,8 – 6,7). La majorité des participants (76 sur 82, 92,7 %) ont accumulé au moins 100 jours d'exposition. Dans le cadre de l'étude d'extension, 67 patients ont reçu un traitement prophylactique à une posologie médiane de 34 UI/kg (16 – 57 UI/kg). La fréquence d'administration du traitement était majoritairement de 2 fois par semaine pour la plupart des patients (61 sur 67,91 %). Le taux médian annuel d'hémorragie observé en l'espace de 48 heures après l'injection chez les patients sous traitement prophylactique était de 0,7 (0,0 – 1,9), le taux médian annuel d'hémorragie indépendamment du moment de l'injection était de 1,9 (0,3 – 3,9).
La majorité de l'ensemble des 472 hémorragies (394 sur 472, 83,5 %) ont été traitées par 1-2 perfusions de Kovaltry. L'efficacité a été jugée excellente ou bonne dans la plupart des cas (415 sur 472, 87,9 %).
PharmacocinétiqueAbsorption
La substance de la préparation est immédiatement et complètement disponible après administration intraveineuse.
Distribution
voir «Absorption»
Métabolisme
voir «Élimination»
Élimination
Après administration de Kovaltry, l'élimination du facteur VIII du plasma est biphasique, avec une demi-vie cliniquement significative, comparable à la demi-vie terminale moyenne du facteur VIII plasmatique (env. 13 heures).
Cinétique pour certains groupes de patients
Les propriétés pharmacocinétiques (PK) de Kovaltry ont été étudiées chez l'adulte, l'adolescent et l'enfant prétraité (cf. Tableau 2). Les mesures PK répétées au bout de 6 à 12 mois de prophylaxie n'ont pas révélé de variations significatives des paramètres pharmacocinétiques après un traitement au long cours.
Tableau 2: Paramètres pharmacocinétiques (moyenne géométrique [% CV]) de Kovaltry reposant sur les résultats du dosage chromogénique
|
Paramètres [unité]
|
0 à < 6 ans
(N = 8)
|
6 à < 12 ans (N = 11)
|
12 à < 18 ans
(N = 5)
|
≥18 ans
(N = 21)
| |
ASC [UI*h/dl] a
|
1499,3 (27,6)
|
1010,5 (59,3)
|
1519,5 (30,1)
|
1989,8 (35,9)
| |
Cmax [UI/dl]
|
85,3 (36,6)
|
82,2 (24,5)
|
124,0 (46,4)
|
131,6 (15,8)
| |
t½ [h] a
|
11,8 (20,6)
|
11,0 (31,2)
|
13,7 (35,9)
|
13,8 (27,0)
| |
CL [dl/h/kg] a
|
0,032 (28,6)
|
0,049 (59,5)
|
0,033 (30,1)
|
0,025 (35,9)
| |
TSMIV [h] a
|
17,4 (19,3)
|
15,9 (37,6)
|
19,2 (28,4)
|
19,3 (27,2)
| |
Vss [dl/kg] a
|
0,56 (23,3)
|
0,79 (29,6)
|
0,63 (57,6)
|
0,49 (21,1)
| |
a
n = 7 pour les PTP de 0 à < 6 ans
|
A partir des données relatives à la PK et à la récupération établies à partir de 183 patients issus de 3 études cliniques, une analyse de la population a été effectuée pour Kovaltry. L'analyse de toutes les récupérations in vivo (RIV) des patients prétraités adultes/adolescents a révélé une hausse médiane du facteur VIII: C de > 2 UI/dl par UI/kg de poids corporel (cf. Tableau 3). Cette valeur est semblable aux valeurs communiquées pour le facteur VIII extrait de plasma humain. Pour les enfants et adolescents, les valeurs médianes de la récupération in vivo étaient de 1,6 kg/dl (de 0 à < 6 ans) ou de 1,8 kg/dl (de 6 à 12 ans). Au cours de la phase de traitement de 6 à 12 mois, on n'a pas enregistré de variations significatives.
Tableau 3: récupération in vivo (kg/dl)
|
|
Leopold Kids, Partie A
|
Leopold I + II
| |
Tranche d'âge
|
0 à < 6 ans
|
6 à 12 ans
|
≥12 ans
| |
Nombre de patients
|
N = 24
|
N = 25
|
N = 115
| |
Valeurs du dosage chromogénique
Médiane; (T1; T3) (kg/dl)
|
Début a 1,6 (1,3; 1,9)
Fin a 1,8 (1,4; 2,0)
|
Début a 1,7 (1,4; 2,0)
Fin a 1,8 (1,2; 2,1)
|
2,3 (1,8; 2,6)
| |
Valeurs du dosage en un temps
Médiane; (T1; T3) (kg/dl)
|
--
|
--
|
2,2 (1,8; 2,4)
| |
a
Début et fin de la période d'étude de 6 mois
|
Données précliniquesDes études non cliniques visant à déterminer l'efficacité de Kovaltry sur des modèles de souris atteints d'hémophilie A ont permis de mettre en évidence la restauration de l'hémostase. Les examens précliniques de la sécurité d'emploi, la toxicité aiguë, la toxicité après une administration répétée et la génotoxicité n'ont pas permis d'émettre des réserves quant à la sécurité d'emploi chez l'homme.
Le développement embryonnaire/fœtal n'a pas fait l'objet d'études expérimentales sur l'animal, car le facteur VIII est une protéine endogène de substitution et en outre, la population de patients est essentiellement masculine.
Pour les études sur la toxicité en cas d'administration répétée, on n'a pas observé d'effet sur les organes masculins de reproduction. Aucun effet de cette protéine endogène n'a été constaté sur la fertilité humaine.
Le test de dépistage sur lignées cellulaires de lymphome de souris n'a mis en évidence aucune génotoxicité de Kovaltry.
Aucune étude de carcinogénicité n'a été menée, parce que le facteur VIII est une protéine endogène de substitution et le facteur VIII recombinant ne démontre en aucun cas un potentiel génotoxique ou carcinogène.
Dans le cadre d'études impliquant l'administration de doses uniques et multiples à des rats, des lapins et des chiens, aucune toxicité n'a été mise en évidence pour les doses qui étaient plusieurs fois supérieures à la dose clinique recommandée (rapportée au poids corporel).
Remarques particulièresIncompatibilités
Kovaltry ne peut pas être mélangé à d'autres médicaments et solutions à perfuser.
Influence sur les méthodes de diagnostic
Voir la rubrique «Mécanisme d'action»
Stabilité
La date figurant sur l'emballage sous «EXP» ne peut en aucun cas être dépassée. La solution prête à l'emploi doit être utilisée dans les 3 heures.
Remarques particulières concernant le stockage
Conserver dans l'emballage d'origine au réfrigérateur (2-8 °C). Protéger de la lumière. Ne pas congeler.
La poudre lyophilisée peut être conservée à température ambiante (15-25 °C) pour un temps limité de 12 mois. Si Kovaltry est conservé hors du réfrigérateur, il faut noter la date de sortie, et indiquer la nouvelle date de péremption sur l'emballage et le flacon perforable. Dans ce cas, le produit sera périmé au terme de la période de 12 mois. Cette nouvelle date de péremption ne peut cependant en aucun cas être postérieure à la date indiquée sur l'emballage sous «EXP». Si Kovaltry a été stocké à température ambiante, on ne peut pas le remettre au réfrigérateur pour le conserver.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Si l'un des composants de l'emballage est ouvert ou endommagé, il ne faut pas l'utiliser.
Lors de la reconstitution de la solution, et de son injection i.v. peu après, veillez au respect des conditions d'asepsie.
Avant l'emploi, il faut s'assurer que le médicament à utiliser par voie parentérale ne présente ni particules, ni colorations. Ne pas utiliser Kovaltry si après la préparation de la solution, on remarque qu'elle contient des particules ou qu'elle est trouble.
Il faut préparer et utiliser Kovaltry avec les composants fournis, car une adsorption du facteur VIII humain de coagulation au niveau des surfaces internes d'un certain nombre de sets de perfusion peut engendrer une réduction de la dose injectée de facteur VIII.
Avant l'application, il faut filtrer la solution prête à l'emploi en utilisant l'embout fourni à filtre intégré qui retient les particules éventuellement présentes.
Le dispositif d'injection fourni ne doit pas être utilisé pour effectuer des prises de sang, car il contient un filtre in-line. Si une prise de sang est nécessaire avant la perfusion de Kovaltry, il convient d'utiliser un dispositif d'injection sans filtre.
Manipulation de l'embout et du dispositif d'injection (embout)
Toutes les étapes ne sont pas illustrées. Veuillez absolument tenir compte du texte.
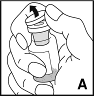
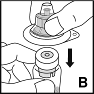
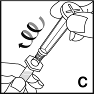


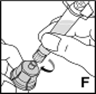

1.Se laver soigneusement les mains à l'eau et au savon. Travailler sur une surface propre.
2.Réchauffer le flacon du produit non ouvert et la seringue remplie de solvant entre les mains environ à la température du corps (37 °C au plus). Essuyer les traces d'humidité visibles sur le flacon du produit.
3.Retirer le capuchon du flacon de produit (A) et nettoyer le bouchon en caoutchouc avec un tampon imbibé d'alcool (ou utiliser un spray désinfectant).
4.Poser le flacon sur une surface stable et antidérapante. Enlever l'opercule de l'emballage de l'embout, mais ne pas l'extraire de l'emballage. Bien tenir l'emballage de l'embout, le placer au-dessus du flacon perforable contenant la poudre et bien enfoncer l'embout sur le flacon (B). L'embout s'enclenche sur le capuchon du flacon. A ce moment-là, il ne faut pas encore enlever l'emballage de l'embout.
5.Sortir la seringue contenant la solution de dilution et maintenir droite cette seringue remplie d'eau. Prendre le piston comme indiqué en image et le visser dans le sens horaire sur le bouchon fileté (C).
6.Bien tenir le cylindre de la seringue et enlever le capuchon de sa pointe (D). Ne plus toucher la pointe de la seringue avec les mains ou une quelconque surface. Mettre la seringue de côté pour l'utiliser plus tard.
7.Retirer alors l'emballage de l'embout et le jeter (E).
8.Visser désormais la seringue dans le filetage de l'embout dans le sens horaire (F).
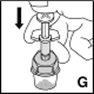
9.Appuyer lentement pour faire passer le solvant dans le flacon de produit (G).
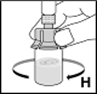
10.Dissoudre la poudre d'un mouvement circulaire (H). Ne pas secouer le flacon! S'assurer que la poudre soit complètement dissoute. Ne pas utiliser de solutions contenant des particules visibles ou de solutions troubles.
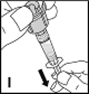
11.Maintenir le flacon, son embout et la seringue vers le haut (I) et remplir la seringue en tirant doucement et lentement sur le piston. S'assurer que le contenu du flacon est passé en totalité dans la seringue. Faire sortir les bulles d'air de la seringue.
12.S'il faut plus d'une dose, préparer la quantité de produit souhaitée. Pour cela, répéter les étapes 2 à 11.
13.Poser un garrot. Choisir le point d'injection, nettoyer l'endroit avec un tampon imbibé d'alcool et préparer la peau au moyen d'un antiseptique. Piquer la veine et fixer le dispositif d'injection à l'aide d'un sparadrap.
14.Dévisser la seringue de l'embout du flacon, et ce sans déplacer le piston (l'embout du flacon doit rester sur le flacon perforable).
15.Raccorder la seringue au dispositif d'injection par une rotation sur la droite et éviter que du sang n'entre dans la seringue (J).
16.Retirer le garrot!
17.Injecter la solution en intraveineuse sur plusieurs minutes tout en surveillant la position de l'aiguille! La vitesse d'administration est adaptée au niveau de confort du patient (vitesse maximale de perfusion: 2 ml/min).
18.Si une dose supplémentaire doit être administrée, retirer la seringue vide par une rotation sur la gauche et raccorder une nouvelle seringue prête au dispositif d'injection.
19.Si aucune autre dose n'est nécessaire, retirer le dispositif d'injection en même temps que la seringue. Maintenir fermement une compresse sur le bras tendu au niveau du point d'injection pendant environ 2 minutes. Poser finalement un petit pansement compressif et, si nécessaire, un sparadrap sur le point d'injection.
Numéro d’autorisation65773 (Swissmedic).
PrésentationKovaltry 500 UI (B)
1 flacon perforable avec embout et poudre contenant 500 UI d'octocog alpha.
1 seringue pré-remplie avec solvant (2,5 ml d'eau pour injection) et piston emballé séparément.
1 dispositif d'injection
Kovaltry 1000 UI (B)
1 flacon perforable avec embout et poudre contenant 1000 UI d'octocog alpha.
1 seringue pré-remplie avec solvant (2,5 ml d'eau pour injection) et piston emballé séparément.
1 dispositif d'injection
Kovaltry 2000 UI (B)
1 flacon perforable avec embout et poudre contenant 2000 UI d'octocog alpha.
1 seringue pré-remplie avec solvant (5 ml d'eau pour injection) et piston emballé séparément.
1 dispositif d'injection
Titulaire de l’autorisationBayer (Schweiz) AG, 8045 Zurich.
Mise à jour de l’informationJanvier 2022.
|










