CompositionPrincipes actifs:
Nucléides mère et fille:
Radionucléide parent 99Mo
Radionucléide de filiation 99mTc
Excipients
Matériaux de la colonne de chromatographie:
·Colonne de chromatographie en verre contenant de l'alumine
·Acide nitrique pour l'adaptation du pH
·Hydroxyde de sodium pour l'adaptation du pH
1 ml de solution de [99mTc]pertechnétate de sodium contient 3,6 mg de sodium.
En fonction du moment de l'administration de l'injection, la teneur en sodium administrée au patient peut dans certains cas être supérieure à 1 mmol
(23 mg). Il convient d'en tenir compte chez les patients qui doivent suivre un régime pauvre en sel.
Flacons-ampoules contenant une solution antibactérienne:
·Bromure de benzododécinium
·Eau pour préparations injectables
Flacons-ampoules contenant l'éluant:
·Chlorure de sodium
·Eau pour préparations injectables
Flacons-ampoules sous vide
Spécifications
Pureté du radionucléide (monographie 0124 «Solution injectable de pertechnétate (99mTc) de sodium obtenu par fission» de la Pharmacopée européenne, édition en vigueur):
• Iode-131: au maximum 5 × 10−3 pour cent de la radioactivité totale.
• Molybdène-99: au maximum 0,1 pour cent de la radioactivité totale (correspondant au maximum à 1 kBq 99Mo/MBq 99mTc)
• Ruthénium-103: au maximum 5 × 10−3 pour cent de la radioactivité totale
• Strontium-89: au maximum 6 × 10−6 pour cent de la radioactivité totale
• Strontium-90: au maximum 6 × 10−6 pour cent de la radioactivité totale
• Autres radionucléides émetteurs de rayons gamma: au maximum 0,01 pour cent de la radioactivité totale
• Radionucléides émetteurs de rayons alpha: au maximum 1 × 10−7 pour cent de la radioactivité totale
Pureté radiochimique (monographie 0124 «Solution injectable de pertechnétate (99mTc) de sodium obtenu par fission» de la Pharmacopée européenne, édition en vigueur):
Ion pertechnétate (99mTc): au minimum 95 pour cent de la radioactivité totale due au technétium-99m
Indications/Possibilités d'emploiCe médicament est à usage diagnostique uniquement.
L'éluat du générateur (solution injectable de pertechnétate [99mTc] de sodium) est indiqué pour les utilisations suivantes:
·Radiomarquage de trousses pour préparations radiopharmaceutiques développées et autorisées pour le marquage avec une telle solution.
·Scintigraphie thyroïdienne: imagerie directe et mesure de la fixation thyroïdienne permettant d'obtenir des informations sur la taille, la position, la nodularité et la fonction de la glande dans les affections thyroïdiennes.
·Scintigraphie des glandes salivaires: diagnostic des sialadénites chroniques (p.ex syndrome de Sjögren) ainsi qu'évaluation de la fonction des glandes salivaires et des éventuelles obstructions canalaires dans les troubles des glandes salivaires.
·Localisation de muqueuse gastrique ectopique (diverticule de Meckel).
·Scintigraphie des canaux lacrymaux: pour l'évaluation des troubles du flux lacrymal et le suivi de la réponse aux interventions thérapeutiques.
Posologie/Mode d'emploiCe médicament radiopharmaceutique doit être utilisé exclusivement dans un service de médecine nucléaire, par le personnel autorisé.
Posologie
Lorsque le pertechnétate (99mTc) de sodium est administré par voie intraveineuse, les activités (administrées) peuvent largement varier selon les informations cliniques recherchées et l'appareillage utilisé. L'injection d'activités supérieures aux niveaux de référence diagnostiques localement applicables doit être justifiée pour l'indication en question. Les activités recommandées sont les suivantes:
Adultes (70 kg) et patients âgés
·Scintigraphie thyroïdienne: 20-80 MBq (1 MBq/kg)
·Scintigraphie des glandes salivaires: 30-150 MBq (2 MBq/kg)
·Scintigraphie du diverticule de Meckel: 200 MBq (2 MBq/kg)
·Scintigraphie des canaux lacrymaux: 2-4 MBq par goutte pour chaque œil
Tableau des NRD conformément à L-08-01 (OFSP)
|
Examen
|
NRD (activité) pour 70 kg [MBq]
| |
Thyroïde
|
75
| |
Diverticule de Meckel
|
180
|
Insuffisance rénale
La radioactivité à administrer doit être déterminée avec un soin particulier parce que ces patients risquent d'être exposés de façon accrue aux radiations.
Population pédiatrique
L'utilisation chez l'enfant et l'adolescent doit être envisagée avec prudence en évaluant soigneusement la nécessité clinique et le rapport avantages-risques.
Les activités à administrer doivent être ajustées chez l'enfant et l'adolescent; elles peuvent être calculées conformément aux recommandations de la carte posologique pour patients pédiatriques publiée par l'association européenne de médecine nucléaire (EANM 1.2.2014 et «joint EANM/SNM recommandations»). Les activités minimales utilisées peuvent être réduites selon la caméra et le collimateur utilisés. Les activités à administrer aux enfants et aux adolescents peuvent être calculées par multiplication des activités de base (à des fins de calcul) par le facteur de correction indiqué pour le poids du patient (voir le tableau 2).
A[MBq]administrée = activité de base × facteur
Scintigraphie thyroïdienne: Activité administrée [MBq] = 5,6 MBq x facteur de correction (tableau 2). L'activité minimale utilisée (10 MBq) devrait pouvoir être réduite en utilisant le bon équipement pour des images de diagnostic avec 4 MBq chez le nouveau-né.
Identification/localisation d'une muqueuse gastrique ectopique: Activité administrée [MBq] = 10,5 MBq x facteur de correction (tableau 2). Une activité minimale de 20 MBq est nécessaire pour obtenir des images de qualité satisfaisante.
Tableau 1:
Activité de base pour l'utilisation chez l'enfant (pour la scintigraphie thyroïdienne et pour l'identification/localisation d'une muqueuse gastrique ectopique) conformément aux directives de l'EANM (février 2014)
|
Indication
|
Activité de base
|
Activité minimale recommandée
| |
Muqueuse gastrique ectopique
|
10,5
|
20
| |
Glande thyroïde
|
5,6
|
10
|
Tableau 2: Facteurs de correction en fonction du poids pour l'utilisation chez l'enfant (pour la scintigraphie thyroïdienne et pour l'identification/localisation d'une muqueuse gastrique ectopique) conformément aux directives de l'EANM (février 2014)
|
Poids
[kg]
|
Facteur
|
Poids [kg]
|
Facteur
|
Poids [kg]
|
Facteur
| |
3
|
1
|
22
|
5,29
|
42
|
9,14
| |
4
|
1,14
|
24
|
5,71
|
44
|
9,57
| |
6
|
1,71
|
26
|
6,14
|
46
|
10,00
| |
8
|
2,14
|
28
|
6,43
|
48
|
10,29
| |
10
|
2,71
|
30
|
6,86
|
50
|
10,71
| |
12
|
3,14
|
32
|
7,29
|
52-54
|
11,29
| |
14
|
3,57
|
34
|
7,72
|
56-58
|
12,00
| |
16
|
4,00
|
36
|
8,00
|
60-62
|
12,71
| |
18
|
4,43
|
38
|
8,43
|
64-66
|
13,43
| |
20
|
4,86
|
40
|
8,86
|
68
|
14,00
|
A[MBq]administrée = activité de base x facteur
Pour le calcul de l'activité à administrer en fonction du poids, on multiplie l'activité de base par le facteur indiqué pour le poids. Si l'activité calculée est inférieure à l'activité minimale recommandée, on administrera l'activité minimale recommandée.
Les valeurs diagnostiques de référence ne doivent pas être dépassées.
Scintigraphie des canaux lacrymaux: Les recommandations posologiques s'appliquent aussi bien aux enfants qu'aux adultes.
Utilisation pour le marquage de trousses
Lors de l'utilisation de la solution de pertechnétate (99mTc) de sodium pour le radiomarquage d'une trousse, la dose doit être définie en accord avec l'information professionnelle de la trousse en question.
Mode d'administration
Pour la scintigraphie thyroïdienne, la scintigraphie des glandes salivaires et l'identification de muqueuse gastrique ectopique, la solution de pertechnétate (99mTc) de sodium est administrée par voie intraveineuse.
Pour la scintigraphie des canaux lacrymaux, des gouttes sont instillées dans chaque œil (application oculaire).
Pour les instructions concernant la préparation du médicament avant son utilisation, voir la rubrique «Remarques particulières»: «Remarques concernant la manipulation», «Instructions pour la préparation des radiopharmaceutiques». Pour la préparation du patient, voir la rubrique «Mises en garde et précautions».
Acquisition des images
Scintigraphie thyroïdienne: 20 minutes après l'injection intraveineuse.
Scintigraphie des glandes salivaires: Acquisition dynamique dans les 30 minutes suivant l'injection, avec test de provocation (au jus de citron) à 15 minutes, ou acquisition d'images dynamiques et statiques avant et après le test de provocation.
Identification/localisation de muqueuse gastrique ectopique: Immédiatement après l'injection et à intervalles réguliers pendant 30 minutes.
Scintigraphie des canaux lacrymaux: Acquisition dynamique dans les 2 minutes suivant l'instillation, puis acquisition d'images statiques à intervalles réguliers sur 20 minutes.
Exposition aux radiations
L'exposition aux radiations dépend du traitement préalable par des substances inhibitrices ainsi que du degré d'activité physique. Les valeurs estimées des doses de radiations absorbées par les différents organes après l'administration directe de pertechnétate (99mTc) de sodium chez des sujets sains sont indiquées dans les tableaux suivants. Les valeurs se rapportent à des utilisations sans administration préalable de substances inhibitrices. Les données proviennent de la publication ICRP 80 «Radiation Dose to Patients from Radiopharmaceuticals» (Addendum 2 to ICRP Publication 53).
Tableau 3: Pertechnétate sans prétraitement par une substance inhibitrice
|
Organe
|
Dose absorbée par unité d'activité administrée (µGy/MBq)
| |
|
Adultes
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
3,7
|
4,7
|
7,2
|
11
|
19
| |
Vessie
|
18
|
23
|
30
|
33
|
60
| |
Surface des os
|
5,4
|
6,6
|
9,7
|
14
|
26
| |
Cerveau
|
2,0
|
2,5
|
4,1
|
6,6
|
12
| |
Seins
|
1,8
|
2,3
|
3,4
|
5,6
|
11
| |
Vésicule biliaire
|
7,4
|
9,9
|
16
|
23
|
35
| |
Voies gastro-intestinales
|
|
|
|
|
| |
Estomac
|
26
|
34
|
48
|
78
|
160
| |
Intestin grêle
|
16
|
20
|
31
|
47
|
82
| |
Côlon
|
42
|
54
|
88
|
140
|
270
| |
Côlon supérieur
|
57
|
73
|
120
|
200
|
380
| |
Côlon inférieur
|
21
|
28
|
45
|
72
|
130
| |
Cœur
|
3,1
|
4,0
|
6,1
|
9,2
|
17
| |
Reins
|
5,0
|
6,0
|
8,7
|
13
|
21
| |
Foie
|
3,8
|
4,8
|
8,1
|
13
|
22
| |
Poumons
|
2,6
|
3,4
|
5,1
|
7,9
|
14
| |
Muscles
|
3,2
|
4,0
|
6,0
|
9,0
|
16
| |
Œsophage
|
2,4
|
3,2
|
4,7
|
7,5
|
14
| |
Ovaires
|
10
|
13
|
18
|
26
|
45
| |
Pancréas
|
5,6
|
7,3
|
11
|
16
|
27
| |
Moelle osseuse rouge
|
3,6
|
4,5
|
6,6
|
9
|
15
| |
Glande salivaire
|
9,3
|
12
|
17
|
24
|
39
| |
Peau
|
1,8
|
2,2
|
3,5
|
5,6
|
10
| |
Rate
|
4,3
|
5,4
|
8,1
|
12
|
21
| |
Testicules
|
2,8
|
3,7
|
5,8
|
8,7
|
16
| |
Thymus
|
2,4
|
3,2
|
4,7
|
7,5
|
14
| |
Thyroïde
|
22
|
36
|
55
|
120
|
220
| |
Utérus
|
8,1
|
10
|
15
|
22
|
37
| |
Autres tissus
|
3,5
|
4,3
|
6,4
|
9,6
|
17
| |
Dose efficace
µSv/MBq
|
13
|
17
|
26
|
42
|
79
|
La dose efficace résultant de l'administration intraveineuse de 400 MBq de pertechnétate (99mTc) de sodium est de 5,2 mSv pour un adulte de 70 kg.
Tableau 4: Pertechnétate après un prétraitement par une substance inhibitrice
|
Organe
|
Dose absorbée par unité d'activité administrée (µGy/MBq)
| |
|
Adultes
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
2,9
|
3,7
|
5,6
|
8,6
|
16
| |
Vessie
|
30
|
38
|
48
|
50
|
91
| |
Surface des os
|
4,4
|
5,4
|
8,1
|
12
|
22
| |
Cerveau
|
2,0
|
2,6
|
4,2
|
7,1
|
12
| |
Seins
|
1,7
|
2,2
|
3,2
|
5,2
|
10
| |
Vésicule biliaire
|
3,0
|
4,2
|
7,0
|
10
|
13
| |
Voies gastro-intestinales
|
|
|
|
|
| |
Estomac
|
2,7
|
3,6
|
5,9
|
8,6
|
15
| |
Intestin grêle
|
3,5
|
4,4
|
6,7
|
10
|
18
| |
Côlon
|
3,6
|
4,8
|
7,1
|
10
|
18
| |
Côlon supérieur
|
3,2
|
4,3
|
6,4
|
10
|
17
| |
Côlon inférieur
|
4,2
|
5,4
|
8,1
|
11
|
19
| |
Cœur
|
2,7
|
3,4
|
5,2
|
8,1
|
14
| |
Reins
|
4,4
|
5,4
|
7,7
|
11
|
19
| |
Foie
|
2,6
|
3,4
|
5,3
|
8,2
|
15
| |
Poumons
|
2,3
|
3,1
|
4,6
|
7,4
|
13
| |
Muscles
|
2,5
|
3,1
|
4,7
|
7,2
|
13
| |
Œsophage
|
2,4
|
3,1
|
4,6
|
7,5
|
14
| |
Ovaires
|
4,3
|
5,4
|
7,8
|
11
|
19
| |
Pancréas
|
3,0
|
3,9
|
5,9
|
9,3
|
16
| |
Moelle osseuse rouge
|
2,5
|
3,2
|
4,9
|
7,2
|
13
| |
Peau
|
1,6
|
2,0
|
3,2
|
5,2
|
9,7
| |
Rate
|
2,6
|
3,4
|
5,4
|
8,3
|
15
| |
Testicules
|
3,0
|
4,0
|
6,0
|
8,7
|
16
| |
Thymus
|
2,4
|
3,1
|
4,6
|
7,5
|
14
| |
Thyroïde
|
2,4
|
3,1
|
5,0
|
8,4
|
15
| |
Utérus
|
6,0
|
7,3
|
11
|
14
|
23
| |
Autres tissus
|
2,5
|
3,1
|
4,8
|
7,3
|
13
| |
Dose efficace µSv/MBq
|
4,2
|
5,4
|
7,7
|
11
|
19
|
Si une substance inhibitrice est administrée au patient avant l'utilisation, la dose efficace après l'utilisation de 400 MBq de pertechnétate (99mTc) de sodium est de 1,68 mSv. La dose de radiations absorbée par le cristallin de l'œil après l'utilisation de pertechnétate (99mTc) de sodium pour la scintigraphie des canaux lacrymaux est estimée à 38 µGy/MBq. Cela correspond à une dose efficace inférieure à 10 µSv pour une activité administrée de 4 MBq.
Irradiation externe
Tableau 5:
|
Pertector
|
Débit de dose du 99Mo/99mTc à la surface du générateur (µSv/h/GBq)
|
Débit de dose du 99Mo/99mTc
à 1 m de distance du générateur (µSv/h/GBq)
| |
Blindage de 50 mm en plomb
|
31
|
0,3
|
Des mesures au lieu de travail et durant le travail sont d'une importance centrale et doivent être réalisées pour une détermination plus précise et instructive de l'exposition totale du personnel aux radiations. Pour des raisons de radioprotection, le dispositif Pertector doit être conservé dans un blindage supplémentaire conformément à l'ordonnance sur la radioprotection.
Lorsque le générateur Pertector est livré avant sa calibration, le niveau par conséquent plus élevé de l'activité doit être pris en compte dans le cadre de l'autorisation d'utilisation (voir le tableau 7).
Le blindage supplémentaire présent de façon stationnaire chez le client doit réduire le débit de dose localement émis lors de la livraison du générateur à une dose maximale de 0,01 mSv/h à 1 m de la surface.
Débits de dose au contact du blindage d'un flacon-ampoule d'élution qui contient un éluat typique:
|
Moment de la mesure
|
Débit de dose de 99mTc
(µSv/h/GBq) à la surface
| |
Blindage en plomb
|
<0,1
| |
Blindage en verre plombé
|
<0,6
|
Contre-indications·Hypersensibilité à la substance active ou à l'un des excipients.
·Grossesse
·Allaitement
Mises en garde et précautionsMédicament radiopharmaceutique
Les médicaments radioactifs doivent être manipulés avec un soin particulier, en appliquant des mesures strictes de radioprotection afin de réduire autant que possible l'exposition du patient et du personnel aux radiations.
Toute utilisation de produits radiopharmaceutiques chez les patients relève exclusivement de la compétence et de la responsabilité d'un spécialiste en médecine nucléaire. Les examens ne sont indiqués que si leurs avantages prédominent par rapport au risque lié à une exposition aux radiations. Ceci s'applique particulièrement à l'utilisation chez l'enfant et l'adolescent. L'administration doit en tout cas toujours respecter les règles de précaution de la radioprotection. Une grossesse doit être exclue chez les femmes en âge de procréer. Veuillez consulter la section «Grossesse/Allaitement» à ce sujet.
Potentiel d'hypersensibilité ou de réactions anaphylactiques
La survenue d'une réaction d'hypersensibilité ou d'anaphylaxie exige une interruption immédiate de l'administration du produit. Un traitement par voie intraveineuse doit être instauré si nécessaire. Pour pouvoir réagir immédiatement en cas d'urgence, il convient d'avoir les médicaments et instruments nécessaires, notamment une sonde d'intubation trachéale et du matériel de ventilation, à portée de main. Un accès veineux doit être prêt pendant toute la durée du processus.
Insuffisance rénale
Le rapport avantages-risques doit être évalué soigneusement, étant donné que ces patients risquent éventuellement d'être exposés de façon accrue aux radiations.
Population pédiatrique
Voir la rubrique «Posologie/Mode d'emploi» pour des informations sur l'utilisation chez cette population. L'indication doit être considérée avec prudence, car la dose efficace par MBq est plus élevée que chez l'adulte (voir la rubrique «Exposition aux radiations»).
Une inhibition de la thyroïde est particulièrement importante chez l'enfant, sauf pour la scintigraphie thyroïdienne ou la scintigraphie des glandes salivaires.
Préparation du patient
Inhibition éventuelle de la thyroïde
Un prétraitement des patients par des thyréostatiques / agents inhibiteurs de la thyroïde peut être nécessaire pour certaines indications.
Le patient doit être bien hydraté avant l'examen et vider sa vessie aussi souvent que possible au cours des premières heures suivant l'examen afin de réduire l'exposition aux radiations. Une diurèse forcée peut être envisagée.
Scintigraphie thyroïdienne, scintigraphie des surrénales, scintigraphie des glandes salivaires
Il ne faut pas inhiber la thyroïde dans ces cas.
Dans la scintigraphie des glandes salivaires, il faut s'attendre à une spécificité inférieure à celle de la sialographie par IRM.
Scintigraphie de diverticules de Meckel
Une inhibition de la thyroïde est indiquée dans ces cas.
Avant l'utilisation de pertechnétate (99mTc) de sodium pour la scintigraphie de diverticules de Meckel, le patient doit être à jeun depuis 3 à 4 heures afin que le péristaltisme de l'intestin grêle reste faible. Les médicaments susceptibles d'inhiber le symport sodium/iodure doivent être exclus, étant donné qu'ils réduisent l'absorption du pertechnétate à travers la muqueuse gastrique.
Scintigraphie des canaux lacrymaux
Afin d'éviter des résultats faux positifs et minimiser l'irradiation en réduisant l'accumulation de pertechnétate (99mTc) dans la thyroïde ou les glandes salivaires, il faut administrer un inhibiteur de la thyroïde.
Réduction maximale du marquage d'érythrocytes
Après un marquage des érythrocytes in vivo avec utilisation d'ions étain comme agent réducteur, le pertechnétate (99mTc) de sodium est incorporé essentiellement dans les érythrocytes. C'est pourquoi l'administration i.v. de 99mTc doit avoir lieu avant le marquage in vivo des érythrocytes ou quelques jours après.
En vertu de précédentes études de médecine nucléaire portant sur des trousses de radiomarquage contenant de l'étain (II) pour un médicament radioactif, un temps d'attente d'au moins 8 jours est indiqué sous peine de risquer un marquage indésirable des érythrocytes.
Après l'examen
Tout contact étroit avec un jeune enfant ou une femme enceinte doit être évité au cours des 12 heures suivant l'examen.
Mises en garde spécifiques
La solution de pertechnétate (99mTc) de sodium contient 3,6 mg/ml de sodium. En fonction du moment d'administration de l'injection, la teneur en sodium administrée au patient peut être supérieure à 1 mmol (23 mg) dans certains cas. Cette quantité doit être prise en compte chez les patients suivant un régime hyposodé.
Lors du marquage d'une trousse avec une solution de pertechnétate (99mTc) de sodium, la teneur totale en sodium de la dose administrée – provenant de l'éluat et de la trousse – doit être prise en compte. Voir l'information professionnelle et la notice de la trousse en question.
InteractionsL'atropine, l'adrénaline, l'isoprénaline et les analgésiques peuvent retarder la vidange gastrique et induire ainsi une redistribution du pertechnétate (99mTc) en imagerie abdominale.
L'administration de laxatifs doit être interrompue car ceux-ci irritent les voies gastro-intestinales.
Les examens avec produits de contraste (p.ex. produit de contraste baryté) et les examens des voies digestives supérieures doivent être évités durant les 48 heures précédant l'administration du pertechnétate (99mTc) pour une scintigraphie de diverticules de Meckel.
De nombreux agents pharmacologiques sont connus pour modifier la fixation thyroïdienne.
·Les thyréostatiques (p.ex. carbimazole ou autres dérivés imidazolés tels que le propylthiouracile), les salicylés, les corticostéroïdes, le nitroprussiate de sodium, la bromsulfaléine de sodium et le perchlorate doivent être arrêtés 1 semaine avant la scintigraphie thyroïdienne.
·La phénylbutazone et les expectorants doivent être arrêtés deux semaines auparavant.
·Les hormones thyroïdiennes naturelles ou de synthèse (p.ex. thyroxine sodique, liothyronine sodique, extrait thyroïdien) doivent être arrêtées 2 à 3 semaines auparavant.
·L'amiodarone, les benzodiazépines et le lithium doivent être arrêtés 4 semaines auparavant.
·Aucun produit de contraste iodé intraveineux ne doit avoir été administré au cours des 1 à 2 mois précédents.
Les ions étain (II) et les sulfamides peuvent conduire à une concentration accrue de pertechnétate de sodium (99mTc) dans les globules rouges, et donc à une accumulation réduite dans le plasma. Les médicaments correspondants doivent être arrêtés au moins 8 jours avant l'utilisation.
Pour des informations concernant les interactions possibles lors d'une utilisation pour le marquage d'une trousse pour médicament radioactif, voir les informations correspondantes du fabricant de la trousse en question.
Grossesse, AllaitementFemmes en âge de procréer
Quand l'administration d'un médicament radioactif est prévue chez une femme en âge de procréer, il est important de vérifier si la patiente est enceinte ou non. Toute femme n'ayant pas eu ses règles doit être considérée comme étant enceinte jusqu'à preuve du contraire. En cas de doute quant à une éventuelle grossesse (lors d'aménorrhée, de cycles irréguliers, etc.), d'autres techniques n'impliquant pas une exposition aux radiations doivent être proposées (si possible) à la patiente.
Grossesse
Il a été démontré que le technétium (99mTc) de sodium traverse la barrière placentaire. Le technétium (99mTc) de sodium est contre-indiqué chez la femme enceinte (voir «Contre-indications»). On envisagera à la place l'utilisation de procédés de diagnostic non radiologiques.
Allaitement
Avant l'administration de radiopharmaceutiques à une mère qui allaite, il est nécessaire de vérifier si l'option de repousser l'examen à une date après la fin de l'allaitement est cliniquement justifiable et d'examiner quel radiopharmaceutique paraît le mieux approprié en considérant le passage de radioactivité dans le lait maternel. Si l'administration est jugée absolument nécessaire, l'allaitement doit être interrompu pendant 12 heures après l'administration et le lait tiré doit être jeté. Le contact étroit de la mère avec le nourrisson doit être évité durant cette période.
Effet sur l'aptitude à la conduite et l'utilisation de machinesAucune étude correspondante n'a été effectuée.
Effets indésirablesRésumé du profil de sécurité
On dispose de données de rapports spontanés d'effets indésirables. Les effets indésirables rapportés englobent des réactions anaphylactoïdes, de réactions végétatives et divers types de réactions au site d'injection. Le pertechnétate (99mTc) de sodium issu du générateur Pertector est utilisé pour le marquage radioactif de différentes substances. Les types d'effets indésirables pouvant survenir après l'administration intraveineuse d'une préparation marquée au pertechnétate (99mTc) de sodium dépendent de la substance radiomarquée. Les informations correspondantes sont fournies dans les informations professionnelles des trousses utilisées pour la préparation de médicaments radioactifs.
Liste des effets indésirables sous forme de tableau
Les fréquences des effets indésirables sont définies selon la convention suivante:
Très fréquents (≥1/10)Fréquents (<1/10, ≥1/100)Occasionnels (<1/100, ≥1/1000)Rares (<1/1000, ≥1/10'000)Très rares (<1/10,000)Fréquence indéterminée (ne peut pas être estimée à partir des données disponibles)
|
Classes de systèmes d'organes MedDRA
|
Effets indésirables
|
Fréquence
| |
Affections du système immunitaire
|
Réactions anaphylactoïdes (par exemple dyspnée, coma, urticaire, érythème, éruption cutanée, prurit, œdème de diverses localisations, p.ex. au visage).
|
Fréquence indéterminée*
| |
Affections du système nerveux
|
Réactions vasovagales (par exemple syncope, tachycardie, bradycardie, sensations vertigineuses, céphalées, vue trouble, bouffées vasomotrices [rougeur faciale, sensation de chaleur]).
|
Fréquence indéterminée*
| |
Affections gastro-intestinales
|
Vomissements, nausées, diarrhée.
|
Fréquence indéterminée*
| |
Troubles généraux et anomalies au site d'administration
|
Réactions au site de l'injection (par exemple cellulite, douleurs, érythème, tuméfaction)
|
Fréquence indéterminée*
|
* Effets indésirables décrits dans des rapports spontanés
Les rayons ionisants peuvent induire des cancers et des anomalies génétiques. La dose efficace étant de 5,2 mSv quand la radioactivité maximale recommandée de 400 MBq est administrée sans inhibition de la thyroïde, le risque d'une survenue de ces effets indésirables est jugé faible.
Description d'effets indésirables sélectionnés
Réactions anaphylactiques (par exemple dyspnée, coma, urticaire, érythème, éruption cutanée, prurit, œdème de diverses localisations, p.ex. au visage).
Des réactions anaphylactoïdes, incluant divers symptômes cutanés et respiratoires tels qu'irritations cutanées, œdèmes ou dyspnée, ont été rapportées après l'injection intraveineuse de pertechnétate (99mTc) de sodium.
Réactions végétatives (affections du système nerveux et affections gastro-intestinales)
Des cas isolés de réactions végétatives sévères ont été rapportés, mais la plupart des effets indésirables rapportés étaient des réactions gastro-intestinales telles que des nausées ou des vomissements. D'autres rapports ont concerné des réactions vasovagales telles que des céphalées ou une sensation de vertige. Les effets végétatifs sont imputés plutôt à la situation d'examen qu'au technétium (99mTc), surtout chez les patients anxieux.
Troubles généraux et anomalies au site d'administration
D'autres rapports ont décrit des réactions locales au site d'injection. De telles réactions sont dues à l'extravasation de la substance radioactive pendant l'injection. Les réactions observées vont d'une tuméfaction localisée jusqu'à une cellulite. Selon la dose de radioactivité administrée et selon la substance radiomarquée, une extravasation importante peut éventuellement exiger un traitement chirurgical.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSi une dose excessive de radioactivité a été administrée par le pertechnétate (99mTc) de sodium, la dose absorbée par le patient doit être réduite dans la mesure du possible en augmentant l'élimination du radionucléide par défécation, diurèse forcée et mictions aussi fréquentes que possible.
La fixation dans la thyroïde, les glandes salivaires et la muqueuse gastrique peut être significativement réduite par l'administration de 400 mg de perchlorate de sodium et de 2 x 100 mg d'iodure de sodium par jour immédiatement après l'administration accidentelle d'une dose trop élevée de pertechnétate (99mTc) de sodium.
Propriétés/EffetsCode ATC: V09FX01
Mécanisme d’action
Aucune activité pharmacologique n'a été observée aux doses administrées à des fins diagnostiques.
Pharmacodynamique
Aucune information disponible
Efficacité clinique
Aucune information disponible
PharmacocinétiqueAbsorption
Aucune information disponible
Distribution
L'ion pertechnétate présente une distribution biologique similaire à celle des ions iodure et perchlorate, se concentrant transitoirement dans les glandes salivaires, les plexus choroïdes, l'estomac (muqueuse gastrique) et la glande thyroïde, d'où il est éliminé sous forme inchangée. L'ion pertechnétate tend également à se concentrer dans des régions présentant une hypervascularisation ou des anomalies de la perméabilité vasculaire, particulièrement quand un prétraitement par un inhibiteur de la thyroïde a inhibé la fixation dans les structures glandulaires. Si la barrière hémato-encéphalique est intacte, le pertechnétate (99mTc) ne pénètre pas dans les tissus cérébraux.
Métabolisme
Dans la circulation sanguine, 70 à 80 % du pertechnétate (99mTc) de sodium injecté par voie intraveineuse sont liés aux protéines, principalement à l'albumine de façon non spécifique. La fraction non liée (20 à 30 %) s'accumule transitoirement dans la thyroïde et les glandes salivaires, les muqueuses gastrique et nasale et les plexus choroïdes.
Contrairement à l'iode, le pertechnétate (99mTc) n'est ni utilisé dans la synthèse des hormones thyroïdiennes (organification), ni absorbé dans l'intestin grêle. Dans la thyroïde, selon son état fonctionnel et sa saturation en iode (environ 0,3 à 3 % en euthyroïdie et jusqu'à 25 % en hyperthyroïdie et en déplétion iodée), l'accumulation maximale est atteinte environ 20 minutes après l'injection puis rediminue rapidement. Il en est de même pour les cellules pariétales de la muqueuse gastrique et les cellules acineuses des glandes salivaires.
Contrairement à la thyroïde, qui libère ensuite le pertechnétate (99mTc) de sodium dans la circulation sanguine, les glandes salivaires et la muqueuse gastrique déversent leurs sécrétions dans la salive ou dans le suc gastrique. L'accumulation dans les glandes salivaires est de l'ordre de 0,5 % de l'activité administrée et atteint sa valeur maximale au bout d'environ 20 minutes. Une heure après injection, la concentration salivaire est environ 10 à 30 fois supérieure à la concentration plasmatique. L'excrétion peut être accélérée par la prise de jus de citron; le perchlorate réduit l'absorption.
Élimination
La demi-vie de clairance plasmatique est d'environ 3 heures. Le pertechnétate (99mTc) n'est pas métabolisé dans l'organisme. Une fraction est éliminée très rapidement par voie rénale. Le restant est éliminé plus lentement dans les fèces, la salive et le liquide lacrymal. Durant les 24 heures suivant l'administration, l'élimination s'effectue principalement par voie rénale (~25 %), tandis que l'élimination fécale se répartit sur les 48 heures suivantes. Environ 50 % de l'activité administrée sont excrétés au cours des 50 premières heures. Quand la fixation sélective du pertechnétate (99mTc) de sodium dans des structures glandulaires est inhibée par l'administration préalable d'inhibiteurs, l'élimination s'effectue par les mêmes voies, mais la clairance rénale est plus élevée.
Les informations ci-dessus ne s'appliquent pas lorsque le pertechnétate (99mTc) de sodium est utilisé pour le marquage d'autres produits radiopharmaceutiques.
Cinétique pour certains groupes de patients
Aucune information disponible
Données précliniquesOn ne dispose pas de données sur la toxicité aiguë, subaiguë ou chronique après administration d'une dose unique ou de doses répétées. Les quantités de pertechnétate (99mTc) de sodium administrées dans le cadre d'examens cliniques de diagnostic est très faible. Ce médicament n'est pas destiné à une administration régulière ou continue. Aucune étude de mutagénicité ou de carcinogénicité à long terme n'a été menée.
Toxicité pour la reproduction
Le passage transplacentaire du 99mTc à partir d'une injection intraveineuse de pertechnétate (99mTc) de sodium a été étudié chez la souris. Jusqu'à 60 % du pertechnétate (99mTc) injecté sans prétraitement par du perchlorate ont été retrouvés dans l'utérus gravide chez la souris. L'administration à des souris gestantes et/ou allaitantes a causé chez la progéniture un poids réduit, une apilosité et une stérilité.
Remarques particulièresIncompatibilités
Ce médicament ne doit pas être mélangé avec d'autres médicaments que ceux mentionnés dans la rubrique «Indications».
Les médicaments radioactifs marqués au pertechnétate (99mTc) de sodium ne doivent pas être mélangés avec d'autres médicaments.
En vertu d'une précédente étude de médecine nucléaire portant sur une trousse de marquage pour médicaments qui contenait des ions étain, un temps d'attente d'au moins 8 jours est indiqué avant l'administration de technétium (99mTc de sodium.
Influence sur les Methodes de diagnostic
Aucune information disponible
Stabilité
Générateur:
14 jours à partir de la calibration. La date de calibration et la date de péremption sont indiquées sur l'étiquette. Ne pas conserver au-dessus de 30 °C. Le dispositif ne doit pas être utilisé au-delà de la date de péremption.
Éluat de pertechnétate (99mTc) de sodium:
À utiliser immédiatement après élution, en tout cas dans les 12 heures. Conserver à température ambiante (15-25 °C).
Flacons-ampoules contenant une solution de chlorure de sodium à 0,9 % ainsi que flacons-ampoules sous vide: 3 mois.
Remarques particulières concernant le stockage
Générateur: Ce produit n'exige pas de précautions particulières de conservation concernant la température.
Éluat: Pour les conditions de conservation du médicament après élution, voir la section «Stabilité».
Le stockage doit se conformer aux règlementations nationales relatives aux produits radioactifs.
Remarques concernant la manipulation
Description du générateur
Le générateur Pertector comporte (cf. l'illustration):
·Une colonne stérile en verre (1), contenant de l'alumine sur laquelle est adsorbé le radionucléide molybdène-99. La colonne est fermée à chacune de ses deux extrémités par un bouchon en caoutchouc muni d'un capuchon de sécurité en métal.
·Un système d'aiguilles (2) permettant de connecter les flacons-ampoules d'éluant et les flacons-ampoules sous vide à la colonne du générateur. Pendant le transport et les pauses d'élution, les aiguilles sont protégées par deux flacons-ampoules contenant une solution bactériostatique (solution aqueuse de bromure de benzododécinium à 0,02 %).
·Blindage en plomb (3) épais de 50 mm, dans lequel se trouvent la colonne et les aiguilles du générateur.
·Filtres stériles (4 et 9) pour l'éluat et l'air aspiré dans le flacon-ampoule d'éluant.
·Contrôle du volume d'éluat (5), permettant de régler le volume d'éluat souhaité (4 à 8 ± 0,5 ml), et ainsi la concentration radioactive souhaitée de l'éluat. Le réglage du volume est effectué en tournant le haut du porte-flacon (7) conformément à la graduation visible.
Accessoires fournis avec le générateur:
·16 flacons-ampoules contenant l'éluant (solution de NaCl à 0,9 %) et 16 flacons-ampoules sous vide (destinés à recevoir l'éluat).
·Compartiment blindé (8) destiné à recevoir le flacon-ampoule d'élution.
Les flacons-ampoules (solution de chlorure de sodium ou vide) sont des flacons en verre de 10 ml munis d'un bouchon en caoutchouc et d'un capuchon.
Les accessoires – éluant (solution de NaCl à 0,9 %) et flacons-ampoules sous vide (flacons destinés à recevoir l'éluat) – peuvent être achetés séparément.
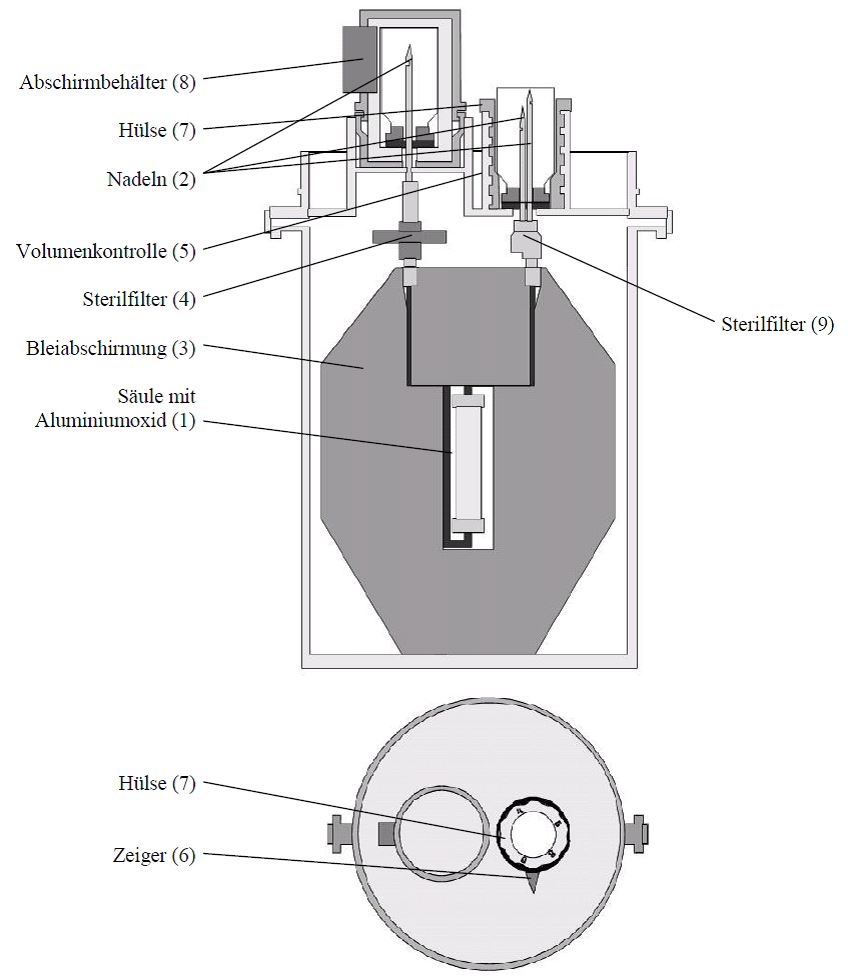
Illustration: Schéma du générateur
Mise en circulation du générateur
Il est recommandé de rester derrière un blindage supplémentaire adéquat (p.ex. paroi de plomb de 50 mm) pour effectuer l'élution du générateur ainsi que toutes les autres manipulations de la solution sodique. Le débit de dose à la surface et à 1 m de la surface ne doit pas dépasser 1mSv/h et 10 µSv/h respectivement. Les seringues utilisées pour la fabrication du produit radiopharmaceutique doivent également être munies d'un blindage en plomb (codes OS-2, OS-5, OS-10 et OS-P-10).
·Ouvrir le conteneur de transport.
·Prélever le compartiment blindé prévu pour l'éluat, qui se trouve dans le couvercle du conteneur (lors de la livraison initiale).
·Retirer le couvercle du conteneur.
·Prélever les emballages contenant les kits d'élution.
·Retirer le générateur et le placer dans le blindage supplémentaire préparé.
Instructions pour la préparation des radiopharmaceutiques
L'élution du générateur doit être réalisée dans des locaux conformes à la règlementation nationale relative à la sécurité d'utilisation des produits radioactifs.
Instructions pour le marquage de trousses
L'utilisation d'une solution de pertechnétate (99mTc) de sodium pour le marquage d'une trousse pour médicament radioactif doit se conformer aux informations correspondantes fournies pour la trousse en question. Les spécifications de l'éluat, et en particulier la durée entre deux élutions, doivent être consultées dans l'information professionnelle correspondante.
Instructions pour l'élution
La règlementation relative à la radioprotection doit être respectée pendant la manipulation et utilisation du médicament. Les élutions ne doivent être faites que dans des locaux conformes. Afin d'assurer la stérilité de l'éluat généré, il faut travailler de façon strictement aseptique pendant l'élution du générateur. Respecter l'ordre d'enchaînement des séquences suivantes pour obtenir des résultats optimaux:
Attention:
Ne pas utiliser de l'éthanol, de l'éther éthylique ou des détergents pour rincer les aiguilles ou les bouchons des flacons.
N'utiliser que les accessoires fournis pour ce générateur de radionucléide – l'éluant (solution de chlorure de sodium à 0,9 %) et les flacons-ampoules sous vide – pour l'élution du générateur de radionucléide.
Élution
-Dévisser le couvercle du générateur.
-Placer le générateur de sorte à ce que les deux flacons contenant la solution bactériostatique, qui sont fixés sur les connexions du générateur, se trouvent alignés parallèlement
à l'utilisateur et que le réglage du contrôle du volume d'éluat soit bien visible.
-Retirer les flacons bactériostatiques des aiguilles du générateur.
-Régler le contrôle du volume d'éluat selon vos désirs.
Attention: ne pas dévisser le porte-flacon de son support sur le générateur en réglant le volume!
-Retirer le scellage du flacon d'éluant, désinfecter le bouchon et placer le flacon sur l'aiguille fixée dans le socle du porte-flacon muni du contrôle du volume. Percer le bouchon en enfonçant le flacon-ampoule jusqu'à ce qu'il touche le fond.
-Retirer le scellage du flacon sous vide, désinfecter le bouchon et placer le flacon sous vide dans le compartiment blindé. Enfoncer celui-ci avec précaution sur l'aiguille du support d'élution jusqu'à ce qu'il touche le fond du support d'élution.
-Attendre que l'élution soit achevée. Le temps dépend du volume d'éluat; il peut varier entre 2, 3 et 4 minutes (pour l'obtention de 4, 6 et 8 ml d'éluat respectivement).
-Retirer le récipient blindé, en sortir le flacon-ampoule contenant l'éluat et mesurer l'activité éluée à l'aide d'un activimètre calibré approprié.
-Retirer le flacon-ampoule contentant l'éluant. Il est plus facile à manipuler si vous réglez le contrôle du volume à «0».
Replacer les flacons-ampoules contenant le bactériostatique sur les aiguilles du générateur.
-Fermer le couvercle du générateur.
Calcul de l'activité du générateur
L'activité nominale du générateur est indiquée en tant qu'activité en pertechnétate (99mTc) de sodium à 12:00 h HNEC (jour 0, tableau 5).
L'activité éluable entre 08:00 et 12:00 h est pratiquement constante, à un niveau de 96 à 100 % de l'activité nominale du jour correspondant.
Les activités les plus élevées sont obtenues lorsque la pause entre les élutions n'est pas inférieure à 23-24 heures.
Tableau 7: Activité théoriquement éluable en technétium (99mTc) de sodium à la date de référence
|
Activité du générateur en 99Mo [GBq]
| |
|
2,3
|
4,6
|
5,7
|
6,9
|
8,5
|
9,1
|
11,4
|
13,7
|
14,9
|
17,1
|
19,4
|
21,1
|
22,9
|
26,3
|
28,6
|
34,3
|
40
|
45,7
|
57,1
| |
Activité du générateur en 99mTc [GBq]
| |
Jour
|
| |
Jour avant le jour de calibration
|
-5
|
7,1
|
14,1
|
17,6
|
21,2
|
26,4
|
28,2
|
35,3
|
42,3
|
45,8
|
52,9
|
59,9
|
65,2
|
70,5
|
81,1
|
88,2
|
105,8
|
123,4
|
141,1
|
176,3
| |
-4
|
5,5
|
11,0
|
13,7
|
16,4
|
20,6
|
21,9
|
27,4
|
32,9
|
35,6
|
41,1
|
46,6
|
50,7
|
54,8
|
63,0
|
68,5
|
82,2
|
95,9
|
109,6
|
137,0
| |
-3
|
4,3
|
8,5
|
10,7
|
12,8
|
16,0
|
17,0
|
21,3
|
25,6
|
27,7
|
32,0
|
36,2
|
39,4
|
42,6
|
49,0
|
53,3
|
63,9
|
74,6
|
85,2
|
106,5
| |
-2
|
3,3
|
6,6
|
8,3
|
9,9
|
12,4
|
13,2
|
16,6
|
19,9
|
21,5
|
24,8
|
28,1
|
30,6
|
33,1
|
38,1
|
41,4
|
49,7
|
57,9
|
66,2
|
82,8
| |
-1
|
2,6
|
5,1
|
6,4
|
7,7
|
9,6
|
10,3
|
12,9
|
15,4
|
16,7
|
19,3
|
21,9
|
23,8
|
25,7
|
29,6
|
32,2
|
38,6
|
45,0
|
51,5
|
64,3
| |
Jour de calibration
|
2,00
|
4,00
|
5,00
|
6,00
|
7,50
|
8,00
|
10,00
|
12,00
|
13,00
|
15,00
|
17,00
|
18,50
|
20,00
|
23,00
|
25,00
|
30,00
|
35,00
|
40,00
|
50,00
| |
Lendemain du jour de calibration
|
1
|
1,55
|
3,11
|
3,89
|
4,66
|
5,83
|
6,22
|
7,77
|
9,33
|
10,10
|
11,66
|
13,21
|
14,38
|
15,54
|
17,88
|
19,43
|
23,32
|
27,20
|
31,09
|
38,86
| |
2
|
1,21
|
2,42
|
3,02
|
3,62
|
4,53
|
4,83
|
6,04
|
7,25
|
7,85
|
9,06
|
10,27
|
11,17
|
12,08
|
13,89
|
15,10
|
18,12
|
21,14
|
24,16
|
30,20
| |
3
|
0,94
|
1,88
|
2,35
|
2,82
|
3,52
|
3,76
|
4,69
|
5,63
|
6,10
|
7,04
|
7,98
|
8,69
|
9,39
|
10,80
|
11,74
|
14,08
|
16,43
|
18,78
|
23,47
| |
4
|
0,73
|
1,46
|
1,82
|
2,19
|
2,74
|
2,92
|
3,65
|
4,38
|
4,74
|
5,47
|
6,20
|
6,75
|
7,30
|
8,39
|
9,12
|
10,95
|
12,77
|
14,59
|
18,24
| |
5
|
0,57
|
1,13
|
1,42
|
1,70
|
2,13
|
2,27
|
2,84
|
3,40
|
3,69
|
4,25
|
4,82
|
5,25
|
5,67
|
6,52
|
7,09
|
8,51
|
9,93
|
11,34
|
14,18
| |
6
|
0,44
|
0,88
|
1,10
|
1,32
|
1,65
|
1,76
|
2,20
|
2,64
|
2,87
|
3,31
|
3,75
|
4,08
|
4,41
|
5,07
|
5,51
|
6,61
|
7,71
|
8,82
|
11,02
| |
7
|
0,34
|
0,69
|
0,86
|
1,03
|
1,28
|
1,37
|
1,71
|
2,06
|
2,23
|
2,57
|
2,91
|
3,17
|
3,43
|
3,94
|
4,28
|
5,14
|
6,00
|
6,85
|
8,56
| |
8
|
0,27
|
0,53
|
0,67
|
0,80
|
1,00
|
1,07
|
1,33
|
1,60
|
1,73
|
2,00
|
2,26
|
2,46
|
2,66
|
3,06
|
3,33
|
3,99
|
4,66
|
5,33
|
6,66
| |
9
|
0,21
|
0,41
|
0,52
|
0,62
|
0,78
|
0,83
|
1,03
|
1,24
|
1,35
|
1,55
|
1,76
|
1,91
|
2,07
|
2,38
|
2,59
|
3,10
|
3,62
|
4,14
|
5,17
| |
10
|
0,16
|
0,32
|
0,40
|
0,48
|
0,60
|
0,64
|
0,80
|
0,96
|
1,05
|
1,21
|
1,37
|
1,49
|
1,61
|
1,85
|
2,01
|
2,41
|
2,81
|
3,22
|
4,02
| |
11
|
0,13
|
0,25
|
0,31
|
0,38
|
0,47
|
0,50
|
0,63
|
0,75
|
0,81
|
0,94
|
1,06
|
1,16
|
1,25
|
1,44
|
1,56
|
1,88
|
2,19
|
2,50
|
3,13
| |
12
|
0,10
|
0,19
|
0,24
|
0,29
|
0,36
|
0,39
|
0,49
|
0,58
|
0,63
|
0,73
|
0,83
|
0,90
|
0,97
|
1,12
|
1,21
|
1,46
|
1,70
|
1,94
|
2,43
| |
13
|
0,08
|
0,15
|
0,19
|
0,23
|
0,28
|
0,30
|
0,38
|
0,45
|
0,49
|
0,57
|
0,64
|
0,70
|
0,76
|
0,87
|
0,94
|
1,13
|
1,32
|
1,51
|
1,89
| |
14
|
0,06
|
0,12
|
0,15
|
0,18
|
0,22
|
0,23
|
0,29
|
0,35
|
0,38
|
0,44
|
0,50
|
0,54
|
0,59
|
0,67
|
0,73
|
0,88
|
1,03
|
1,17
|
1,47
|
Tableau 8: Facteurs de correction pour le calcul de l'activité en pertechnétate (99mTc) de sodium en fonction des intervalles d'élution
|
Temps depuis la dernière élution (heures)
|
0
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
18
|
20
|
23
| |
Facteur de correction: Désintégration du 99Mo
|
1,0
|
0,979
|
0,960
|
0,940
|
0,919
|
0,900
|
0,881
|
0,863
|
0,845
|
0,828
|
0,811
|
0,785
| |
Facteur de correction: Augmentation du 99mTc
|
0,0
|
0,21
|
0,39
|
0,51
|
0,62
|
0,71
|
0,79
|
0,85
|
0,89
|
0,93
|
0,96
|
1,0
|
Exemples de calcul
·Un générateur ayant une activité nominale de 15 GBq est élué le jour «+2» à 08:00 h, puis à nouveau le même jour à 12:00 h, c'est-à-dire 4 heures après l'élution précédente.
L'activité de la première élution est de 9,06 GBq (voir le tableau 5).
L'activité de la deuxième élution est de 9,06 * 0,960 * 0,39 = 3,39 GBq
(facteurs de correction du tableau 8).
·Un générateur ayant une activité nominale de 23 GBq est élué le jour «+4» à 08:00 h, puis à nouveau le même jour à 14:00 h, c'est-à-dire 6 heures après l'élution précédente.
L'activité de la première élution est de 8,39 GBq (voir le tableau 5).
L'activité de la deuxième élution est de 8,39 * 0,940 * 0,51 = 4,02 GBq
(facteurs de correction du tableau 8).
Contrôle de la qualité
Chaque éluat doit être contrôlé visuellement à travers la fenêtre de verre plombé du récipient d'élution. Si l'éluat est trouble ou présente une coloration, il ne doit pas être utilisé. Le titulaire de l'autorisation doit immédiatement être informé. Pour le premier éluat d'un générateur après la livraison de ce dernier, il faut vérifier l'absence d'une fuite de 99Mo pour exclure un défaut dû à des dommages de transport. Il est recommandé de faire le test pour le premier éluat de chaque journée.
Caractéristiques de l'éluat obtenu du générateur
Correspond à la monographie 0124 «Solution injectable de pertechnétate (99mTc) de sodium obtenu par fission» de la Pharmacopée européenne.
L'éluat obtenu est une solution limpide et incolore de pertechnétate (99mTc) de sodium et présente les propriétés suivantes:
Rendement d'élution 90 à 110 %Pureté radiochimique de l'éluat >98 %Teneur de l'éluat en 99Mo <0,1 %, correspondant à 1 kBq 99Mo/MBq 99mTcTeneur de l'éluat en Al3+ <5 mg/mlpH de l'éluat 5,5 à 7,5
Sauf indication contraire, le premier éluat du générateur ne peut généralement pas être utilisé. Pour le marquage d'une trousse, l'éluat peut encore être utilisé 24 h après la dernière élution si l'information professionnelle de la trousse n'exige pas l'utilisation d'un éluat fraîchement produit.
Tableau 9: Molybdène-99: facteurs de désintégration en fonction du temps écoulé depuis la calibration (demi-vie du 99Mo: 66 heures)
|
GMT
|
Jours avant/après la calibration
| |
(h)
|
-10
|
-9
|
-8
|
-7
|
-6
|
-5
|
-4
|
-3
|
-2
|
-1
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
| |
2,00
|
13,8123
|
10,7349
|
8,3432
|
6,4844
|
5,0397
|
3,9169
|
3,0442
|
2,3660
|
1,8388
|
1,4291
|
1,1107
|
0,8633
|
0,6709
|
0,5215
|
0,4053
|
0,3150
|
0,2448
|
0,1903
|
0,1479
|
0,1149
|
0,0893
|
0,0694
|
0,0540
|
0,0419
|
0,0326
| |
4,00
|
13,5252
|
10,5118
|
8,1698
|
6,3496
|
4,9349
|
3,8354
|
2,9809
|
2,3168
|
1,8006
|
1,3994
|
1,0876
|
0,8453
|
0,6570
|
0,5106
|
0,3969
|
0,3084
|
0,2397
|
0,1863
|
0,1448
|
0,1125
|
0,0875
|
0,0680
|
0,0528
|
0,0411
|
0,0319
| |
6,00
|
13,2441
|
10,2933
|
8,0000
|
6,2176
|
4,8324
|
3,7557
|
2,9190
|
2,2686
|
1,7632
|
1,3704
|
1,0650
|
0,8278
|
0,6433
|
0,5000
|
0,3886
|
0,3020
|
0,2347
|
0,1824
|
0,1418
|
0,1102
|
0,0856
|
0,0666
|
0,0517
|
0,0402
|
0,0313
| |
8,00
|
12,9688
|
10,0794
|
7,8337
|
6,0884
|
4,7319
|
3,6777
|
2,8583
|
2,2215
|
1,7265
|
1,3419
|
1,0429
|
0,8105
|
0,6300
|
0,4896
|
0,3805
|
0,2957
|
0,2299
|
0,1786
|
0,1388
|
0,1079
|
0,0839
|
0,0652
|
0,0507
|
0,0394
|
0,0306
| |
10,00
|
12,6992
|
9,8699
|
7,6709
|
5,9618
|
4,6336
|
3,6012
|
2,7989
|
2,1753
|
1,6906
|
1,3140
|
1,0212
|
0,7937
|
0,6169
|
0,4794
|
0,3726
|
0,2896
|
0,2251
|
0,1749
|
0,1360
|
0,1057
|
0,0821
|
0,0638
|
0,0496
|
0,0386
|
0,0300
| |
12,00
|
12,4353
|
9,6647
|
7,5114
|
5,8379
|
4,5373
|
3,5264
|
2,7407
|
2,1301
|
1,6555
|
1,2867
|
1,0000
|
0,7772
|
0,6040
|
0,4695
|
0,3649
|
0,2836
|
0,2204
|
0,1713
|
0,1331
|
0,1035
|
0,0804
|
0,0625
|
0,0486
|
0,0378
|
0,0293
| |
14,00
|
12,1768
|
9,4638
|
7,3553
|
5,7166
|
4,4429
|
3,4531
|
2,6837
|
2,0858
|
1,6211
|
1,2599
|
0,9792
|
0,7610
|
0,5915
|
0,4597
|
0,3573
|
0,2777
|
0,2158
|
0,1677
|
0,1304
|
0,1013
|
0,0787
|
0,0612
|
0,0476
|
0,0370
|
0,0287
| |
16,00
|
11,9237
|
9,2671
|
7,2024
|
5,5978
|
4,3506
|
3,3813
|
2,6280
|
2,0425
|
1,5874
|
1,2337
|
0,9589
|
0,7452
|
0,5792
|
0,4502
|
0,3499
|
0,2719
|
0,2113
|
0,1642
|
0,1277
|
0,0992
|
0,0771
|
0,0599
|
0,0466
|
0,0362
|
0,0281
| |
18,00
|
11,6758
|
9,0745
|
7,0527
|
5,4814
|
4,2602
|
3,3110
|
2,5733
|
2,0000
|
1,5544
|
1,2081
|
0,9389
|
0,7297
|
0,5672
|
0,4408
|
0,3426
|
0,2663
|
0,2069
|
0,1608
|
0,1250
|
0,0972
|
0,0755
|
0,0587
|
0,0456
|
0,0354
|
0,0275
| |
20,00
|
11,4332
|
8,8859
|
6,9061
|
5,3675
|
4,1716
|
3,2422
|
2,5198
|
1,9584
|
1,5221
|
1,1830
|
0,9194
|
0,7146
|
0,5554
|
0,4316
|
0,3355
|
0,2607
|
0,2026
|
0,1575
|
0,1224
|
0,0951
|
0,0739
|
0,0575
|
0,0447
|
0,0347
|
0,0270
| |
22,00
|
11,1955
|
8,7012
|
6,7626
|
5,2559
|
4,0849
|
3,1748
|
2,4675
|
1,9177
|
1,4905
|
1,1584
|
0,9003
|
0,6997
|
0,5438
|
0,4227
|
0,3285
|
0,2553
|
0,1984
|
0,1542
|
0,1199
|
0,0932
|
0,0724
|
0,0563
|
0,0437
|
0,0340
|
0,0264
| |
24,00
|
10,9628
|
8,5203
|
6,6220
|
5,1467
|
4,0000
|
3,1088
|
2,4162
|
1,8779
|
1,4595
|
1,1343
|
0,8816
|
0,6852
|
0,5325
|
0,4139
|
0,3217
|
0,2500
|
0,1943
|
0,1510
|
0,1174
|
0,0912
|
0,0709
|
0,0551
|
0,0428
|
0,0333
|
0,0259
|
Tableau 10: Facteurs pour l'augmentation du technétium-99m à différents moments après l'élution précédente (demie-vie du 99mTc: 6,02 heures)
|
Heures
|
Facteur
|
Heures
|
Facteur
|
Heures
|
Facteur
|
Heures
|
Facteur
|
Heures
|
Facteur
|
Heures
|
Facteur
| |
1
|
0,094
|
9
|
0,579
|
17
|
0,788
|
25
|
0,879
|
33
|
0,918
|
41
|
0,935
| |
2
|
0,179
|
10
|
0,615
|
18
|
0,804
|
26
|
0,884
|
34
|
0,921
|
42
|
0,937
| |
3
|
0,256
|
11
|
0,648
|
19
|
0,818
|
27
|
0,892
|
35
|
0,924
|
43
|
0,938
| |
4
|
0,324
|
12
|
0,678
|
20
|
0,831
|
28
|
0,898
|
36
|
0,926
|
44
|
0,940
| |
5
|
0,386
|
13
|
0,705
|
21
|
0,843
|
29
|
0,903
|
37
|
0,929
|
45
|
0,941
| |
6
|
0,442
|
14
|
0,729
|
22
|
0,853
|
30
|
0,907
|
38
|
0,930
|
46
|
0,941
| |
7
|
0,492
|
15
|
0,751
|
23
|
0,863
|
31
|
0,911
|
39
|
0,932
|
47
|
0,941
| |
8
|
0,538
|
16
|
0,771
|
24
|
0,871
|
32
|
0,915
|
40
|
0,934
|
48
|
0,942
|
Un générateur ou un flacon-ampoule dont l'intégrité est douteuse à un quelconque moment du processus ne doit pas être utilisé.
L'administration doit être faite de sorte à réduire au maximum le risque de contamination du médicament et le risque d'exposition de l'utilisateur aux radiations. Un blindage approprié est absolument nécessaire.
L'utilisation de médicaments radioactifs expose d'autres personnes à un risque d'irradiation externe ou de contamination par le biais d'urine, de vomi, etc. Il faut par conséquent respecter la règlementation nationale concernant la radioprotection.
Sécurité de manipulation
Un générateur pèse environ 16 kg. Il faut veiller à la sécurité en soulevant et en portant le générateur. Pour limiter le risque de blessures, il faut respecter la règlementation en vigueur concernant la sécurité de manipulation.
Élimination des générateurs après la durée d'utilisation admissible:
Tout médicament non utilisé ou déchet doit être évacué conformément à la règlementation nationale.
Des instructions précises pour retourner les générateurs au fabricant sont fournies avec chaque générateur. Les utilisateurs sont informés que l'emballage, la documentation et les conditions de transport doivent être en accord avec les règlementations internationales de transport et les règlementations locales applicables ou se conformer aux codes de conduite à respecter en la matière.
Dispositions légales
Directives de radioprotection:
L'utilisation de substances radioactives chez l'homme est réglementée par l'ordonnance sur la radioprotection (RS 814.501) et l'ordonnance sur l'utilisation des sources radioactives non scellées (RS 814.554). L'utilisation de substances radioactives exige une autorisation de l'Office fédéral de la santé publique. Lors de l'utilisation de substances radioactives et pour l'élimination des déchets radioactifs qui s'en suit, les mesures de protection mentionnées dans cette ordonnance sont à respecter, afin d'éviter toute irradiation inutile des patients et du personnel soignant.
Les solutions radioactives non utilisées et les objets contaminés par celles-ci doivent être conservés jusqu'à la décroissance de l'activité au seuil autorisé du radionucléide dans un local de décroissance équipé à cet effet.
Numéro d'autorisation65778 (A)
PrésentationEmballages disponibles:
Générateur de radionucléide avec une activité de 2,3, de 4,6, de 5,7, de 6,9, de 8,5, de 9,1, de 11,4, de 13,7, de 14,9, de 17,1, de 19,4, de 21,1, de 22,9, de 26,3, de 28,6, de 34,3, de 40,0, de 45,7 ou de 57,1 GBq en molybdène-99 et les activités correspondantes variables en technétium-99m à la calibration. L'activité du générateur au moment de la calibration est indiquée sur chaque emballage.
Catégorie de remise A
Fabricant
National Centre for Nuclear Research, Polen
Titulaire de l'autorisationmedeo SA, Schöftland, Suisse
Mise à jour de l'informationDécembre 2015
|

