Propriétés/EffetsCode ATC
N03AX23
Mécanisme d'action
Le brivaracétam présente une affinité élevée et sélective pour la protéine 2A des vésicules synaptiques (SV2A), une glycoprotéine transmembranaire présente dans les neurones et cellules endocrines au niveau présynaptique. La liaison à SV2A est considérée comme étant le principal mécanisme de l'activité anticonvulsivante du brivaracétam.
Pharmacodynamique
Impact sur l'intervalle QT
Chez les sujets sains, il n'y a eu aucun indice que le brivaracétam prolonge l'intervalle QTc aux doses de 150 mg/jour et 800 mg/jour (4x la dose journalière maximale recommandée).
Efficacité clinique
L'efficacité du brivaracétam en association dans le traitement des crises d'origine focale a été établie dans trois études cliniques multicentriques, randomisées en double aveugle (N01252, N01253 et N01358), contrôlées contre placebo, à dose fixe. Dans ces études, la dose quotidienne de brivaracétam était de 5 à 200 mg/jour. Toutes les études comportaient une période initiale de 8 semaines suivie d'une période de traitement de 12 semaines sans augmentation de dose. Parmi les 1558 patients participant à l'étude, 1099 ont reçu du brivaracétam. Selon les critères d'inclusion de l'étude, les patients devaient présenter des crises non contrôlées d'origine focale malgré un traitement par 1 ou 2 antiépileptiques concomitants. Les patients devaient présenter au moins 8 crises d'origine focale pendant la période initiale.
Les antiépileptiques les plus fréquemment utilisés au moment de l'inclusion dans les études ont été: carbamazépine (40,6%), lamotrigine (25,2%), valproate (20,5%), oxcarbazépine (16,0%), topiramate (13,5%), phénytoïne (10,2%) et lévétiracétam (9,8%) [voir «Efficacité clinique/Traitement par lévétiracétam»]. La fréquence médiane des crises durant la période initiale sur l'ensemble des trois études était de 9 crises en 28 jours. La durée moyenne de l'épilepsie des patients était d'environ 23 ans.
Le tableau 2 présente une synthèse des résultats d'efficacité.
Les résultats du pourcentage de réduction, en comparaison au placebo, de N01252 et N01253, se basent sur la fréquence des crises d'origine focale en l'espace de 28 jours, pour permettre la comparaison avec les résultats de N01358, bien que les analyses primaires de l'efficacité de N01252 et N01253 reposent sur la fréquence des crises d'origine focale en l'espace de 7 jours. Les résultats concernant la significativité statistique n'ont pas été influencés par la modification de la durée en fonction de laquelle la fréquence des crises d'origine focale a été standardisée pour N01252 et N01253.
Tableau 2: principaux résultats d'efficacité sur la fréquence des crises d'origine focale, en l'espace de 28 jours
|
Étude
|
Placebo
|
Brivaracétam
*Statistiquement significatif (valeur p)
| |
50
mg/jour
|
100 mg/jour
|
200 mg/jour
| |
Étude N01253(1)
| |
|
n = 96
|
n = 101
|
|
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
22,0* (p=0,004)
|
~
|
~
| |
Taux de répondeurs à 50%** (%)
|
16,7
|
32,7* (p=0,008)
|
~
|
~
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,8
|
30,5* (p=0,003)
|
~
|
~
| |
Étude N01252(1)
| |
|
n = 100
|
n = 99
|
n = 100
|
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
9,2
(p=0,274)
|
20,5(2)
(p=0,01)
|
~
| |
Taux de répondeurs à 50%** (%)
|
20,0
|
27,3
(p=0,372)
|
36,0(2)
(p=0,023)
|
~
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,0
|
26,8
(p=0,092)
|
32,5(2)
(p=0,004)
|
~
| |
Étude N01358
| |
|
n = 259
|
|
n = 252
|
n = 249
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
~
|
22,8* (p<0,001)
|
23,2*
(p<0,001)
| |
Taux de répondeurs à 50%** (%)
|
21,6
|
~
|
38,9 (p<0,001)
|
37,8
(p<0,001)
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,6
|
~
|
37,2* (p<0,001)
|
35,6*
(p<0,001)
|
n = patients randomisés ayant reçu au moins une dose du médicament expérimental
~ Dose non étudiée
* Statistiquement significatif
** Taux de répondeurs à 50%: pourcentage de patients chez lesquels il y a eu une réduction de la fréquence des crises d'origine focale d'au moins 50% en l'espace de 28 jours, de la valeur initiale à la période de traitement.
(1) Environ 20% des patients ont reçu un traitement concomitant par lévétiracétam.
(2) Le critère primaire de N01252 n'a pas atteint la significativité statistique selon la procédure de test séquentiel, lequel exigeait la significativité statistique à 0,050 pour la dose de 50 mg/jour de brivaracétam par rapport au placebo avant les tests avec 100 mg/jour de brivaracétam. La dose de 100 mg/jour a été nominalement significative.
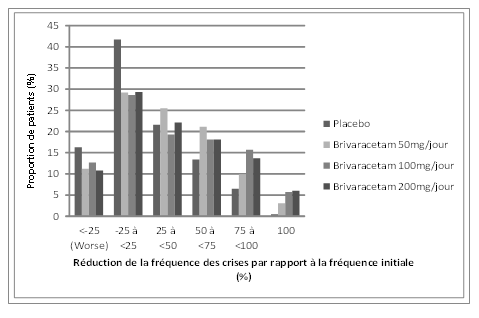
La figure 1 présente la proportion de patients (excluant les patients traités de façon concomitante par lévétiracétam) classée par pourcentage de réduction de la fréquence des crises d'origine focale par période de 28 jours par rapport à la fréquence initiale dans les trois études. Les patients avec une augmentation de plus de 25% des crises d'origine focale sont représentés à gauche du graphique sous «aggravation» (worse). Les patients avec une amélioration en termes de réduction de la fréquence des crises d'origine focale par rapport à la fréquence initiale apparaissent dans les quatre catégories de droite. Les pourcentages de patients ayant obtenu une réduction d'au moins 50% de la fréquence des crises ont été respectivement de 20,3%, 34,2%, 39,5% et 37,8% dans le groupe placebo et les groupes brivaracétam 50 mg/jour, 100 mg/jour et 200 mg/jour.
Figure 1: proportion de patients classée par pourcentage de réduction de la fréquence des crises par rapport à la fréquence initiale dans les groupes brivaracétam et placebo pendant 12 semaines issue des trois études cliniques pivots en double aveugle
Dans une analyse poolée des trois études pivots, aucune différence d'efficacité (mesurée par le taux de répondeurs à 50%) n'a été observée lorsque le brivaracétam était associé à des antiépileptiques inducteurs ou non inducteurs.
Dans les études cliniques, 2,5% (4/161), 5,1% (17/332) et 4,0% (10/249) des patients recevant respectivement du brivaracétam 50 mg/jour, 100 mg/jour et 200 mg/jour sont devenus libres de crises pendant la période de traitement de 12 semaines versus 0,5% (2/418) des patients recevant le placebo.
L'efficacité du brivaracétam en monothérapie n'a pas été examinée. Le brivaracétam ne doit pas être administré en monothérapie.
Traitement par lévétiracétam
Dans les études cliniques N01252 et N01253, le lévétiracétam a été l'antiépileptique concomitant administré chez environ 20% des patients. Chez les patients recevant un traitement concomitant par lévétiracétam, aucun bénéfice du brivaracétam par rapport au placebo n'a été observé. Aucun problème de sécurité ou de tolérance supplémentaire n'a été observé.
Dans la troisième étude (N01358), le lévétiracétam n'était pas autorisé en tant qu'antiépileptique concomitant. Une analyse prédéfinie a démontré l'efficacité cliniquement significative du brivaracétam en comparaison au placebo. L'efficacité était cependant plus faible chez les patients ayant au préalable reçu du lévétiracétam que chez les patients sans traitement préalable par lévétiracétam. L'efficacité plus faible observée chez ces patients en comparaison aux patients naïfs de traitement par lévétiracétam a probablement été due au nombre plus élevé d'antiépileptiques pris précédemment et à la fréquence des crises plus élevée durant la période initiale.
Dans les données poolées sur l'efficacité, les patients recevant un traitement concomitant par lévétiracétam ont été exclus.
Études d'extension en ouvert
Toutes études confondues, 81,7% des patients ayant terminé les études randomisées ont été inclus dans les études d'extension en ouvert à long terme. À partir de l'inclusion dans les études randomisées, 5,3% des sujets traités par brivaracétam pendant 6 mois (n=1500) ont été libres de crises versus 4,6% et 3,7% des patients traités pendant respectivement 12 mois (n=1188) et 24 mois (n=847).
Potentiel d'abus
Bien que les études réalisées avec le brivaracétam n'aient pas montré de potentiel d'abus, cette possibilité ne peut pas être complètement exclue.
Dépendance
Dans une évaluation poolée des études d'association contrôlées contre placebo, il n'y avait aucune indication d'un potentiel de dépendance physique ou de symptômes de sevrage provoqués par le brivaracétam.
Sécurité et efficacité chez les patients âgés
Personnes âgées
Les trois études cliniques en double aveugle contrôlées contre placebo ont inclus 38 (2,4%) personnes âgées de ≥65 ans. Parmi ces patients de ≥65 ans, 30 ont été traités par brivaracétam. Au total, 2 patients de ≥75 ans ont été traités par brivaracétam [voir «Instructions spéciales pour la posologie/Patients âgés»].
Sécurité et efficacité chez les patients pédiatriques
Enfants et adolescents
Chez les enfants âgés de 2 ans et plus, les crises partielles ont une physiopathologie similaire à celles observées chez les adolescents et les adultes. L'expérience acquise sur les médicaments antiépileptiques laisse supposer que les résultats des études d'efficacité menées chez les adultes peuvent être extrapolés aux enfants à partir de 2 ans, à condition que les ajustements posologiques pédiatriques soient confirmés et que le profil de sécurité soit établi (voir rubriques «Pharmacocinétique» et «Effets indésirables»). Les posologies chez les patients à partir de 2 ans ont été définies par des ajustements de dose en fonction du poids, établis pour obtenir des concentrations plasmatiques similaires à celles observées chez les adultes traités par des doses efficaces (voir rubrique «Pharmacocinétique»).
Une étude de tolérance à long terme non contrôlée, en ouvert a inclus des enfants (âgés d'1 mois à moins de 16 ans) ayant poursuivi le traitement après avoir terminé l'étude de pharmacocinétique (voir rubrique «Pharmacocinétique»), des enfants qui ont poursuivi le traitement après avoir terminé l'étude de sécurité pour la forme IV et des enfants recrutés directement pour cette étude de tolérance. Les enfants recrutés directement pour cette étude ont reçu une dose initiale de brivaracétam d'1 mg/kg/jour. En fonction de la réponse et de la tolérance, la dose a été augmentée jusqu'à 5 mg/kg/jour en doublant la dose chaque semaine. Aucun enfant n'a reçu une dose supérieure à 200 mg/jour. Pour les enfants pesant 50 kg ou plus, la dose initiale de brivaracétam était de 50 mg/jour. En fonction de la réponse et de la tolérance, la dose a été augmentée jusqu'à un maximum de 200 mg/jour en augmentant la dose de 50 mg/jour chaque semaine.
Dans les études poolées de sécurité et de pharmacocinétique menées en ouvert, en association, 186 enfants présentant des crises partielles dans la tranche d'âge allant d'1 mois à < 16 ans ont reçu du brivaracétam, parmi lesquels 149 ont été traités pendant ≥3 mois, 138 pendant ≥6 mois, 123 pendant ≥12 mois, 107 pendant ≥24 mois, et 90 pendant ≥36 mois.
|

