CompositionPrincipes actifs
Brivaracétam.
Excipients
Comprimés pelliculés:
Noyau du comprimé (tous les dosages): croscarmellose sodique, lactose monohydraté, bétadex, lactose, stéarate de magnésium.
Chaque comprimé pelliculé de 10 mg contient 0,6 mg de sodium.
Chaque comprimé pelliculé de 25 mg contient 0,75 mg de sodium.
Chaque comprimé pelliculé de 50 mg contient 1,5 mg de sodium.
Chaque comprimé pelliculé de 75 mg contient 2,25 mg de sodium.
Chaque comprimé pelliculé de 100 mg contient 3 mg de sodium.
Chaque comprimé pelliculé de 10 mg contient 87,85 mg de lactose.
Chaque comprimé pelliculé de 25 mg contient 94,57 mg de lactose.
Chaque comprimé pelliculé de 50 mg contient 188,15 mg de lactose.
Chaque comprimé pelliculé de 75 mg contient 282,97 mg de lactose.
Chaque comprimé pelliculé de 100 mg contient 377,3 mg de lactose.
Pelliculage du comprimé (tous les dosages): alcool polyvinylique (40 %), dioxyde de titane (E171), macrogol 3350, talc et
25 mg: oxyde de fer jaune (E172), oxyde de fer noir (E172).
50 mg: oxyde de fer jaune (E172), oxyde de fer rouge (E172).
75 mg: oxyde de fer jaune (E172), oxyde de fer rouge (E172), oxyde de fer noir (E172).
100 mg: oxyde de fer jaune (E172), oxyde de fer noir (E172).
Solution buvable:
citrate de sodium, acide citrique, carmellose sodique, sucralose, sorbitol liquide (équivalent à sorbitol (E420) 167,9 mg/ml), glycérol (E422), eau purifiée, arôme framboise, parahydroxybenzoate de méthyle (E218, 1 mg/ml).
Teneur maximale en sodium par ml de solution buvable: 1,16 mg.
Solution injectable:
acétate de sodium (trihydraté), acide acétique glacial, chlorure de sodium, eau pour préparations injectables
Teneur maximale en sodium par ml de solution injectable: 3,8175 mg.
Indications/Possibilités d’emploiBriviact est indiqué en association dans le traitement des crises partielles avec ou sans généralisation secondaire chez les adultes, les adolescents et les enfants à partir de 2 ans présentant une épilepsie.
Posologie/Mode d’emploiLa posologie recommandée pour les adultes, les adolescents et les enfants à partir de 2 ans est résumée dans le tableau suivant. La dose doit être administrée en deux prises égales, à environ 12 heures d'intervalle.
|
Dose initiale recommandée
|
Dose d'entretien recommandée
|
Intervalle thérapeutique*
| |
Adolescents et enfants pesant 50 kg ou plus, et adultes
| |
50 mg/jour (ou 100 mg/jour)**
|
100 mg/jour
|
50 – 200 mg/jour
| |
Adolescents et enfants pesant de 20 kg à moins de 50 kg
| |
1 mg/kg/jour (jusqu'à 2 mg/kg/jour)**
|
2 mg/kg/jour
|
1 – 4 mg/kg/jour
| |
Enfants pesant de 10 kg à moins de 20 kg
| |
1 mg/kg/jour (jusqu'à 2,5 mg/kg/jour)**
|
2,5 mg/kg/jour
|
1 – 5 mg/kg/jour
|
* En fonction de la réponse individuelle du patient, la dose peut être ajustée dans les limites de cet intervalle thérapeutique efficace.
** En fonction de l'évaluation du médecin concernant la nécessité de contrôler les crises
Adultes
La dose initiale recommandée est de 50 mg/jour. Il est également possible de commencer avec 100 mg/jour, sur la base de l'avis du médecin concernant la nécessité de réduire les crises et en tenant compte des effets indésirables potentiels.
En fonction de la réponse clinique et de la tolérance du patient, la dose efficace peut être ajustée entre 50 mg/jour et 200 mg/jour.
Adolescents et enfants pesant 50 kg ou plus
La dose initiale recommandée est de 50 mg/jour. Le brivaracétam peut également être instauré à 100 mg/jour en fonction de l'évaluation par le médecin de la nécessité de contrôler les crises. La dose d'entretien recommandée est de 100 mg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l'intervalle thérapeutique efficace de 50 mg/jour et 200 mg/jour.
Adolescents et enfants pesant de 20 kg à moins de 50 kg
La dose initiale recommandée est de 1 mg/kg/jour. Le brivaracétam peut également être instauré à des doses pouvant s'élever jusqu'à 2 mg/kg/jour en fonction de l'évaluation par le médecin de la nécessité de contrôler les crises. La dose d'entretien recommandée est de 2 mg/kg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l'intervalle thérapeutique efficace de 1 mg/kg/jour et 4 mg/kg/jour.
Enfants pesant de 10 kg à moins de 20 kg
La dose initiale recommandée est de 1 mg/kg/jour. Le brivaracétam peut également être instauré à des doses pouvant s'élever jusqu'à 2,5 mg/kg/jour en fonction de l'évaluation par le médecin de la nécessité de contrôler les crises. La dose d'entretien recommandée est de 2,5 mg/kg/jour. En fonction de la réponse individuelle de chaque patient, la dose peut être ajustée au sein de l'intervalle thérapeutique efficace de 1 mg/kg/jour à 5 mg/kg/jour.
Comprimés pelliculés:
Le médecin doit prescrire la forme et le dosage les plus adaptés en fonction du poids corporel et de la dose.
Solution buvable:
Le médecin doit prescrire la forme et le dosage les plus adaptés en fonction du poids et de la dose. Il est conseillé aux parents ou aux accompagnateurs d'administrer Briviact, solution buvable à l'aide de la mesurette fournie dans la boîte pliante (seringue pour administration orale de 10 ml ou 5 ml).
La dose par prise pour chaque patient doit être calculée selon la formule suivante:
Volume par administration (ml) = [poids (kg) x dose journalière (mg/kg/jour) ] x 0,05
Briviact, solution buvable est fourni avec:
·une seringue de 5 ml (marques de graduation bleues) avec des traits de graduation de 0,1 ml (chaque trait de graduation de 0,1 ml correspond à 1 mg de brivaracétam). Des graduations supplémentaires à 0,25 ml et 0,75 ml commençant à 0,25 ml jusqu'à 5 ml sont présentes.
·une seringue de 10 ml (marques de graduation noires) avec des traits de graduation de 0,25 ml (chaque trait de graduation de 0,25 ml correspond à 2,5 mg de brivaracétam).
Le médecin doit informer le patient de la seringue appropriée devant être utilisée.
Si la dose calculée par prise est de 5 mg (0,5 ml) ou plus et jusqu'à 50 mg (5 ml), la seringue pour administration orale de 5 ml doit être utilisée.
Si la dose calculée par prise est supérieure à 50 mg (5 ml), la seringue pour administration orale plus grande de 10 ml doit être utilisée.
La dose calculée doit être arrondie au trait de graduation le plus proche. Si la dose calculée est équidistante entre deux traits de graduation, le trait de graduation le plus grand doit être utilisé.
Le tableau ci-dessous donne des exemples de volume de solution buvable par prise en fonction de la dose prescrite et du poids. Le volume précis de solution buvable doit être calculé en fonction du poids exact de l'enfant.
Veuillez noter: le dosage doit respecter les graduations disponibles sur les seringues. Par exemple, pour un patient qui a besoin d'une dose de 2,15 ml, le volume appliqué doit être arrondi à 2,2 ml car la seringue de 5 ml ne peut délivrer que 2,1 ml ou 2,2 ml. De même un volume de 1,13 ml devrait être arrondi à un volume administré de 1,1 ml.
|
|
Volumes de solution buvable à administrer par prise pour les adolescents et enfants pesant 50 kg ou plus, et les adultes
| |
Dose prescrite
|
Pour une dose de 50 mg/Jour
25 mg/
prise
|
Pour une dose de 100 mg/Jour
50 mg/
prise
|
Pour une dose de 150 mg/Jour
75 mg/ prise
|
Pour une dose de 200 mg/Jour
100 mg/ prise
| |
Seringue recommandée
|
5 ml
|
10 ml
| |
Poids corporel
|
Volume administré
|
Volume administré
| |
50 kg ou plus
|
2,5 ml
(25 mg)
|
5 ml
(50 mg)
|
7,5 ml
(75 mg)
|
10 ml
(100 mg)
|
|
|
Volumes de solution buvable à administrer par prise pour les adolescents et les enfants pesant entre 20 kg et moins de 50 kg
| |
Dose prescrite
|
Pour une dose de 1 mg/kg/jour
0,05 ml/kg/prise
(ce qui correspond à 0,5 mg/kg/prise)
|
Pour une dose de 2 mg/kg/jour
0,1 ml/kg/prise
(ce qui correspond à 1 mg/kg/prise)
|
Pour une dose de 3 mg/kg/jour
0,15 ml/kg/prise
(ce qui correspond à 1,5 mg/kg/prise)
|
Pour une dose de 4 mg/kg/jour
0,2 ml/kg/prise
(ce qui correspond à 2 mg/kg/prise)
| |
Seringue recommandée
|
5 ml
|
5 ml ou 10 ml*
| |
Poids corporel
|
Volume administré
|
Volume administré
| |
20 kg
|
1 ml
(10 mg)
|
2 ml
(20 mg)
|
3 ml
(30 mg)
|
4 ml
(40 mg)
| |
25 kg
|
1,25 ml
(12,5 mg)
|
2,5 ml
(25 mg)
|
3,75 ml
(37,5 mg)
|
5 ml
(50 mg)
| |
30 kg
|
1,5 ml
(15 mg)
|
3 ml
(30 mg)
|
4,5 ml
(45 mg)
|
6 ml*
(60 mg)
| |
35 kg
|
1,75 ml
(17,5 mg)
|
3,5 ml
(35 mg)
|
5,25 ml*
(52,5 mg)
|
7 ml*
(70 mg)
| |
40 kg
|
2 ml
(20 mg)
|
4 ml
(40 mg)
|
6 ml*
(60 mg)
|
8 ml*
(80 mg)
| |
45 kg
|
2,25 ml
(22,5 mg)
|
4,5 ml
(45 mg)
|
6,75 ml*
(67,5 mg)
|
9 ml*
(90 mg)
| |
* Pour un volume supérieur à 5 ml et jusqu'à 10 ml, le patient doit être informé d'utiliser la seringue pour administration orale de 10 ml
|
|
|
Volumes de solution buvable à administrer par prise pour des enfants pesant entre 10 kg et moins de 20 kg
| |
Dose
prescrite
|
Pour une dose de 1 mg/kg/jour
0,05 ml/kg/prise
(ce qui correspond à 0,5 mg/kg/prise)
|
Pour une dose de 2,5 mg/kg/jour
0,125 ml/kg/prise
(ce qui correspond à 1,25 mg/kg/prise)
|
Pour une dose de 3 mg/kg/jour
0,15 ml/kg/prise
(ce qui correspond à 1,5 mg/kg/prise)
|
Pour une dose de 4 mg/kg/jour
0,2 ml/kg/prise
(ce qui correspond à 2 mg/kg/prise)
|
Pour une dose de 5 mg/kg/jour
0,25 ml/kg/prise
(ce qui correspond à 2,5 mg/kg/prise)
| |
Seringue recommandée: 5 ml
| |
Poids
|
Volume administré
| |
10 kg
|
0,5 ml
(5 mg)
|
1,25 ml
(12,5 mg)
|
1,5 ml
(15 mg)
|
2 ml
(20 mg)
|
2,5 ml
(25 mg)
| |
12 kg
|
0,6 ml
(6 mg)
|
1,5 ml
(15 mg)
|
1,8 ml
(18 mg)
|
2,4 ml
(24 mg)
|
3,0 ml
(30 mg)
| |
14 kg
|
0,7 ml
(7 mg)
|
1,75 ml
(17,5 mg)
|
2,1 ml
(21 mg)
|
2,8 ml
(28 mg)
|
3,5 ml
(35 mg)
| |
15 kg
|
0,75 ml
(7,5 mg)
|
1,9 ml
(19,0 mg)
|
2,25 ml
(22,5 mg)
|
3 ml
(30 mg)
|
3,75 ml
(37,5 mg)
|
Solution injectable/pour perfusion
La solution injectable/pour perfusion de brivaracetam constitue un mode d'administration alternatif pour les patients chez qui une administration orale est temporairement impossible. Il n'existe aucune donnée sur l'administration intraveineuse du brivaracétam deux fois par jour sur des périodes de plus de 4 jours.
Oubli de doses
Les patients qui ont oublié une ou plusieurs doses doivent prendre une seule dose dès qu'ils s'en souviennent puis continuer le traitement avec la dose habituelle le matin ou le soir.
Arrêt du traitement
Pour les patients âgés de 16 ans et plus, si le traitement par brivaracétam doit être arrêté, il est recommandé de diminuer progressivement la dose par paliers de 50 mg par jour chaque semaine.
Pour les patients de moins de 16 ans, si le traitement par brivaracétam doit être arrêté, il est recommandé de diminuer la dose au maximum d'une demi-dose chaque semaine, jusqu'à ce que la dose de 1 mg/kg/jour (pour les patients dont le poids corporel est inférieur à 50 kg) ou 50 mg/jour (pour les patients dont le poids corporel est de 50 kg ou plus) soit atteinte.
Après une semaine de traitement à la dose de 50 mg/jour, une dernière semaine de traitement à la dose de 20 mg/jour est recommandée avant de complètement arrêter le traitement.
Mode d'emploi
Le brivaracétam peut être pris au cours ou en dehors des repas.
La dose doit être administrée en deux prises égales, à environ 12 heures d'intervalle.
Le brivaracétam peut être initié par voie intraveineuse ou par voie orale. Lors du passage de la voie orale à la voie intraveineuse, ou inversement, la dose journalière totale et la fréquence d'administration doivent être maintenues. Le brivaracétam en solution injectable est une alternative pour les patients chez lesquels l'administration orale est temporairement impossible.
Comprimés pelliculés:
Les comprimés pelliculés doivent être avalés avec du liquide sans être croqués.
Les patients ne pouvant pas avaler de comprimés entiers ou les patients pour lesquels la dose appropriée ne peut être atteinte avec des comprimés entiers doivent utiliser Briviact 10 mg/ml en solution buvable.
Solution buvable:
La solution buvable de brivaracétam peut être diluée dans l'eau ou dans du jus de fruit peu de temps avant d'être avalée et peut être prise avec ou sans nourriture (voir rubrique «Pharmacocinétique»).
Une sonde gastrique ou PEG peut être utilisée pour l'administration de la solution buvable.
Briviact, solution buvable est fourni avec une seringue pour administration orale de 5 ml et une seringue de 10 ml et leur adaptateur.
Solution injectable:
Bolus intraveineux:
Le brivaracétam peut être administré en bolus intraveineux sans dilution.
Perfusion intraveineuse:
Le brivaracétam peut être dilué dans une solution pour perfusion compatible [voir «Remarques concernant la manipulation»] et administré en perfusion intraveineuse de 15 minutes.
Un goût amer peut apparaître après une administration intraveineuse.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique
L'exposition au brivaracétam est respectivement augmentée de 50 %, 57 % et 59 % en fonction des stades de Child Pugh A, B et C chez les patients présentant une maladie hépatique chronique en comparaison au groupe contrôle sain.
Chez les patients atteints d'insuffisance hépatique, les doses ajustées suivantes, administrées en 2 prises égales à environ 12 heures d'intervalle, sont recommandées quel que soit le stade de l'insuffisance hépatique (voir les rubriques «Mises en garde et précautions» et «Pharmacocinétique»). Il n'existe aucune donnée clinique chez les patients pédiatriques présentant une insuffisance hépatique.
|
Âge et poids corporel
|
Dose initiale
recommandée
|
Dose quotidienne
maximale recommandée
| |
Adolescents et enfants pesant 50 kg ou plus, et
adultes
|
50 mg/jour
|
150 mg/jour
| |
Adolescents et enfants pesant de 20 kg à moins de
50 kg
|
1 mg/kg/jour
|
3 mg/kg/jour
| |
Enfants pesant de 10 kg à moins de 20 kg
|
1 mg/kg/jour
|
4 mg/kg/jour
|
Patients présentant des troubles de la fonction rénale
Aucun ajustement posologique n'est nécessaire chez les patients atteints d'insuffisance rénale légère. Les patients atteints d'insuffisance rénale modérée ou sévère ne doivent pas être traités par brivaracétam [voir «Mises en garde et précautions»].
En raison du manque de données, le brivaracétam n'est pas recommandé chez les patients atteints d'insuffisance rénale terminale sous dialyse. Il n'existe aucune donnée clinique chez les patients pédiatriques présentant une insuffisance rénale.
Patients âgés
Aucun ajustement posologique n'est nécessaire chez les patients âgés dans la mesure où ils disposent d'une fonction rénale suffisamment bonne (clairance de la créatinine >50 ml/min) [voir «Pharmacocinétique»].
L'expérience clinique avec le brivaracétam chez les patients âgés de ≥65 ans est limitée. Un premier traitement ne devrait pas être administré à des patients âgés de ≥75 ans [voir «Efficacité clinique»].
Patients pédiatriques de moins de 2 ans
L'efficacité du brivaracétam chez les patients pédiatriques âgés de moins de 2 ans n'a pas encore été établie. Les données actuellement disponibles sont décrites aux rubriques «Effets indésirables», «Propriétés/Effets» et «Pharmacocinétique» mais aucune recommandation sur la posologie ne peut être donnée.
Contre-indicationsHypersensibilité au brivaracétam, aux substances apparentées ou à l'un des excipients.
Mises en garde et précautionsIdées et comportements suicidaires
Des cas d'idées et de comportements suicidaires ont été rapportés chez des patients traités par des médicaments antiépileptiques, y compris par le brivaracétam, dans plusieurs indications. Une méta-analyse d'études cliniques randomisées, contrôlées contre placebo, portant sur des antiépileptiques, a également montré une légère augmentation du risque d'idées et de comportements suicidaires. Le mécanisme de ce risque n'est pas connu et les données disponibles n'excluent pas la possibilité d'une augmentation de ce risque avec le brivaracétam.
Les patients doivent donc être surveillés afin de détecter des signes d'idées et de comportements suicidaires et un traitement approprié devra être envisagé. Il faudra recommander aux patients (et à leurs aidants) de consulter un médecin dans les plus brefs délais en cas de survenue de signes d'idées ou de comportements suicidaires. Voir la rubrique «Effets indésirables», données pédiatriques.
Insuffisance hépatique
Les données cliniques concernant l'utilisation de brivaracétam chez les patients présentant une insuffisance hépatique préexistante sont limitées.
Des ajustements de la posologie sont recommandés chez les patients atteints d'insuffisance hépatique [voir «Posologie/Mode d'emploi»].
Insuffisance rénale
Les données cliniques concernant l'utilisation de brivaracétam chez les patients présentant une insuffisance rénale modérée ou sévère sont limitées. Le brivaracétam ne devrait pas être utilisé chez les patients présentant une insuffisance rénale modérée ou sévère [voir «Pharmacocinétique/Insuffisance rénale»].
Comprimés pelliculés
Les comprimés pelliculés avec 10 mg, 25 mg, 50 mg, 75 mg et 100 mg de brivaracétam contiennent respectivement 88 mg, 95 mg, 188 mg, 283 mg et 377 mg de lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Les comprimés pelliculés Briviact contiennent moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'ils sont essentiellement «sans sodium».
Solution buvable
La solution buvable contient du parahydroxybenzoate de méthyle (E218), qui peut provoquer des réactions allergiques (éventuellement retardée).
La solution buvable Briviact contient 167,9 mg de sorbitol par ml. Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas prendre ce médicament.
La solution buvable Briviact contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'elle est essentiellement «sans sodium».
Solution injectable
La solution injectable Briviact contient moins de 1 mmol (23 mg) de sodium par flacon (5 ml), c.-à-d. qu'elle est essentiellement «sans sodium».
InteractionsDonnées in vitro
L'hydrolyse du brivaracétam est médiée par des amidases indépendantes des CYP. L'hydroxylation du brivaracétam, principalement médiée par le CYP2C19, semble représenter une voie secondaire d'élimination. L'oxydation médiée par les CYP est responsable d'une proportion limitée de l'élimination du brivaracétam. Pour cette raison, il est peu probable que l'élimination du brivaracétam soit significativement influencée par des inhibiteurs des CYP (p.ex. CYP1A, 2C8, 2C9, 2C19, 2D6 et 3A4).
Des données cliniques limitées indiquent que l'administration concomitante de cannabidiol peut augmenter l'exposition plasmatique du brivaracetam. Cela peut s'expliquer, au moins en partie, par l'inhibition du CYP2C19. La pertinence clinique n'est pas claire.
Inhibition d'enzymes métabolisant des médicaments
Il est peu probable que le brivaracétam inhibe ou induise la clairance d'autres médicaments métabolisés par des isoformes du CYP450. Les essais in vitro ont montré que le brivaracétam à des concentrations plasmatiques thérapeutiques n'inhibe que peu ou pas les isoformes du CYP450 (CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 3A4).
Le brivaracétam est un inhibiteur de l'époxyde hydrolase (CI50 = 8,2 µM), ce qui suggère que le brivaracétam peut inhiber l'enzyme in vivo.
Induction d'enzymes métabolisant des médicaments
Le brivaracétam n'a, pour des concentrations allant jusqu'à 10 µM, entraîné que peu ou pas de modifications de l'expression de l'ARNm des CYP1A2, 2B6, 2C9, 2C19, 3A4 et de l'époxyde hydrolase. Une induction de ces enzymes par des concentrations thérapeutiques de brivaracétam (Cmax = 13 µM) ne peut pas être exclue.
Transporteurs
Le brivaracétam n'est pas un substrat de la P-gp, la MRP1 ou la MRP2.
Le brivaracétam n'a pas inhibé les transporteurs P-gp, BCRP, BSEP, MRP2, MATE1, MATE2/K, OATP1B1, OATP1B3, OAT1, OCT1, OCT2 in vitro. Le brivaracétam a inhibé l'OAT3 avec une demi concentration inhibitrice maximale 42 fois supérieure à la Cmax de la dose clinique maximale. Le métabolite principal (métabolite hydroxylé) a entraîné une inhibition statistiquement significative de la BCRP et de l'OCT1 (inhibition de resp. 15 et 39%) à des concentrations suprathérapeutiques in vitro.
Données in vivo
Les études d'interaction n'ont été réalisées que chez des adultes.
Interactions entre le brivaracétam et d'autres médicaments
Le tableau 1 contient une liste des interactions cliniques pertinentes prouvées ou potentielles, mises en évidence par les variations de l'AUC et de la Cmax avec les symboles «↔» (au sein), «↑» (au-dessus) ou «↓» (au-dessous) des limites d'équivalence prédéfinies, le rapport des moyennes géométriques des moindres carrés [moyenne géométrique] avec et sans médicament interagissant ainsi que l'intervalle de confiance à 90% correspondant.
Les interactions médicamenteuses décrites ont été observées soit dans des études de phase 1, soit dans une analyse poolée des concentrations plasmatiques de principes actifs, soit dans des modèles pharmacocinétiques de population issus des données d'études de phase 2/3.
Un ajustement de la posologie n'est pas nécessaire lorsque le brivaracétam est utilisé de façon concomitante avec les médicaments cités dans la liste, à l'exception de la rifampicine, la rifabutine et la rifapentine (voir tableau 1).
Tableau 1: interactions entre le brivaracétam et d'autres médicaments
Rapports des moyennes géométriques de l'AUC et de la Cmax avec/sans médicament interagissant (intervalle de confiance à 90%)
|
Médicament en fonction de l'emploi thérapeutique
|
Effets du médicament sur la concentration plasmatique du brivaracétam
|
Effets du brivaracétam sur la concentration plasmatique du médicament
|
Recommandation en ce qui concerne l'utilisation concomitante avec le brivaracétam
| |
ANTICONVULSIVANTS
| |
Carbamazépine
|
Carbamazépine
600 mg/jour
AUC ↓ 0,74 (0,71; 0,77)
Cmax ↓ 0,87 (0,74; 1,02)
Carbamazépine
200-2400 mg/jour
AUC ↓ 0,74 (0,72; 0,76)
|
Brivaracétam 400 mg/jour
AUC ↔ 0,88 (0,85; 0,90)
Cmax ↔ 0,89 (0,86; 0,93)
Brivaracétam 50-200 mg/jour
Css ↔ 0,94 (0,92; 0,96)
|
Aucun ajustement de la posologie nécessaire
| |
Époxyde de carbamazépine
|
Non pertinent
|
Brivaracétam
400 mg/jour
AUC ↑ 2,57 (2,42; 2,74)
Cmax ↑ 2,64 (2,41; 2,89)
Brivaracétam
50-200 mg/jour
Css ↑ 1,63 (1,58; 1,67)
|
Aucun ajustement de la posologie nécessaire.
Aucune toxicité n'a été mise en évidence dans les études contrôlées.
| |
Clobazam
|
Interaction non examinée
Attendu: ↔
|
Brivaracétam
100-200 mg/jour
Css ↔ 0,95 (0,85; 1,05)
|
Aucun ajustement de la posologie nécessaire
| |
Clonazépam
|
Interaction non examinée
Attendu: ↔
|
Brivaracétam
100-200 mg/jour
Css ↔ 0,98 (0,87; 1,11)
|
Aucun ajustement de la posologie nécessaire
| |
Lacosamide
|
Interaction non examinée
Attendu:↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 0,95 (0,90; 1,00)
|
Aucun ajustement de la posologie nécessaire
| |
Lamotrigine
|
Aucune interaction
AUC ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,08 (1,05; 1,11)
Brivaracétam 400 mg
AUC ↔ 1,17 (1,09; 1,25)
Cmax ↔ 1,10 (1,03; 1,17)
|
Aucun ajustement de la posologie nécessaire
| |
Lévétiracétam
|
Aucune interaction
AUC ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,06 (0,99; 1,13)
|
Aucun ajustement de la posologie nécessaire
| |
Oxcarbazépine
|
Aucune interaction
AUC ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,01 (0,98; 1,05)
|
Aucun ajustement de la posologie nécessaire
| |
Phénobarbital
|
AUC ↓ 0,81 (0,76; 0,86)
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,02 (0,99; 1,05)
|
Aucun ajustement de la posologie nécessaire
| |
Phénytoïne
|
Phénytoïne
250-600 mg/jour
AUC ↓ 0,79 (0,75; 0,83)
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,02 (0,91; 1,14)
Brivaracétam
400 mg/jour
AUC ↑ 1,20 (1,01; 1,42)
Cmax ↑ 1,20 (1,03; 1,40)
|
Aucun ajustement de la posologie nécessaire
| |
Prégabaline
|
Interaction non examinée
Attendu: ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,12 (0,99; 1,27)
|
Aucun ajustement de la posologie nécessaire
| |
Topiramate
|
Aucune interaction
AUC ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 0,98 (0,94; 1,03)
Brivaracétam 400 mg
AUC ↔ 0,95 (0,89; 1,01)
Cmax ↔ 0,98 (0,93; 1,03)
|
Aucun ajustement de la posologie nécessaire
| |
Acide valproïque
|
Aucune interaction
AUC ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,00 (0,97; 1,03)
|
Aucun ajustement de la posologie nécessaire
| |
Zonisamide
|
Interaction non examinée
Attendu: ↔
|
Brivaracétam
50-200 mg/jour
Css ↔ 1,01 (0,95; 1,07)
|
Aucun ajustement de la posologie nécessaire
| |
AGENTS HYPOLIPÉMIANTS/FIBRATES
| |
Gemfibrozil
|
Gemfibrozil 1200 mg/jour
AUC ↔ 0,95 (0,93; 0,97)
Cmax ↔ 1,01 (0,94; 1,08)
|
Interaction non examinée
Attendu: ↔
|
Aucun ajustement de la posologie nécessaire
| |
ANTIMYCOBACTÉRIENS
| |
Rifampicine
|
Rifampicine 600 mg/jour
AUC ↓ 0,55 (0,53; 0,58)
Cmax ↔ 0,89 (0,83; 0,95)
|
Interaction non examinée
Attendu: ↔
|
Une élévation de la dose de brivaracétam devrait être prise en compte.
| |
Rifabutine
Rifapentine
|
Interactions non examinées
Attendu: ↓
|
Interactions non examinées
Attendu: ↔
|
Une élévation de la dose de brivaracétam devrait être prise en compte.
| |
PRÉPARATIONS PHYTHOTHÉRAPEUTIQUES
| |
Millepertuis
(Hypericum perforatum)
|
Interaction non examinée
Attendu: ↓
|
Interaction non examinée
Attendu: ↔
|
Un traitement avec du millepertuis doit être initié resp. arrêté avec précaution.
| |
CONTRACEPTIFS ORAUX
| |
Lévonorgestrel (LVN) Éthinylestradiol (EES)
|
LVN 150 µg/jour
EES 30 µg/jour
Ctrough ↔ 1,10 (1,01-1,20)
|
Brivaracétam
100 mg/jour
EES AUC ↔ 0,90 (0,86; 0,95)
EES Cmax ↔ 0,96 (0,88; 1,04)
LVN AUC ↔ 0,92 (0,88; 0,97)
LVN Cmax ↔ 0,95 (0,91; 0,99)
Brivaracétam
400 mg/jour
EES AUC ↓ 0,73 (0,69; 0,78)
EES Cmax ↓ 0,86 (0,79; 0,94)
LVN AUC ↓ 0,78 (0,72; 0,83)
LVN Cmax ↔ 0,90 (0,85; 0,95)
Aucune modification des marqueurs endogènes estradiol, progestérone, hormone lutéinisante, hormone folliculo-stimulante et globuline liant les hormones sexuelles n'a été observée.
|
Aucun ajustement de la posologie nécessaire.
Une perte de l'effet des contraceptifs oraux après administration de 200 mg de brivaracétam par jour ne peut pas être exclue.
| |
SOMNIFÈRES
| |
Midazolam
|
Interaction non examinée
Attendu: ↔
|
Brivaracétam
150 mg/jour
AUC ↔1,08 (0,97; 1,21)
Cmax ↑ 1,49 (1,18; 1,87)
|
Aucun ajustement de la posologie nécessaire
|
Notes:
·Les effets de la carbamazépine, du phénobarbital et de la phénytoïne sur le brivaracétam ont été examinés dans une analyse rétrospective de pharmacocinétique de population et étaient statistiquement significatifs.
·Les effets de la lamotrigine, du lévétiracétam, de l'oxcarbazépine, du topiramate et de l'acide valproïque ont été examinés dans une analyse rétrospective de pharmacocinétique de population et n'étaient pas statistiquement significatifs.
·Css = concentration plasmatique à l'état d'équilibre obtenue lors du suivi thérapeutique pharmacologique des patients; les données sont basées sur des doses thérapeutiques de brivaracétam de 50 à 200 mg/jourCtrough = concentration avant l'administration de la dose à l'état d'équilibre
Autres
L'ampleur de la résorption du brivaracétam n'est pas influencée par les aliments.
Une étude d'interaction pharmacocinétique et pharmacodynamique entre le brivaracétam 200 mg en dose unique et l'éthanol 0,6 g/l en perfusion continue chez des sujets sains a montré que le brivaracétam a presque doublé l'effet de l'alcool sur les fonctions psychomotrices, l'attention et la mémoire. Aucune interaction pharmacocinétique mutuelle n'a été enregistrée. La prise de brivaracétam avec de l'alcool n'est pas recommandée.
Grossesse, allaitementFemmes en âge de procréer
Les médecins doivent parler de planification familiale et de contraception avec les femmes en âge de procréer traitées par brivaracétam.
Une perte de l'effet des contraceptifs oraux ne pouvant pas être exclue, des méthodes contraceptives non hormonales devraient être utilisées.
Si une femme prévoit une grossesse, l'utilisation de brivaracétam devra être soigneusement réévaluée.
Grossesse
Il n'existe pas de données suffisantes concernant l'utilisation du brivaracétam chez la femme enceinte.
Il n'existe pas de données concernant le passage transplacentaire chez l'humain, mais les études chez le rat ont montré que le brivaracétam traverse le placenta (voir «Données précliniques»). Le risque potentiel pour l'être humain n'est pas connu.
Les études chez l'animal, que cela soit chez le rat ou le lapin, n'ont détecté aucun potentiel tératogène du brivaracétam (voir «Données précliniques»).
Le brivaracétam a été utilisé en association dans des études cliniques et a entraîné une augmentation dose-dépendante de la concentration du métabolite actif époxycarbamazépine lors d'une administration concomitante avec la carbamazépine (voir «Interactions»). Il n'existe pas de données suffisantes pour déterminer la pertinence clinique de cet effet pendant la grossesse.
Le brivaracétam ne doit pas être administré pendant la grossesse, sauf lorsque cela est clairement nécessaire.
Allaitement
Le brivaracétam est excrété dans le lait maternel humain. Une décision concernant l'interruption de l'allaitement ou l'interruption de l'administration de brivaracétam doit être prise en tenant compte des bénéfices du médicament pour la mère. En cas de co-administration de brivaracétam et de carbamazépine, la quantité d'époxycarbamazépine excrétée dans le lait maternel pourrait augmenter. Les données sont insuffisantes pour déterminer la pertinence clinique.
Fertilité
Il n'existe pas de données sur l'effet du brivaracétam sur la fertilité humaine. Chez le rat, le traitement par brivaracétam n'a pas eu d'effet sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude relative aux effets sur l'aptitude à la conduite et l'utilisation de machines n'a été effectuée.
Le brivaracétam peut avoir un effet sur l'aptitude à la conduite et l'utilisation de machines.
En raison des différences possibles de sensibilité individuelle, certains patients pourraient présenter une somnolence, des sensations vertigineuses et d'autres troubles du système nerveux central au début du traitement ou après une augmentation de la dose. Il faut suggérer aux patients de ne pas conduire de véhicules ni d'utiliser de machines potentiellement dangereuses avant d'être familiarisés avec les effets du brivaracétam sur leur capacité à effectuer ce type d'activités.
Effets indésirablesDans les études contrôlées et non contrôlées menées chez des patients épileptiques, 2388 patients ont au total reçu du brivaracétam. Parmi ces patients, 1740 ont été traités pendant ≥6 mois, 1363 pendant ≥12 mois, 923 pendant ≥24 mois, 733 pendant ≥36 mois et 569 pendant ≥60 mois (5 ans).
Dans les études d'association poolées contrôlées contre placebo menées chez 1558 patients adultes avec des crises partielles (1099 patients ont reçu du brivaracétam, 459 un placebo), des effets indésirables sont survenus chez 68,3% des patients traités par brivaracétam et 62,1% des patients traités par placebo.
Les effets indésirables les plus fréquemment rapportés (>10%) avec le brivaracétam étaient une somnolence (14,3%) et des sensations vertigineuses (11,0%). L'intensité était en règle générale légère à modérée. Somnolence et fatigue (8,2%) étaient plus fréquemment rapportées à une dose plus élevée. Les types d'effets indésirables rapportés au cours des 7 premiers jours de traitement ressemblaient à ceux de l'ensemble de la période de traitement.
Le taux d'interruption suite à des effets indésirables était de 6,0%, 7,4% et 6,8% chez les patients qui avaient reçu respectivement 50 mg/jour, 100 mg/jour et 200 mg/jour de brivaracétam et de 3,5% chez les patients qui avaient reçu le placebo. Les effets indésirables qui entraînaient le plus fréquemment l'interruption du traitement par brivaracétam étaient les sensations vertigineuses (0,8%) et les convulsions (0,8%).
La liste suivante présente les effets indésirables des études cliniques poolées contrôlées contre placebo avec le brivaracétam chez des patients ≥16 ans par classe de système d'organes et fréquence.
La fréquence est définie comme suit: «très fréquent» (≥1/10), «fréquent» (≥1/100, <1/10), «peu fréquent» (≥1/1000, <1/100). Dans les groupes individuels de fréquence, les effets indésirables sont indiqués par degré de sévérité décroissant.
Infections et infestations
Fréquent: grippe.
Affections du système immunitaire
Peu fréquent: hypersensibilité immédiate (type I).
Affections hématologiques et du système lymphatique
Peu fréquent: neutropénie.
Troubles du métabolisme et de la nutrition
Fréquent: diminution de l'appétit.
Affections psychiatriques
Fréquent: dépression, anxiété, insomnie, irritabilité.
Peu fréquent: idées suicidaires, agressivité, agitation, troubles psychotiques.
Affections du système nerveux
Très fréquent: sensations vertigineuses, somnolence.
Fréquent: convulsion, vertiges.
Affections respiratoires, thoraciques et médiastinales
Fréquent: infections des voies respiratoires supérieures, toux.
Affections gastro-intestinales
Fréquent: nausées, vomissements, constipation.
Troubles généraux et anomalies au site d'administration
Fréquent: fatigue
Description d'effets indésirables sélectionnés
Une neutropénie a été observée chez 0,5% (6/1099) des patients traités par brivaracétam et 0% (0/459) des patients sous placebo. Quatre de ces sujets présentaient une diminution du nombre de neutrophiles à l'inclusion, et ont présenté une diminution supplémentaire du nombre de neutrophiles après l'introduction du brivaracétam. Aucun des 6 cas de neutropénie n'était sévère, n'a requis de traitement spécifique ou n'a conduit à l'arrêt du traitement par brivaracétam et aucun n'a présenté d'infections associées.
Des cas d'idées suicidaires ont été rapportés chez 0,3% (3/1099) des patients traités par brivaracétam et 0,7% (3/459) des patients sous placebo. Dans les études cliniques à court terme du brivaracétam menées chez des patients atteints d'épilepsie, aucun cas de suicide ou de tentative de suicide n'a été observé. Ces événements ont toutefois tous deux été rapportés dans les études d'extension en ouvert.
Des réactions évoquant une hypersensibilité immédiate (type I) ont été rapportées chez un faible nombre de patients traités par brivaracétam (9/3022) au cours du développement clinique.
Population pédiatrique
Le profil de sécurité du brivaracétam observé chez les enfants à partir d'1 mois est comparable au profil de sécurité observé chez les adultes. Dans les études à long terme, en ouvert, non contrôlées, des idées suicidaires ont été rapportées chez 4,7 % des patients pédiatriques (évalués à partir de l'âge de 6 ans, plus fréquent chez les adolescents) comparé à 2,4 % chez les adultes. En outre, des troubles du comportement ont été rapportés chez 24,8 % des patients pédiatriques comparé à 15,1 % chez les adultes. La majorité des événements étaient d'intensité légère à modérée, non graves et n'ont pas entraîné l'arrêt du médicament étudié. Un effet indésirable additionnel a été observé chez les enfants: l'hyperactivité psychomotrice (4,7 %). De plus, une perte d'appétit a été souvent rapportée dans la population pédiatrique (10,1 %), comparable en fréquence à celle observée chez les adultes.
Aucun schéma spécifique d'événement indésirable (EI) n'a été identifié chez les enfants à partir d'1 mois et jusqu'à < 4 ans, comparativement à des tranches d'âge pédiatrique plus élevées. Aucune information de sécurité considérée comme significative n'a été identifiée indiquant une incidence accrue d'un EI particulier dans cette tranche d'âge.
Les données disponibles chez les enfants de moins de 2 ans étant limitées, le brivaracétam n'est pas indiqué pour cette tranche d'âge. Les données cliniques disponibles chez les nouveau-nés sont très limitées.
Administration intraveineuse
Les effets indésirables lors de l'administration intraveineuse ressemblaient en général à ceux d'une administration orale. Lors de l'administration intraveineuse, 2,8% des patients ont présenté des douleurs au site de perfusion.
Études d'extension en ouvert
Le profil de sécurité dans les études d'extension en ouvert (jusqu'à 8 ans) a été comparable à celui observé dans les études à court terme contrôlées contre placebo.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
L'expérience clinique sur le surdosage avec du brivaracétam chez l'homme est limitée. Somnolence et sensations vertigineuses ont été rapportées chez un volontaire sain ayant reçu une dose unique de 1400 mg de brivaracétam.
Traitement
Il n'existe pas d'antidote spécifique en cas de surdosage de brivaracétam. Le traitement d'un surdosage doit comprendre des mesures générales de soutien. Moins de 10% du brivaracétam étant éliminés dans les urines, l'hémodialyse ne devrait pas améliorer significativement l'élimination du brivaracétam [voir «Pharmacocinétique»].
Propriétés/EffetsCode ATC
N03AX23
Mécanisme d'action
Le brivaracétam présente une affinité élevée et sélective pour la protéine 2A des vésicules synaptiques (SV2A), une glycoprotéine transmembranaire présente dans les neurones et cellules endocrines au niveau présynaptique. La liaison à SV2A est considérée comme étant le principal mécanisme de l'activité anticonvulsivante du brivaracétam.
Pharmacodynamique
Impact sur l'intervalle QT
Chez les sujets sains, il n'y a eu aucun indice que le brivaracétam prolonge l'intervalle QTc aux doses de 150 mg/jour et 800 mg/jour (4x la dose journalière maximale recommandée).
Efficacité clinique
L'efficacité du brivaracétam en association dans le traitement des crises d'origine focale a été établie dans trois études cliniques multicentriques, randomisées en double aveugle (N01252, N01253 et N01358), contrôlées contre placebo, à dose fixe. Dans ces études, la dose quotidienne de brivaracétam était de 5 à 200 mg/jour. Toutes les études comportaient une période initiale de 8 semaines suivie d'une période de traitement de 12 semaines sans augmentation de dose. Parmi les 1558 patients participant à l'étude, 1099 ont reçu du brivaracétam. Selon les critères d'inclusion de l'étude, les patients devaient présenter des crises non contrôlées d'origine focale malgré un traitement par 1 ou 2 antiépileptiques concomitants. Les patients devaient présenter au moins 8 crises d'origine focale pendant la période initiale.
Les antiépileptiques les plus fréquemment utilisés au moment de l'inclusion dans les études ont été: carbamazépine (40,6%), lamotrigine (25,2%), valproate (20,5%), oxcarbazépine (16,0%), topiramate (13,5%), phénytoïne (10,2%) et lévétiracétam (9,8%) [voir «Efficacité clinique/Traitement par lévétiracétam»]. La fréquence médiane des crises durant la période initiale sur l'ensemble des trois études était de 9 crises en 28 jours. La durée moyenne de l'épilepsie des patients était d'environ 23 ans.
Le tableau 2 présente une synthèse des résultats d'efficacité.
Les résultats du pourcentage de réduction, en comparaison au placebo, de N01252 et N01253, se basent sur la fréquence des crises d'origine focale en l'espace de 28 jours, pour permettre la comparaison avec les résultats de N01358, bien que les analyses primaires de l'efficacité de N01252 et N01253 reposent sur la fréquence des crises d'origine focale en l'espace de 7 jours. Les résultats concernant la significativité statistique n'ont pas été influencés par la modification de la durée en fonction de laquelle la fréquence des crises d'origine focale a été standardisée pour N01252 et N01253.
Tableau 2: principaux résultats d'efficacité sur la fréquence des crises d'origine focale, en l'espace de 28 jours
|
Étude
|
Placebo
|
Brivaracétam
*Statistiquement significatif (valeur p)
| |
50
mg/jour
|
100 mg/jour
|
200 mg/jour
| |
Étude N01253(1)
| |
|
n = 96
|
n = 101
|
|
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
22,0* (p=0,004)
|
~
|
~
| |
Taux de répondeurs à 50%** (%)
|
16,7
|
32,7* (p=0,008)
|
~
|
~
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,8
|
30,5* (p=0,003)
|
~
|
~
| |
Étude N01252(1)
| |
|
n = 100
|
n = 99
|
n = 100
|
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
9,2
(p=0,274)
|
20,5(2)
(p=0,01)
|
~
| |
Taux de répondeurs à 50%** (%)
|
20,0
|
27,3
(p=0,372)
|
36,0(2)
(p=0,023)
|
~
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,0
|
26,8
(p=0,092)
|
32,5(2)
(p=0,004)
|
~
| |
Étude N01358
| |
|
n = 259
|
|
n = 252
|
n = 249
| |
Pourcentage de réduction par rapport au placebo (%)
|
NA
|
~
|
22,8* (p<0,001)
|
23,2*
(p<0,001)
| |
Taux de répondeurs à 50%** (%)
|
21,6
|
~
|
38,9 (p<0,001)
|
37,8
(p<0,001)
| |
Pourcentage de réduction médian à partir de la valeur initiale (%)
|
17,6
|
~
|
37,2* (p<0,001)
|
35,6*
(p<0,001)
|
n = patients randomisés ayant reçu au moins une dose du médicament expérimental
~ Dose non étudiée
* Statistiquement significatif
** Taux de répondeurs à 50%: pourcentage de patients chez lesquels il y a eu une réduction de la fréquence des crises d'origine focale d'au moins 50% en l'espace de 28 jours, de la valeur initiale à la période de traitement.
(1) Environ 20% des patients ont reçu un traitement concomitant par lévétiracétam.
(2) Le critère primaire de N01252 n'a pas atteint la significativité statistique selon la procédure de test séquentiel, lequel exigeait la significativité statistique à 0,050 pour la dose de 50 mg/jour de brivaracétam par rapport au placebo avant les tests avec 100 mg/jour de brivaracétam. La dose de 100 mg/jour a été nominalement significative.
La figure 1 présente la proportion de patients (excluant les patients traités de façon concomitante par lévétiracétam) classée par pourcentage de réduction de la fréquence des crises d'origine focale par période de 28 jours par rapport à la fréquence initiale dans les trois études. Les patients avec une augmentation de plus de 25% des crises d'origine focale sont représentés à gauche du graphique sous «aggravation» (worse). Les patients avec une amélioration en termes de réduction de la fréquence des crises d'origine focale par rapport à la fréquence initiale apparaissent dans les quatre catégories de droite. Les pourcentages de patients ayant obtenu une réduction d'au moins 50% de la fréquence des crises ont été respectivement de 20,3%, 34,2%, 39,5% et 37,8% dans le groupe placebo et les groupes brivaracétam 50 mg/jour, 100 mg/jour et 200 mg/jour.
Figure 1: proportion de patients classée par pourcentage de réduction de la fréquence des crises par rapport à la fréquence initiale dans les groupes brivaracétam et placebo pendant 12 semaines issue des trois études cliniques pivots en double aveugle
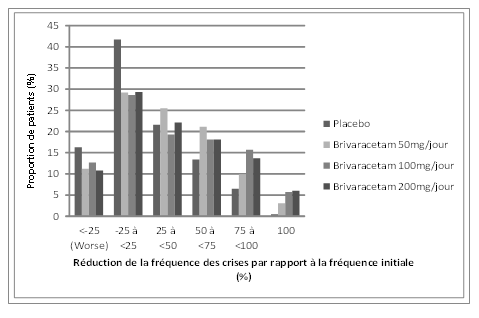
Dans une analyse poolée des trois études pivots, aucune différence d'efficacité (mesurée par le taux de répondeurs à 50%) n'a été observée lorsque le brivaracétam était associé à des antiépileptiques inducteurs ou non inducteurs.
Dans les études cliniques, 2,5% (4/161), 5,1% (17/332) et 4,0% (10/249) des patients recevant respectivement du brivaracétam 50 mg/jour, 100 mg/jour et 200 mg/jour sont devenus libres de crises pendant la période de traitement de 12 semaines versus 0,5% (2/418) des patients recevant le placebo.
L'efficacité du brivaracétam en monothérapie n'a pas été examinée. Le brivaracétam ne doit pas être administré en monothérapie.
Traitement par lévétiracétam
Dans les études cliniques N01252 et N01253, le lévétiracétam a été l'antiépileptique concomitant administré chez environ 20% des patients. Chez les patients recevant un traitement concomitant par lévétiracétam, aucun bénéfice du brivaracétam par rapport au placebo n'a été observé. Aucun problème de sécurité ou de tolérance supplémentaire n'a été observé.
Dans la troisième étude (N01358), le lévétiracétam n'était pas autorisé en tant qu'antiépileptique concomitant. Une analyse prédéfinie a démontré l'efficacité cliniquement significative du brivaracétam en comparaison au placebo. L'efficacité était cependant plus faible chez les patients ayant au préalable reçu du lévétiracétam que chez les patients sans traitement préalable par lévétiracétam. L'efficacité plus faible observée chez ces patients en comparaison aux patients naïfs de traitement par lévétiracétam a probablement été due au nombre plus élevé d'antiépileptiques pris précédemment et à la fréquence des crises plus élevée durant la période initiale.
Dans les données poolées sur l'efficacité, les patients recevant un traitement concomitant par lévétiracétam ont été exclus.
Études d'extension en ouvert
Toutes études confondues, 81,7% des patients ayant terminé les études randomisées ont été inclus dans les études d'extension en ouvert à long terme. À partir de l'inclusion dans les études randomisées, 5,3% des sujets traités par brivaracétam pendant 6 mois (n=1500) ont été libres de crises versus 4,6% et 3,7% des patients traités pendant respectivement 12 mois (n=1188) et 24 mois (n=847).
Potentiel d'abus
Bien que les études réalisées avec le brivaracétam n'aient pas montré de potentiel d'abus, cette possibilité ne peut pas être complètement exclue.
Dépendance
Dans une évaluation poolée des études d'association contrôlées contre placebo, il n'y avait aucune indication d'un potentiel de dépendance physique ou de symptômes de sevrage provoqués par le brivaracétam.
Sécurité et efficacité chez les patients âgés
Personnes âgées
Les trois études cliniques en double aveugle contrôlées contre placebo ont inclus 38 (2,4%) personnes âgées de ≥65 ans. Parmi ces patients de ≥65 ans, 30 ont été traités par brivaracétam. Au total, 2 patients de ≥75 ans ont été traités par brivaracétam [voir «Instructions spéciales pour la posologie/Patients âgés»].
Sécurité et efficacité chez les patients pédiatriques
Enfants et adolescents
Chez les enfants âgés de 2 ans et plus, les crises partielles ont une physiopathologie similaire à celles observées chez les adolescents et les adultes. L'expérience acquise sur les médicaments antiépileptiques laisse supposer que les résultats des études d'efficacité menées chez les adultes peuvent être extrapolés aux enfants à partir de 2 ans, à condition que les ajustements posologiques pédiatriques soient confirmés et que le profil de sécurité soit établi (voir rubriques «Pharmacocinétique» et «Effets indésirables»). Les posologies chez les patients à partir de 2 ans ont été définies par des ajustements de dose en fonction du poids, établis pour obtenir des concentrations plasmatiques similaires à celles observées chez les adultes traités par des doses efficaces (voir rubrique «Pharmacocinétique»).
Une étude de tolérance à long terme non contrôlée, en ouvert a inclus des enfants (âgés d'1 mois à moins de 16 ans) ayant poursuivi le traitement après avoir terminé l'étude de pharmacocinétique (voir rubrique «Pharmacocinétique»), des enfants qui ont poursuivi le traitement après avoir terminé l'étude de sécurité pour la forme IV et des enfants recrutés directement pour cette étude de tolérance. Les enfants recrutés directement pour cette étude ont reçu une dose initiale de brivaracétam d'1 mg/kg/jour. En fonction de la réponse et de la tolérance, la dose a été augmentée jusqu'à 5 mg/kg/jour en doublant la dose chaque semaine. Aucun enfant n'a reçu une dose supérieure à 200 mg/jour. Pour les enfants pesant 50 kg ou plus, la dose initiale de brivaracétam était de 50 mg/jour. En fonction de la réponse et de la tolérance, la dose a été augmentée jusqu'à un maximum de 200 mg/jour en augmentant la dose de 50 mg/jour chaque semaine.
Dans les études poolées de sécurité et de pharmacocinétique menées en ouvert, en association, 186 enfants présentant des crises partielles dans la tranche d'âge allant d'1 mois à < 16 ans ont reçu du brivaracétam, parmi lesquels 149 ont été traités pendant ≥3 mois, 138 pendant ≥6 mois, 123 pendant ≥12 mois, 107 pendant ≥24 mois, et 90 pendant ≥36 mois.
PharmacocinétiqueAbsorption
Après administration orale, le brivaracétam est rapidement et complètement absorbé. La biodisponibilité absolue du comprimé pelliculé est de 103%. Le tmax moyen à jeun est de 1 heure pour les comprimés pelliculés (intervalle du tmax 0,25 à 3 h).
L'administration pendant un repas riche en graisses a ralenti la vitesse d'absorption du brivaracétam tandis que l'ampleur de l'absorption n'était pas modifiée.
Les comprimés pelliculés, la solution buvable et la solution injectable sont bioéquivalents.
Après administration de doses uniques de 10 mg à 600 mg, l'AUC du brivaracétam augmente proportionnellement à la dose administrée. L'administration de doses uniques plus élevées entraîne une augmentation légèrement disproportionnée de l'AUC.
Après administration de 2,5 mg à 200 mg deux fois par jour (dose journalière 5 mg - 400 mg) pendant 10 à 14 jours, l'AUC du brivaracétam augmente également proportionnellement à la dose administrée. L'administration de 400 mg deux fois par jour entraîne après plusieurs doses une augmentation de l'exposition au brivaracétam légèrement inférieure à une augmentation proportionnelle à la dose.
Lors d'une administration deux fois par jour, l'état d'équilibre est atteint en l'espace de 2 jours.
Distribution
La liaison du brivaracétam aux protéines plasmatiques est faible (≤20%). Le volume de distribution est de 0,5 l/kg, une valeur proche de celle de l'eau corporelle totale.
Métabolisme
Le brivaracétam est métabolisé principalement par hydrolyse de la fraction amide pour former l'acide carboxylique correspondant et secondairement par hydroxylation sur la chaîne latérale propyle. L'hydrolyse de la fraction amide entraînant la formation du métabolite acide carboxylique fait intervenir des amidases hépatiques et extra-hépatiques (EC3.5.1.4). In vitro, l'hydroxylation du brivaracétam est principalement due au CYP2C19. In vivo chez l'homme, la formation du métabolite hydroxylé est diminuée de 2 ou 10 fois chez les sujets présentant des mutations inefficaces du CYP2C19 tandis que l'AUC du brivaracétam est augmentée respectivement de 22% ou 42% chez les sujets porteurs de mutations impliquant une perte de fonction sur l'un ou les deux allèles, en comparaison aux sujets avec l'enzyme de type sauvage. Les inhibiteurs du CYP2C19 n'ont par conséquent probablement pas d'impact significatif sur la pharmacocinétique du brivaracétam. Un autre métabolite (le métabolite hydroxyacide) est en majeure partie créé par l'hydroxylation de la chaîne latérale propyle du métabolite acide carboxylique (principalement par le CYP2C9). L'AUC des métabolites hydroxy, acide et hydroxyacide correspond respectivement jusqu'à 10%, 8% et 2% de la substance mère. Les 3 métabolites ne sont pas pharmacologiquement actifs.
Élimination
Le brivaracétam est éliminé essentiellement par métabolisme et excrétion dans les urines. Après administration d'une dose unique marquée au 14C, 96,8% de la dose radioactive administrée est éliminée dans les urines et 0,7% dans les selles. 34% de la dose radioactive est éliminée dans les urines en l'espace de 48 heures sous forme de métabolite acide carboxylique. La proportion de brivaracétam inchangé éliminée dans les urines a été de 9%.
La demi-vie plasmatique (t1/2) est d'environ 9 heures.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Une étude de pharmacocinétique chez des patients présentant une cirrhose (classes A, B et C de Child-Pugh) a montré des augmentations de l'exposition au brivaracétam comparables, quelle que soit la sévérité de la maladie (50%, 57% et 59%) en comparaison aux sujets sains. Des ajustements de la posologie sont recommandés chez les patients atteints d'insuffisance hépatique [voir «Posologie/Mode d'emploi»].
Troubles de la fonction rénale
Une étude chez des patients présentant une insuffisance rénale sévère (clairance de la créatinine <30 ml/min/1,73 m2 ne nécessitant pas de dialyse) a montré que l'AUC de la concentration plasmatique du brivaracétam en fonction du temps était légèrement augmentée (+21%) par rapport aux sujets témoins sains, tandis que les AUC des concentrations plasmatiques des métabolites acide, hydroxy et hydroxyacide en fonction du temps étaient augmentées de respectivement 3, 4 et 21 fois. La clairance rénale de ces métabolites inactifs était diminuée de 10 fois. Des adaptations de la dose ne sont pas nécessaires chez les patients présentant une insuffisance rénale légère [voir «Posologie/Mode d'emploi»]. Le brivaracétam ne doit pas être administré en cas d'insuffisance rénale modérée ou sévère.
Le brivaracétam n'a pas été étudié chez les patients sous hémodialyse.
Patients âgés
Dans une étude chez des patients âgés (de 65 à 79 ans avec une clairance de la créatinine comprise entre 53 et 98 ml/min/1,73 m2) recevant 400 mg de brivaracétam par jour en deux prises, la demi-vie plasmatique du brivaracétam a respectivement été de 7,9 heures et 9,3 heures dans les groupes âgés de 65 à 75 ans et de >75 ans. La clairance plasmatique du brivaracétam à l'état d'équilibre a été légèrement inférieure (0,76 ml/min/kg) à celle observée chez des sujets sains, jeunes et de sexe masculin (0,83 ml/min/kg). Des adaptations de la dose ne sont pas nécessaires [voir «Posologie/Mode d'emploi»].
Sexe
Il n'y a pas de différences spécifiques de la pharmacocinétique du brivaracétam en fonction du sexe.
Origine ethnique
L'origine ethnique n'a pas eu d'influence significative sur la pharmacocinétique du brivaracétam dans un modèle de pharmacocinétique de population issu des données de patients atteints d'épilepsie (blanc, noir/afro-américain, asiatique, amérindien [USA et Alaska], espagnol/latino-américain).
Population pédiatrique
Une étude de pharmacocinétique a été réalisée chez 99 sujets dont l'âge était compris entre 1 mois et < 16 ans, pendant 3 semaines, sur la base d'une titration hebdomadaire fixe de la solution orale de brivaracétam en 3 paliers. Le brivaracétam a été administré à des doses croissantes hebdomadaires d'environ 1 mg/kg/jour, 2 mg/kg/jour et 4 mg/kg/jour. Toutes les doses ont été ajustées en fonction du poids et n'ont pas dépassé un maximum de 50 mg/jour, 100 mg/jour et 200 mg/jour. À la fin de la période d'évaluation, les sujets pouvaient intégrer une étude de suivi à long terme en continuant à la dernière dose reçue (voir rubrique «Effets indésirables»). Les concentrations plasmatiques ont été proportionnelles à la dose dans toutes les tranches d'âge. Le modèle de pharmacocinétique de population a été établi sur des données de concentration plasmatique éparses recueillies au cours de l'étude PK de 3 semaines, et lors de l'étude de suivi à long terme en cours. 232 patients pédiatriques atteints d'épilepsie, âgés de 2 mois à 17 ans, ont été inclus dans l'analyse. Celle-ci indiquait que des doses de 5,0 mg/kg/jour (poids corporel compris entre 10 et 20 kg) et 4,0 mg/kg/jour (poids corporel compris entre 20 et 50 kg) présentaient la même concentration plasmatique moyenne à l'état d'équilibre que celle atteinte chez les adultes recevant 200 mg par jour. La clairance plasmatique estimée a été de 0,96 l/h, 1,61 l/h, 2,18 l/h et 3,19 l/h pour les enfants pesant respectivement 10 kg, 20 kg, 30 kg et 50 kg. En comparaison, la clairance plasmatique a été estimée à 3,58 l/h chez les patients adultes (pesant 70 kg). Actuellement, il n'existe aucune donnée clinique chez les nouveau-nés.
Données précliniquesPharmacologie de sécurité
Dans des études conventionnelles de sécurité pharmacologique, les effets prédominants étaient liés au SNC (principalement dépression transitoire du SNC et diminution de l'activité locomotrice spontanée). Ces effets ont été observés à partir de 100 mg/kg, ce qui représente plusieurs fois (plus de 50 fois) la dose pharmacologiquement efficace de 2 mg/kg. De plus, les fonctions d'apprentissage et de mémoire n'ont pas été affectées par le brivaracétam.
Toxicité aiguë
La dose orale non mortelle maximale chez le rat après une administration unique était >1000 mg/kg. Aucun signe de toxicité n'a été identifié à une dose de 500 mg/kg.
Toxicité à long terme (ou toxicité en cas d'administration répétée)
Aucun effet indésirable hépatique n'a été observé chez le rat et le singe après administration chronique de brivaracétam à des expositions nettement supérieures (5 à 42 fois) à l'exposition humaine avec la dose clinique de 200 mg/jour. L'administration de brivaracétam chez le chien a entraîné des effets hépatotoxiques, principalement une porphyrie, à une exposition similaire à celle d'une dose clinique de 200 mg/jour chez l'homme. Les données collectées sur le brivaracétam et un composé structurellement apparenté indiquent toutefois que les modifications hépatiques (principalement porphyrie) chez le chien se sont développées par des mécanismes non pertinents chez l'homme.
Mutagénicité
Les expériences in vitro sur des bactéries et des cellules de mammifères et in vivo chez le rat et la souris n'ont pas mis en évidence d'effets mutagènes ou clastogènes.
Carcinogénicité
Une étude de carcinogenèse chez le rat n'a pas montré de potentiel cancérogène. Une étude chez la souris a montré une légère augmentation de la fréquence de tumeurs hépatiques chez la souris mâle, considérées comme étant dues à un mode d'action non génotoxique lié à l'induction d'enzymes hépatiques par des agents de type phénobarbital, un phénomène connu chez le rongeur et lui étant spécifique.
Toxicité sur la reproduction
Le brivaracétam n'a pas eu d'effet sur la fertilité mâle ou femelle et n'a pas montré de potentiel tératogène chez le rat ou le lapin. Une embryotoxicité a été observée chez le lapin à une dose maternotoxique correspondant à un niveau d'exposition 8 fois supérieur à l'exposition clinique. Chez le rat, il a été montré que le brivaracétam traverse le placenta et est excrété dans le lait des femelles.
Études de toxicité juvénile chez l'animal
Chez les rats juvéniles (dose maximale: 600 mg/kg/jour) les niveaux d'exposition de brivaracétam correspondant à l'exposition de 6 à 15 fois l'AUC clinique de la dose maximale recommandée, ont induit des effets indésirables sur le développement (mortalité, signes cliniques, diminution du poids corporel et du poids du cerveau). Aucun effet secondaire n'a été constaté sur le fonctionnement du SNC ou sur les résultats des examens neuropathologique et histopathologique du cerveau. Le NOAEL a été estimé à 300 mg/kg/jour (ce qui correspond à 3 à 20 fois l'exposition humaine pour une dose clinique de 200 mg/jour).
Chez les chiens juvéniles, la dose de 100 mg/kg/jour a induit des anomalies hépatiques similaires à celles observées chez les animaux adultes. Aucun effet négatif n'a été observé au niveau des paramètres standard de croissance ou de développement. Le NOAEL a été estimé à 30 mg/kg/jour (ce qui correspond à 1 à 3 fois l'exposition humaine pour une dose clinique de 200 mg/jour). Une exposition similaire au brivaracétam a été atteinte chez les animaux juvéniles et adultes lors du NOAEL, hormis au jour 4 après la naissance (PND4), où l'exposition était plus élevée que chez les animaux adultes.
Autres données
Les études chez le rat n'ont pas montré de potentiel d'abus ou de dépendance.
Remarques particulièresIncompatibilités
La solution injectable Briviact ne doit pas être mélangée avec d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Stabilité après ouverture
Solution buvable:
Après première ouverture: à consommer dans les 5 mois.
Remarques particulières concernant le stockage
Comprimés pelliculés:
Ne pas conserver au-dessus de 30°C.
Solution buvable et solution injectable:
Conserver à 15-30°C.
Solution buvable:
Conserver dans le récipient d'origine.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Solution injectable
La solution injectable Briviact étant destinée à un usage unique et ne contenant pas d'agents conservateurs, utiliser la solution immédiatement après avoir brisé le sceau du flacon et éliminer la solution non utilisée. La solution injectable ne doit pas être utilisée si des particules sont visibles ou si elle est colorée.
Dilution avec des solutions pour perfusion
La solution injectable Briviact peut être diluée avec une solution pour perfusion de chlorure de sodium 9 mg/ml (0,9%), une solution pour perfusion de glucose 50 mg/ml (5%) ou une solution pour perfusion de lactate de Ringer. La stabilité physique et chimique de la solution diluée, conservée dans des poches en PVC ou en polyoléfine à température ambiante pendant 24 heures, a été démontrée à des concentrations de 0,1 à 1,5 mg de brivaracétam par millilitre.
Les solutions diluées ne contiennent pas de conservateurs et doivent, pour des raisons microbiologiques, immédiatement être utilisées après dilution, sauf si la méthode de dilution exclut le risque d'une contamination microbiologique. Si la solution n'est pas utilisée immédiatement après dilution, le délai d'utilisation et les conditions de conservation relèvent de la responsabilité de l'utilisateur.
Numéro d’autorisation65830, 65831, 65832 (Swissmedic).
PrésentationComprimés pelliculés:
10 mg: emballages de 14 comprimés pelliculés [B]
25 mg, 50 mg, 75 mg et 100 mg: emballages de 56 comprimés pelliculés [B]
emballages hospitaliers de 14 comprimés pelliculés individuels à 25 mg, 50 mg, 75 mg et 100 mg [B]
Solution buvable (10 mg/ml):
emballage de 300 ml de solution (avec une seringue de 5 ml (marques de graduation bleues) et une seringue de 10 ml (marques de graduation noires) en polypropylène/polyéthylène et adaptateur en polyéthylène) [B]
Solution injectable (50 mg/5 ml):
emballage de 10 flacons de 5 ml [B]
Titulaire de l’autorisationUCB-Pharma AG, Bulle.
Mise à jour de l’informationNovembre 2023.
|

