CompositionPrincipes actifs
Isoleucine, leucine, lysine sous forme de chlorhydrate, méthionine, phénylalanine, thréonine, tryptophane, valine, arginine, histidine sous forme de chlorhydrate monohydraté, alanine, acide aspartique, acide glutamique, glycine, proline, sérine, hydroxyde de sodium, chlorure de sodium, acétate de sodium sous forme trihydraté, acétate de potassium, acétate de magnésium sous forme tétrahydraté, chlorure de calcium sous forme dihydraté, glucose sous forme monohydrate, phosphate monosodique sous forme dihydraté, acétate de zinc sous forme dihydraté, huile de soja, triglycérides à chaîne moyenne, acides gras omega-3.
Excipients
Acide citrique monohydraté, lécithine d'oeuf, glycérol, oléate de sodium corresp. à sodium 4,5 mg/l, allracα-tocophérol (E 307), hydroxyde de sodium corresp. à sodium jusqu'à max. 6,90 mg/l (pour ajustement du pH), eau pour préparations injectables.
1000 ml d'émulsion contiennent également 0,49 mmol de sodium (sous forme d'oléate de sodium et d'hydroxyde de sodium).
Indications/Possibilités d’emploiApport d’énergie, d’acides gras essentiels omega-6 et omega-3, d’acides aminés, d’électrolytes et liquidien lors de la nutrition parentérale chez des patients avec un catabolisme modérément sévère à sévère, lorsque l'alimentation par voie orale ou entérale est impossible, inadéquate ou contre-indiquée.
Posologie/Mode d’emploiPour perfusion intraveineuse par voie centrale.
La posologie doit être adaptée aux besoins individuels des patients.
Il est recommandé d'administrer Omegaflex special de manière continue. Une augmentation par paliers de la vitesse de perfusion pendant les 30 premières minutes jusqu'à obtention de la vitesse de perfusion désirée permet d'éviter d'éventuelles complications.
Adultes
La posologie maximale journalière est de 35 ml/kg PC, soit :
2,0 g d'acides aminés/kg PC et jour,
5,04 g de glucose/kg PC et jour,
1,40 g de lipides/kg PC et jour.
La vitesse de perfusion maximale est de 1,7 ml/kg de poids corporel et par heure, soit:
0,1 g d'acides aminés/kg de poids corporel et par heure,
0,24 g de glucose/kg de poids corporel et par heure,
0,07 g de lipides/kg de poids corporel et par heure.
Pour un patient de 70 kg, cela correspond à une vitesse de perfusion de 119 ml par heure. La quantité administrée est alors de 6,8 g/heure d'acides aminés, de 17,1 g/heure de glucose et de 4,8 g/heure pour les lipides.
Patients avec altération de la fonction hépatique
Le dosage doit être adaptée individuellement chez les patients souffrant d’insuffisance hépatique (voir aussi «Mise en garde et précautions»).
Patients avec altération de la fonction rénale
Le dosage doit être adaptée individuellement chez les patients souffrant d’insuffisance rénale (voir aussi «Mise en garde et précautions»).
Patients sous nutrition parentérale perdialytique (NPPD)
La nutrition parentérale perdialytique est destinée aux patients dialysés non atteints d’une maladie aiguë et souffrant de malnutrition, pour lesquels les conseils nutritionnels ou le traitement par des compléments alimentaires oraux se sont avérés inefficaces. Le choix du volume approprié de Omegaflex special pour la NPPD doit être guidé par l’écart entre les apports spontanés et les apports recommandés. La tolérance métabolique doit de plus être prise en compte.
Pour Omegaflex special chez les patients traités par NPPD, la vitesse de perfusion maximale est de 2,3 ml/kg/heure, ce qui correspond à
0,13 g/kg/heure d’acides aminés,
0,33 g/kg/heure de glucose,
0,092 g/kg/heure de lipides
pour 4 heures.
Compte tenu des pertes connues en acides aminés (taux de rétention de 73%) et en glucose (25 g / 4 heures de séance de dialyse) pendant la dialyse, le patient reçoit 0,095 g/kg/h d’acides aminés, 0,24 g/kg/h de glucose et 0,095 g/kg/h de lipides. Cela correspond, pour un patient de 70 kg (40 kg) et une séance de dialyse de quatre heures, à 27 g (15 g) d’acides aminés, 67 g (38 g) de glucose, 26 g (15 g) de lipides et 644 ml (368 ml) de liquides.
Enfants et adolescents
Nouveaux-nés, nourrissons et enfants d’âge < 2 ans
Omegaflex special ne doit pas être utilisé chez les nouveau-nés, les nourrissons et les jeunes enfants âgés de moins de 2 ans chez qui l’acide aminé cystéine est considéré comme conditionnellement essentiel (voir «Contre-indications»).
Enfants âgés > 2 ans et adolescents
Aucune étude clinique n’a été menée dans la population pédiatrique.
Omegaflex special ne peut fournir qu’un apport de base en nutriments et en énergie aux patients pédiatriques. En fonction des besoins de chaque patient, une supplémentation en carnitine peut être envisagée chez les patients pédiatriques susceptibles de recevoir une alimentation parentérale pendant plus de 4 semaines. La posologie exacte dépend de la dépense énergétique du patient et de sa capacité à métaboliser les substances actives d’Omegaflex special. Elle doit être adaptée à chaque patient en fonction de l’âge, du poids corporel, de l’état clinique et de la maladie sous-jacente.
Comme les besoins de chaque enfant et adolescent varient, l’administration d’Omegaflex special ne suffit pas pour couvrir l’ensemble des besoins énergétiques, nutritionnels, électrolytiques et hydriques de certains patients. Dans de telles situations, des acides aminés et/ou des glucides et/ou des lipides et/ou des minéraux et/ou des liquides doivent être administrés en plus sous une forme appropriée.
L’état d’hydratation du patient pédiatrique doit être pris en compte lors de l’établissement de la posologie.
Chez les enfants, il peut être nécessaire de commencer la thérapie nutritionnelle à la moitié de la posologie cible. La posologie doit être augmentée progressivement en fonction de la capacité de traitement de chaque patient jusqu’à sa valeur maximale.
Les besoins quotidiens en liquide, en glucose et en énergie diminuent avec l’âge, raison pour laquelle deux groupes d’âge, 2 à 12 ans et 12 à 18 ans, sont pris en compte.
Dose journalière maximale
La dose journalière maximale dépend de l’âge et de l’état clinique du patient (phase aiguë, phase stable et phase de convalescence).
Pour Omegaflex special, dans le groupe d’âge 2 à ≤ 12 ans, le facteur limitant pour la dose journalière maximale pour toutes les phases cliniques est la concentration en magnésium.
Chez les patients âgés de 12 à 18 ans, le facteur limitant dans la phase aiguë et la phase stable est la concentration en glucose, et le facteur limitant dans la phase de convalescence est la concentration en magnésium.
Les doses quotidiennes maximales qui en découlent sont indiquées dans le tableau ci-dessous.
|
|
2 à ≤ 12 ans
|
12 à 18 ans
| |
|
Recommandation
|
Omegaflex special
|
Recommandation
|
Omegaflex special
| |
|
|
Phase
|
|
Phase
| |
|
|
aiguë
|
stable
|
convalescence
|
|
aiguë
|
stable
|
Convalescence
| |
Dose journalière maximale (ml/kg/j)
|
|
24
|
|
9,5
|
20
|
24
| |
|
|
correspondant à
|
|
correspondant à
| |
Liquides (ml/kg/j)
|
60-100
|
24
|
50-70
|
9,5
|
20
|
24
| |
Acides aminés (g/kg/j)
|
1,0-2,0 (2,5)
|
1,34
|
1,0-2,0
|
0,53
|
1,12
|
1,34
| |
Glucose (g/kg/j)
|
|
|
|
| |
Phase aiguë
|
1,4-3,6
|
3,46
|
0,7-1,4
|
1,37
|
-
|
-
| |
Phase stable
|
2,2-5,8
|
1,4-2,9
|
-
|
2,88
|
-
| |
Phase de convalescence
|
4,3-8,6
|
2,9-4,3
|
-
|
-
|
3,46
| |
Lipides (g/kg/j)
|
≤ 3
|
0,96
|
≤ 3
|
0,38
|
0,8
|
0,96
| |
Énergie (kcal/kg/j)
|
|
|
|
| |
Phase aiguë
|
30-45
|
28,3
|
20-30
|
11,2
|
-
|
-
| |
Phase stable
|
40-60
|
25-40
|
-
|
23,6
|
-
| |
Phase de convalescence
|
55-75
|
30-55
|
-
|
-
|
28,3
| |
Sodium (mmol/kg/j)
|
1-3
|
1,29
|
1-3
|
0,51
|
1,07
|
1,29
| |
Potassium (mmol/kg/j)
|
1-3
|
0,9
|
1-3
|
0,36
|
0,75
|
0,90
| |
Calcium (mmol/kg/j)
|
0,25-0,4
|
0,10
|
0,25-0,4
|
0,04
|
0,08
|
0,10
| |
Magnésium (mmol/kg/j)
|
0,1
|
0,10
|
0,1
|
0,04
|
0,08
|
0,10
| |
Chlorure (mmol/kg/j)
|
2-4
|
1,15
|
2-4
|
9,46
|
0,96
|
1,15
| |
Phosphate (mmol/kg/j)
|
0,2-0,7
|
0,38
|
0,2-0,7
|
0,15
|
0,32
|
0,38
|
Phase aiguë = phase de réanimation pendant laquelle le patient a besoin d’une assistance vitale des organes (sédation, ventilation mécanique, vasopresseurs, remplacement des fluides); phase stable = le patient est stable ou l’assistance vitale des organes peut être arrêtée; phase de convalescence = le patient est mobilisé.
Vitesse de perfusion maximale
La vitesse de perfusion maximale dépend de l’âge et de l’état clinique du patient (phase aiguë, stable et de convalescence).
Pour Omegaflex special, le facteur limitant dans les deux groupes d’âge et dans tous les états cliniques est la vitesse de perfusion du glucose.
Les vitesses de perfusion horaires maximales qui en découlent sont indiquées dans le tableau ci-dessous.
|
|
|
2 à ≤ 12 ans
|
|
12 à 18 ans
| |
|
Recommandation
|
Omegaflex special
|
Recommandation
|
Omegaflex special
| |
|
|
Phase
|
|
Phase
| |
|
|
aiguë
|
stable
|
convalescence
|
|
aiguë
|
stable
|
convalescence
| |
Vitesse de perfusion maximale (ml/kg/h)
|
|
0,63
|
1,25
|
1,67
|
|
0,42
|
0,83
|
1,25
| |
|
|
correspondant à
|
|
correspondant à
| |
Acides aminés (g/kg/h)
|
≤ 0,1
|
0,035
|
0,07
|
0,094
|
≤ 0,1
|
0,024
|
0,046
|
0,07
| |
Glucose (g/kg/h)
|
|
|
|
|
|
|
|
| |
Phase aiguë
|
0,09
|
0,09
|
-
|
-
|
0,03 -
0,06
|
0,06
|
-
|
-
| |
Phase stable
|
0,09-0,18
|
-
|
0,18
|
-
|
0,06 -
0,12
|
-
|
0,12
|
-
| |
Phase de convalescence
|
0,18 -
0,24
|
-
|
-
|
0,24
|
0,12 -
0,18
|
-
|
-
|
0,18
| |
Lipides (g/kg/h)
|
≤ 0,15
|
0,025
|
0,05
|
0,067
|
≤ 0,15
|
0,017
|
0,033
|
0,05
|
Durée du traitement
La durée du traitement pour les indications mentionnées n'est pas limitée.
Lors de l'administration à long terme d’Omegaflex special, il est nécessaire de supplémenter en oligo-éléments et vitamines appropriés.
Mode d’administration
Perfusion intraveineuse.
Lors de la nutrition parentérale perdialytique (NPPD), la poche doit être administrée via la chambre compte-gouttes veineuse des lignes de circulation extracorporelle.
Contre-indications·Hypersensibilité aux principes actifs, protéines d’œuf, de poisson, cacahuètes ou soja ou à l’un des excipients conformément à la composition
·Troubles congénitaux du métabolisme des acides aminés
·Hypertriglycéridémie grave (≥ 1000 mg/dl ou 11,4 mmol/l)
·Troubles sévères de la coagulation
·Hyperglycémie ne répondant pas à des doses d'insuline allant jusqu'à 6 unités d'insuline/heure
·Acidose
·Cholestase intrahépatique
·Insuffisance hépatique sévère
·Insuffisance rénale sévère lorsqu’aucune thérapie en dialyse n’est présente
·Diathèses hémorragiques sévères
·Accidents thrombo-emboliques aigus, embolie graisseuse
De par sa composition, Omegaflex special ne doit pas être administré aux nouveau-nés, nourrissons et enfants de moins de 2 ans.
Les contre-indications générales de la nutrition parentérale sont entre autres:
·instabilité hémodynamique avec menace vitale (collapsus et choc)
·phase aiguë d’infarctus du myocarde et cérébral
·métabolisme instable (p.ex. syndrome sévère postagressif, coma d'origine inconnue)
·apport cellulaire en oxygène inapproprié
·troubles des balances électrolytique et hydrique
·oedème pulmonaire aigu
·insuffisance cardiaque décompensée
Mises en garde et précautionsUne attention particulière est requise en cas d'élévation de l'osmolarité sérique.
Les anomalies des balances hydrique, électrolytique ou acido-basique doivent être corrigées avant le début de la perfusion.
Une perfusion trop rapide peut conduire à une surcharge hydrique avec des concentrations sériques en électrolytes pathologiques, une hyperhydratation et un oedème pulmonaire.
La perfusion doit être immédiatement interrompue lors des premiers symptômes d'une réaction anaphylactique (tel que fièvre, frissons, éruptions cutanées ou dyspnée).
La concentration sérique en triglycérides doit être surveillées pendant la perfusion d’Omegaflex special.
Selon les conditions métaboliques du patient, une hypertriglycéridémie occasionnelle peut apparaître. Si la concentration de triglycérides plasmatiques dépasse 4,6 mmol/l (400 mg/dl) pendant l'administration de lipides, il est recommandé de diminuer la vitesse de perfusion. En cas d’élévation des valeurs, une interruption de la perfusion doit être envisagée, vu que le risque d’une pancréatite augmente avec des valeurs supérierues à 11.4 mmol/l.
Patients souffrant de troubles du métabolisme lipidique
Omegaflex special doit être administré avec prudence aux patients souffrant de troubles du métabolisme lipidique présentant un taux en triglycérides élevé, par exemple insuffisance rénale, diabète mellitus, pancréatite, fonction hépatique altérée, hypothyroïdie (avec hypertriglyceridémie), septicémie et syndrome métabolique (combinaison d’un diabète, d’une pression artérielle élevée et d’une obésité). Si Omegaflex special est administré à des patients présentant un tel tableau clinique, une surveillance étroite de la concentration sérique des triglycérides est nécessaire pour s’assurer de l’élimination des triglycérides et de maintenir un taux stable en triglycéride plasmatique sous le seuil de 4,6 mmol/l (400 mg/dl).
En cas d’hyperlipidémie combinée et d’un syndrome métabolique, les taux plasmatiques en triglycérides réagissent au glucose, aux lipides et à la surcharge alimentaire. La dose doit dans ces cas être adaptée en conséquence. D’autres sources de lipides et de glucose, ainsi que les drogues et les médicaments qui affectent le métabolisme du patient, doivent être déterminés et surveillés.
L’apparition d’une hypertriglycéridémie 12 heures après l’administration de lipides indique également une anomalie du métabolisme des lipides.
Comme toute solution contenant des hydrates de carbone, l'administration de Omegaflex special peut entraîner une hyperglycémie. La glycémie doit être surveillée. En cas d'hyperglycémie, il faut réduire la vitesse de perfusion ou administrer de l'insuline. Si le patient reçoit en même temps d’autres solutions de glucose par voie intraveineuse, il faut tenir compte de la quantité additionnelle de glucose.
Un arrêt de l'administration est également nécessaire quand la glycémie dépasse 14 mmol/l (250 mg/dl) pendant l'administration des lipides.
Le syndrome « Refeeding » ou replétion des patients carencés ou dénutris peut provoquer une hypokaliémie, une hypophosphatémie et une hypomagnésémie. Une surveillance étroite des électrolytes plasmatiques est absolument nécessaire. Une supplémentation en électrolytes est nécessaire en cas de baisse des taux sanguins en dessous des normes recommandées.
De plus, il est nécessaire de contrôler l'ionogramme sérique, la balance hydrique, l'équilibre acido-basique, la numération sanguine, la coagulation et la fonction hépatique.
Une substitution d'électrolytes, de vitamines et d'oligo-éléments adaptée aux besoins du patient est éventuellement nécessaire. Omegaflex special contient du zinc, du magnésium, du calcium et du phosphate. Il convient d'en tenir compte lors de l'administration simultanée de solutions qui contiennent ces substances.
Omegaflex special est une préparation de composition complexe. Il est fortement conseillé de ne pas la mélanger à d'autres solutions (dont la compatibilité n’a pas été mise en évidence - voir « Remarques particulières »).
Omegaflex special ne devrait pas être administré ensemble avec du sang par le même dispositif de perfusion à cause du risque de pseudo-agglutination.
Comme pour toute solution intraveineuse, en particulier les solutions de nutrition parentérale, une asepsie stricte est nécessaire lors de la perfusion d’Omegaflex special.
Il n'y a pas d’expérience clinique concernant l'emploi d’Omegaflex special chez l'enfant et l'adolescent.
Patients âgés
Les dosages sont raisonnablement les mêmes que chez l’adulte mais la prudence est requise pour des patients souffrant d’autres maladies comme une insuffisance cardiaque ou rénale qui sont fréquemment observées avec l’âge.
Patients souffrant de diabète ou d’une fonction hépatique ou rénale altérée
Comme pour toute solution de perfusion de grand volume, Omegaflex special doit être administré avec prudence aux patients présentant une altération des fonctions rénale ou cardiaque.
L'expérience clinique est limitée concernant l'administration de la solution chez des patients souffrant de diabète ou d'insuffisance rénale.
InteractionsCertains médicaments comme par exemple l'insuline peuvent influencer le système de lipases du corps. Cette interaction est néanmoins sans signification clinique particulière.
L'héparine administrée à des doses cliniques provoque temporairement une élévation de la libération de lipoprotéine lipase dans la circulation sanguine. Cela peut se manifester par une élévation initiale de la lipolyse plasmatique, suivie par une diminution passagère de la clearance de triglycérides.
Soja contient naturellement de la vitamine K1, cela peut significativement influencer le processus de coagulation des patients traités par les dérivés de la coumarine. Les patients qui sont traités par cette substance doivent de ce fait être sous surveillance stricte.
Les solutions contenant du potassium, comme Omegaflex special, doivent être administrées avec prudence chez les patients recevant des traitements qui peuvent augmenter la concentration en potassium par exemple les diurétiques épargneurs de potassium (par ex. amiloride, spironolactone, triamtérène), des inhibiteurs de l'ECA (énalapril, captopril), des antagonistes des récepteurs de l'angiotensine II (losartan, valsartan), la ciclosporine et le tacrolismus.
Le potassium contenu dans la solution peut diminuer l'efficacité des glucosides cardiotoniques.
L’administration de corticostéroïdes et d’ACTH peut induire une rétention de sodium et liquidienne.
Grossesse, AllaitementGrossesse
Il n'existe pas ou très peu d'expériences sur l’administration d’Omegaflex special chez la femme enceinte. Les expérimentations animales sont insuffisantes pour l’évaluation de la toxicité de reproduction (Voir « Données précliniques »).
Pendant la grossesse une nutrition parentérale peut s’avérer nécessaire. Omegaflex special ne devrait être administré pendant la grossesse qu'après évaluation soigneuse.
Allaitement
Des composants/métabolites d’Omegaflex special sont éliminés dans le lait maternel mais aucun effet sur le nouveau-né allaité n’est attendu à doses thérapeutiques. Il n’est cependant pas conseillé d’allaiter chez les femmes qui reçoivent une alimentation parentérale.
Fertilité
Il n’existe pas de données lors de l’administration d’Omegaflex special.
Effet sur l’aptitude à la conduite et l’utilisation de machinesSans objet.
Effets indésirablesLes réactions précoces possibles lors de l'administration d'une émulsion de lipides sont les suivantes: légère élévation de la température, sensation de chaud ou de froid; frissons, perte d'appétit, nausées; vomissements, dyspnée, maux de tête ou de dos, douleurs osseuses, dans la poitrine ou lombaires, hausse ou baisse de la tension artérielle (hypotension, hypertension), réactions d'hypersensibilité (par ex. réactions anaphylactoïdes, éruption cutanée).
Les effets indésirables sont classés par classe d'organes du système MedDRA et par fréquence selon la convention suivante:
très fréquents (≥1/10)
fréquents (≥1/100 à <1/10)
occasionnels (≥1/1000 à <1/100)
rares (≥1/10'000 à <1/1000)
très rares (<1/10'000),
non connus (fréquence ne pouvant pas être déterminée sur la base des données disponibles).
Les effets indésirables mentionnés ci-dessous comprennent une série de réactions généralisées qui peuvent être en rapport avec l'utilisation d'Omegaflex special. En cas d'utilisation appropriée, de respect du dosage et des consignes de sécurité et des restrictions d'utilisation, les effets indésirables sont rares (≥1/10'000 à <1/1000).
Affections hématologiques et du système lymphatique
Rares: hypercoagulation.
Non connus : leucopénie, thrombocytopénie.
Affections du système immunitaire
Rares: réactions allergiques (par ex. réactions anaphylactoïdes, éruption cutanée, oedème du larynx, oedème facial et buccal).
Troubles du métabolisme et de la nutrition
Très rares: hyperlipidémie, hyperglycémie, acidose métabolique, acidocétose.
La fréquence de ces effets indésirables est dose-dépendante et peut être augmentée par un surdosage absolu ou relatif en lipides.
Affections du système nerveux
Rares: maux de tête, somnolence.
Affections vasculaires
Rares: hypertension ou hypotension, rougeurs de la peau (flush).
Affections respiratoires, thoraciques et médiastinales)
Rares: dyspnée, cyanose.
Affections gastro-intestinales
Occasionnels: nausées, vomissements, perte d'appétit.
Affections hépatobiliaires
Non connu: cholestase.
Affections de la peau et du tissus sous-cutané
Rares: érythème, sudation.
Affections de la musculosquelettiques et du tissu conjonctif
Rares: maux de dos, douleurs osseuses, dans la poitrine ou dans les lombaires.
Troubles généraux et anomalies au site d'administration
Rares: élévation de la température corporelle, sensation de froid, frissons.
Très rares: syndrome de surcharge lipidique (voir description ci-dessous).
En cas d’apparition d’effets indésirables, l’administration doit être interrompue.
En cas d’élévation du taux de triglycérides au-dessus de 4,6 mmol/l (400 mg/dl) lors de la perfusion, l'administration d’Omegaflex special doit être poursuivie à une posologie réduite (voir « Mises en garde et précautions »). Si les triglycérides plasmatiques continuent à augmenter. il faut interrompre la perfusion car à partir de 11,4 mmol/l, le risque de pancréatite augmente.
Dans le cas où la perfusion est relancée, le patient doit être suivi avec précaution, plus particulièrement en début de perfusion et les triglycérides sériques doivent être contrôlés à intervalles rapprochés.
Description des effets indésirables spécifiques et informations complémentaires
Des nausées, des vomissements et une perte d'appétit surviennent fréquemment dans les états cliniques nécessitant une alimentation parentérale ou sont des effets secondaires généraux de l'alimentation parentérale.
Syndrome de surcharge lipidique
Une altération de la capacité d'élimination des triglycérides peut conduire à un syndrome de surcharge lipidique pouvant être causé par un surdosage. C'est pourquoi d'éventuels signes de surcharge métabolique doivent être surveillés. La cause peut être génétique (métabolisme individuellement différent) ou le métabolisme lipidique peut être affecté par des pathologies associées ou anciennes. Ce syndrome peut également apparaître lors d'hypertriglycéridémie sévère, même à la vitesse de perfusion recommandée, et en association avec un changement soudain de l'état clinique du patient, tel qu'une altération de la fonction rénale ou une infection. Le syndrome de surcharge lipidique se caractérise par une hyperlipidémie, de la fièvre, une infiltration lipidique, une hépatomégalie avec ou sans ictère, une splénomégalie, une anémie, une leucopénie, une thrombocytopénie, des troubles de la coagulation, une hémolyse et une réticulocytose, des tests fonctionnels hépatiques anormaux et un coma. Les symptômes sont en général réversibles lorsque la perfusion de l'émulsion lipidique est interrompue.
En cas d'apparition de signes d'un syndrome de surcharge lipidique, la perfusion doit être immédiatement interrompue.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
Surdosage hydrique et électrolytique:
Hyperhydratation, déséquilibre électrolytique et oedème pulmonaire.
Surdosage en acides aminés:
Pertes rénales d'acides aminés associant des déséquilibres en acides aminés, nausée, vomissements et frissons.
Surdosage glucidique:
Hyperglycémie, glycosurie, déshydratation, hyperosmolarité, coma hyperglycémiquehyperosmolaire.
Surdosage lipidique
Voir «Effets indésirables» (valeurs limites du taux de triglycérides ainsi que du syndrome de surcharge graisseuse).
Traitement
En cas de surdosage, un arrêt immédiat de la perfusion est nécessaire. D’autres mesures thérapeutiques peuvent être envisagées en fonction des symptômes et de leur sévérité. Lors de la reprise de la perfusion après diminution des symptômes, il est recommandé d’augmenter graduellement la vitesse de perfusion et d’effectuer une surveillance à intervalles fréquents.
Propriétés/EffetsCode ATC
B05BA10
Solutions de nutrition parentérale, combinaisons.
Mécanisme d’action
La nutrition parentérale doit apporter à l'organisme l'ensemble des éléments nécessaires à la croissance et à la réparation tissulaire tout comme l’énergie nécessaire au maintien des fonctions corporelles.
Les lipides, de par leur haute densité énergétique, sont des sources d'énergie efficaces. Les triglycérides à chaîne longue fournissent à l'organisme des acides gras essentiels pour la synthèse des constituants cellulaires. Pour ce faire, l'émulsion lipidique contient des triglycérides à chaîne moyenne et à chaîne longue (huile de soja et de poisson).
La part de triglycérides à chaîne longue contient des acides gras oméga-6 et oméga-3 nécessaires à la synthèse des acides gras polyinsaturés. Ils servent d’une part à la prévention et d’autre part au traitement d’une carence en acides gras essentiels et également comme fournisseur d’énergie.
Omegaflex special contient des acides gras essentiels omega-6, principalement sous forme d’acide linoléique et des acides gras oméga-3 sous forme d’acide linolénique, d’acide eicosapentanoïque et d’acide docosahexaénoïque. le rapport d’acides gras oméga-6 sur oméga-3 est de env. 2,5:1.
Pharmacodynamique
Pas de données.
Efficacité clinique
Pas de données.
PharmacocinétiqueAbsorption
Pas de données.
Distribution
La dose, la vitesse de perfusion, la situation métabolique et les facteurs individuels du patient (dernière prise alimentaire) déterminent de manière décisive le taux de triglycérides maximal atteint. Lors du respect des consignes posologiques et d’une administration appropriée, les triglycérides plasmatiques ne dépassent pas généralement la valeur de 4,6 mmol/l (400 mg/dl).
Les triglycérides à chaîne moyenne ont une faible affinité pour l’albumine.
Il n'y a pas d'information disponible au sujet du passage dans le placenta.
Métabolisme
Pas de données.
Élimination
Les triglycérides issus de l’huile de soja mais aussi les triglycérides à chaîne moyenne sont totalement métabolisés en CO2 et H2O.
Une élimination rénale n’existe pratiquement pas.
Données précliniquesDes études précliniques avec Omegaflex special n'ont pas été réalisées.
On ne devrait pas observer d'effets toxiques de mélanges de substances nutritives, qui sont administrés dans le cadre d'un traitement nutritionnel si l'on respecte les recommandations de dosage préconisées.
Toxicologie pour la reproduction
Des huiles végétales, spécialement l'huile de soja peuvent convenir des phytooestrogènes tels que le βsitosterol. Lors de l'administration sous-cutanée ou intravaginale de βsitosterol, on a observé chez les rates et les lapins une altération sur la fertilité. Après administration de βsitosterol pur, on a constaté une diminution du poids des gonades et de la concentration en spermatozoïdes chez les rats et un taux réduit de grossesse chez les lapines. Selon l'état actuel des connaissances les effets observés chez les animaux ne semblent pas avoir de pertinence pour l'utilisation clinique
Remarques particulièresIncompatibilités
Omegaflex special est une préparation de composition complexe. Ainsi, il est fortement conseillé de ne pas la mélanger à d'autres solutions. Il y a néanmoins quelques mélanges avec des suppléments (oligoéléments, electrolytes) qui ont été étudiés dans des conditions d’emploi définies. Ces données sont disponibles sur demande chez le fabricant.
Influence sur les méthodes de diagnostic
La teneur en lipides peut avoir un impact sur la mesure des valeurs de laboratoire (p. ex. la bilirubine, la lactate deshydrogénase, la saturation en oxygène) lorsque les prélèvements sanguins ont lieu avant que les lipides soient éliminés suffisamment du sang.
Stabilité
Omegaflex special ne doit pas être utilisé au-delà de la date d'expiration «Exp.» imprimée sur le récipient.
Stabilité après ouverture
Après avoir retiré le suremballage et mélange du contenu des compartiments
La stabilité de la préparation prête à l'emploi a été testée et démontrée pendant 7 jours à une température de 2-8 °C et à l'abri de la lumière. Après avoir sorti l'emballage du réfrigérateur, la préparation est stable pendant 48 heures à 25 °C et à l'abri de la lumière.
Après mélange avec des additifs compatibles
D’un point de vue microbiologique, la préparation doit être utilisée immédiatement après mélange avec les additifs. Si la préparation n’est pas utilisée immédiatement après le mélange, les temps de conservation et conditions d’administration sont sous la responsabilité de l’administrateur.
Après ouverture du récipient (rupture du port d'injection)
L'émulsion doit être utilisée immédiatement après ouverture.
Remarques particulières concernant le stockage
Ne pas conserver au-delà de 25° C. Ne pas congeler. Conserver les poches dans le cartonpour protéger le contenu de la lumière. Jeter la poche si elle a été congelée par erreur.
La poche à trois compartiments est protégée par un suremballage. Un absorbeur d’oxygène et un indicateur d’oxygène sont placés entre la poche et le suremballage. La poche contenant l’absorbeur d’oxygène est composée de matériel inerte et contient de l’hydroxyde de fer.
Le compartiment supérieur contient la solution de glucose, le compartiment intermédiaire l’émulsion lipidique et le compartiment inférieur la solution d’acides aminés.
Le compartiment supérieur et intermédiaire peuvent être mélangés au compartiment inférieur après ouverture de la soudure. La présentation de la poche permet un mélange des acides aminés, du glucose, des lipides et des électrolytes dans un seul compartiment. La rupture de la soudure conduit à un mélange stérile et à la formation d’une émulsion.
Remarques concernant la manipulation
Aucune exigence particulière pour l’élimination.
Les préparations pour alimentation parentérale doivent être examinées visuellement pour identifier une irrégularité, coloration ou une instabilité de l’émulsion.
N'utiliser qu'un récipient non endommagé dont le suremballage et la poche ne présentent pas d’irrégularités, les soudures entre les compartiments sont intactes, les solutions d’acides aminés et de glucose sont limpides à légèrement jaunes et l’émulsion est un liquide blanc laiteux homogène. Ne pas utiliser si la solution est colorée ou contient des particules. Ne pas utiliser si l’émulsion présente une séparation de phases (gouttes d’huile, couche d’huile).
Avant ouverture du suremballage, contrôler la couleur de l’indicateur d’oxygène (voir image A)
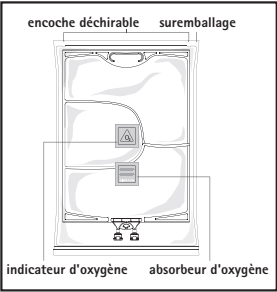
Image A
Ne pas utiliser si l’indicateur d’oxygène présente une couleur rose. Utiliser uniquement si l’indicateur d’oxygène présente une couleur jaune.
Constitution de l’émulsion
Les règles d’asepsie s’appliquent strictement.
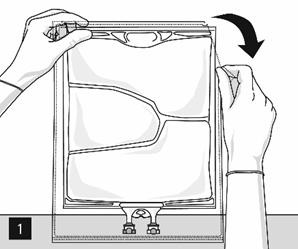
Ouverture : déchirer le suremballage en commençant par les encoches de déchirure (image 1).
Sortir la poche du suremballage. Eliminer le suremballage, l’absorbeur et l’indicateur d’oxygène.
Vérifier visuellement l'absence de fuites sur la poche. Une poche suspecte doit être éliminée car la stérilité n’est plus assurée.
Mélange du contenu des poches et ajout d'additifs
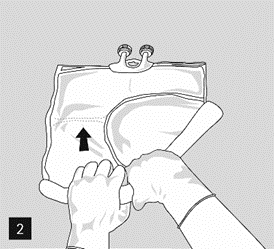
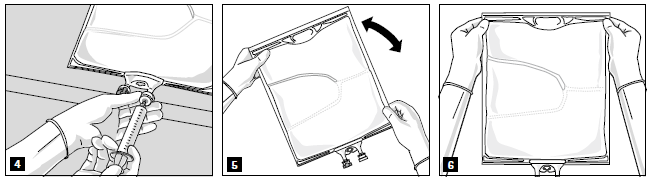
Pour ouvrir les compartiments les uns après les autres et mélanger leur contenu, rouler la poche à l’aide des 2 mains, en commençant par rompre la soudure qui sépare le compartiment supérieur (glucose) du compartiment inférieur (acides aminés) (image 2).
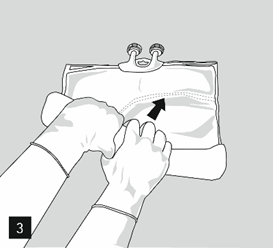
Exercer ensuite une pression ferme pour que la soudure séparant le compartiment intermédiaire (lipides) et inférieur soit rompue (image 3).

Après mélange de tous les compartiments et élimination de la fermeture en aluminium (image 3A), des additifs compatibles peuvent être ajoutés dans le port pour médicaments (image 4).
Le contenu de la poche doit être soigneusement mélangé. (image 5) et la solution examinée visuellement (image 6). Aucune séparation de phase de l’émulsion ne doit être identifiée.
La préparation est une émulsion blanche laiteuse homogène huile dans eau.
Préparation pour perfusion
L'émulsion doit toujours être amenée à température ambiante avant la perfusion.
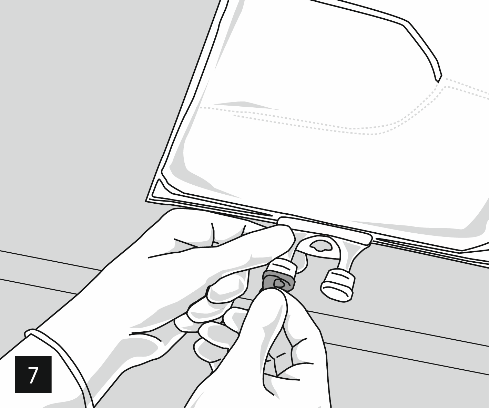
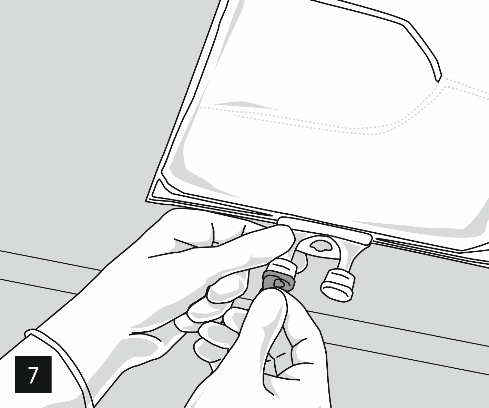
Retirer la feuille d'aluminium du port de perfusion (image 7) et fixer le dispositif de perfusion (image 8). Utiliser un dispositif non ventilé ou, en cas d’utilisation d’un dispositif ventilé, fermer la valve d’échappement.
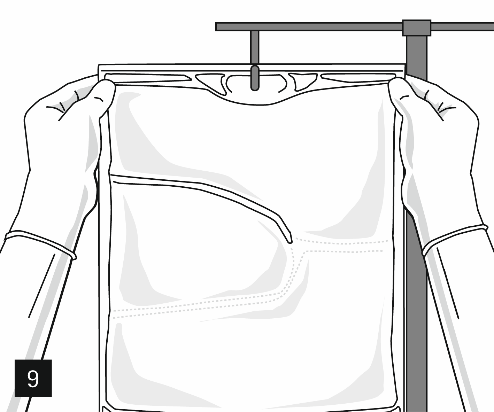
Suspendre la poche au crochet de perfusion (image 9) et démarrer la perfusion conformément au schéma standard.
Destiné à une utilisation unique. L’emballage et le reste de l’émulsion non utilisé doivent être éliminé après utilisation.
Ne pas reconnecter des récipients partiellement utilisés à un système de perfusion.
Si des filtres sont utilisés, ils doivent être perméables aux lipides. (diamètre des pores ≥ 1,2 µm).
Numéro d’autorisation65852 (Swissmedic).
PrésentationOmegaflex special est disponible en poche souple de polypropylène :
5 x 625 ml (B)
5 x 1250 ml (B)
5 x 1875 ml (B)
Titulaire de l’autorisationB. Braun Medical AG
Sempach.
Mise à jour de l’informationJanvier 2025
|









